挥发性脂肪酸(volatile fatty acids,VFAs)是反刍动物主要的能量来源,其产生速率影响营养分配[1],决定瘤胃氢供应,影响甲烷生成[2-3]。鉴于VFAs对反刍动物的巨大贡献,定量研究VFAs已成为反刍动物能量研究中的重要内容,此定量研究对于我们更清楚地认识反刍动物能量供应机制、更好地调控反刍动物能量代谢有重要意义。VFAs的产生﹑吸收﹑流通是一个动态平衡过程,瘤胃中的VFAs库存量则是这个动态过程,即边产生﹑边吸收﹑边流通的平衡结果。因为VFAs的转化效率直接影响到反刍动物对饲粮的利用效率、产品质量及饲养成本,因此不管我们是用何种方法研究,最终的目的都是想提高VFAs的吸收效率,从而最大满足反刍动物的能量需要[4]。López等[5]﹑熊本海[6]、Dieho等[7]的一系列研究表明,VFAs的吸收速率与其产生速率呈显著相关。饲喂不同类型饲粮的反刍动物,瘤胃生成的VFAs总量及比例有很大不同,高纤维饲粮有利于乙酸的产生,乙酸比例相对高;高谷物淀粉饲粮则有利于丙酸的产生,丙酸比例相对高,乙酸和丁酸比例则相对下降。作为可代谢生脂物质指标测定研究体系,笔者在前期研究了绵羊瘤胃乙酸和丁酸的产生、吸收和流通规律并计算了可代谢生脂物质的每日提供数量[8]。本研究的目的是在前期研究[9]基础上通过人为提高乙酸和丁酸产生速率的前提下,探讨基础饲粮条件下,绵羊瘤胃乙酸和丁酸产生速率的提高是否影响其在消化道的吸收和流通。
1 材料与方法 1.1 试验动物选用体况良好、体重相近、1.5岁左右的内蒙古半细毛羯羊6只,安装有永久性瘤胃瘘管和十二指肠瘘管。
1.2 试验饲粮及饲喂试验饲粮配制参照NRC(1985)[10]绵羊饲养标准,代谢能供给量为1.0倍的维持需要。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the experimental diet (DM basis) |
试验羊每隔3 h给予等量混和饲粮,日喂8次,预试期和试验期内均单笼饲养,预试期15 d,试验期10 d,预试期内试验羊自由饮水,试验期停止供水,取而代之用灌注液满足水的需要。
1.3 测定方法瘤胃内VFAs的产生速率计算公式采用Bergman[4]的方法,乙二胺四乙酸钴(Co-EDTA)的制备根据Uden等[11]介绍的方法进行。
1.4 试验设计试验羊随机分为2组,每组3只,一组为乙酸灌注组,另一组为丁酸灌注组。每组设置3个处理,每个处理代表 1个灌注的乙酸﹑丁酸水平及1次灌注试验,在每1次试验中,同测定稳态下瘤胃乙酸、丁酸基本产生速率一样,由启动灌注和连续灌注2个部分组成,启动-连续灌注液配制见表 2。
|
|
表 2 瘤胃乙酸、丁酸灌注液配制 Table 2 Formulation of acetate and butyrate infusion solution |
连续饲喂15 d后,第16天06:00采集20 mL瘤胃液后将1 g Co-EDTA溶于50 mL蒸馏水中,经采样管通过瘤胃瘘管灌入绵羊瘤胃内不同位点,灌注完毕再抽取瘤胃液反复冲洗采样管3次,并将冲洗瘤胃液回灌瘤胃内。上述Co-EDTA投放后继续连续饲喂1周,第8天06:00开始启动灌注,将100 mL启动灌注液通过注射器经采样管迅速注入瘤胃内不同位点,灌注完毕用采样管尽量充分搅匀瘤胃液,并抽取瘤胃液反复冲洗采样管和注射器,冲洗瘤胃液应及时回灌瘤胃内,紧接着进行连续灌注。启动和连续灌注阶段的瘤胃液﹑小肠液均2 h采集1次,用以测定pH、Co和VFAs浓度;连续灌注结束后,紧接着灌注水溶液,灌注速率不变,灌水中间每小时采瘤胃液1次,结束后让羊自由采食,自由饮水。
1.5 样品处理及分析方法 1.5.1 瘤胃液样品处理及分析采集的瘤胃液立即用4层纱布过滤,取4 mL瘤胃液和1 mL 25%偏磷酸,静置30 min,3 000 r/min下离心10 min,-20 ℃冰箱保存。VFAs浓度用日本岛津GC-7A气相色谱仪按照内标法进行测定,Co浓度采用原子吸收法测定,pH用pH酸度计直接测定。
1.5.2 十二指肠液样品处理及分析将不同时间点十二指肠液样品分为2份:一份等量混合制成混合样本,然后冷冻干燥,以备测Co浓度。另一份在20 000×g下离心10 min,取上清液按1 : 4比例与25%偏磷酸溶液混合后,置-20 ℃下保存用于VFAs浓度测定。
十二指肠食糜Co浓度测定:称取一定量的食糜冻干粉于25~30 mL坩埚内,置于马福炉400 ℃下灼烧2 h,加入3 mol/L硝酸(HNO3)和3 mol/L盐酸(HCl)溶解所得灰分,过滤,定容滤液至25 mL,然后取一定量滤液上机测定。
1.6 计算公式(以乙酸为例)灌注前后的瘤胃液相小时稀释速率K和K’(h-1)计算公式如下:
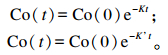
|
式中:Co(t)为t时间点Co浓度;Co(0)为投放时间Co浓度;t为采样不同时间点。
灌注前后的瘤胃液相流通速率F和F’(L/h)计算公式如下:
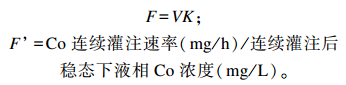
|
式中:V为灌注前瘤胃液相体积;K为灌注前瘤胃液相小时稀释速率。
灌注前后的瘤胃液相体积V和V’(L)计算公式如下:
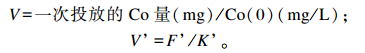
|
式中:Co(0)为上述公式回归出的投放时间点Co浓度;F’为灌注后的瘤胃液相流通速率;K’为灌注后瘤胃液相小时稀释速率。
灌注前后的瘤胃乙酸流通速率AFR和AFR’(mmol/h)计算公式如下:
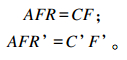
|
式中:C和C’分别为灌注前后的瘤胃乙酸浓度;F和F’分别为灌注前后的瘤胃液相流通速率。
灌注前后的瘤胃乙酸产生速率P和P’(mmol/h)计算公式如下:
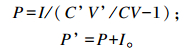
|
式中:C’V’和CV为灌注前后的瘤胃乙酸浓度与瘤胃液相体积分别相乘;I为乙酸连续灌注速率。
灌注前后的瘤胃乙酸吸收速率AAR和AAR’(mmol/h)计算公式如下:
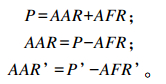
|
式中:P和P’分别为灌注前后的瘤胃乙酸产生速率;AFR和AFR’分别为灌注前后的瘤胃乙酸流通速率。
灌注前后的瘤胃乙酸吸收率A和A’(%)计算公式如下:
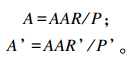
|
式中:AAR和AAR’分别为灌注前后的瘤胃乙酸吸收速率;P和P’分别为灌注前后的瘤胃乙酸产生速率。
1.7 数据统计分析试验数据采用SAS 6.12统计软件进行方差分析,用Duncan法进行多重比较。P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 提高瘤胃乙酸、丁酸产生速率对瘤胃液相指标的影响通过增加连续灌注乙酸、丁酸的产生速率得到乙酸、丁酸3个瘤胃产生水平稳态条件下,瘤胃内液相pH,乙酸、丁酸浓度及液相中Co浓度的变化结果均列在表 3中。结果表明,随着瘤胃乙酸、丁酸产生速率的提高,pH逐渐下降,不同水平间差异显著(P < 0.05);瘤胃乙酸、丁酸浓度呈直线上升趋势,不同水平间差异极显著(P < 0.01);而瘤胃乙酸产生速率的提高对瘤胃液相Co浓度则影响不大,不同水平间差异不显著(P>0.05)。丁酸灌注组的瘤胃液相Co浓度低水平和中、高水平之间差异极显著(P < 0.01),而中、高水平之间差异不显著(P>0.05),这一现象不同于乙酸灌注组。
|
|
表 3 提高瘤胃乙酸、丁酸产生速率对瘤胃pH﹑乙酸/丁酸浓度和钴浓度的影响 Table 3 Effects of increasing ruminal acetate and butyrate production rate on ruminal pH, acetate/butyrate concentration and Co concentration |
3个瘤胃乙酸、丁酸产生速率水平下,由公式计算所得的瘤胃液相小时稀释速率、瘤胃液相流通速率、瘤胃液相体积、瘤胃乙酸/丁酸流通速率、瘤胃乙酸/丁酸吸收速率及瘤胃乙酸/丁酸吸收率结果均列在表 4中。数据表明,瘤胃乙酸、丁酸产生速率的提高对瘤胃液相小时稀释速率、瘤胃液相流通速率和瘤胃液相体积影响不大,不同水平间差异不显著(P>0.05)。而随着瘤胃乙酸、丁酸产生速率的提高,瘤胃乙酸/丁酸流通速率直线上升,不同水平间差异极显著(P < 0.01);相应的瘤胃乙酸、丁酸吸收速率也大幅上升,不同水平间差异也极显著(P < 0.01);而瘤胃乙酸吸收率却随之下降,低水平和中、高水平之间差异极显著(P < 0.01),而中、高水平之间差异不显著(P>0.05)。瘤胃丁酸吸收率随着瘤胃丁酸产生速率的提高显著下降,不同水平间差异极显著(P < 0.01)。
|
|
表 4 提高瘤胃乙酸、丁酸产生速率对瘤胃乙酸、丁酸流通速率和吸收速率等指标的影响 Table 4 Effects of increasing ruminal acetate and butyrate production rate on ruminal indexes related to ruminal acetate/butyrate passage and absorption |
分析表 5数据之前,需要先交代一下的是:由于整个VFAs在小肠中的流通量较少,所以前面部分测瘤胃乙酸、丁酸基本产生速率时十二指肠中的乙酸、丁酸均未检测到,而在提高瘤胃乙酸、丁酸产生速率条件下,由于进入小肠的乙酸绝对量增加,乙酸被检测到了,而丁酸绝对量虽然也增加了,但由于它本身在VFAs中相对比例比乙酸低的多,所以仍未检测到,因此,表 5中列出的只是提高瘤胃产生速率水平下检测到的乙酸在十二指肠的流通情况。从表 5可看出,随着瘤胃乙酸产生速率水平的提高,试验羊十二指肠乙酸流通速率的绝对量逐渐增加,但不同水平间差异不显著(P>0.05);而进入十二指肠的乙酸占进入后消化道总乙酸的比例下降,不同水平间差异极显著(P < 0.01),相应此规律的则是乙酸在瓣胃、真胃的吸收比例上升,不同水平间差异极显著(P < 0.01)。
|
|
表 5 提高瘤胃乙酸产生速率后,十二指肠乙酸流通速率及瓣胃、真胃对乙酸的吸收 Table 5 Effects of increasing ruminal acetate production rate on duodenum acetate passage and absorption |
VFAs作为瘤胃发酵最重要的终产物,提供给反刍动物机体代谢绝大部分的能量前体物。当前集约化生产条件下,饲粮品质的提高及采食量的增加通常会使瘤胃VFAs产量增加,导致瘤胃pH下降,若较低的pH持续时间较长,会造成瘤胃微生物区系及瘤胃发酵类型的改变,影响瘤胃上皮对VFAs的吸收,严重会导致瘤胃屏障功能受损,引发酸中毒,从而影响动物生产性能和机体健康[12]。一般情况下,机体的自我稳衡为了维持瘤胃发酵的适宜条件,瘤胃VFAs的产生、清除(吸收和流通)成为一个必需且动态平衡的过程[13-14]。如果瘤胃VFAs的产生速率大于其清除速率,VFAs将在瘤胃内蓄积,导致代谢障碍[15]。瘤胃液VFAs浓度主要是其产生速率和清除速率平衡后的结果,受瘤胃液相体积的影响程度不大[7]。封贵[16]研究表明,瘤胃内灌注高剂量乙酸溶液(2.0 g/kg)后,瘤胃pH显著降低,乙酸浓度显著升高,推测可能是瘤胃内灌注高剂量的乙酸溶液超出了瘤胃壁吸收能力,过量乙酸的蓄积导致瘤胃pH的下降和乙酸浓度的升高。此规律在Peters等[17-18]、熊本海[6]研究中均见报道。本研究中,在连续饲喂获得绵羊瘤胃稳态条件下,通过连续灌注3个水平的乙酸和丁酸溶液后也得到了与上述研究者一致的结果,随着瘤胃乙酸、丁酸产生速率的提高,瘤胃pH显著下降,乙酸和丁酸浓度显著提高。
3.2 瘤胃乙酸、丁酸产生速率的提高对瘤胃乙酸、丁酸吸收和流通的影响瘤胃产生的VFAs主要有2个去向:被瘤胃壁吸收以及随瘤胃液流通到后消化道[17]。瘤胃pH主要受VFAs产生的影响,而pH的高低又反过来影响VFAs的吸收,彼此互相制约。瘤胃VFAs吸收主要通过瘤胃上皮进行,受到3种途径的制约:瘤胃内VFAs产生和吸收的平衡;上皮对VFAs吸收的通透性以及上皮血液对VFAs的清除[19-20]。具体来说,瘤胃VFAs吸收速率主要受VFAs碳链长度、瘤胃液pH、VFAs浓度及瘤胃液相体积、瘤胃上皮血流量以及上皮易化运输的能力等因素影响[19, 21-23]。早期经典的瘤胃VFAs吸收理论认为VFAs主要是以未解离形式通过被动扩散被瘤胃上皮吸收。瘤胃液与瘤胃上皮细胞内VFAs浓度梯度越大,分子形式VFAs被动扩散的速度越快[21, 24]。而质子化状态进行的亲脂性扩散也曾被认为是瘤胃上皮吸收VFAs的主要方式[5, 25]。Melo等[26]研究认为,pH高低会影响瘤胃上皮VFAs吸收,低pH使质子化形式的VFAs比例增加,更有利于VFAs的被动扩散吸收。当然目前诸多研究表明这些机制是不全面的[5, 15, 21, 27]。瘤胃上皮还能通过其他方式完成对VFAs的吸收,如在离子状态下在转运载体的帮助下被吸收进入瘤胃上皮细胞[28-30],有研究表明,绵羊体内高达50%的VFAs通过这种交换方式被瘤胃上皮吸收[31]。
需要强调的是,这些pH对瘤胃VFAs吸收的影响结果仅适用在瘤胃可承受的pH范围内,过高或者过低都会影响瘤胃上皮VFAs吸收能力,而且过低的酸性环境会破坏瘤胃上皮屏障。李文[32]研究表明,随着瘤胃VFAs浓度(乙酸30~102 mmol/L,丁酸5~17 mmol/L)的升高,总酸及3种酸的吸收速度(单位有效吸收面积的绝对吸收速度)也不断升高;而随着pH(5~8)的不断升高,VFAs的吸收速度呈下降趋势。Dijkstra等[21]在奶牛上利用瘤胃排空灌注技术研究了瘤胃液相体积(10、30 L),pH(4.5、5.4、6.3和7.2)和单个VFA浓度(20、50和100 mmol/L)对瘤胃VFAs吸收的影响,结果发现随着pH升高,3种酸的吸收速率下降,且吸收速率随其瘤胃浓度增加而增加。熊本海[6]在绵羊上的研究也验证了这一结果。本研究结果也表明,随着瘤胃乙酸、丁酸产生速率的提高,瘤胃乙酸、丁酸浓度显著提高,pH显著下降,瘤胃乙酸、丁酸的瘤胃流通速率和吸收速率也随之显著提高,这与前面研究者的报道规律相一致。Peters等[18]通过提高瘤胃乙酸灌注水平研究认为:当瘤胃乙酸浓度升高时,2/3~3/4的乙酸从瘤胃壁被吸收,其余随液相流向后消化道,在乙酸高产生速率条件下,瘤网胃吸收效率明显下降,他认为高产生速率导致的高液相外流速度是这个效率下降的主要原因,这一现象和原因在本研究中也同样被证实,当乙酸产生速率从89.99 mmol/h升至184.97 mmol/h时,乙酸吸收率从65.63%下降至58.02%;丁酸产生速率从11.52 mmol/h升至46.08 mmol/h时,丁酸吸收率从67.23%下降至57.06%。
3.3 提高瘤胃乙酸产生速率对后消化道乙酸流通和吸收的影响瘤胃内产生的VFAs有50%~85%被瘤胃上皮所吸收,其余的才进入后肠道。瘤胃中未被瘤网胃吸收而进入后肠道的VFAs比例在绵羊体内约为15%[33]。本研究中,随着瘤胃乙酸产生速率的提高,十二指肠乙酸流通速率分别为2.95、3.18、3.47 mmol/h,由此计算得到的进入十二指肠的乙酸占进入后消化道总乙酸的比例分别为5.68%、4.42%、3.35%。VFAs由于主要是在瘤胃内产生和吸收,所以关于VFAs的研究一般也聚焦在瘤胃部位,因而VFAs对真胃作用的研究国内外报道很少,赵玮[34]、吴美玲[35]研究发现,反刍动物体内过量的VFAs会抑制胃的运动,致使真胃胃底黏膜肌层变薄。封贵[16]研究表明,瘤胃灌注高剂量的乙酸造成了真胃胃底壁组织结构的损伤,说明高剂量的瘤胃乙酸灌注会使流通到真胃的乙酸超过其正常承受能力,从而引起负面效应。本研究中,随着瘤胃乙酸产生速率的提高,瓣胃、真胃乙酸吸收比例也随之提高(94.32、95.45、96.65),也从一定程度上印证了上述研究者的结论。
从瘤胃VFAs产生、吸收和流通的整体规律及相互影响来讲,本研究和前人研究有相似的规律发现,但从绝对数值来讲还有较大差异,这种差异主要是与国内外研究者在动物品种、生理阶段、试验方法、试验饲粮等因素有关。特别是研究方法的差异,是引起系统误差及其重要的一个因素,目前关于瘤胃VFAs产生、吸收、流通速率的研究中,比较常见的是同位素标记灌注和非同位素标记连续灌注法,2种方法各有优缺点,缓冲液灌注技术反映了标准化条件下瘤胃对VFAs的吸收,而同位素稀释技术可以在真实生理状态下反映测定时间内的VFAs吸收[7]。理论上讲,VFAs的相互交换导致乙酸库碳原子的净外流和丙酸库特别是丁酸库碳原子的净流入[27, 36-37],所以同位素稀释技术测定的乙酸消失速率被高估,相应的丙酸和丁酸消失速率则被低估[7]。Dieho等[7]采用缓冲液灌注技术测定的乙酸、丙酸、丁酸的吸收速率比同位素稀释技术测定的分别高出20%、25%、45%,他认为脉冲式的启动灌注同时扩充了乙酸、丙酸、丁酸,所以不能对3种酸之间的碳原子流量进行量化,这或许能解释丁酸吸收速率值较低的原因。
4 结论本研究条件下,绵羊瘤胃乙酸、丁酸产生速率的增加提高了其瘤胃浓度,降低了瘤胃pH,提高了其瘤胃吸收速率和瘤胃、十二指肠流通速率,但瘤胃吸收效率下降。
| [1] |
MOLONEY A P. Growth and carcass composition in sheep offered isoenergetic rations which resulted in different concentrations of ruminal metabolites[J]. Livestock Production Science, 1998, 56(2): 157-164. DOI:10.1016/S0301-6226(98)00191-2 |
| [2] |
JANSSEN P H. Influence of hydrogen on rumen methane formation and fermentation balances through microbial growth kinetics and fermentation thermodynamics[J]. Animal Feed Science and Technology, 2010, 160(1/2): 1-22. |
| [3] |
KOHN R A, BOSTON R C.The role of thermodynamics in controlling rumen metabolism[C]//MCNAMARA J P, FRANCE J, BEEVER D E.Modelling nutrient utilization in farm animals.Wallingford, UK: CABI Publishing.
|
| [4] |
BERGMAN E N. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J]. Physiological Reviews, 1990, 70(2): 567-590. DOI:10.1152/physrev.1990.70.2.567 |
| [5] |
LÓPEZ S, HOVELL F D D, DIJKSTRA J, et al. Effects of volatile fatty acid supply on their absorption and on water kinetics in the rumen of sheep sustained by intragastric infusions[J]. Journal of Animal Science, 2003, 81(10): 2609-2616. DOI:10.2527/2003.81102609x |
| [6] |
熊本海.生长肥育羊瘤胃内VFA产生、吸收规律及模型参数研究[D].博士学位论文.北京: 中国农业科学院, 1998.
|
| [7] |
DIEHO K, DIJKSTRA J, SCHONEWILLE J T, et al. Changes in ruminal volatile fatty acid production and absorption rate during the dry period and early lactation as affected by rate of increase of concentrate allowance[J]. Journal of Dairy Science, 2016, 99(7): 5370-5384. DOI:10.3168/jds.2015-10819 |
| [8] |
杜瑞平, 卢德勋, 高民.绵羊瘤胃乙酸和丁酸的产生、吸收和流通规律及可代谢生脂物质的测定[J/OL].动物营养学报: 1-11[2019-09-18].http://kns.cnki.net/kcms/detail/11.5461.s.20190912.1910.018.html.
|
| [9] |
杜瑞平.绵羊瘤胃乙酸和丁酸的产生、吸收和利用规律及可代谢生脂物质(MLS)的测定[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2006.
|
| [10] |
NRC.Nutrient Requirements of sheep[S].Washington, D.C.: National Academy Press, 1985.
|
| [11] |
UDEN P, COLUCCI P E, VAN SOEST P J. Investigation of chromium, cerium and cobalt as markers in digesta.Rate of passage studies[J]. Journal of the Science of Food and Agriculture, 1980, 31(7): 625-632. DOI:10.1002/jsfa.2740310702 |
| [12] |
KOLVER E S, DE VETH M J. Prediction of ruminal pH from pasture-based diets[J]. Journal of Dairy Science, 2002, 85(5): 1255-1266. DOI:10.3168/jds.S0022-0302(02)74190-8 |
| [13] |
PENNER G B, ASCHENBACH J R, GÄBEL G, et al. Epithelial capacity for apical uptake of short chain fatty acids is a key determinant for intraruminal pH and the susceptibility to subacute ruminal acidosis in sheep[J]. The Journal of Nutrition, 2009, 139(9): 1714-1720. DOI:10.3945/jn.109.108506 |
| [14] |
DIJKSTRA J, ELLIS J L, KEBREAB E, et al. Ruminal pH regulation and nutritional consequences of low pH[J]. Animal Feed Science and Technology, 2012, 172(1/2): 22-33. |
| [15] |
ASCHENBACH J R, PENNER G B, STUMPFF F, et al. Ruminant nutrition symposium:role of fermentation acid absorption in the regulation of ruminal pH[J]. Journal of Animal Sicence, 2011, 89(4): 1092-1107. |
| [16] |
封贵.瘤胃内灌注乙酸对山羊瘤胃内环境及真胃壁M2、M3和eNOS的基因表达影响[D].硕士学位论文.扬州: 扬州大学, 2016.
|
| [17] |
PETERS J P, SHEN R Y W, ROBINSON J A, et al. Disappearance and passage of propionic acid from the rumen of the beef steer[J]. Journal of Animal Science, 1990, 68(10): 3337-3349. DOI:10.2527/1990.68103337x |
| [18] |
PETERS J P, SHEN R Y, ROBINSON J A. Disappearance of acetic acid from the bovine reticulorumen at basal and elevated concentrations of acetic acid[J]. Journal of Animal Science, 1992, 70(5): 1509-1517. DOI:10.2527/1992.7051509x |
| [19] |
STORM A C, HANIGAN M D, KRISTENSEN N B. Effects of ruminal ammonia and butyrate concentrations on reticuloruminal epithelial blood flow and volatile fatty acid absorption kinetics under washed reticulorumen conditions in lactating dairy cows[J]. Journal of Dairy Science, 2011, 94(8): 3980-3994. DOI:10.3168/jds.2010-4091 |
| [20] |
STORM A C, KRISTENSEN N B. Effects of particle size and dry matter content of a total mixed ration on intraruminal equilibration and net portal flux of volatile fatty acids in lactating dairy cows[J]. Journal of Dairy Science, 2010, 93(9): 4223-4238. DOI:10.3168/jds.2009-3002 |
| [21] |
DIJKSTRA J, BOER H, VAN BRUCHEM J, et al. Absorption of volatile fatty acids from the rumen of lactating dairy cows as influenced by volatile fatty acid concentration, pH and rumen liquid volume[J]. British Journal of Nutrition, 1993, 69(2): 385-396. DOI:10.1079/BJN19930041 |
| [22] |
PENNER G B, STEELE M A, ASCHENBACH J R, et al. Ruminant nutrition symposium:molecular adaptation of ruminal epithelia to highly fermentable diets[J]. Journal of Animal Sicence, 2011, 89(9): 1108-1119. |
| [23] |
SCHURMANN B L, WALPOLE M E, GÓRKA P, et al. Short-term adaptation of the ruminal epithelium involves abrupt changes in sodium and short-chain fatty acid transport[J]. American Journal of Physiology.Regulatory, Integrative and Comparative Physiology, 2014, 307(7): R802-R816. DOI:10.1152/ajpregu.00035.2014 |
| [24] |
GRAHAM C, GATHERAR I, HASLAM I, et al. Expression and localization of monocarboxylate transporters and sodium/proton exchangers in bovine rumen epithelium[J]. American Journal of Physiology.Regulatory, Integrative and Comparative Physiology, 2007, 292(2): R997-R1007. DOI:10.1152/ajpregu.00343.2006 |
| [25] |
BUGAUT M. Occurrence, absorption and metabolism of short chain fatty acids in the digestive tract of mammals[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1987, 86(3): 439-472. DOI:10.1016/0305-0491(87)90433-0 |
| [26] |
MELO L Q, COSTA S F, LOPES F, et al. Rumen morphometrics and the effect of digesta pH and volume on volatile fatty acid absorption[J]. Journal of Animal Science, 2013, 91(4): 1775-1783. DOI:10.2527/jas.2011-4999 |
| [27] |
SUTTON J D, DHANOA M S, MORANT S V, et al. Rates of production of acetate, propionate, and butyrate in the rumen of lactating dairy cows given normal and low-roughage diets[J]. Journal of Dairy Science, 2003, 86(11): 3620-3633. DOI:10.3168/jds.S0022-0302(03)73968-X |
| [28] |
ALUWONG T, KOBO P, ABDULLAHI A. Volatile fatty acids production in ruminants and the role of monocarboxylate transporters:a review[J]. African Journal of Biotechnology, 2010, 9(38): 6229-6232. |
| [29] |
KIRAT D, MATSUDA Y, YAMASHIKI N, et al. Expression, cellular localization, and functional role of monocarboxylate transporter 4(MCT4) in the gastrointestinal tract of ruminants[J]. Gene, 2007, 391(1/2): 140-149. |
| [30] |
CONNOR E E, LI R W, BALDWIN R L, et al. Gene expression in the digestive tissues of ruminants and their relationships with feeding and digestive processes[J]. Animal, 2010, 4(7): 993-1007. DOI:10.1017/S1751731109991285 |
| [31] |
GÄBEL P, BESTMANN M, MARTENS H. Influences of diet, short-chain fatty acids, lactate and chloride on bicarbonate movement across the reticulo-rumen wall of sheep[J]. Journal of Veterinary Medicine Series A, 1991, 38(1/2/3/4/5/6/7/8/9/10): 523-529. |
| [32] |
李文.瘤胃液pH值、渗透压、挥发性脂肪酸(VFAs)浓度对绵羊瘤胃上皮VFAs吸收影响的研究[D].硕士学位论文.泰安: 山东农业大学, 2014.
|
| [33] |
EDRISE B M, SMITH R H. Absorption of volatile fatty acids in different compartments of the ruminant stomach[J]. Proceeding of the Nutrition Society, 1977, 36(3): 149A. |
| [34] |
赵玮.舍饲羊皱胃组织形态学研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2010.
|
| [35] |
吴美玲.1.5岁阿尔巴斯绒山羊在不同饲养条件下瓣胃与皱胃形态变化的研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2005.
|
| [36] |
FRANCE J, DIJKSTRA J.Volatile fatty acid production[M]//DIJKSTRA J, FORBES J M, FRANCE J.Quantitative aspects of ruminant digestion and metabolism.Wallingford, UK: CABI Publishing, 2005: 157-175.
|
| [37] |
MARKANTONATOS X, GREEN M H, VARGA G A. Use of compartmental analysis to study ruminal volatile fatty acid metabolism under steady state conditions in Holstein heifers[J]. Animal Feed Science and Technology, 2008, 143(1/2/3/4): 70-88. |




