2. 新疆肉乳用草食动物营养重点实验室, 乌鲁木齐 830052
2. Xinjiang Key Laboratory of Meat & Milk Production Herbivore Nutrition, Urumqi 830052, China
奶牛在泌乳前期由于产奶量高峰早于采食量高峰,使其机体处于一种能量负平衡状态,致使奶牛体况变差,免疫力下降,如若不及时对其进行营养补充,则会使这种情况不断恶化,最终会引发一些代谢类疾病,如乳房炎和酮病。大豆异黄酮是在豆科类植物的生长过程中形成的一类次级代谢产物,大部分存在于豆科植物的胚轴及其子叶中,少量分布在种皮中,具有雌激素样效应。大豆异黄酮可以作为抗氧化剂以及调节体内激素水平的调节剂[1],它还可以促进乳腺发育、提高奶产量以及机体免疫力等[2]。朱河水等[3]研究发现,泌乳后期奶牛饲喂大豆黄酮能缓解其产奶量的下降趋势,且乳中乳蛋白含量有所升高,乳脂率有所下降,并提高了血浆中生长激素(GH)、催乳素(PRL)等含量。人类医学研究发现植物雌激素可以抑制癌症、白血病,同时还具有绿色、安全、有效以及副作用小等优点[4]。
本研究在奶牛的基础饲粮中添加不同水平的大豆异黄酮,测定泌乳前期奶牛的乳成分,研究大豆异黄酮对泌乳前期奶牛平均日产奶量、乳成分和体细胞数及血清相关细胞因子含量的影响,为大豆异黄酮在泌乳前期荷斯坦奶牛生产中的应用提供依据。
1 材料与方法 1.1 试验时间与地点试验于2018年11月至2019年1月在新疆天山畜牧生物工程股份有限公司进行。
1.2 主要试剂大豆异黄酮购自西安华庚生物科技有限公司(纯度98%)。
1.3 试验动物试验选取泌乳前期、泌乳天数为(32±12) d,胎次2~3胎、产奶量和体重[(600±50) kg]相近的荷斯坦奶牛40头,随机分成4组,分别为对照组及试验Ⅰ、Ⅱ和Ⅲ组,每组10头。试验分为2期,预试期(7 d)以及正试期(60 d),试验共进行67 d。
1.4 试验设计对照组和试验组均饲喂全混合日粮(TMR),同时试验Ⅰ、Ⅱ、Ⅲ组分别补喂5、15和30 mg/kg的大豆异黄酮,将大豆异黄酮与100 g精料混合均匀后于早、晚饲喂给试验组奶牛,对照组的奶牛只额外饲喂100 g精料,在每日饲喂奶牛时,提前设置颈夹,将混合了大豆异黄酮的100 g精料分别洒在试验奶牛正下方,观察并保证奶牛将其完全采食。在预试期和正试期,试验组和对照组奶牛进行分组饲喂。基础饲粮参考NRC(2001)配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
每5 d统计1次各组奶牛的奶产量,用于统计分析平均日产奶量的变化趋势。在正试期的第1、10、20、30、40、50和60天对4组奶牛进行乳样收集,分别在采样日的04:00、11:00、17:00进行。收集乳样时,提前将套管安装在挤奶设备上,按照挤奶规程把前3把奶舍弃,乳样在套管中收集好后,取下套管,将采集的牛乳分别装于做好标记的奶样瓶中,然后将套管重新安装回挤奶设备。最后把早、中、晚3次取的乳样按照4 : 3 : 3的比例均匀混合成100 mL后,储存在-20 ℃冰箱中待测。
在正试期第1、30、60天通过尾静脉采集血液,每头牛采血10 mL,分装于5 mL的普通采血管中,将所有血样在离心机中1 780×g离心15 min,收集血清,分装至2 mL Eppendorf管中(每管1.5 mL),-20 ℃保存待测。
1.6 测定指标和方法TMR样品中常规营养成分测定方法:干物质(DM)、粗灰分(Ash)、钙(Ca)和磷(P)含量的测定方法参照国标方法[6-9];粗蛋白质(CP)含量使用全自动凯氏定氮仪(VELP.UDK159,意大利)进行测定;粗脂肪(EE)含量测定方法参照AOAC(2000)[10];酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)含量采用美国ANKOM纤维分析仪测定[11]。
奶牛日产奶量为每天3次挤奶量之和,平均日产奶量为奶牛每10 d产奶量的平均值。
混合后的乳样,测定其乳成分及体细胞数。体细胞数的测定采用Soma Count FCM体细胞检测仪(美国本特利仪器公司),乳成分的测定采用Bentley NexGen-500型Dairy Spec FT精密傅立叶红外乳成分分析仪(美国本特利仪器公司)。乳样、清洗剂和蒸馏水使用前在水浴锅中预热,温度为42 ℃,仪器在使用前预热20 min。
对照组和试验组奶牛隐性乳房炎的发病率采用兰州乳房炎检测法(LMT)检测,检测试剂:隐性乳房炎诊断液(兰州兽医研究所生产)。采样前将奶牛的乳房和乳头进行清洁,并弃去前3把奶,然后将奶牛4个乳区的乳样分别对应挤入诊断盘,各约2 mL,再分别对应加入2 mL的诊断液,水平方向逆时针轻微晃动诊断盘,充分混合乳样和诊断液,30 s后观察结果并记录。
血清中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的含量均送至北京华英生物技术研究所使用酶免法(华卫德朗DR-200S酶标分析仪,无锡华卫德朗仪器有限公司)测定。在保温箱中放置干冰,将样品放置保温箱中,空运至测定中心,样品在低温且3 d之内送达,保证样品活性正常。
1.7 数据处理试验数据使用Excel 2016软件进行整理,SAS 9.4软件进行统计分析,采用MIXED模型,Duncan氏法进行多重比较,显著性检验的判断标准为:P<0.01时差异极显著,P<0.05时差异显著,P>0.05时差异不显著。
2 结果与分析 2.1 大豆异黄酮对奶牛平均日产奶量的影响由表 2可知,在试验全期内,试验组平均日产奶量均高于对照组。其中,试验Ⅲ组在试验全期内,平均日产奶量均极显著高于对照组(P<0.01);试验Ⅰ组的平均日产奶量在试验第10、20、30和50天显著高于对照组(P<0.05),在试验第40和60天极显著高于对照组(P<0.01);试验Ⅱ组的平均日产奶量在试验第20、30、40和50天显著高于对照组(P<0.05),在试验第60天极显著高于对照组(P<0.01)。在试验第1~60天,试验Ⅰ、Ⅱ、Ⅲ组的平均日产奶量与对照组相比均差异极显著(P<0.01),试验Ⅲ组的平均日产奶量与试验Ⅰ、Ⅱ组相比也差异极显著(P<0.01)。
|
|
表 2 饲喂不同水平大豆异黄酮对奶牛平均日产奶量的影响 Table 2 Effects of feeding different levels of soy isoflavones on average daily milk yield of dairy cows |
由表 3可知,在试验全期内,试验组的乳脂含量均高于对照组,但均无显著差异(P>0.05)。在试验第30天,试验Ⅱ、Ⅲ组的乳糖含量高于对照组和试验Ⅰ组,且与试验Ⅰ组差异显著(P<0.05),其他各期各组间乳糖含量均无显著差异(P>0.05)。在试验第20天后,试验Ⅲ组的乳蛋白含量均高于其他3组,其中,试验Ⅲ组与对照组相比,在试验第30天差异达到极显著水平(P<0.01),第40天差异均到显著水平(P<0.05);试验Ⅲ组与试验Ⅰ组相比,在试验第30天时,差异极显著(P<0.01),在试验第40天时,差异显著(P<0.05);试验Ⅲ组与试验Ⅱ组相比,在试验第30天时差异显著(P<0.05)。此外,在试验第10天,试验Ⅱ组的乳蛋白含量显著低于试验Ⅲ组和对照组(P<0.05)。在试验第1~60天,试验Ⅲ组的乳蛋白含量极显著高于对照组和试验Ⅰ、Ⅱ组(P<0.01)。在试验第30天,试验Ⅰ组的非脂固形物含量与试验Ⅲ组相比差异显著(P<0.05),与试验Ⅱ组相比,差异显著(P<0.05)。
|
|
表 3 饲喂不同水平大豆异黄酮对奶牛乳成分的影响 Table 3 Effects of feeding different levels of soy isoflavones on milk components of dairy cows |
由表 4可知,在试验全期内,试验组乳中体细胞数均低于对照组。在试验第40天,对照组乳中的体细胞数显著高于试验Ⅰ、Ⅱ、Ⅲ组(P<0.05)。在试验第1~60天,对照组乳中的体细胞数极显著高于各试验组(P<0.01)。
|
|
表 4 饲喂不同水平大豆异黄酮对奶牛乳中体细胞数的影响 Table 4 Effects of feeding different levels of soy isoflavones on number of somatic cells in milk of dairy cows |
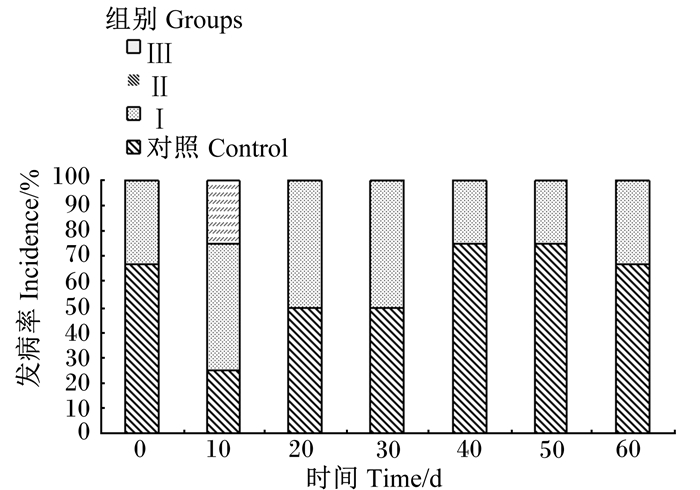
由图 1可知,随着大豆异黄酮添加水平的升高,隐性乳房炎的发病率呈现下降的趋势。在试验全期内,试验Ⅲ组未出现隐性乳房炎的发病情况。在试验第20~60天,试验Ⅱ组的隐性乳房炎发病率均低于对照组。在试验第10天,对照组、试验Ⅰ、Ⅱ组隐性乳房炎发病率分别为20%、60%和20%。在第40、50和60天,试验Ⅰ组乳房炎发病率分别为20%、20%和30%,对照组隐性乳房炎发病率分别为80%、80%和70%,试验Ⅰ组均低于对照组。
|
图 1 饲喂不同水平大豆异黄酮对奶牛隐性乳房炎发病率的影响 Fig. 1 Effects of feeding different levels of soy isoflavones on incidence of recessive mastitis of dairy cows |
由表 5可知,在试验全期内,试验Ⅲ组血清IL-1β含量高于对照组,但差异不显著(P>0.05);在试验全期内,试验Ⅱ、Ⅲ组血清IL-6含量高于对照组,但差异不显著(P>0.05);在试验全期内,试验Ⅰ组血清TNF-α含量高于对照组,但差异不显著(P>0.05)。
|
|
表 5 饲喂不同水平大豆异黄酮对奶牛血清IL-1β、IL-6、TNF-α含量的影响 Table 5 Effects of feeding different levels of soy isoflavones on IL-1β, IL-6 and TNF-α contents in serum of dairy cows |
产奶量的高低是衡量奶牛生产性能的重要指标之一。本试验结果显示,在试验全期,试验组的平均日产奶量均显著高于对照组,在试验第1~60天,试验Ⅰ、Ⅱ、Ⅲ组的平均日产奶量与对照组相比分别提高了13.60%、11.34%和20.77%,因此,大豆异黄酮对产奶量的提高具有促进作用。刘德义等[12]、Lunch[13]和杨建英[14]研究均发现在奶牛的饲粮中添加大豆异黄酮可提高奶牛的平均日产奶量。这些研究结果均与本试验的结果一致。
大豆异黄酮具有弱雌激素效应,能与动物体内的雌激素受体相结合,而它的雌激素效应和抗雌激素效应取决于动物体内的雌激素水平,由于奶牛体内雌二醇水平相对较低,因此在奶牛的基础饲粮中添加一定量的大豆异黄酮可以发挥其雌激素效应[15-16]。李玉斌等[17]在12头奶牛饲粮中添加8 mg/kg的大豆异黄酮,结果显示乳中GH、PRL含量升高。杨慧敏等[18]研究结果显示,大豆黄酮可以提高奶牛血浆中GH、PRL的含量。上述结果说明,本试验中试验组平均日产奶量提高的原因可能是大豆异黄酮在饲喂后经瘤胃吸收进入血液,发挥弱雌激素作用,促进垂体GH和PRL的分泌,并通过增加体内GH和PRL的含量,发挥其促进乳腺发育的作用。
3.2 大豆异黄酮对奶牛乳成分的影响乳蛋白含量的变化可以反映出乳腺机能的变化,并可以从中了解乳腺细胞代谢情况[19]。本试验结果显示,给泌乳前期的奶牛饲喂不同水平的大豆异黄酮,试验组与对照组相比,乳蛋白含量得到显著提升。杨建英[14]发现给奶牛饲喂含有大豆黄酮的饲粮能明显提高乳蛋白的含量。李琮[20]研究表明,给奶牛饲喂大豆苷元和芒柄花素可以提高乳蛋白的含量。上述研究结果与本试验结果一致。研究表明,大豆黄酮可以使体内蛋白质分解下降,合成代谢增加,同时可以影响机体对胆固醇的转化,从而调节体内氮代谢的水平,增进机体对营养物质的吸收利用[21]。本试验中大豆异黄酮可以提高乳蛋白含量可能是因为其可以促进肝脏蛋白质合成,使血液中蛋白质含量发生变化,从而增加乳中蛋白质沉淀。
乳糖和乳脂的合成主要源自血液中的葡萄糖和脂肪酸[22]。在本试验条件下,大豆异黄酮对试验组乳脂含量有提升作用,对乳糖含量影响不大,均无显著差异。卢志勇等[23]研究表明,给奶牛饲喂大豆异黄酮可以显著提高其乳腺上皮细胞分泌乳糖的能力。此研究结果与本试验结果不一致,可能是由于本试验选择的试验对象是处于泌乳前期的奶牛。泌乳前期的奶牛随着机体内环境的改变,体内的物质代谢也不断变化。有研究表明,大豆异黄酮在饲喂后可发挥弱雌激素作用,提高体内胰岛素生长因子-Ⅰ(IGF-Ⅰ)的含量[24]。胰岛素是调节体内三大物质代谢的重要激素[25]。陈杰等[26]研究表明,给水牛瘤胃灌注大豆黄酮, 可以促进瘤胃微生物蛋白质合成, 并使挥发性脂肪酸(VFA)、氨态氮(NH3-N)的含量增加。故推测在本试验中,大豆异黄酮可能通过调节体内胰岛素的水平,从而增加了血液中甘油三酯的含量,且对血糖没有产生较大影响。
由本试验结果推断大豆异黄酮可以作为一种营养物质加入奶牛饲粮中提高产奶量的同时还能提高乳蛋白含量,改善乳品质,提高奶牛的生产性能。
3.3 大豆异黄酮对奶牛乳中体细胞数的影响检测乳中体细胞数是判断奶牛乳房炎主要方法之一,当乳中体细胞数超过50万个/mL,就可怀疑奶牛患有乳房炎。再结合利用LMT检测隐性乳房炎的发病情况,可以更好地为生产提供有力依据。因此,降低乳中体细胞数是保证奶牛健康和提高其生产性能的关键。本试验结果显示,在试验第1~60天,对照组乳中的体细胞数极显著高于试验组,随着试验天数的增加,对照组乳中的体细胞数大幅度上升,但试验组乳中的体细胞数得到有效控制。同时,根据对奶牛隐性乳房炎的检测,在试验全期,试验组隐性乳房炎的发病率均低于对照组。这说明大豆异黄酮可以通过抑制乳中体细胞数的增加,降低隐性乳房炎的发病率。邹阿玲等[27]发现给奶牛饲喂恰玛古可以使试验组乳中的体细胞数平均值低于对照组。田丰等[28]发现在牛的饲粮中添加0.1%的植物雌激素可显著减少牛奶中的体细胞数并减少乳腺感染的可能性。这些研究结果均与本试验结果吻合。
体细胞数下降的原因可能是饲喂大豆异黄酮导致其有效基团硫代葡萄糖苷能有效地去除自由基,从而减少了自由基对乳腺上皮细胞的损害,增强其抗氧化能力和免疫力,进而使乳中的体细胞数降低了。有研究结果显示,利用甘草中的类黄酮化合物对乳房炎主要病原菌进行体外抑菌处理,结果显示其能抑制乳房炎病原菌金黄色葡萄球菌、无乳链球菌和大肠杆菌的生长,并且对治疗奶牛的乳房炎有一定的效果[29]。韩军艳[30]的研究结果也表明,葎草中的异黄酮类化合物可以显著抑制金黄色葡萄球菌的作用。由此可推断大豆异黄酮可能也是通过抑制乳房炎的主要病原菌进而降低了试验组奶牛隐性乳房炎的发病率。
3.4 大豆异黄酮对奶牛血清中IL-1β、IL-6和TNF-α含量的影响陈涛[31]研究结果显示,利用大豆异黄酮诱导代谢综合征(MS)大鼠,可以降低代谢综合征模型大鼠血清中IL-6的含量。这与本试验结果不一致,可能是由于本试验所选试验动物为奶牛,所产生的作用及其作用机制还有待于进一步研究。侯昆等[32]研究结果显示,添加黄酮类植物雌激素可以使奶牛血清中IL-1β和TNF-α含量显著降低。这与本试验结果不一致,可能是本试验饲喂的是大豆异黄酮,所产生的作用与其他黄酮类植物雌激素有些许差别,但本研究中大豆异黄酮对奶牛血清IL-1β和TNF-α含量影响的具体作用机制尚未有报道,还有待于进一步研究。
4 结论① 饲喂不同水平的大豆异黄酮,可以提高泌乳早期奶牛的平均日产奶量。
② 饲喂30 mg/kg大豆异黄酮可以提升乳蛋白含量,改善乳品质。
③ 饲喂不同水平的大豆异黄酮能显著降低乳中体细胞数,有效控制奶牛患隐性乳房炎的发病率。
④ 饲喂不同水平的大豆异黄酮对奶牛血清中IL-1β、IL-6和TNF-α的含量无显著影响。
| [1] |
邓卉, 刘进远, 汪林书, 等. 大豆异黄酮发挥抗氧化作用的途径及机理研究[J]. 四川畜牧兽医, 2012, 39(2): 32-34. |
| [2] |
方洛云, 赵燕飞, 金凯, 等. 大豆异黄酮对奶牛泌乳性能、血液免疫及抗氧化指标的影响[J]. 中国农学通报, 2015, 31(11): 9-15. |
| [3] |
朱河水, 王艳玲, 杨国宇, 等. 大豆黄酮对奶牛相关产奶性能的影响[J]. 华北农学报, 2006, 21(6): 127-129. DOI:10.3321/j.issn:1000-7091.2006.06.031 |
| [4] |
李延杰. 大豆异黄酮的生理作用以及在畜牧生产中的应用[J]. 现代畜牧科技, 2016(11): 47. |
| [5] |
冯仰廉, 陆治年. 奶牛营养需要和饲料成分[M]. 3版. 北京: 中国农业出版社, 2007.
|
| [6] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 6435-2006饲料中水分和其他挥发性物质含量的测定[S].北京: 中国标准出版社, 2007.
|
| [7] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 6438-2007饲料中粗灰分的测定[S].北京: 中国标准出版社, 2007.
|
| [8] |
中华人民共和国国家质量监督检验检疫总局.GB/T 6436-2002饲料中钙的测定[S].北京: 中国标准出版社, 2002.
|
| [9] |
中华人民共和国国家质量监督检验检疫总局.GB/T 6437-2002饲料中总磷的测定分光光度法[S].北京: 中国标准出版社, 2002.
|
| [10] |
AOAC. Official methods of analysis[M]. 17th ed. Arlington, VA: AOAC, 2000.
|
| [11] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [12] |
刘德义, 周玉传, 陆天水, 等. 大豆异黄酮对奶牛产奶量和乳脂率及饲料转化率的影响[J]. 中国畜牧杂志, 2004, 40(4): 31-32, 55. DOI:10.3969/j.issn.0258-7033.2004.04.011 |
| [13] |
LUNCH T. Metabolism of estrogenic isoflavones in domestic animals[J]. Proceedings of the Society for Experimental Biology and Medicine, 1995, 208(1): 33-39. |
| [14] |
杨建英.大豆黄酮对不同泌乳期奶牛产奶量、乳成分的影响及相关作用机制的研究[D].硕士学位论文.郑州: 河南农业大学, 2003. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGXJ200408001163.htm
|
| [15] |
ADAMS N R. Detection of the effects of phytoestrogens on sheep and cattle[J]. Journal of Animal Science, 1995, 73(5): 1509-1515. DOI:10.2527/1995.7351509x |
| [16] |
王明.大豆异黄酮对奶牛肠系膜淋巴结与脾脏主要免疫指标的影响研究[D].硕士学位论文.北京: 北京农学院, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10020-1012503029.htm
|
| [17] |
李玉斌, 师然伟. 新型动物保健因子-大豆异黄酮在蛋鸡和奶牛生产中的应用[J]. 饲料广角, 2008(15): 32-34. DOI:10.3969/j.issn.1002-8358.2008.15.012 |
| [18] |
杨慧敏, 谷文举. 大豆黄酮对奶牛泌乳及相关激素的影响[J]. 今日畜牧兽医, 2007(7): 9. |
| [19] |
王加启. 牛奶乳脂肪和乳蛋白的合成与调控机理[J]. 饲料与畜牧, 2011(2): 8-14. |
| [20] |
李琮.添喂植物雌激素对奶牛泌乳性能、乳和血浆性激素及雌马酚含量的影响[D].硕士学位论文.乌鲁木齐: 新疆农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10758-1016236260.htm
|
| [21] |
艾晓杰, 吴晓林, 朱勇琪, 等. 大豆黄酮对荷斯坦牛围产期血液生化成分的影响[J]. 中国畜牧杂志, 2004, 40(11): 19-21. DOI:10.3969/j.issn.0258-7033.2004.11.008 |
| [22] |
王根林. 养牛学[M]. 3版. 北京: 中国农业出版社, 2014: 260-265.
|
| [23] |
卢志勇, 梁代华, 杨运玲, 等. 大豆异黄酮对奶牛乳腺上皮细胞泌乳性能及抗氧化能力的影响[J]. 饲料与畜牧, 2013(2): 25-28. |
| [24] |
程蕾, 王定发, 刘晓华, 等. 大豆异黄酮对奶牛产奶量及乳成分的影响[J]. 饲料博览, 2009(4): 5-7. DOI:10.3969/j.issn.1001-0084.2009.04.002 |
| [25] |
艾晓杰, 吴晓林, 朱勇琪, 等. 大豆黄酮对荷斯坦牛围产期某些代谢激素的影响[J]. 中国奶牛, 2004(5): 13-15. DOI:10.3969/j.issn.1004-4264.2004.05.006 |
| [26] |
陈杰, 杨国宇, 韩正康. 大豆黄酮对反刍动物血清睾酮和瘤胃消化代谢的影响[J]. 江苏农业研究, 1999, 20(2): 17-19. DOI:10.3969/j.issn.1671-4652.1999.02.005 |
| [27] |
邹阿玲, 赵艳坤, 张晓雪, 等. 饲喂恰麻古对奶牛生产性能、体细胞数及血清抗氧化水平的影响[J]. 畜牧与兽医, 2016, 48(4): 54-56. |
| [28] |
田丰, 任海军, 史彬林, 等. 壳聚糖对奶牛产奶性能、乳体细胞数及血清免疫球蛋白的影响[J]. 饲料工业, 2009, 30(5): 31-33. |
| [29] |
李诗莹.甘草总黄酮混悬乳房注射剂对奶牛乳房炎治疗效果研究[D].硕士学位论文.大庆: 黑龙江八一农垦大学, 2015.
|
| [30] |
韩军艳.葎草总黄酮的提取及体内外抑菌效果观察[D].硕士学位论文.郑州: 河南农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10466-1014420983.htm
|
| [31] |
陈涛.大豆异黄酮对膳食诱导代谢综合征大鼠血清IL-6及ADPN的影响[D].硕士学位论文.哈尔滨: 黑龙江中医药大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10228-1011223871.htm
|
| [32] |
侯昆, 童津津, 楚康康, 等. 竹叶黄酮与青蒿提取物对患隐性乳房炎奶牛产奶性能、乳中体细胞数及血清免疫和抗氧化相关指标的影响[J]. 动物营养学报, 2019, 31(09): 4286-4295. |




