2. 广东省畜禽育种与营养研究重点实验室, 广州 510640;
3. 农业部华南动物营养与饲料重点实验室, 广州 510640;
4. 广州飞禧特生物科技有限公司, 广州 510640
2. Guangdong Key Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China;
3. Key Laboratory of Animal Nutrition and Feed Science(South China) of Ministry of Agriculture, Guangzhou 510640, China;
4. Guangzhou Fishtech Biotechnology Co., Ltd., Guangzhou 510640, China
随着规模化和集约化养殖的迅猛发展,水产品质量和安全相比产量显得更为重要。水产动物所面临的人为活动、自然环境变化、饲料及水体中各种应激因子日益增加,从而造成氧化应激。氧化应激是众多疾病发生的重要病理原因之一。氧化应激状态下,机体组织和细胞内氧自由基生成增加,导致活性氧累积而引发细胞氧化损伤,使机体抗氧化和免疫力下降并引发大规模病害,影响水产动物生产性能、水产品品质和安全,同时给水产养殖业带来严重的经济损失。动物健康程度与机体抗氧化防御体系的能力强弱密切相关[1]。
啤酒酵母提取物是一类富含蛋白质、核苷酸、多糖、促生长因子、抗氧化活性物质的营养素,自20世纪90年代起就用作水产饲料添加剂[2]。啤酒酵母提取物最显著的特点体现在它的促生长和抗氧化作用,通常归因于其活性成分的生物活性作用,在畜禽水产中具有广阔的应用前景[3]。由于酵母提取物含有丰富的蛋白质和氨基酸,以往报道多集中在酵母提取物替代鱼粉等饲料蛋白质源的研究。1.5%的啤酒酵母提取物替代血浆蛋白粉可改善断奶仔猪的生长性能,降低仔猪腹泻率并促进肠绒毛发育[4]。啤酒酵母提取物替代鱼粉不影响凡纳滨对虾的生长性能,但可提高对虾营养物质消化率,增强血清溶菌酶活性[3]。酵母提取物替代鱼粉还能增加河蟹呈味游离氨基酸含量,改善蟹肉风味[5]。酵母提取物不仅具有诱食效果,还能刺激机体和细胞抗氧化系统,增强动物健康。饲料中添加0.01%啤酒酵母提取物显著增加草鱼血清中谷胱甘肽过氧化物酶和超氧化物歧化酶活性[6]。啤酒酵母提取物对梭鲈(Sander lucioperca L.)幼鱼和绵羊均具有较强的免疫刺激作用[7-8],其不仅激活机体体液和细胞免疫系统,且无任何毒副作用。尽管酵母提取物的生物活性已被人们所认知,但其作用机理仍不完全清楚,尤其对于水产动物的抗氧化作用以及酵母提取物的抗应激能力仍然缺乏进一步研究。因此,本试验以花鲈(Lateolabrax japonicus)幼鱼为试验动物,主要研究饲料中添加啤酒酵母提取物对花鲈生长性能、抗氧化和抗低氧胁迫能力的影响,以期为酵母提取物在鱼类饲料中的合理应用提供理论依据。
1 材料与方法 1.1 试验饲料试验共配制5组等氮等脂饲料,其组成及营养水平见表 1。以鱼粉、豆粕、菜籽粕和花生麸为蛋白质源,高精面粉为糖源,豆油和鱼油为脂肪源配制鱼粉含量为28%的饲料T1。在T1基础上,通过降低鱼粉用量,配制鱼粉含量为25%的饲料T2。在T2基础上,分别向饲料中添加0.1%(T3)、0.2%(T4)和0.3%(T5)的啤酒酵母提取物。啤酒酵母提取物由山东金城生物药业有限公司提供,主要由氨基酸、还原型谷胱甘肽和核苷酸组成,其粗蛋白质含量为58.2%、水分含量为3.8%、粗灰分含量为15.3%、谷胱甘肽含量为15.5%、总核苷酸含量为0.5%、总糖含量为0.5%。全部饲料原料均过60目筛网,维生素和矿物质预混料等微量组分采用逐级扩大法混匀,全部饲料混合均匀后用SLX-80型双螺杆挤压机(华南理工大学科技实业有限公司)制成直径为2.0 mm的颗粒饲料,55 ℃烘干后冷却至室温,饲料过20目筛网并装入密封袋中,于-20 ℃冰箱中保存备用。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experiment diets (DM basis) |
试验所用花鲈鱼苗购于福建诏安县英港育苗场,饲养试验在广东省农业科学院动物科学研究所室内循环水养殖系统中进行。养殖系统由15个圆柱形玻璃纤维桶(直径80 cm、高70 cm、容积350 L)组成,实际养殖水容量为300 L,进水速率为1.5 L/min。鱼苗先于室外水泥暂养池中暂养,每天投喂2次(08:00和18:00)肉鱼商品饲料(40%粗蛋白质、10%粗脂肪)。试验开始前,花鲈鱼苗禁食12 h,随后选取体格健壮、大小均匀、平均初始体重为(10.14±0.12) g的花鲈幼鱼525尾,随机分为5组,每组3个重复,每个重复35尾,分别投喂5种试验饲料。每日记录投喂量、死亡情况、水温和水质情况。分别于每天08:00和18:00各投喂1次,投喂量为鱼体重的4%~6%,饲养周期为56 d。试验期间水温为(27.4±2.4) ℃,pH 7.5~8.0,氨氮含量≤0.02 mg/L,亚硝酸盐含量≤0.01 mg/L,溶氧含量>5.0 mg/L。
1.3 样品采集与分析试验结束前12 h禁食,随后统计每桶花鲈的数量和总重量,计算末体重和增重率。每桶随机取12尾鱼,用40 mg/L的间氨基苯甲酸乙酯甲磺酸盐(MS-222)麻醉,称重后测体长。采用1 mL无菌注射器(预先用1 mg/mL肝素钠润洗)于尾静脉取血,室温下静置2 h,离心制备血清(3 500 r/min,10 min),置于-80 ℃保存,用于血清生化指标测定。每桶随机取6尾鱼解剖,剥离内脏团,分离肝脏、肠道、腹腔脂肪后称重,计算脏体比、肝体比和腹腔脂肪率。每桶随机取3尾鱼解剖,取肝脏于冷冻管中,置于-80 ℃保存,用于肝脏抗氧化酶活性测定。每桶随机取3尾鱼,称重后置于65 ℃烘干,用于全鱼体组成分析。
养殖试验结束后,每桶随机选取15尾鱼进行低氧胁迫试验,方法参照Zeng等[9]并做适当调整。低氧胁迫开始前,将循环水关闭,每桶中水量由300 L下调至50 L,水面距离桶底约10 cm,将1层透明的悬浮薄膜覆盖在水面上,防止空气和水体中氧气交换。试验期间使用便携式溶氧仪(Seven2Go,Mettler Toledo,美国)每隔30 min监测1次水体溶氧量。当水体溶氧量由初始值6.5 mg/L下降至1.0 mg/L时,记录每桶试验起始时间以及鱼的死亡情况。当对照组(未添加啤酒酵母提取物)中鱼的死亡率达到50%时,终止低氧胁迫试验。每桶随机取3尾活鱼,分别取血清和肝脏,置于-80 ℃保存,用于抗氧化酶活性指标测定。
饲料和全鱼样品中的水分含量采用105 ℃常压干燥法(GB/T 6435—1986)、粗蛋白质含量采用凯氏定氮法(GB/T 6432—1994)、粗脂肪含量采用乙醚抽提法(GB/T 6432—1994)、粗灰分含量采用550 ℃灼烧法(GB/T 6438—1992)。饲料总能采用氧弹量热仪(IKA-C2000,德国)进行测定。血清胆固醇(CHO)、甘油三酯(TG)、葡萄糖(GLU)、尿素氮(UN)、白蛋白(ALB)、球蛋白(GLB)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)含量及谷草转氨酶(AST)、谷丙转氨酶(ALT)活性采用全自动生化分析仪(日立7600,日本)进行测定。血清和肝脏的总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、碱性磷酸酶(AKP)、一氧化氮酶(NOS)、溶菌酶(LZM)活性及丙二醛(MDA)、抗超氧阴离子自由基(Anti-O2-·)含量采用商业试剂盒(南京建成生物工程研究所)并依照试剂盒说明书进行测定。血清免疫球蛋白M(IgM)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)含量使用酶联免疫吸附试验(ELISA)商业试剂盒(R & D Systems,Minneapolis,Minnesota,美国)并依照试剂盒说明书进行测定。
1.4 指标计算

|

|
采用SPSS 17.0统计软件中单因素方差分析(one-way ANOVA)和Duncan氏法均值多重比较法对试验结果的差异显著性进行分析处理,若不满足方差齐性则采用Dunnett-T3检验法进行多重比较。试验数据用平均值±标准误(mean±SE)表示,P < 0.05表示差异显著。
2 结果 2.1 啤酒酵母提取物对花鲈幼鱼生长性能的影响由表 2可知,T2组花鲈摄食量显著低于T1组(P < 0.05),T3~T5组花鲈摄食量与T1组无显著差异(P>0.05)。各组间末体重、增重率、特定生长率、成活率、饲料系数、蛋白质效率、肥满度、脏体比、肝体比、肠体比和腹脂率无显著差异(P>0.05)。
|
|
表 2 啤酒酵母提取物对花鲈幼鱼生长性能的影响 Table 2 Effects of brewers' yeast extract on growth performance of juvenile Japanese seabass |
由表 3可知,各组间全鱼水分、粗蛋白质、粗脂肪和粗灰分含量均无显著差异(P>0.05)。
|
|
表 3 啤酒酵母提取物对花鲈幼鱼体组成的影响(湿重基础) Table 3 Effects of brewers' yeast extract on body composition of juvenile Japanese seabass (wet weight basis) |
由表 4可知,各组间花鲈血清生化指标无显著差异(P>0.05)。随着啤酒酵母提取物添加量升高,花鲈血清过氧化氢酶活性增加,丙二醛和白细胞介素-6含量降低,T5组血清过氧化氢酶活性显著高于T2组(P < 0.05),T3~T5组血清丙二醛和白细胞介素-6含量均显著低于T2组(P < 0.05),其他血清抗氧化和非特异性免疫指标各组间无显著差异(P>0.05)。
|
|
表 4 啤酒酵母提取物对花鲈幼鱼血清生化、抗氧化和非特异性免疫指标的影响 Table 4 Effects of brewers' yeast extract on serum biochemical, antioxidant and non-specific immune indices of juvenile Japanese seabass |
由表 5可知,随着啤酒酵母提取物添加量升高,花鲈肝脏总抗氧化能力和过氧化氢酶活性增加,T4和T5组肝脏总抗氧化能力均显著高于T1~T3组(P < 0.05),T3~T5组肝脏过氧化氢酶活性显著高于T1组(P < 0.05),其他肝脏抗氧化指标各组间无显著差异(P>0.05)。
|
|
表 5 啤酒酵母提取物对花鲈幼鱼肝脏抗氧化指标的影响 Table 5 Effects of brewers' yeast extract on hepatic antioxidant indices of juvenile Japanese seabass |
由图 1可知,各组间3 h低氧胁迫花鲈累计死亡率均为0。6 h低氧胁迫,随着啤酒酵母提取物添加量升高,花鲈累计死亡率逐渐下降,T3~T5组累计死亡率显著低于T2组(P < 0.05)。由表 6可知,T4和T5组血清过氧化氢酶活性显著高于T1~T3组(P < 0.05),血清丙二醛含量显著低于T1和T2组(P < 0.05)。T4和T5组肝脏超氧化物歧化酶活性显著高于T1和T2组(P < 0.05),T3~T5组肝脏丙二醛含量显著低于T1和T2组(P < 0.05),其他血清和肝脏抗氧化指标各组间无显著差异(P>0.05)。
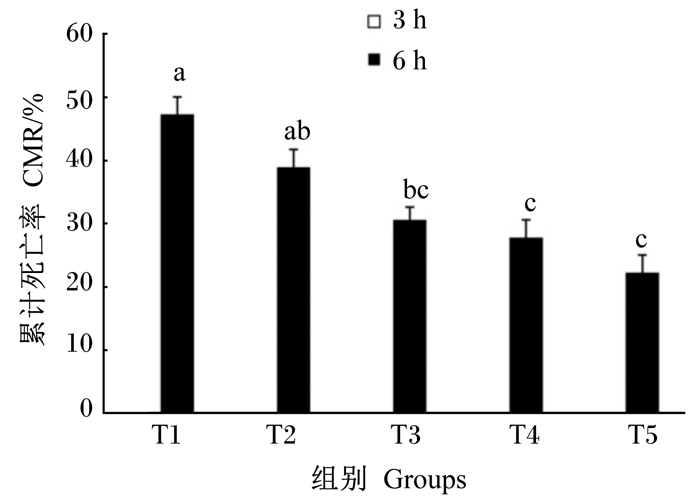
|
数据柱形标注不同字母表示差异显著(P < 0.05)。 Value columns with different letter superscripts mean significant difference (P < 0.05). 图 1 啤酒酵母提取物对低氧胁迫花鲈幼鱼累计死亡率的影响 Fig. 1 Effects of brewers' yeast extract on cumulative mortality rate of juvenile Japanese seabass suffered hypoxic challenges |
|
|
表 6 啤酒酵母提取物对低氧胁迫花鲈幼鱼血清和肝脏抗氧化指标的影响 Table 6 Effects of brewers' yeast extract on serum and hepatic antioxidant indices of juvenile Japanese seabass suffered hypoxic challenges |
本试验结果表明,饲料中鱼粉添加量由28%下降到25%时,花鲈幼鱼摄食量、末体重和增重率均下降,但啤酒酵母提取物的添加可弥补低鱼粉饲料花鲈生长性能的不足,说明饲料中添加啤酒酵母提取物可增加花鲈幼鱼的生长性能,减少鱼粉的用量,这对于节省饲料成本具有重要意义。有研究表明,啤酒酵母提取物富含小肽、氨基酸、核苷酸、谷胱甘肽等生物活性物质,能够增强鱼类自身免疫力,促进摄食和营养物质的消化吸收,改善饲料蛋白质等营养素的利用率[3]。酵母源物质也被报道对凡纳滨对虾、草鱼、斑点叉尾鮰、加州鲈、大菱鲆等水产动物具有促生长作用[3, 6, 10-12]。本试验选用的啤酒酵母提取物含有谷胱甘肽与核苷酸活性成分,花鲈生长性能的提高可能与二者的促生长作用密切相关。饲料中添加谷胱甘肽可提高鲈鱼幼鱼(Dicentrarchus labrax)的生长性能[13]。谷胱甘肽可促进鱼类摄食,提高生长速度,归因于谷胱甘肽能够破坏细胞生长抑素分子的二硫键、增加胰岛素样生长因子-Ⅰ(IGF-Ⅰ)含量的作用[14-15]。谷胱甘肽亦能提高鱼类细胞RNA表达水平,增加蛋白质合成量,从而促进水产动物生长[16]。
有研究表明,核苷酸对水产动物具有显著的促生长效果,因此通常作为动物诱食剂。核苷酸与肉食性鱼虾的味觉感应密切相关[17],已有文献报道,外源添加核苷酸可增加鱼类和甲壳类动物的摄食量[18-19],促进细胞分裂和生长,从而提高动物生长性能。核苷酸促生长机制可能是通过提高动物摄食率、减少营养物质溶失,使饲料中更多的营养物质参与机体生长代谢过程[20]。核苷酸亦能激活细胞蛋白激酶活性,诱导体内激素和代谢酶合成,促进蛋白质合成,达到增重的效果[21]。外源添加酵母核苷酸可减少花鲈饲料中4%的鱼粉用量,并提高增重率[22]。酵母核苷酸的促生长作用也在罗非鱼[23]、斑点叉尾[24]、黄颡鱼[25]、大黄鱼[26]中有相关报道。本试验结果表明,饲料中添加0.1%~0.3%的啤酒酵母提取物可节省3%的鱼粉用量,并提高花鲈幼鱼的生长性能,这与王武刚[3]在凡纳滨对虾、尹子煜等[27]在异育银鲫上的试验结果相似。
3.2 啤酒酵母提取物对花鲈幼鱼血清和肝脏抗氧化指标的影响酵母提取物的抗氧化作用一般归因于自身含有的核苷酸、多糖(如β-葡聚糖、甘露寡糖)和一些活性物质。本试验所用啤酒酵母提取物主要活性物质为核苷酸和谷胱甘肽,花鲈血清抗氧化能力的升高,可能与二者作用密切相关。有研究表明,动物体内参与抗氧化调控的组织或细胞合成核苷酸能力有限,需要外源补充核苷酸[28]。核苷酸化学结构中的碱性氮原子可以捕捉机体氧化过程形成的自由基,具有保护血细胞膜脂质过氧化及氧化损伤造成的红细胞破裂作用[29]。核苷酸还具有增强巨噬细胞吞噬作用以及强化自然杀伤细胞活性,从而提高机体抵抗外源应激的能力[30]。谷胱甘肽能够促进机体内过氧化氢(H2O2)、有机氢过氧化物和脂质氢过氧化物的还原,减轻细胞氧化损伤,清除体内过量的氧自由基[6]。饲料中添加谷胱甘肽可提高罗非鱼和对虾血清中谷胱甘肽还原酶活性[31-32],增强抗氧化相关基因mRNA表达[14, 33],从而提高机体抗氧化能力。谷胱甘肽可增强花鲈血清谷胱甘肽过氧化物酶、谷胱甘肽转移酶活性,提高花鲈血清抗氧化力[34]。啤酒酵母提取物的抗氧化作用可能通过激活抗氧化酶活性、减少自由基等氧化因子含量的途径实现,但其作用机理有待进一步阐明。
肝脏是鱼类最主要的氧化应激器官,由氧化应激导致的肝脏损伤通常会引起鱼体的多器官功能障碍,严重影响养殖经济效益。本试验结果表明,饲料中添加啤酒酵母提取物可提高花鲈幼鱼肝脏总抗氧化能力和过氧化氢酶活性。过氧化氢酶可以催化H2O2(存在于活体组织中的活性氧)分解而维持体内H2O2平衡,是一种重要的防御细胞过氧化损伤的抗氧化酶。花鲈肝脏总抗氧化能力的升高可能是由于过氧化氢酶活性升高的原因。啤酒酵母提取物增强鱼类肝脏过氧化氢酶活性的机制尚不清楚,可能与啤酒酵母提取物中含有的活性物质如核苷酸、谷胱甘肽有关。饲料中添加谷胱甘肽可显著增加罗非鱼[14]和黄颡鱼[35]幼鱼肝脏氧化氢酶活性,归因于谷胱甘肽上调相应抗氧化酶mRNA表达量的结果。因此,啤酒酵母提取物增强花鲈肝脏抗氧化状态的作用可以归因于啤酒酵母提取物自身含有的核苷酸和谷胱甘肽的抗氧化作用。
3.3 啤酒酵母提取物对花鲈血清免疫指标的影响酵母提取物是通过水解酵母细胞得到的水溶性细胞内含物,相比于酵母粉、酵母细胞壁等物质更容易被动物消化,且含有更加丰富的氨基酸、核苷酸、免疫因子等活性物质,可作为水产动物免疫调节剂[36]。啤酒酵母提取物可激活鲤鱼的免疫系统,上调免疫相关基因表达量,发挥其免疫刺激作用[37]。酵母提取物对白梭吻鲈(Sander lucioperca)[36]、凡纳滨对虾[38]等水产动物的免疫调节作用也有类似报道。本试验结果表明,饲料中添加啤酒酵母提取物可显著降低花鲈血清白细胞介素-6和丙二醛含量,说明啤酒酵母提取物能够增强花鲈血清免疫能力。
3.4 啤酒酵母提取物对花鲈抗低氧胁迫能力的影响缺氧是水产养殖中最重要的环境变量之一,是水产动物经常遭受的一种极端不利的养殖条件。缺氧影响动物行为和生理生化机制,容易导致机体和细胞氧化损伤[39],甚至造成水产动物大量死亡[40]。有研究表明,鱼类主要通过激活酶系统来对抗氧化应激,如超氧化物歧化酶、过氧化氢酶、谷胱甘肽酶、谷胱甘肽过氧化物酶等。抗氧化酶在水产动物抵抗低氧应激过程中发挥至关重要的作用,相关研究已在大口黑鲈(Micropterus salmoides)[39]、鲤鱼(Cyprinus carpio)[41]、黄颡鱼(Pelteobagrus fulvidraco)[42]、斑马鱼(Danio rerio)[43]中进行报道。
本试验结果表明,花鲈6 h低氧胁迫的累计死亡率随着啤酒酵母提取物添加量的增加而降低,说明饲料中添加啤酒酵母提取物可增强花鲈抗低氧胁迫的能力。低氧胁迫下,花鲈累计死亡率的下降可能归因于机体抗氧化能力的提高,反映在花鲈血清过氧化氢酶和肝脏超氧化物歧化酶活性的升高,血清和肝脏中丙二醛含量的降低。与过氧化氢酶相似,超氧化物歧化酶是生物体内重要的抗氧化酶之一,它可对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,削弱自由基对细胞的伤害,消除有害物质[44]。丙二醛是多不饱和脂肪酸过氧化的产物,直接反映了脂质过氧化水平。丙二醛的积累会导致组织损伤和致死作用[45]。目前,有关啤酒酵母提取物增强鱼类抗低氧应激的作用尚无报道,其作用机理可能通过啤酒酵母提取物中核苷酸、谷胱甘肽等活性物质激活机体抗氧化酶系统,减少自由基生成和脂质过氧化,从而发挥抗氧化作用效果,提高花鲈抗氧化应激能力。
4 结论饲料中添加0.1%~0.3%的啤酒酵母提取物可提高花鲈幼鱼的生长性能,改善血清和肝脏抗氧化状态,提高花鲈抵抗低氧胁迫的能力。
| [1] |
俸家富, 赵平武, 王东. 血液中总抗氧化态与疾病的关系[J]. 国际检验医学杂志, 2009, 30(6): 571-573. DOI:10.3760/cma.j.issn.1673-4130.2009.06.018 |
| [2] |
FERREIRA I M P L V O, PINHO O, VIEIRA E, et al. Brewer's Saccharomyces yeast biomass:characteristics and potential applications[J]. Trends in Food Science & Technology, 2010, 21(2): 77-84. |
| [3] |
王武刚.酵母提取物替代鱼粉在凡纳滨对虾饲料中的应用研究[D].硕士学位论文.上海: 上海海洋大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10264-1013000320.htm
|
| [4] |
刘明, 谭利伟, 杨凤娟, 等. 啤酒酵母提取物替代血浆蛋白粉对断奶仔猪生产性能、腹泻发生率和肠道形态的影响[J]. 中国畜牧杂志, 2017, 53(2): 116-121. |
| [5] |
陈春燕, 姚杰宝, 黄旭雄, 等. 饲料中鱼粉用量及添加酵母提取物对中华绒螯蟹幼蟹蜕壳及蟹体游离氨基酸组成的影响[J]. 中国水产, 2013(11): 58-61. DOI:10.3969/j.issn.1002-6681.2013.11.024 |
| [6] |
彭凯, 孙育平, 王国霞, 等. 5种酵母源物质对草鱼生长性能、肌肉品质和血清指标的影响[J]. 饲料工业, 2018, 39(20): 16-22. |
| [7] |
JARMOŁOWICZ S, ZAKEŚ Z, SIWICKI A, et al. Effects of brewer's yeast extract on growth performance and health of juvenile pikeperch Sander lucioperca (L.)[J]. Aquaculture Nutrition, 2012, 18(4): 457-464. DOI:10.1111/j.1365-2095.2011.00915.x |
| [8] |
WOJCIK R. Effect of brewers's yeast (Saccharomyces cerevisiae) extract on selected parameters of humoral and cellular immunity in lambs[J]. Bulletin-Veterinary Institute in Pulawy, 2010, 54(2): 181-187. |
| [9] |
ZENG L, WANG Y H, AI C X, et al. Effects of β-glucan on ROS production and energy metabolism in yellow croaker (Pseudosciaena crocea) under acute hypoxic stress[J]. Fish Physiology and Biochemistry, 2016, 42(5): 1395-1405. DOI:10.1007/s10695-016-0227-1 |
| [10] |
ROBINETTE H R, YOUNG C, 孟繁伊. 酵母培养物对斑点叉尾鮰幼鱼生长性能的影响[J]. 饲料工业, 2011, 32(6): 25-27. |
| [11] |
曾本和, 杨文娇, 吴振, 等. 酵母水解物对加州鲈幼鱼生长性能及免疫酶指标的影响[J]. 饲料工业, 2016, 37(14): 11-15. |
| [12] |
柳茜, 杨文娇, 吴振, 等. 酵母水解物对大菱鲆幼鱼非特异性免疫及抗应激能力的影响[J]. 饲料工业, 2015, 36(18): 33-37. |
| [13] |
INFANTE J L Z, CAHU C L, PERES A. Partial substitution of di-and tripeptides for native proteins in sea bass diet improves Dicentrarchus labrax larval development[J]. The Journal of Nutrition, 1997, 127(4): 608-614. DOI:10.1093/jn/127.4.608 |
| [14] |
周婷婷, 曹俊明, 黄燕华, 等. 饲料中添加谷胱甘肽对吉富罗非鱼肝脏生长及抗氧化相关基因mRNA表达量的影响[J]. 广东农业科学, 2012, 39(14): 146-149. DOI:10.3969/j.issn.1004-874X.2012.14.045 |
| [15] |
赵红霞, 曹俊明, 朱选, 等. 日粮添加谷胱甘肽对草鱼生长性能血清生化指标和体组成的影响[J]. 动物营养学报, 2008, 20(5): 540-546. DOI:10.3969/j.issn.1006-267X.2008.05.008 |
| [16] |
梁萌青, 王成刚, 陈超, 等. 几种添加剂对红鳍东方鲀的促生长效果与RNA/DNA关系[J]. 海洋水产研究, 2001, 22(2): 38-41. |
| [17] |
胡俊茹, 曹俊明, 黄燕华, 等. 几种诱食剂对凡纳滨对虾生长、血清生化指标和肝胰腺消化酶的影响[J]. 淡水渔业, 2010, 40(2): 30-35. DOI:10.3969/j.issn.1000-6907.2010.02.006 |
| [18] |
RUMSEY G L, WINFREE R A, HUGHES S G. Nutritional value of dietary nucleic acids and purine bases to rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1992, 108(1/2): 97-110. |
| [19] |
许丹丹, 曹俊明, 黄燕华, 等. 饲料中添加核苷酸对凡纳滨对虾幼虾生长、肠道形态及抗氧化酶活力的影响[J]. 中国水产科学, 2011, 18(5): 1115-1124. |
| [20] |
LI P, GATLIN Ⅲ D M. Nucleotide nutrition in fish:current knowledge and future applications[J]. Aquaculture, 2006, 251(2/3/4): 141-152. |
| [21] |
曹俊明, 许丹丹, 黄燕华, 等. 饲料中添加核苷酸对凡纳滨对虾幼虾生长、组织生化组成及非特异性免疫功能的影响[J]. 水产学报, 2011, 35(4): 594-603. |
| [22] |
伏枥龙, 曹俊明, 黄燕华, 等.植物蛋白部分替代鱼粉饲料添加四种物质对花鲈生长性能和生化指标的影响[C]//第九届世界华人鱼虾营养学术研讨会论文集.厦门: 中国水产学会, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=8695809
|
| [23] |
RAMADAN A, ATEF M, AFIFI N A. Effect of the biogenic performance enhancer (Ascogen "S") on growth rate of tilapia fish[J]. Experimental Cell Research, 1991, 87: 304-306. |
| [24] |
王锐, 李琴, 朱惠玲, 等. 外源核苷酸对斑点叉尾生长及肠道组织发育的影响[J]. 水产科学, 2010, 29(12): 718-720. DOI:10.3969/j.issn.1003-1111.2010.12.006 |
| [25] |
牛凤池, 黄燕华, 曹俊明, 等. 5种添加剂对黄颡鱼生长性能、体成分及血清生化指标的影响[J]. 动物营养学报, 2015, 27(7): 2176-2183. DOI:10.3969/j.issn.1006-267x.2015.07.023 |
| [26] |
吴文俊, 周飘萍, 黎明, 等. 饲料中添加不同核苷酸对大黄鱼生长、血液指标及血清酶活性的影响[J]. 宁波大学学报, 2014, 27(2): 7-12. |
| [27] |
尹子煜, 薛敏, 郑银桦, 等. 酵母提取物在异育银鲫饲料中促摄食作用的研究[J]. 饲料工业, 2017, 38(8): 4-8. |
| [28] |
王广军, 朱旺明, 谭永刚, 等. 酵母核苷酸对凡纳滨对虾生长、免疫以及抗应激影响的研究[J]. 饲料工业, 2006, 27(8): 29-32. DOI:10.3969/j.issn.1001-991X.2006.08.008 |
| [29] |
周兴华, 石芸, 罗孟川, 等. 酵母核苷酸对锦鲤幼鱼生长、体组成及饲料利用影响[J]. 粮食与饲料工业, 2009(2): 36-37, 40. DOI:10.3969/j.issn.1003-6202.2009.02.014 |
| [30] |
CARVER J D, COX W I, BARNESS L A. Dietary nucleotide effects upon murine natural killer cell activity and macrophage activation[J]. Journal of Parenteral and Enteral Nutrition, 1990, 14(1): 18-22. DOI:10.1177/014860719001400118 |
| [31] |
梁春梅.还原型谷胱甘肽对尼奥罗非鱼幼鱼生长、免疫功能的影响及机理研究[D].硕士学位论文.广州: 华南农业大学, 2006.
|
| [32] |
刘晓华, 曹俊明, 吴建开, 等.饲料中添加谷胱甘肽对凡纳滨对虾肝胰腺抗氧化指标和脂质过氧化物含量的影响[J].水产学报, 31(2): 235-240. http://www.cnki.com.cn/Article/CJFDTotal-SCKX200702015.htm
|
| [33] |
刘晓华.谷胱甘肽对凡纳滨对虾抗氧化防御的调控机理[D].博士学位论文.武汉: 华中农业大学, 2010. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CDFD&filename=1011405639.nh
|
| [34] |
李国明, 孙育平, 王国霞, 等. 饲料中添加谷胱甘肽对花鲈幼鱼生长性能、血清生化指标和抗氧化能力的影响[J]. 动物营养学报, 2019, 31(7): 3207-3217. |
| [35] |
ZHAO H X, CAO J M, HUANG Y H, et al. Effects of dietary nucleotides on growth, physiological parameters and antioxidant responses of juvenile Yellow Catfish Pelteobagrus fulvidraco[J]. Aquaculture Research, 2017, 48(1): 214-222. DOI:10.1111/are.12875 |
| [36] |
JARMOLOWICZ S, ZAKEŚ Z, SIWICKI A, et al. Immunomodulatory effect of dietary brewer's yeast extract in Sander lucioperca juveniles against the challenge of Aeromonas salmonicida[J]. Aquaculture International, 2013, 21(4): 939-945. DOI:10.1007/s10499-012-9546-0 |
| [37] |
BISWAS G, KORENAGA H, TAKAYAMA H, et al. Cytokine responses in the common carp, Cyprinus carpio L. treated with baker's yeast extract[J]. Aquaculture, 2012, 356/357: 169-175. DOI:10.1016/j.aquaculture.2012.05.019 |
| [38] |
黄旭雄, 罗词兴, 危立坤, 等. 饲料中添加酵母提取物对凡纳滨对虾免疫相关基因表达及抗菌机能的影响[J]. 水产学报, 2014, 38(12): 2049-2058. |
| [39] |
YANG S, YAN T, WU H, et al. Acute hypoxic stress:effect on blood parameters, antioxidant enzymes, and expression of HIF-1 alpha and GLUT-1 genes in Largemouth bass (Micropterus salmoides)[J]. Fish & Shellfish Immunology, 2017, 67: 449-458. |
| [40] |
POLLOCK M S, CLARKE L M J, DUBE M G. The effects of hypoxia on fishes:from ecological relevance to physiological effects[J]. Environmental Reviews, 2007, 15(NA): 1-14. DOI:10.1139/a06-006 |
| [41] |
LUSHCHAK V I, BAGNYUKOVA T V, LUSHCHAK O V, et al. Hypoxia and recovery perturb free radical processes and antioxidant potential in common carp (Cyprinus carpio) tissues[J]. The International Journal of Biochemistry & Cell Biology, 2005, 37(6): 1319-1330. |
| [42] |
YANG K, FAN Q X, ZHANG L, et al. Effect of dissolved oxygen levels on growth performance, energy budget and antioxidant responses of yellow catfish, Pelteobagrus fulvidraco (Richardson)[J]. Aquaculture Research, 2015, 46(8): 2025-2033. DOI:10.1111/are.12359 |
| [43] |
FENG J F, GUO Y, GAO Y F, et al. Effects of hypoxia on the physiology of zebrafish (Danio rerio):initial responses, acclimation and recovery[J]. Bulletin of Environmental Contamination and Toxicology, 2015, 96(1): 43-48. |
| [44] |
张立颖, 赵萌, 王跃智. 水生生物超氧化物岐化酶的研究进展[J]. 江西农业大学学报, 2012, 34(4): 800-804. DOI:10.3969/j.issn.1000-2286.2012.04.031 |
| [45] |
BUEGE J A, AUST S D. Microsomal lipid peroxidation[J]. Methods in Enzymology, 1978, 52: 302-310. DOI:10.1016/S0076-6879(78)52032-6 |




