2. 内蒙古毒物监控及毒理学重点实验室, 通辽 028000
2. Inner Mongolia Key Laboratory of Toxicant Monitoring and Toxicology, Tongliao 028000, China
动物肠道内存在着一个数量巨大的菌群生态系统,这些菌群与其宿主动物相互作用,对动物生理功能产生了重要影响[1-2]。多数情况下,这种影响是有益的,能够增强动物免疫力、促进营养吸收,在抑制外来有害菌群、保护动物肠道健康方面也起到了重要作用[3]。因此,益生菌对动物生理功能及肠道菌群的改善引起了人们的关注。目前对水生生物肠道菌群的研究集中于2个方面:一是对鱼类肠道菌群组成的研究。例如,黄丽丽等[4]用16S rRNA基因高通量测序的方法研究了新疆额尔齐斯河流域的多种冷水鱼类,包括狗鱼(Esox reicherti)、哲罗鱼(Hucho taimen)、细鳞鲑的肠道微生物菌群结构,在门和属的水平上揭示了鱼类肠道菌群的组成。Wu等[5]研究发现草鱼(Ctenopharyngodon idellus)肠道内含有大量纤维素降解菌,其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)是草鱼肠道的核心菌群。二是对鱼类肠道菌群调控的研究,目的是通过调控肠道菌群来改善动物的免疫、生长、营养等状态。例如,Nikoskelainen等[6]使用鼠李糖乳杆菌(Lactobacillus rhamnosus)调控虹鳟(Oncorhynchus mykiss)肠道菌群组成,增加了乳杆菌、双歧杆菌(Bifidobacterium)等有益菌的数量,并抑制了有害菌的增殖。尹军霞等[7]给鲫鱼(Carassius auratus)饲喂添加乳酸杆菌的饲料,通过培养基分离培养的方法发现益生菌投喂增加了鲫鱼肠道双歧杆菌及乳酸杆菌的数量。在营养调控方面,Bogut等[8]发现益生菌复合制剂能够改善鲤鱼(Cyprinus carpio)的生长速度和饲料转化率。Hoseinifar等[9]发现嗜酸乳杆菌(Lactobacillus acidophilus)能提高养殖10周的剑尾鱼(Xiphophorus helleri)皮肤黏膜免疫功能,还能提高其增重率及特定生长率,降低饲料转化率。Gioacchini等[10]使用鼠李糖乳杆菌饲喂斑马鱼(Danio rerio),发现益生菌促进了斑马鱼的排卵数量及破膜率,卵母细胞成熟相关基因的表达上调。
细鳞鲑(Brachymystax lenok)是一种常年生活在低温水环境下的冷水鱼类,其生活水温通常不超过18 ℃[11]。因此,在低温条件下,益生菌能否影响肠道菌群并发挥其功能,有待探索验证。植物乳杆菌(Lactobacillus plantarum)是饲料及食品中常用的益生菌,可分泌乳酸,抑制有害菌,帮助分解胆固醇及脂类,提高动物免疫力和健康水平[12]。本文拟就植物乳杆菌在冷水鱼细鳞鲑肠道菌群调控中的作用进行研究,为冷水鱼中益生菌的研究及应用提供参考。
1 材料与方法 1.1 试验设计饲养试验在内蒙古民族大学冷水鱼养殖实验室内进行,具有水温调控系统和过滤系统。细鳞鲑鱼苗购自丹东凤城冷水鱼养殖基地,鱼苗体长6~7 cm,体重5~8 g,先预养殖20 d。将试验鱼于6个养殖桶内养殖,养殖桶高1.5 m,直径1.5 m,底部直径1.2 m,每桶投放25尾。将6个养殖桶编号,A1、A2、A3分至对照组,B1、B2、B3分至试验组,对照组投喂基础饲料,试验组投喂添加植物乳杆菌(购自中国科学院微生物研究所)饲料,每日投喂2次,日投喂量占鱼体重的10%~15%(根据鱼类摄食情况调节投喂量),每日使用吸底器吸除底部残留的鱼饵和粪便。试验期间,2~3 d换水1次,换水量为总水量的40%~60%;养殖水温控制在12~15 ℃,溶氧水平控制在6 mg/mL以上,pH为6.7±0.4,循环水流动从养殖桶顶部流下。养殖起始时间为2017年11月15日,结束时间为2018年1月10日,试验期56 d。
1.2 饲料制备饲养试验使用自制的全价配合颗粒饲料,粒径2~3 mm,基础饲料组成及营养水平见表 1。试验组饲料是在基础饲料上喷植物乳杆菌菌液,使每克饲料中植物乳杆菌活菌数量达到1×106 CFU。
|
|
表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
在养殖28和56 d时各采样1次,其中28 d时仅测定体长、体重,并每桶取3条鱼解剖取肝脏称重。取样前停食24 h,先对各桶鱼进行计数,称重,测量体长,计算特定生长率。每桶取3尾规格基本一致的鱼,先用MS-222麻醉,然后用70%酒精擦拭鱼体表面,在超净台内无菌操作,解剖、分离并取出肝脏,对肝脏称重,分离并取出中后肠段的内容物,然后用灭菌解剖刀刮取肠道内侧黏膜,与内容物混合后,液氮速冻,-80 ℃保存。
1.4 生长指标的计算

|
取约0.5 g肠道内容物与黏膜混合样品,按照使用MP-bio土壤DNA提取试剂盒说明提取细菌基因组,将提取的DNA进行1.5%琼脂糖凝胶电泳,并用Nanodrop对DNA的浓度和OD260 nm/OD280 nm值进行测定。
首先针对16S rRNA基因的V3~V4区设计引物,引物两端带有12 bp的barcode,用以识别不同样品的序列。然后进行PCR扩增,程序如下:95 ℃预变性3 min,之后进入扩增循环,循环数27,循环过程为95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,最后是72 ℃延伸10 min。扩增产物使用2%浓度的琼脂糖凝胶进行电泳检测;使用Thermo Scientific公司的GeneJET胶回收试剂盒回收产物;使用Illumina测序专用的NEB Next® UltraTM DNA Library Prep Kit试剂盒按照说明建立基因克隆文库。构建好的文库经过Qubit定量和检测合格后,基于Illumina Miseq PE300平台进行高通量测序(上海美吉生物工程有限责任公司)。
使用Usearch(version 7.0)软件(http://drive5.com/uparse/),将所得序列根据97%相似度关系进行操作分类单元(OTU)聚类分析,产生OTU表,并与Silva数据库(http://www.arb-silva.de)比对进行分类学分析,所用平台为Qiime平台(http://qiime.org/scripts/assign_taxonomy.html),统计后得到各样本的群落组成。然后对群落进行基于OTU水平的α多样性分析,所用软件为Mothur(version v.1.30.1,http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity),分析指标包括Sobs指数、Shannon指数、Chao指数、Simpson指数、Ace指数以及覆盖度(coverage)。肠道菌群组成分析及热图使用R语言工具作图,主成分分析(PCA)采用R语言的vegan软件包进行分析和作图。
1.6 数据统计与分析试验数据经Excel 2007软件初步整理后,使用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),采用Tukey法进行平均值间的多重比较,P < 0.05为差异显著,描述性统计值以平均值±标准差(mean±SD)表示。
2 结果与分析 2.1 植物乳杆菌对细鳞鲑生长的影响由表 2可知,经过56 d的养殖,对照组试验鱼体重为(18.23±0.45) g/尾,试验组试验鱼体重为(19.08±0.14) g/尾,组间差异显著(P < 0.05);试验组的增重率在养殖28及56 d时均显著高于对照组(P < 0.05)。试验组的特定生长率在养殖28及56 d时均显著高于对照组(P < 0.05)。在体长和肝体指数方面,试验组与对照组在养殖28及56 d时均差异不显著(P>0.05)。
|
|
表 2 植物乳杆菌对细鳞鲑生长的影响 Table 2 Effects of Lactobacillus plantarum on growth of Brachymystax lenok |
获得原始序列数1 228 410条,经过质量控制,包括去除质量值低于20的尾部碱基及含氮的碱基,根据双端序列间的重叠关系进行序列拼接,通过末端条形码识别得到每个样本的序列,最终得到优化序列数312 339条,平均序列长度为444.85 bp。其中对照组获得的有效序列数为43 165条,试验组获得的有效序列数为58 910条,2组之间差异显著(P < 0.05)(表 3)。在后续分析中,为降低统计误差,将每个样本序列数抽平至37 818条。
|
|
表 3 细鳞鲑肠道菌群α多样性指数 Table 3 α diversity indexes of intestinal microbial flora of Brachymystax lenok |
|
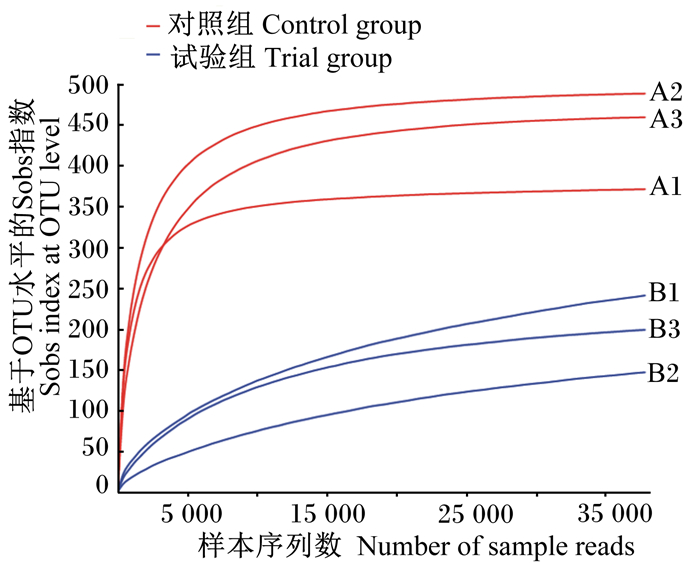
图 1 基于OTU水平的肠道菌群稀释曲线 Fig. 1 Rarefaction curve of intestinal microbial flora at OTU level |
|
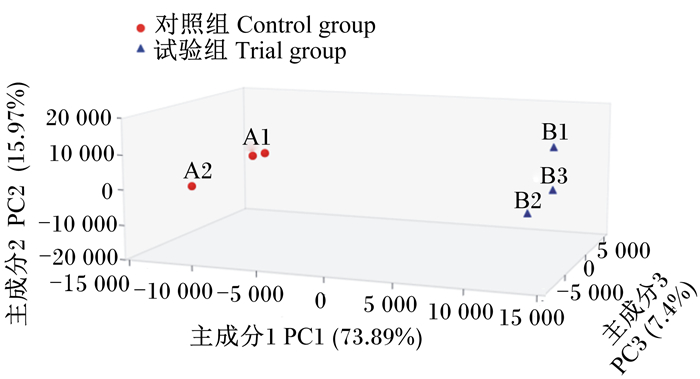
蓝色坐标点对应试验组样本,红色坐标点对应对照组样本,Stress值< 0.05,说明分析结果具有很好的代表性。 Coordinate points with blue color represent the samples of trial group, and coordinate points with red color represent the samples of control group. The Stress value which is below 0.05, indicates the reliability of the result. 图 4 基于OTU水平的肠道菌群PCA Fig. 4 PCA of intestinal microbial flora at OTU level |
各组的覆盖度均约等于1.00,说明了该测序结果已基本覆盖样本的多样性。基于97%相似性水平划分得到810个OTU,它们分别归属644个种、454个属、213科、113目、53纲、26门。ɑ多样性指数包括Sobs指数、Shannon指数、Simpson指数、Ace指数、Chao指数,对对照组和试验组ɑ多样性指数的平均值进行显著性分析,结果显示2组之间上述指标均存在着显著差异(P < 0.05)(表 3)。此外,Sobs指数由对照组的439降低到试验组的196,组间差异显著(P < 0.05)(表 3),表明植物乳杆菌的添加显著降低了样本中所观察到的物种数目;Shannon指数由对照组的4.018 3降低到了试验组的1.327 5,Simpson指数由对照组的0.098 6升高到了试验组的0.402 9,表明对照组细鳞鲑肠道菌群多样性较试验组肠道高,植物乳杆菌的添加显著降低了细鳞鲑肠道菌群多样性;Chao指数由对照组的446.299 2降低到了试验组的249.347 6,Ace指数由对照组的443.724 4降低到了试验组的251.130 7,表明对照组细鳞鲑肠道菌群物种丰富度较试验组高,植物乳杆菌的添加显著降低了细鳞鲑肠道菌群物种丰富度。稀释曲线(图 1)显示,各样本曲线均已进入平台期,表明测序深度可靠,能够真实反映样本中大多数微生物组成情况。
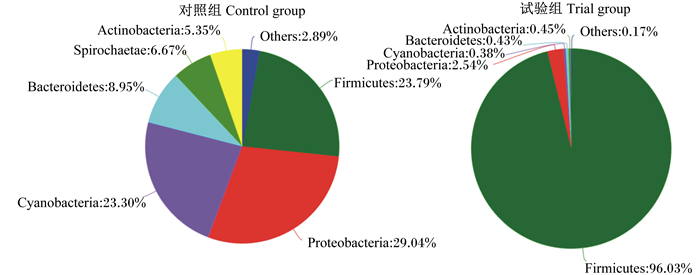
2.3 植物乳杆菌对细鳞鲑肠道菌群组成的影响在门水平上,试验组肠道菌群中,厚壁菌门的丰度达96.03%,占绝对优势,变形菌门的丰度为2.54%,其他门类的丰度均低于1%。对照组肠道菌群中,厚壁菌门的丰度为23.79%,相比试验组差异显著(P < 0.05),蓝细菌门(Cyanobacteria)的丰度为23.30%,拟杆菌门(Bacteroidetes)的丰度为8.95%,螺旋菌门(Spirochaetae)的丰度为6.67%,放线菌门(Actinobacteria)的丰度为5.35%,丰度低于1%的物种的总丰度很高,达到41.28%。
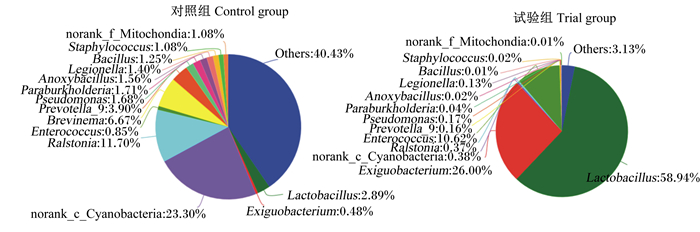
在属水平上,对照组和试验组肠道菌群组成差别也很大。对照组中丰度在1%以上的属有11个,丰度低于1%的属的总丰度达41.76%,其中丰度相对较高的菌属有未命名_蓝细菌门(norank_c_Cyanobacteria)(23.30%)、劳尔氏菌属(Ralstonia)(11.70%)、短螺旋体属(Brevinema)(6.67%)、普氏菌属(Prevotella)(3.90%)和乳杆菌属(Lactobacillus)(2.89%)。而试验组中丰度高于1%的菌属仅有3个,以乳杆菌属的丰度最高,占58.94%,微小杆菌属(Exiguobacterium)占26.00%,肠球菌属(Enterococcus)占10.62%,其他丰度低于1%的菌属的总丰度仅占4.44%。
|
Firmicutes:厚壁菌门;Proteobacteria:变形菌门;Cyanobacteria:蓝细菌门;Bacteroidetes:拟杆菌门;Spirochaetae:螺旋菌门;Actinobacteria:放线菌门;Others:其他。 图 2 基于门水平的肠道菌群组成 Fig. 2 Composition of intestinal microbial flora at phylum level |
|
Ralstonia:劳尔氏菌属;Brevinema:短螺旋体属;Prevotella:普氏菌属;Lactobacillus:乳杆菌属;Exiguobacterium:微小杆菌属;Enterococcus:肠球菌属;Staphylococcus:葡萄球菌属;norank_f_Mitochondia:未命名_线粒体;Bacillus:芽孢杆菌属;norank_c_Cyanobacteria:未命名_蓝细菌门;Legionella:军团菌属;Paraburkholderia:副伯克氏菌属;Anoxybacillus:无氧芽孢杆菌属;Pseudomonas:假单胞菌属;Exiguobacterium:微小杆菌属;Others:其他。 图 3 基于属水平的肠道菌群组成 Fig. 3 Composition of intestinal microbial flora at genus level |
三维PCA图(图 4)显示,来自试验组和对照组的肠道菌群样本分别聚类成2个群体,这种聚类主要体现在主成分1(PC1)上,PC1坐标轴的影响因素占总成分的73.89%。Venn图(图 5)分析显示,在所有样本的1 107个OTU中,共有OTU数为359个,占OTU总数的32.40%;对照组特有OTU数达到了418个,占OTU总数的37.80%;而试验组特的OTU数为34个,仅占OTU总数的3.10%。试验组OTU数(393个)远少于对照组(777个),使得物种丰富度降低约49.42%。
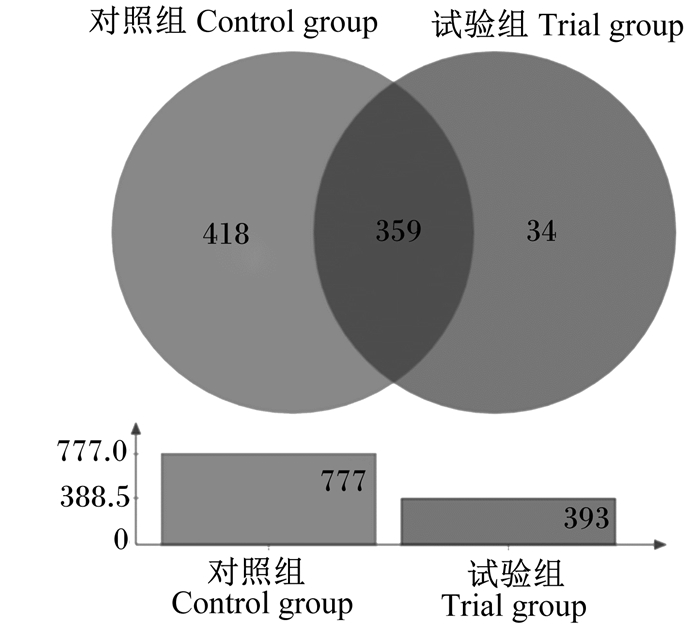
|
图 5 基于OTU水平的肠道菌群Venn图 Fig. 5 Venn diagram of intestinal microbial flora at OTU level |
为反映细鳞鲑肠道菌群与植物乳杆菌处理的关系,进行了热图构建分析(图 6),图中不同的颜色代表了不同菌群的丰度,左侧代表基于属水平的菌群系统发育进化树,图中顶端代表样品聚类关系。热图显示,对照组的3个样本彼此临近,而试验组的3个样本彼此临近,2组样本各自聚类成1个群体,结合菌群的进化关系,说明2组细鳞鲑肠道菌群组成差别明显。从热图还可以看出,添加植物乳杆菌导致许多菌属受到抑制甚至从肠道菌群中消失,如葡萄球菌属(Staphylococcus)、杆菌属(Geobacillus)、梭菌科-1属(Clostridiaceae_1)、芽孢杆菌属(Bacillus)、无氧芽孢杆菌属(Anoxybacillus)、芽孢八叠球菌属(Sporosarcina)、副伯克氏菌属(Paraburkholderia)、链球菌属(Streptococcus)、类诺卡氏菌属(Nocardioides)、气单胞菌属(Aeromonas)、普氏菌属等。此外,相比对照组,试验组中肠球菌属、乳杆菌属、微小杆菌属这3个菌属的丰度增加明显。与之对应的是,Venn图显示多达284个OTU从试验组中消失(图 5),说明添加的植物乳杆菌在细鳞鲑肠道内抑制了多种菌群的生长,改变了其菌群组成。
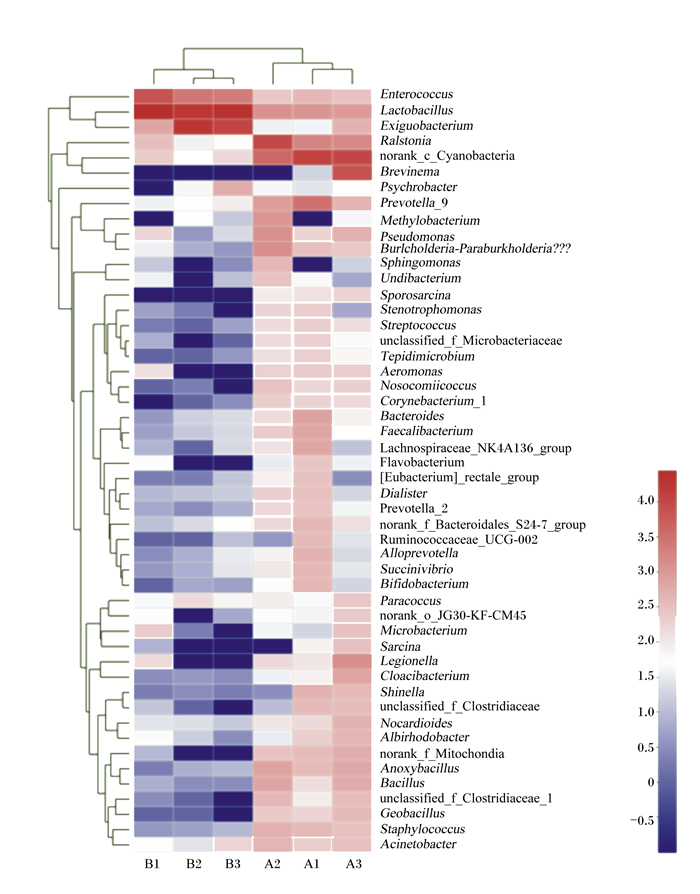
|
Enterococcus:肠球菌属;Lactobacillus:乳杆菌属; Exiguobacterium:微小杆菌属; Ralstonia:劳尔氏菌属; norank_c_Cyanobacteria:未命名_蓝细菌门; Brevinema:短螺旋体属; Psychrobacter:嗜冷杆菌属; Prevotella_9:普氏菌属_9;Methylobacterium:甲基杆菌属; Pseudomonas:假单孢菌属; Paraburkholderia:副伯克氏菌属; Sphingomonas:鞘氨醇单胞菌属; Undibacterium:属于草酸杆菌科未定;Sporosarcina:芽孢八叠球菌属; Stenotrophomonas:寡养单胞菌属; Streptococcus:链球菌属; unclassified_f_Microbacteriaceae:未分类_微杆菌科; Tepidimicrobium:一种微菌属; Aeromonas:气单胞菌属; Nosocomiicoccus:一种分离自医院的球菌未定; Corynebacterium_1:棒状杆菌属_1;Bacteroides:拟杆菌属; Faecalibacterium:粪杆菌属; [Eubacterium]_rectale_group:真杆菌属直肠组; Dialister:小类杆菌属; Prevotella_2:普氏菌属_2;norank_f_Bacteroidales_S24-7_group:未命名_拟杆菌目_S24-7组; Ruminococcaceae_UCG-002:瘤胃菌科_UCG-002;Alloprevotella:拟普雷沃菌属; Succinivibrio:琥珀酸弧菌属; Bifidobacterium:双歧杆菌属; Paracoccus:副球菌属; norank_o_JG30-KF-CM45:未知菌; Microbacterium:微杆菌属; Sarcina:八叠球菌属; Legionella:军团菌属; Cloacibacterium:管道杆菌属; Shinella:申氏菌属; unclassified_f_Clostridiaceae:未分类_梭菌科; Nocardioides:类诺卡氏菌属; Albirhodobacter:白色红杆菌属; norank_f_Mitochondia:未命名_线粒体; Anoxybacillus:无氧芽孢杆菌属; Bacillus:芽孢杆菌属; unclassified_f_Clostridiaceae_1:未分类_梭菌科_1;Geobacillus:地衣芽孢杆菌属; Staphylococcus:葡萄球菌属; Acinetobacter:不动杆菌属。 A1、A2、A3为对照组样本菌群组成与丰度,B1、B2、B3为试验组样本菌群丰度组成。A1, A2, A3 represent the intestinal microbial flora composition and abundance of control group samples, and B1, B2, B3 represent the intestinal microbial flora composition and abundance of trial group samples. 图 6 肠道菌群组成与丰度的热图分析 Fig. 6 Heatmap analysis of intestinal microbial flora composition and abundance |
健康的肠道菌群结构对动物多种生理机能有重要的影响,如营养吸收、生长发育、免疫调节、疾病预防等[13]。本研究发现,虽然添加植物乳杆菌未对细鳞鲑的体长产生显著影响,但对细鳞鲑的体重有一定的促进作用,在养殖期28和56 d时均提高了特定生长率。Carnevali等[14]使用德氏乳杆菌(Lactobacillus delbrueckii)投喂欧洲鲈鱼(Dicentrarchus labrax),经25和59 d养殖后,发现其增重率分别比对照组提高了28%和81%。Lee等[15]用戊糖乳杆菌(Lactobacillus pentosus)饲喂日本鳗鲡(Anguilla japonica),5周后发现在特定生长率、饲料转化率及存活率方面均显著优于对照组。
Illumina高通量测序技术测序深度大,对菌群多样性的反应准确、全面,在鱼类肠道菌群研究中获得了广泛应用。李建柱等[16]采用高通量测序技术分析了养殖池塘鲢鱼、鳙鱼、鲫鱼、草鱼的肠道菌群组成,OTU数最低298个,最高412个,Shannon指数介于2.21~3.09。黄丽丽等[4]在新疆额尔齐斯河流域的3种野生冷水鱼(哲罗鱼、细鳞鲑及黑斑狗鱼)的6个样品中共得到了58 328条有效序列,OTU数共242个。本研究中,6个样本共获得了有效序列数612 446条,其中试验组(58 909条)有效序列数多于对照组(43 164条),对照组OTU数777个,试验组OTU数393个,且物种多样性和丰富度方面对照组远大于试验组,说明益生菌植物乳杆菌降低了养殖细鳞鲑肠道菌群多样性,使其菌群种类向简单化发展。
鱼类肠道菌群组成受宿主种类、发育时期、环境和饲料影响而有所差异[17-19]。对新疆额尔齐斯河流域野生细鳞鲑肠道菌群组成的研究发现,变形菌门是细鳞鲑肠道菌群中的优势菌门,属水平上以嗜冷杆菌属(Psychrobacter)、不动杆菌属(Acinetobacter)、梭菌属(Clostridium)等的比例较高[4]。本研究发现,养殖细鳞鲑肠道微生物种类丰富,优势菌门也是变形菌门,此外,厚壁菌门及蓝细菌门的丰度也很高;在属水平上与野生细鳞鲑差别较大,以劳尔氏菌属、短螺旋体属、普氏菌属等的丰度较高。Lyons等[20]同样使用高通量测序技术研究了虹鳟的肠道菌群组成,发现γ-变形菌门占优势,其中肠杆菌科(Enterobacteriaceae)的耶尔森氏菌属(Yersinia)、沙雷氏菌属(Serratia)、哈夫尼菌属(Hafnia)和肥大杆菌属(Obesumbacterium)等优势明显。总结来说,变形菌门是冷水鱼肠道菌群中常见的优势菌门,而在属水平上随着种类、养殖环境的变化差异更大。
本研究表明,饲料中添加植物乳杆菌使细鳞鲑肠道菌群中益生菌的丰度增加,其中乳杆菌属的丰度由对照组的2.89%提高到了试验组的58.94%,增加了近20倍。此外,微小杆菌属、肠球菌属也占有很高的比例,它们均属厚壁菌门的产乳酸菌。这些菌属所占比例的增加使得试验组肠道菌群中厚壁菌门的丰度达到了98%以上。微小杆菌属能够利用糖类发酵产酸,主要产乳酸、乙酸和甲酸,该属很多种类被开发为益生菌,用于环境改良[21-22]。肠球菌属也是乳酸菌家族的重要成员,来自该属的许多乳酸菌用于食品发酵及维持动物肠道健康等,特别是粪肠球菌,是该属中最具代表性的益生菌,该菌不但可以产生乳酸,还可以分泌细菌素,抑制有害菌群的发展[23-24]。而乳酸菌作为益生菌也被广泛用于调控动物肠道菌群,增强宿主免疫力,抑制有害菌群,改善动物营养吸收、生长、发育与繁殖等[25-26]。类似的研究结果也在鲫鱼、罗非鱼及虹鳟等鱼类的肠道菌群研究中得到证实[6-7, 14],表明植物乳杆菌对鱼类肠道乳酸菌数量的提高具有显著的效果。
物种丰富度是指群落中物种数目的多少,本试验结果表明植物乳杆菌使细鳞鲑肠道菌群物种数目变少,在OTU水平上显示49.42%的OTU由于植物乳杆菌的添加而从肠道菌群中消失,表明植物乳杆菌抑制了许多肠道菌群的生长,降低了细鳞鲑肠道菌群的多样性。而这些消失的菌群很多是肠道内有害的革兰氏阳性菌,如葡萄球菌属、短螺旋体属、杆菌属、梭菌科、芽孢杆菌属、副伯克氏菌属、链球菌属及类诺卡氏菌属等。植物乳杆菌对蓝细菌门的抑制作用也很显著,其丰度从对照组的23.3%降低到了试验组的 < 1%。蓝细菌是一类广泛存在于环境中的古老菌群,经常在动物肠道内检测到。蓝细菌并非鱼类肠道固有微生物,而是来自饵料携带或水环境[27-28]。对鲫鱼的研究也发现,益生菌在增加乳酸菌丰度的同时,显著降低了另外一些细菌的丰度,如好氧菌及产气荚膜梭菌(Clostridium perfringens)[7]。
本试验通过在饲料中添加植物乳杆菌研究益生菌对细鳞鲑肠道菌群多样性的影响,揭示了养殖模式下细鳞鲑肠道菌群的组成及其益生菌调控效应,为今后在鱼类肠道微生物菌群调控技术方面以及在肠道微生物层面上研究冷水鱼营养与生长、免疫与疾病等提供参考。
4 结论① 饲料中添加植物乳杆菌可以显著提高细鳞鲑的特定生长率。
② 养殖细鳞鲑肠道菌群在门水平上以变形菌门、厚壁菌门和蓝细菌门为主;在属水平上分布较均匀,劳尔氏菌属、短螺旋体属、普氏菌属的丰度较高但未形成优势菌属,菌属种类繁多且丰度都较低。
③ 饲料中添加植物乳杆菌显著改变了细鳞鲑肠道菌群组成,在门水平上厚壁菌门占绝对优势,在属水平上乳杆菌属占优势,未命名_蓝细菌门丰度明显下降。
④ 综合认为,饲料中添加植物乳杆菌可使细鳞鲑肠道菌群物种多样性和丰富度降低,益生菌丰度增加,并可促进细鳞鱼生长。
| [1] |
LEE K A, KIM S H, KIM E K, et al. Bacterial-derived uracil as a modulator of mucosal immunity and gut-microbe homeostasis in Drosophila[J]. Cell, 2013, 153(4): 797-811. |
| [2] |
CARNEVALI O, MARADONNA F, GIOACCHINI G. Integrated control of fish metabolism, wellbeing and reproduction:the role of probiotic[J]. Aquaculture, 2017, 472: 144-155. DOI:10.1016/j.aquaculture.2016.03.037 |
| [3] |
GUARNER F, MALAGELADA J R. Gut flora in health and disease[J]. The Lancet, 2003, 361(9356): 512-519. DOI:10.1016/S0140-6736(03)12489-0 |
| [4] |
黄丽丽, 张艳, 周红, 等. 基于16S rRNA高通量测序方法比较新疆冷水鱼肠道中微生物多样性[J]. 食品科学, 2018, 39(10): 138-144. DOI:10.7506/spkx1002-6630-201810022 |
| [5] |
WU S G, WANG G T, ANGERT E R, et al. Composition, diversity, and origin of the Bacterial community in grass carp intestine[J]. PLoS One, 2012, 7(2): e30440. DOI:10.1371/journal.pone.0030440 |
| [6] |
NIKOSKELAINEN S, OUWEHAND A C, BYLUND G, et al. Immune enhancement in rainbow trout (Oncorhynchus mykiss) by potential probiotic bacteria (Lactobacillus rhamnosus)[J]. Fish & Shellfish Immunology, 2003, 15(5): 443-452. |
| [7] |
尹军霞, 陈瑛, 孟丽丽. 益生菌剂对鲫鱼肠道菌群影响的初步研究[J]. 水产科学, 2007, 26(11): 610-612. DOI:10.3969/j.issn.1003-1111.2007.11.006 |
| [8] |
BOGUT I, MILAKOVIĆ Z, BUKVIĆ Z, et al. Influence of probiotic (Streptococcus faecium M74) on growth and content of intestinal microflora in carp (Cyprinus carpio)[J]. Czech Journal of Animal Science, 1998, 43(5): 231-235. |
| [9] |
HOSEINIFAR S H, ROOSTA Z, HAJIMORADLOO A, et al. The effects of Lactobacillus acidophilus as feed supplement on skin mucosal immune parameters, intestinal microbiota, stress resistance and growth performance of black swordtail (Xiphophorus helleri)[J]. Fish & Shellfish Immunology, 2015, 42(2): 533-538. |
| [10] |
GIOACCHINI G, MARADONNA F, LOMBARDO F, et al. Increase of fecundity by probiotic administration in zebrafish (Danio rerio)[J]. Reproduction, 2010, 140(6): 953-959. DOI:10.1530/REP-10-0145 |
| [11] |
牟振波, 李永发, 徐革锋, 等. 细鳞鱼在人工流水养殖下的生长特性[J]. 水产学杂志, 2011, 24(2): 13-16. DOI:10.3969/j.issn.1005-3832.2011.02.004 |
| [12] |
徐毓琴, 戴茜茜, 唐慧琴, 等. 产γ-氨基丁酸益生菌的筛选及其生物活性研究[J]. 浙江农业学报, 2016, 28(3): 502-508. DOI:10.3969/j.issn.1004-1524.2016.03.23 |
| [13] |
DALY K, STEWART C S, FLINT H J, et al. Bacterial diversity within the equine large intestine as revealed by molecular analysis of cloned 16S rRNA genes[J]. FEMS Microbiology Ecology, 2001, 38(2/3): 141-151. |
| [14] |
CARNEVALI O, VIVO L D, SULPIZIO R, et al. Growth improvement by probiotic in European sea bass juveniles (Dicentrarchus labrax, L.), with particular attention to IGF-1, myostatin and cortisol gene expression[J]. Aquaculture, 2006, 258(1/2/3/4): 430-438. |
| [15] |
LEE J S, CHENG H, DAMTE D, et al. Effects of dietary supplementation of Lactobacillus pentosus PL11 on the growth performance, immune and antioxidant systems of Japanese eel Anguilla japonica challenged with Edwardsiella tarda[J]. Fish & Shellfish Immunology, 2013, 34(3): 756-761. |
| [16] |
李建柱, 侯杰, 张鹏飞, 等. 鱼菜共生模式中不同鱼类肠道微生物群落结构的比较[J]. 南方水产科学, 2016, 12(6): 42-50. DOI:10.3969/j.issn.2095-0780.2016.06.006 |
| [17] |
BALDO L, PRETUS J L, RIERA J L, et al. Convergence of gut microbiotas in the adaptive radiations of African cichlid fishes[J]. The ISME Journal, 2017, 11(9): 1975-1987. DOI:10.1038/ismej.2017.62 |
| [18] |
STEPHENS W Z, BURNS A R, STAGAMAN K, et al. The composition of the zebrafish intestinal microbial community varies across development[J]. The ISME Journal, 2016, 10(3): 644-654. DOI:10.1038/ismej.2015.140 |
| [19] |
INGERSLEV H C, STRUBE M L, JØRGENSEN L N G, et al. Diet type dictates the gut microbiota and the immune response against Yersinia ruckeri in rainbow trout (Oncorhynchus mykiss)[J]. Fish & Shellfish Immunology, 2014, 40(2): 624-633. |
| [20] |
LYONS P P, TURNBULL J F, DAWSON K A, et al. Exploring the microbial diversity of the distal intestinal lumen and mucosa of farmed rainbow trout Oncorhynchus mykiss (Walbaum) using next generation sequencing (NGS)[J]. Aquaculture Research, 2017, 48(1): 77-91. |
| [21] |
张莹, 石萍, 马炯. 微小杆菌Exiguobacterium spp.及其环境应用研究进展[J]. 应用与环境生物学报, 2013, 19(5): 898-904. |
| [22] |
YANG Y, YANG J, WU W M, et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms:part 2.Role of gut microorganisms[J]. Environmental Science Technology, 2015, 49(20): 12087-12093. DOI:10.1021/acs.est.5b02663 |
| [23] |
佳木泰.酸马奶中屎肠球菌BZ2细菌素Enterocin A和Enterocin B的基因克隆与表达研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2018: 2-6. http://cdmd.cnki.com.cn/Article/CDMD-10129-1018881853.htm
|
| [24] |
文静, 孙建安, 周绪霞, 等. 屎肠球菌对仔猪生长性能、免疫和抗氧化功能的影响[J]. 浙江农业学报, 2011, 23(1): 70-73. DOI:10.3969/j.issn.1004-1524.2011.01.014 |
| [25] |
PANIGRAHI A, KIRON V, KOBAYASHI T, et al. Immune responses in rainbow trout Oncorhynchus mykiss induced by a potential probiotic bacteria Lactobacillus rhamnosus JCM 1136[J]. Veterinary Immunology and Immunopathology, 2004, 102(4): 379-388. DOI:10.1016/j.vetimm.2004.08.006 |
| [26] |
PANIGRAHI A, KIRON V, PUANGKAEW J, et al. The viability of probiotic bacteria as a factor influencing the immune response in rainbow trout Oncorhynchus mykiss[J]. Aquaculture, 2005, 243(1/2/3/4): 241-254. |
| [27] |
YE L, AMBERG J, CHAPMAN D, et al. Fish gut microbiota analysis differentiates physiology and behavior of invasive Asian carp and indigenous American fish[J]. The ISME Journal, 2014, 8(3): 541-551. DOI:10.1038/ismej.2013.181 |
| [28] |
QIAO F, LEI K, LI Z C, et al. Transcriptomic responses of the freshwater snail (Parafossarulus striatulus) following dietary exposure to Cyanobacteria[J]. Science of the Total Environment, 2018, 624: 153-161. DOI:10.1016/j.scitotenv.2017.12.112 |




