氨基酸脱羧酶(amino acid decarboxylase)是催化脱去某种氨基酸的羧基生成对应胺的裂解酶的总称[1-2],主要通过消耗质子和释放二氧化碳(CO2)催化某些氨基酸的脱羧。氨基酸脱羧生成的胺类物质在动物体内有重要作用,脱羧后形成的胺类是某些维生素或激素的成分,具有特殊生理作用。氨基酸脱羧酶活力测定方法的建立对于研究氨基酸代谢具有重要意义。目前测定氨基酸脱羧酶活力的方法主要有以下几种:高效液相色谱(HPLC)、pH指示剂和放射性标记法。高效液相色谱法精确性和重复性好,但是耗时长,并且需要专门的设备[3]。pH指示剂法是利用pH变化对氨基酸脱羧酶活力进行测定[4],通过分光光度计采用比色方法定性或定量检测氨基酸脱羧酶活力[5-7],pH指示剂法费时费力,仅可对几种特定的氨基酸脱羧酶活力进行测定,并且在测定过程中使用的有机溶剂毒性较大。放射性标记法采用放射性物质标记氨基酸底物[8],通过监测CO2的形成量来对氨基酸脱羧酶活力进行定量检测[9-10],该方法操作复杂,且必须在防放射性物质空间里进行操作,对实验人员和环境污染大。
磷酸烯醇式丙酮酸羧化酶是固碳途径中活力较高的羧化酶,利用羧化酶的偶联反应固定CO2可检测氨基酸脱羧酶活力[11]。基于目前还没有快速定量检测氨基酸脱羧酶活力的详细方法和商品化的试剂盒。为了替代测定成本高、耗费时间较长、污染大的测定方法,本试验采用酶偶联固定CO2技术,旨在建立一种对仪器要求低、成本消耗小、操作简单的快速定量检测氨基酸脱羧酶活力的方法,为进一步开发商品化试剂盒做准备,并为深入研究动物组织、微生物培养液等中氨基酸脱羧酶活力提供一种简便的方法。
1 材料与方法 1.1 样品来源试验样品分别来源于30、60、90 kg的杜×长×大杂交猪,采集结肠内容物分离微生物后用于氨基酸脱羧酶活力的测定;采集脑组织用于氨基酸脱羧酶活力的测定。
1.2 试剂配制 1.2.1 反应液与显色液试剂组成及配制快速定量检测氨基酸脱羧酶活力比色方法的试剂配方见表 1。试剂1中所述的氨基酸为待检测的氨基酸脱羧酶所对应的氨基酸;反应液需要现配现用,将试剂2溶于试剂1中即为反应液(pH 7.5);试剂3为显色液。所有溶液均采用无CO2双蒸水配制。无CO2双蒸水的制作方法:临用前将双蒸水加热至沸腾后,继续加热5 min,冷却后密封待用。试验用常规生化试剂购于上海生工生物工程股份有限公司,氨基酸购于上海博耀生物科技有限公司。
|
|
表 1 快速定量检测氨基酸脱羧酶活力比色方法的试剂配方 Table 1 Reagent formulations of colorimetric method for rapid quantitative detection of amino acid decarboxylase activity |
配制样品匀浆介质,所含药品及其浓度如下:0.01 mol/L三羟甲基氨基甲烷盐酸盐(Tris-HCl),0.000 1 mol/L乙二胺四乙酸二钠(EDTA-2Na),0.01 mol/L蔗糖,0.8%的氯化钠溶液,调节pH至7.4。
1.2.3 标准曲线试剂配制将酪氨酸脱羧酶标准品配制成0、0.001、0.002、0.003、0.004、0.005、0.006、0.007和0.008 U/μL活力梯度的溶液,溶剂为匀浆介质。
1.3 微生物样品制备收集猪结肠内容物,采用无菌厌氧操作方法分离微生物[12]。将肠道内容物以10 000 r/min离心5 min,倾去上清,用磷酸盐缓冲液(PBS)反复清洗沉淀2~3次,再10 000 r/min离心5 min,倾尽上清,用生理盐水稀释至OD600 nm=0.8。取10 mL菌悬液,10 000 r/min离心5 min,倾尽上清,加入500 μL匀浆介质,将离心管插入冰中,用振幅30 μm超声处理20 s,置于冰上冷却,反复超声处理3次,使细胞破碎;放进4 ℃台式离心机中离心,转速为16 000 r/min,离心15 min,小心移取500 μL上清液到新的已预冷的1.5 mL离心管中置于冰槽里,检测总蛋白含量后待用。
分别称取30和90 kg猪的1 g脑组织块,用4 ℃的PBS反复漂洗2~3次,除尽血液等杂质,置于10 mL离心管中并将其插入冰中待用。用移液枪移取预冷的匀浆介质总量的2/3于离心管中(匀浆介质的体积总量是组织块重量的9倍),再用干净预冷的剪刀将组织块剪碎入离心管中,于组织匀浆机中10 000~15 000 r/min下研磨成组织匀浆(匀浆10 s/次,间歇30 s,连续3~5次,整个过程需要在冰水中进行,直至研磨均匀),最后将剩余的1/3匀浆介质冲洗匀浆机刀口,液体收集于匀浆用的离心管中,得10%组织匀浆。将制备好的10%组织匀浆用低温低速离心机2 000 r/min左右离心10~15 min,小心移取上清液,分装于预冷的1.5 mL离心管中,检测总蛋白含量后待用。
1.4 标准曲线制备移取450 μL反应液到2 mL离心管;加入50 μL配制好的标准品,上下颠倒数次,混匀;放置在37 ℃下孵育1 h,每隔10 min上下颠倒混匀数次;孵育完成后,加入25 μL显色液于反应体系中,上下颠倒混匀;静置5 min后,蒸馏水调零,用1 cm光径在520 nm下测定各管的OD值;通过测定不同活力标准品的(OD)值构建标准曲线;纵坐标为绝对OD值,每个活力的标准品均需做3次以上重复;横坐标为标准品氨基酸脱羧酶活力(U/μL)。
1.5 待测样品氨基酸脱羧酶活力测定方法移取450 μL反应液到2 mL离心管;向离心管中加入50 μL待测样品或50 μL匀浆介质(空白管加匀浆介质);上下颠倒数次,混匀;放置在37 ℃下孵育1 h,每隔10 min上下颠倒混匀数次;孵育完成后,加入25 μL显色液于反应体系中,上下颠倒混匀;静置5 min后,蒸馏水调零,用1 cm光径在520 nm下测定各管OD值;根据OD值和标准曲线计算对应的氨基酸脱羧酶活力(E实际,U/μL),E实际与标准曲线中x值的对应关系为:
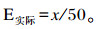
|
再根据E实际计算样品中氨基酸脱羧酶活力(E样品,U/μL):

|
数据的基本统计用Excel 2003软件进行,采用SAS 9.1.3统计软件对测量数据进行分析,氨基酸脱羧酶活力结果采用平均值±标准差表示。
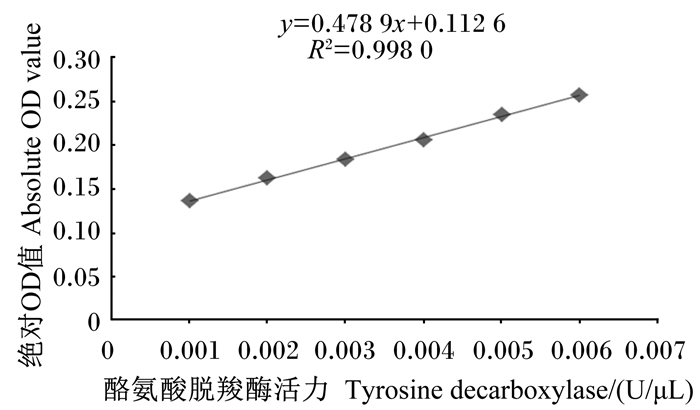
2 结果与分析 2.1 酪氨酸脱羧酶活力的标准曲线酪氨酸脱羧酶标准曲线见图 1。当酪氨酸脱羧酶活力在0.001~0.006 U/μL(不包括0.001和0.006 U/μL)时,线性关系理想,标准曲线为:y=0.478 9x+0.112 6,R2=0.998 0。测定时需同时做空白对照以排除药品与样品颜色误差,用绝对OD值进行计算。通过标准曲线的测定可知,测定样品时可根据样品中氨基酸脱羧酶酶活力测得的OD值适当调整样品浓度。
|
图 1 酪氨酸脱羧酶标准曲线 Fig. 1 Tyrosine decarboxylase standard curve |
使用不同氨基酸脱羧酶做标准曲线,不同氨基酸脱羧酶标准品不同活力对应的绝对OD值见表 2。根据不同氨基酸脱羧酶标准品的绝对OD值,计算不同氨基酸脱羧酶活力的标准曲线。
|
|
表 2 不同氨基酸脱羧酶标准品对应的绝对OD值 Table 2 Absolute OD values corresponding to different amino acid decarboxylase standards |
不同氨基酸脱羧酶活力标准曲线如下(因第1个活力与最后1个活力落在线性范围外,故舍去统计):
赖氨酸脱羧酶:y=0.474x+0.110 7,R2=0.999 8;
谷氨酸脱羧酶:y=0.474x+0.112 3,R2=0.999 2;
酪氨酸脱羧酶:y=0.488x+0.108 2,R2=0.999 6;
甘氨酸脱羧酶:y=0.482x+0.112 3,R2=0.999 9;
色氨酸脱羧酶:y=0.478x+0.111 8,R2=0.999 9;
组氨酸脱羧酶:y=0.480x+0.113 6,R2=0.999 9;
甲硫氨酸脱羧酶:y=0.484x+0.109 3,R2=0.999 2;
精氨酸脱羧酶:y=0.478x+0.112 2,R2=0.999 3。
由以上结果可以看出,因原理都是通过捕捉CO2显色,因此不同种类氨基酸脱羧酶活力的计算均可以用一种脱羧酶标准曲线进行计算,本试验均以酪氨酸脱羧酶的标准曲线为标准曲线进行计算。
2.3 猪结肠微生物氨基酸脱羧酶活力将分离的微生物进行处理后,对微生物的总蛋白含量进行检测。利用比色法测得不同体重猪结肠微生物总蛋白含量分别为:30 kg,(1.64±0.38) mg/mL;60 kg,(0.69±0.11) mg/mL;90 kg,(0.51±0.36) mg/mL。猪结肠微生物各氨基酸脱羧酶活力测定以酪氨酸脱羧酶活力标准曲线为准进行计算,结果见表 3。
|
|
表 3 猪结肠微生物氨基酸脱羧酶活力 Table 3 Amino acid decarboxylase activities in pig colonic microorganism |
制备脑组织匀浆,利用比色法测得不同体重猪脑组织匀浆总蛋白含量如下:30 kg,(0.93±0.32) mg/mL;90 kg,(0.68±0.26) mg/mL。对猪脑组织氨基酸脱羧酶活力测定以酪氨酸脱羧酶活力标准曲线为准进行计算,结果见表 4。
|
|
表 4 猪脑组织氨基酸脱羧酶活力 Table 4 Amino acid decarboxylase activities in pig brain tissue |
取1个未知的待测溶液(选取表 3同批的微生物样品),分装7管,每管25 μL,编号为1~7。在1~7号管中分别加入0(以1号管为空白对照)、0.002、0.004、0.006、0.008、0.010、0.012 U/μL的酪氨酸脱羧酶标准溶液25 μL,充分混匀,经测定,其绝对OD值如表 5所示。由OD值(因为样品中本就有酪氨酸脱羧酶,7号管活力过高超出最适测量值,故舍去)得到该未知样品氨基酸脱羧酶活力的标准曲线为:y=0.445 2x+0.114 3,R2=0.993 8,所测得的酶活力落入已构建的标准曲线范围中,表明该方法有较好的重复性。
|
|
表 5 各管样品对应的绝对OD值 Table 5 Absolute OD values corresponding to different tubes |
生物胺是一类具有生物活性、含氮基的低分子质量化合物[13]。大多数生物胺是微生物氨基酸脱羧酶作用于氨基酸脱羧而生成,动物体内含有少量的生物胺时对机体有促进作用,而过量的生物胺会造成动物体内损伤。对氨基酸脱羧酶活力的定性检测是通过肉汤培养基或平板培养基中微生物产生的碱性物质导致培养基变色来证明有氨基酸脱羧酶的存在[14]。而若想了解氨基酸脱羧酶在动物体内活力的强弱,则需要对氨基酸脱羧酶活力进行定量分析。较常用的氨基酸脱羧酶活力测定方法是用高效液相色谱法,其原理是使用高效液相色谱仪对生物胺含量进行测定,以生物胺的含量来反映氨基酸脱羧酶活力[15-16]。氨基酸脱羧酶活力测定的另一种常用方法是高通量比色法,即pH指示剂法,它是利用pH发生变化引起溴甲酚绿颜色改变而进行测定,此方法对pH敏感,且能测定较小活力的样品[11]。但是pH指示剂法仅对部分氨基酸脱羧酶适用,若要对多种氨基酸脱羧酶的活力进行测定,pH的指示系统需要进一步探讨,并需要仔细研究pH缓冲液与指示剂的适用性[2]。
本试验采用了羧化酶固定CO2可反映氨基酸脱羧酶活力大小的原理,对不同来源的猪结肠微生物及脑组织样品进行了氨基酸脱羧酶活力的测定。通过本试验建立的比色方法得出的不同氨基酸脱羧酶活力标准曲线的线性关系相近,相似度达到了98%,具有较高的重复性,故可以使用同一种氨基酸脱羧酶活力的标准曲线为准进行计算来检测多种氨基酸脱羧酶活力,表明了本方法对多种氨基酸脱羧酶活力有广泛的适用性。本试验以酪氨酸脱羧酶活力标准曲线为基准计算,结果显示,酪氨酸脱羧酶活力标准曲线呈较好的线性关系,能快速地测定猪结肠微生物和脑组织中氨基酸脱羧酶活力。为验证本方法,对未知样品进行测定,所测得氨基酸脱羧酶活力落入已构建的标准曲线范围中,氨基酸脱羧酶活力在0.001~0.006 U/μL之间线性关系良好,所测结果的准确度为98%,与高通量比色法[2]相比,本方法的准确性较高,表明本方法有较高准确性。
相较于常用的高效液相色谱法[3]的仪器要求高、操作复杂和pH指示剂法[4-6]的费时费力且仅对几种特定的氨基酸脱羧酶进行测定的缺点,本试验建立的比色方法在整个试验过程中操作简单快速,整个试验过程快速,只需1 h即可完成,并可对大量样品同时进行处理,且能测定多种氨基酸脱羧酶的活力;所需试剂成本较低,使用的仪器较为常用,只需分光光度计和恒温水浴设备,相比于高仪器要求、高测定成本的氨基酸脱羧酶活力测定方法,本试验所建立的方法在简单的实验室即可完成。此外,本试验建立的比色方法有完整详细的操作步骤,便于开发成试剂盒,还可为进一步研究氨基酸脱羧酶活力的快速测定提供坚实的理论与操作基础。
4 结论本试验建立了快速定量检测氨基酸脱羧酶活力的比色方法。该方法对仪器设备要求低、操作简单,且对多种氨基酸脱羧酶活力的测定有高重复性和高准确性,并有广泛的适用性;此外,整个试验过程测定快速,且具有详细的操作步骤,便于开发成试剂盒。因此,本试验建立的氨基酸脱羧酶活力测定方法具有操作简单、成本低廉、重复性好和适用性广的特点,可为进一步研究氨基酸脱羧酶活力的快速测定提供有效的研究方法。
| [1] |
LI T F, HUO L, PULLEY C, et al. Decarboxylation mechanisms in biological system[J]. Bioorganic Chemistry, 2012, 43: 2-14. DOI:10.1016/j.bioorg.2012.03.001 |
| [2] |
JIANG H, XIA X X, FENG Y, et al. Development of a robust system for high-throughput colorimetric assay of diverse amino acid decarboxylases[J]. Process Biochemistry, 2017, 60: 27-34. DOI:10.1016/j.procbio.2017.05.028 |
| [3] |
GOTO T, TIBA K, SAKURADA Y, et al. Determination of hepatic cysteinesulfinate decarboxylase activity in fish by means of OPA-prelabeling and reverse-phase high-performance liquid chromatographic separation[J]. Fisheries Science, 2010, 67(3): 553-555. |
| [4] |
VIENOŽINSKIENE J, JANUŠEVIČIÜT R, PAULIUKONIS A, et al. Lysine decarboxylase assay by the pH-stat method[J]. Analytical Biochemistry, 1985, 146(1): 180-183. DOI:10.1016/0003-2697(85)90413-0 |
| [5] |
ROSENBERG R M, HERREID R M, PIAZZA G J, et al. Indicator assay for amino acid decarboxylases[J]. Analytical Biochemistry, 1989, 181(1): 59-65. |
| [6] |
KIM Y H, SATHIYANARAYANAN G, KIM H J, et al. A liquid-based colorimetric assay of lysine decarboxylase and its application to enzymatic assay[J]. Journal of Microbiology and Biotechnology, 2015, 25(12): 2110-2115. DOI:10.4014/jmb.1505.05063 |
| [7] |
MÉDICI R, DE MARÍA P D, OTTEN L G, et al. A high-throughput screening assay for amino acid decarboxylase activity[J]. Advanced Synthesis & Catalysis, 2011, 353(13): 2369-2376. |
| [8] |
HENNIG A, BAKIRCI H, NAU W M. Label-free continuous enzyme assays with macrocycle-fluorescent dye complexes[J]. Nature Methods, 2007, 4(8): 629-632. DOI:10.1038/nmeth1064 |
| [9] |
YU K, HU S, HUANG J, et al. A high-throughput colorimetric assay to measure the activity of glutamate decarboxylase[J]. Enzyme and Microbial Technology, 2011, 49(3): 272-276. DOI:10.1016/j.enzmictec.2011.06.007 |
| [10] |
ALCÁZAR R, TIBURCIO A F.Determination of arginine and ornithine decarboxylase activities in plants[M]//ALCÁZAR R, TIBURCIO A.Methods in molecular biology.New York, NY: Humana Press, 2018.
|
| [11] |
SCRIVEN F, WLASICHUK K B, PALCIC M M. A continual spectrophotometric assay for amino acid decarboxylases[J]. Analytical Biochemistry, 1988, 170(2): 367-371. DOI:10.1016/0003-2697(88)90644-6 |
| [12] |
李金龙, 王瑶, 马娅君, 等. 一种猪胃肠道内容物与粪便微生物梯度离心分离方法[J]. 动物营养学报, 2018, 30(5): 1837-1844. DOI:10.3969/j.issn.1006-267x.2018.05.026 |
| [13] |
PESSIONE E, CIRRINCIONE S. Bioactive molecules released in food by lactic acid bacteria:encrypted peptides and biogenic amines[J]. Frontiers in Microbiology, 2016, 7: 876. |
| [14] |
HUSSAIN H, FUAT A R M, VIMALA B, et al. Screening method for detection of immediate amino acid decarboxylases-producing bacteria implicated in food poisoning[J]. Tropical Biomedicine, 2011, 28(2): 351-361. |
| [15] |
SHI F, XIE Y L, JIANG J J, et al. Directed evolution and mutagenesis of glutamate decarboxylase from Lactobacillus brevis Lb85 to broaden the range of its activity toward a near-neutral pH[J]. Enzyme and Microbial Technology, 2014, 61/62: 35-43. DOI:10.1016/j.enzmictec.2014.04.012 |
| [16] |
BOVER-CID S, HUGAS M, IZQUIERDO-PULIDO M, et al. Amino acid-decarboxylase activity of bacteria isolated from fermented pork sausages[J]. International Journal of Food Microbiology, 2001, 66(3): 185-189. DOI:10.1016/S0168-1605(00)00526-2 |




