2. 江西中医药大学实验动物科技中心, 南昌 330006;
3. 江西省石城县农业农村局, 石城 342700;
4. 云南省农业科学院蚕桑蜜蜂研究所, 蒙自 661100
2. Laboratory Animal Science and Technology Center, Jiangxi University of Traditional Chinese Medicine, Nanchang 330006, China;
3. Agricultural and Rural Bureau of Shicheng County, Jiangxi Province, Shicheng 342700, China;
4. Sericultural and Apicultural Institute, Yunnan Academy of Agricultural Sciences, Mengzi 661100, China
花粉是有花植物的雄性器官。蜂花粉是工蜂采集种子植物花粉后携带回巢的花粉团,以营养丰富著称,其含有蛋白质、游离氨基酸、维生素C、维生素E、脂质、核酸和矿物质等多种营养成分[1-3],具有降血脂、增强免疫力、改善营养性贫血、促进脂肪燃烧等作用[4-6]。蜜蜂将花粉采集回巢后,内勤蜂会对贮存在巢房内的花粉团进行咬碎、吐蜜湿润、添加微生物分泌物等初步加工,再夯实在巢房内,经过15 d的发酵酿制而成蜂粮(bee bread)。相较于蜂花粉,青年工蜂分泌王浆及幼虫发育期间更喜食蜂粮,经发酵的蜂粮营养成分更加丰富,营养价值更高[7];并且,天然蜂粮食用起来风味独特,不会造成人体肠胃不适,因此具有重要的食用价值及广阔的市场开发前景[8]。传统观点和现有研究均表明蜂粮的营养价值高于蜂花粉[9-11]。花粉在发酵过程中,细胞壁破碎释放出内容营养物质,并将蛋白质水解成易于机体吸收的小分子多肽。此外,发酵后蜂粮的黄酮类化合物和不饱和脂肪酸含量均较未发酵蜂粮升高[12-14]。发酵后蜂粮的水分活度和酸度下降,成熟蜂粮的酸度在3.4~4.2,具有极强的抑菌效果,有着较长的储存期[15]。当前天然蜂粮难以采收的现状已被打破,江武军等[16]用天然蜂粮生产器成功生产出天然蜂粮,且营养成分含量和巢脾中蜂粮相当。且进一步的大鼠试验证明天然蜂粮降血脂和提升免疫因子含量的效果要优于蜂花粉[9]。人工蜂粮能增强小鼠腹腔巨噬细胞的吞噬能力,提高巨噬细胞溶菌酶的活性,并能促进小鼠血清溶血素抗体的生成[17]。但到目前为止,还未见天然蜂粮对小鼠免疫功能调节作用的报道。为了全面评价天然蜂粮的营养功效,本实验室使用不同剂量的天然蜂粮和蜂花粉来灌胃小鼠,然后检测天然蜂粮与蜂花粉对小鼠生长及自然杀伤(NK)细胞、单核巨噬细胞、脾淋巴细胞增殖能力及体液免疫功能的影响,系统研究天然蜂粮和蜂花粉对小鼠免疫功能的调节作用,进一步确认天然蜂粮和蜂花粉食用的安全性,并探讨二者之间调节免疫功能的差异,以期为天然蜂粮深度开发提供较为充实的科学依据。
1 材料与方法 1.1 试验材料 1.1.1 受试样品2018年6—8月,利用江西农业大学蜜蜂研究所研制的天然蜂粮生产器,在江西省赣州市石城县福星养蜂场生产天然白莲意蜂蜂粮。天然蜂粮生产完毕后,在巢门口加上标准脱粉器,收集白莲意蜂蜂花粉并晒干[18]。将采集到的天然蜂粮和蜂花粉冻存于-18 ℃冰箱中。
1.1.2 试验动物试验动物为224只雄性昆明小鼠,体重21~25 g,由江西中医药大学实验动物科技中心提供,合格证号为SCXK(赣)2018-0003。试验小鼠所用饲粮(主要营养成分含量:粗蛋白质20.70%,粗脂肪4.15%,粗纤维2.31%,钙1.24%,磷0.83%)和垫料统一由湖北万千佳兴有限公司提供。试验小鼠饲养在江西中医药大学实验动物科技中心无特定病原体(SPF)级屏障系统内,环境温度为20~23 ℃、相对湿度45%~55%,使用许可号为SYXK(赣)2018-0004。
1.1.3 仪器与试剂岛津分析天平(AUY 120)、酶标仪(Thermo Fisher)、水浴锅(金坛市普瑞斯机械有限公司)、低温冷冻离心机(Eppendorf)、微量移液器(Eppendorf)、打孔器、注射器(江西三鑫医疗科技有限公司)、CO2培养箱(武汉敬信科技有限公司)、超净工作台(苏州净化设备有限公司)、手术器械、载玻片、计时器、细胞培养板、无菌过滤头、全自动细胞计数仪(德国耶拿分析仪器股份公司)。
RPMI 1640细胞培养液、胎牛血清、刀豆蛋白A(ConA)、噻唑蓝(MTT)、无菌Hank’s液、磷酸盐缓冲液(PBS)、二甲基亚砜、绵羊红细胞(SRBC)、生理盐水、印度墨汁、Na2CO3、YAC-1小鼠骨髓瘤细胞(由武汉普诺赛生物科技有限公司提供,每个T25培养瓶中活细胞数为1×106个)、乳酸钠、硝基氯化四氮唑(TNT)、吩嗪二甲酯硫酸盐(PMS)、氧化型辅酶Ⅰ(NAD)、0.2 mol/L的Tris-HCl缓冲液(pH 8.2)、1% NP40、琼脂糖。
1.2 试验方法 1.2.1 试验分组与剂量设置试验设6个试验组(天然蜂粮设低、中、高3个剂量组,分别用HB-L、HB-M、HB-H表示;蜂花粉设低、中、高3个剂量组,分别用HP-L、HP-M、HP-H表示)和1个空白对照组(用C表示)。参照体重50 kg人推荐用量20 g/d[即人推荐用量400 mg/(d·kg BW)][18],设定400 mg/(d·kg BW)为中剂量,800 mg/(d·kg BW)为高剂量,80 mg/(d·kg BW)为低剂量[9]。将224只昆明小鼠随机分为7组,每组32只。将设定剂量的天然蜂粮和蜂花粉溶于蒸馏水,6个试验组小鼠灌胃量为10 mL/kg BW,空白对照组则灌以等量蒸馏水。试验期间动物自由采食、饮水。连续灌胃30 d,每周称量小鼠体重,以试验开始时体重作为第0周体重。
1.2.2 脾脏和胸腺指数测定在连续灌胃30 d后,禁食不禁水12 h后将小鼠称重后颈椎脱臼处死,取脾脏和胸腺,去其筋膜,用吸水纸吸干脏器表面血污,用分析天平称重,计算脾脏和胸腺指数。
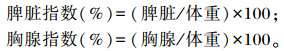
|
测定开始前24 h将靶细胞(YAC-1细胞)进行传代培养。使用前以无菌Hank’s液洗3次,用RPMI 1640完全培养调整细胞浓度为4×105个/mL。
小鼠连续灌胃30 d后颈椎脱臼处死,浸入75%乙醇3~4 min,无菌取脾脏,置于盛有适量无菌Hank’s液的小平皿中,用医疗纱布包住脾脏后再用镊子轻轻磨碎,转移至200目不锈钢筛子中过滤,制成单细胞悬液,用Hank’s液洗2次,每次离心(1 000 r/min)10 min。弃上清将细胞浆弹起,加入0.5 mL灭菌蒸馏水20 s,裂解红细胞后再加入0.5 mL 2倍Hank’s液及8 mL Hank’s液,1 000 r/min离心,弃去上清液。用1 mL含10%胎牛血清的RPMI 1640完全培养液重悬,经0.44 μm滤膜过滤后用全自动细胞计数仪计数活细胞(活细胞比例应在95%以上),调整细胞浓度为2×107个/mL。
取靶细胞和效应细胞各100 μL(效靶比50 : 1),加入96孔培养板中;靶细胞自然释放孔加靶细胞和培养液各100 μL、靶细胞最大释放孔加靶细胞和1% NP40各100 μL,上述各项均设3个复孔,于37 ℃、5%CO2培养箱中培养4 h,然后将培养板离心(1 500 r/min)5 min,每孔吸取上清100 μL置于96孔培养板中,同时加入乳酸脱氢酶(LDH)基质液100 μL,反应3 min,每孔加入1 mol/L的醋酸30 μL,使用酶标仪在490 nm波长处测定光密度(OD)值。
NK细胞活性按下式计算:

|
小鼠连续灌胃30 d后颈椎脱臼处死,浸入75%乙醇3~4 min,无菌取脾脏,置于盛有适量无菌Hank’s液的小平皿中,用医疗纱布包住脾脏后再用镊子轻轻磨碎,过200目不锈钢筛网后,制成单细胞悬液,用Hank’s液洗2次,每次离心(1 000 r/min)10 min。然后用1 mL含10%胎牛血清的RPMI 1640完全培养液重悬细胞,经0.44 μm滤膜过滤后用全自动细胞计数仪计数活细胞(活细胞比例应在95%以上),调整细胞浓度为3×106个/mL。
将每份细胞悬液分2孔加入到24孔培养板中,每孔1 mL,其中一孔加75 μL ConA液,另一孔作为对照,置培养箱中培养48 h。培养结束前4 h,每孔吸去上清液0.7 mL,加入0.7 mL不含血清的RPMI 1640培养液,同时每孔加入MTT 50 μL,继续培养4 h。培养结束后,每孔加入1 mL二甲基亚砜,吹打混匀,使紫色结晶完全溶解。然后分装到96孔培养板,每孔做3个平行孔,使用酶标仪在570 nm波长处测定OD值。以试验孔与对照孔OD值的差值代表淋巴细胞增殖能力。
1.2.5 碳廓清试验小鼠连续灌胃30 d后称重,按体重从小鼠眼眶静脉注入稀释(用生理盐水稀释3~4倍)的印度墨汁(100 mL/kg BW),在墨汁注入完成后立即计时。分别在注入墨汁2、10 min后从内眦静脉丛取血20 μL,并立即将其加到2 mL 0.1% Na2CO3溶液中。使用酶标仪在600 nm波长处测定OD值,以Na2CO3溶液作空白对照。
将取血后的小鼠处死,取肝脏和脾脏,用吸水纸吸干脏器表面血污,分别称重。
以吞噬指数表示小鼠的碳廓清能力,按下式计算吞噬指数:

|
式中:A1、A2分别代表 2、10 min时所取静脉血的OD值;t1、t2分别代表注入墨汁后时间,分别为2、10 min;K代表碳廓清指数。
1.2.6 抗体生成细胞检测(Jerne改良玻片法)小鼠连续灌胃30 d后,再经SRBC免疫4~5 d后颈椎脱臼处死,浸入75%乙醇3~4 min,无菌取脾脏,置于盛有适量无菌Hank’s液的小平皿中,用医疗纱布包住脾脏后再用镊子轻轻磨碎,制成单细胞悬液,用Hank’s液洗2次,每次离心(1 000 r/min)10 min。将细胞悬浮在5 mL RPMI 1640培养液中,计数细胞,并将细胞浓度调整为5×106个/mL。将表层培养基(1 g琼脂糖加双蒸水100 mL)加热溶解后,于45~50 ℃水浴保温,与等量pH 7.2~7.4、2倍浓度的Hank’s液混合,分装于小试管,每管0.5 mL,再向管内加50 μL 10%SRBC(用SA缓冲液配制),20 μL脾细胞悬液(5×106个/mL),迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,做平行片,待琼脂凝固后,将玻片水平扣放在片架上,放入CO2培养箱孵育1.5 h,然后将用SA缓冲液稀释的补体(1 : 8)加入到玻片架凹槽内,继续温育1.5 h,计数溶血空斑数用于反映抗体生成细胞数。
1.3 数据统计分析数据使用平均值±标准误(mean±SE)表示,采用Statview 5.01统计软件进行数据分析,采用ANOVA中的“ANOVA or ANCOVA”程序进行方差分析,组间多重比较采用LSD法,差异显著性设定为P < 0.05。
2 结果与分析 2.1 天然蜂粮和蜂花粉对小鼠体重的影响试验期间各组小鼠生长发育良好,毛色白亮,活动正常。由表 1可知,各组小鼠各周龄体重无显著差异(P>0.05),随着小鼠周龄增加,体重稳定增加。
|
|
表 1 天然蜂粮和蜂花粉对小鼠体重的影响 Table 1 Effects of natural bee bread and bee pollen on body weight of mice |
由表 2可知,除蜂粮中剂量组小鼠的脾脏指数显著低于蜂花粉高剂量组(P < 0.05)外,脾脏指数在其他之组间均无显著差异(P>0.05)。蜂粮中、高剂量组和蜂花粉低、中、高剂量组小鼠的胸腺指数均无显著差异(P>0.05);与蜂粮中、高剂量组相比,蜂粮低剂量组小鼠的胸腺指数显著增加(P < 0.05);与3个蜂花粉剂量组相比,蜂粮低剂量组小鼠的胸腺指数显著增加(P < 0.05)。
|
|
表 2 天然蜂粮和蜂花粉对小鼠脾脏和胸腺指数的影响 Table 2 Effects of natural bee bread and bee pollen on spleen and thymus indices of mice |
由表 3可知,与空白对照组相比,蜂粮中剂量组和3个蜂花粉剂量组小鼠脾脏中NK细胞活性均显著升高(P < 0.05);此外,小鼠脾脏中NK细胞活性在6个试验组之间无显著差异(P>0.05)。
|
|
表 3 天然蜂粮和蜂花粉对小鼠NK细胞活性的影响 Table 3 Effects of natural bee bread and bee pollen on NK cell activity of mice |
由表 4可知,与空白对照组相比,3个蜂粮剂量组和3个蜂花粉剂量组小鼠的脾淋巴细胞增殖能力均无显著差异(P>0.05),且各6个试验组之间也无显著差异(P>0.05)。
|
|
表 4 天然蜂粮和蜂花粉对ConA诱导的小鼠脾淋巴细胞增殖能力的影响 Table 4 Effects of natural bee bread and bee pollen on splenic lymphocyte proliferation capacity of mice induced by ConA |
由表 5可知,与空白对照组相比,3个蜂粮剂量组和3个蜂花粉剂量组的吞噬指数均无显著差异(P>0.05);蜂粮中剂量组和蜂花粉高剂量组的吞噬指数显著高于蜂粮低剂量组以及蜂花粉低、中剂量组(P < 0.05)。
|
|
表 5 天然蜂粮和蜂花粉对小鼠单核-巨噬细胞功能的影响 Table 5 The effect of natural bee bread and pollen on monocyte-macrophage function in mice |
由表 6可知,与空白对照组相比,3个蜂粮剂量组和3个蜂花粉剂量组小鼠溶血空斑数(可体现抗体生成细胞数)显著增加(P < 0.05);与3个蜂花粉剂量组相比,蜂粮高剂量组小鼠溶血空斑数显著增加(P < 0.05);此外,蜂粮高剂量组小鼠溶血空斑数显著高于蜂粮中、低高剂量组(P < 0.05)。
|
|
表 6 天然蜂粮和蜂花粉对小鼠体液免疫功能的影响 Table 6 Effects of natural bee bread and bee pollen on humoral immune function of mice |
本试验中3个蜂粮剂量组和3个蜂花粉剂量组小鼠生长状况良好,说明天然蜂粮和蜂花粉是安全的。脾脏是机体内最大的免疫器官,含有大量B淋巴细胞(约占50%)、T淋巴细胞(约占25%),以及巨噬细胞、单核细胞、多核白细胞、促吞噬素、补体等重要免疫细胞和免疫因子[19]。胸腺是免疫系统中的中枢免疫器官,能够促进未成熟的T淋巴细胞分化为成熟的T淋巴细胞,还能分泌多种胸腺激素,从而起到调节机体免疫和监控的作用[20]。因而,脾脏和胸腺指数大小可作为反映机体免疫水平高低的直观指标。灌胃80 mg/(d·kg BW)天然蜂粮能增加小鼠脾脏指数,但是灌胃400和800 mg/(d·kg BW)天然蜂粮并没有增加其脾脏指数,这可能与天然蜂粮双向调节体液免疫及灌胃剂量设置过高有关[21]。天然蜂粮能显著升高小鼠胸腺指数,这可能与天然蜂粮中含有的活性多糖和黄酮类化合物刺激机体免疫器官的发育有关[22-24],但其调控机理还不清楚,有待进一步研究。
NK细胞是免疫系统中重要的免疫细胞,成熟的NK细胞具有杀伤肿瘤、外来病原体,以及分泌免疫因子、调节效应细胞活性的作用[25]。正常细胞内胞浆中的LDH不能透过细胞膜,当小鼠骨髓瘤细胞被NK细胞杀死后,细胞膜通透性改变,LDH被释放出来。检测组织匀浆上清液中LDH活性可有效反映出NK细胞活性。本试验结果表明,天然蜂粮和蜂花粉都能显著增加小鼠NK细胞活性,但中剂量天然蜂粮提升NK细胞活性的效果已经基本与高剂量蜂花粉持平。从食用成本的角度来分析,天然蜂粮提升NK细胞活性的功效更强。NK细胞活性的增加反映出天然蜂粮和蜂花粉均能增强小鼠体内的细胞免疫作用,进而减少机体受到外来致病菌、病毒及肿瘤的威胁[26]。这是由于天然蜂粮和蜂花粉中含有的多糖提升了小鼠的淋巴细胞转化能力,使其分化成NK细胞[27],但具体作用机制还有待进一步研究。
机体免疫系统由非特异性免疫和特异性免疫组成。其中非特异性免疫由组织屏障(皮肤和黏膜系统、血脑屏障等)、固有免疫细胞(吞噬细胞、NK细胞、单核细胞、淋巴细胞等)、固有免疫分子(补体、细胞因子、酶类物质等)组成,特异性免疫分为体液免疫和细胞免疫[28-29]。抗体生成细胞检测法是体外测定体液免疫功能的经典方法:经过SRBC免疫的小鼠脾细胞悬液与适量SRBC混合,在补体参与下,可使分泌抗体的的脾细胞周围的SRBC溶解,形成肉眼可见的空斑。溶血空斑数可反映抗体含量,即溶血空斑数越多,抗体生成细胞数越多,机体免疫功能也越高[30]。本试验结果表明,6个试验组小鼠的溶血空斑数相对于空白对照组均显著升高,但是蜂粮高剂量组小鼠溶血空斑数显著高于3个蜂花粉剂量组和蜂粮低、中剂量组。这说明天然蜂粮增强小鼠体液免疫的功效优于蜂花粉,且具有一定的剂量累计效应,原因可能是由于天然蜂粮中含量丰富的营养物质促进了抗体生成细胞的增殖和分化。
小鼠碳廓清试验是测定巨噬细胞吞噬能力的常用方法,血碳被清除速率的快慢可反映出机体非特异性免疫水平的高低。本次试验结果显示天然蜂粮具有升高小鼠吞噬指数的作用,其中蜂粮中剂量组小鼠吞噬指数与空白对照组相比增幅达25.58%,远高于3个蜂花粉剂量组和蜂粮低、高剂量组。这可能是因为天然蜂粮中含有的氨基酸、多肽、蛋白质、多糖、维生素等物质促使吞噬细胞合成大量微管、微丝,增强了其与凋亡细胞和病原微生物的结合能力;同时,蜂粮中富含的不饱和脂肪酸增强了细胞膜的流动性,并增强了吞噬细胞的吞噬能力[31]。
结合天然蜂粮对小鼠各项免疫指标的调节作用及食用成本来判定,天然蜂粮最适宜食用剂量为400 mg/(d·kg BW)。我国是世界第一养蜂大国,随着天然蜂粮生产技术的推广以及其营养成分、动物功效研究的深入[8, 16, 32],天然蜂粮这种新型纯天然发酵保健食品市场前景一片大好。
4 结论不同剂量天然蜂粮与蜂花粉对小鼠的生长均无不良影响,且二者均能提高NK细胞活性,并可提高体液免疫功能,而且天然蜂粮还能够刺激胸腺发育。综合来看,天然蜂粮调节免疫的功效要优于蜂花粉。
| [1] |
王谦, 耿越, 李晓, 等. 蜂花粉和松花粉主要营养成分对比分析[J]. 食品研究与开发, 2017, 38(14): 219-224. DOI:10.3969/j.issn.1005-6521.2017.14.047 |
| [2] |
何得平. 临夏油用紫斑牡丹花粉营养成分分析[J]. 林业科技通讯, 2017(3): 57-58. |
| [3] |
高丽娇, 刘佳霖, 程尚, 等. 四种花粉的营养成分及含量分析[J]. 黑龙江畜牧兽医, 2016(10): 175-177. |
| [4] |
牛德芳, 王波, 陈玉勇, 等. 油菜蜂花粉及其蜂粮的营养成分[J]. 食品工业科技, 2019, 40(9): 218-223. |
| [5] |
牛德芳, 王波, 张静, 等. 油菜蜂花粉及其蜂粮不同溶剂提取物抗氧化活性研究[J]. 食品研究发, 2019, 40(6): 42-46. |
| [6] |
牛德芳, 王波, 殷玲, 等. 油菜蜂花粉及其蜂粮的挥发性成分研究[J]. 江苏农业科学, 2019, 47(3): 164-169. |
| [7] |
江武军, 曾志将. 蜂粮研究进展[J]. 黑龙江畜牧兽医, 2015(2): 118-119. |
| [8] |
KIELISZEK M, PIWOWAREK K, KOT A M, et al. Pollen and bee bread as new health-oriented products:a review[J]. Trends in Food Science & Technology, 2018, 71: 170-180. |
| [9] |
李震, 刘志勇, 江武军, 等. 天然蜂粮对高脂血症大鼠血脂、抗氧化及免疫功能的影响[J]. 中国农业科学, 2019, 52(16): 2912-2920. DOI:10.3864/j.issn.0578-1752.2019.16.016 |
| [10] |
ANDERSON K E, CARROLL M J, SHEEHAN T, et al. Hive-stored pollen of honey bees:many lines of evidence are consistent with pollen preservation, not nutrient conversion[J]. Molecular Ecology, 2014, 23(23): 5904-5917. DOI:10.1111/mec.12966 |
| [11] |
DEGRANDI-HOFFMAN G, ECKHOLM B J, HUANG M H. Concentrations of nutrients in pollen can change after conversion to bee bread[J]. American Bee Journal, 2013, 153(11): 1195-1198. |
| [12] |
TAVDIDISHVILI D, KHUTSIDZE T, PKHAKADZE M, et al. Flavonoids in Georgian bee bread and bee pollen[J]. Journal of Chemistry and Chemical Engineering, 2014, 8(7): 676-681. |
| [13] |
KAPLAN M, KARAOGLU Ö, EROGLU N, et al. Fatty acid and proximate composition of bee bread[J]. Food Technology and Biotechnology, 2016, 54(4): 497-504. |
| [14] |
ZHOU J H, QI Y T, RITHO J, et al. Flavonoid glycosides as floral origin markers to discriminate of unifloral bee pollen by LC-MS/MS[J]. Food Control, 2015, 57: 54-61. DOI:10.1016/j.foodcont.2015.03.035 |
| [15] |
贺春玲. 蜂粮的防腐机理[J]. 中国蜂业, 2011, 62(1): 16-17. DOI:10.3969/j.issn.0412-4367.2011.01.005 |
| [16] |
江武军, 吴小波, 刘光楠, 等. 天然蜂粮生产技术研究与应用[J]. 中国农业科学, 2017, 50(19): 3828-3836. DOI:10.3864/j.issn.0578-1752.2017.19.019 |
| [17] |
朱奇, 郭善利, 刘国富, 等. 双歧因子人工蜂粮保健食品对小鼠免疫功能的影响[J]. 食品科技, 2004(6): 101-103. DOI:10.3969/j.issn.1005-9989.2004.06.031 |
| [18] |
曾志将. 养蜂学[M]. 3版. 北京: 中国农业出版社, 2017: 153-155.
|
| [19] |
闫新新.雄激素(苯丙酸诺龙)对小鼠胸腺和脾脏中T细胞发育的影响[D].硕士学位论文.济南: 山东大学, 2018: 2-4. http://cdmd.cnki.com.cn/Article/CDMD-10422-1018108365.htm
|
| [20] |
柏慧敏.沙棘黄酮对大鼠抗氧化与免疫功能作用的研究[D].硕士学位论文.哈尔滨: 东北农业大学, 2009: 38-39. http://cdmd.cnki.com.cn/article/cdmd-10224-2009219455.htm
|
| [21] |
王萌, 方笋, 赵晓娟, 等. 芍芪多苷对小鼠体液免疫的调节作用[J]. 中国新药杂志, 2008, 17(10): 842-846. DOI:10.3321/j.issn:1003-3734.2008.10.008 |
| [22] |
帅学宏, 胡庭俊, 陈炅然, 等. 鬼臼多糖对小鼠免疫功能和抗氧化能力的影响[J]. 畜牧兽医学报, 2008, 39(7): 1000-1004. DOI:10.3321/j.issn:0366-6964.2008.07.027 |
| [23] |
胡庭俊, 郑荣梁. 蕨麻多糖对小鼠免疫功能的调节与体内自由基水平关系的实验察[J]. 广西农业生物科学, 2007, 26(增刊): 45-48. |
| [24] |
曹柏营, 姜秀娟, 戚颖欣, 等. 藤本豆豆荚总黄酮对小鼠免疫功能的影响[J]. 食品与机械, 2017, 33(1): 156-160. |
| [25] |
王恒禹, 董艳萍. 三七花提取物对小鼠NK细胞活性的增强作用[J]. 西华大学学报(自然科学版), 2018, 37(5): 64-67, 72. DOI:10.3969/j.issn.1673-159X.2018.05.014 |
| [26] |
张荣标, 何聆, 陈润, 等. 油菜蜂花粉对正常小鼠免疫功能的影响[J]. 实用预防医学, 2005, 12(1): 44-46. DOI:10.3969/j.issn.1006-3110.2005.01.015 |
| [27] |
钟媛媛, 杨晓涵, 张要武, 等. 三七多糖对小鼠免疫功能的影响[J]. 华西药学杂志, 2016, 31(6): 573-576. |
| [28] |
李耀燕, 张曼, 闫国跃, 等. 骆越壮酒对正常小鼠免疫功能的影响[J]. 中国中医药科技, 2019, 26(2): 185-188. |
| [29] |
BRENNAN C A, ANDERSON K V. Drosophila:the genetics of innate immune recognition and response[J]. Annual Review of Immunology, 2004, 22: 457-483. DOI:10.1146/annurev.immunol.22.012703.104626 |
| [30] |
ELROD-ERICKSON M, MISHRA S, SCHNEIDER D. Interactions between the cellular and humoral immune responses in Drosophila[J]. Current Biology, 2000, 10(13): 781-784. DOI:10.1016/S0960-9822(00)00569-8 |
| [31] |
金伟, 欧兵, 谢惠萍, 等. 蜂花粉王浆胶囊对小鼠免疫功能影响的研究[J]. 职业卫生与病伤, 2010, 25(4): 258-259. DOI:10.3969/j.issn.1006-172X.2010.04.025 |
| [32] |
江武军, 何旭江, 吴小波, 等. 天然蜂粮生产技术及贮存规律研究[J]. 江西农业大学学报, 2018, 40(6): 1293-1298. |




