2. 国家水禽产业技术体系营养与饲料功能研究室, 青岛 266109
2. National Waterfowl Industry Technical System Nutrition and Feed Function Laboratory, Qingdao 266109, China
维生素D具有调节人体内钙和磷的代谢、促进骨骼健康成长的作用,还具有调节免疫及炎症的作用,与癌症的发生也有一定的关系。研究发现,肥胖人群中缺乏维生素D,容易引起骨质疏松等疾病,可以通过补充维生素D提高血液中维生素D含量,预防疾病的发生。甘油二酯是一类甘油三酯中1个脂肪酸被羟基取代的油脂,具有脂类的性质,甘油二酯具有溶解维生素D的性质;甘油二酯与甘油三酯代谢途径不同,不会造成脂肪积累,对减轻体重、降低血脂具有很好的效果。因此,将甘油二酯与维生素D协同,观察其对肥胖大鼠血液25羟基维生素D3[25(OH)D3]含量、胫骨发育指标及肝脏维生素D受体(VDR)和脂类代谢基因过氧化酶体增殖物激活受体α(PPARα)基因表达量的影响,从而研究二者的协同作用,将具有重要意义。
研究表明,肥胖与维生素D的缺乏具有一定的相关性[1]。维生素D为脂溶性维生素,多存在于脂肪组织中,Sulistyoningrum等[2]和Wacker等[3]发现,由于肥胖导致体内脂肪组织含量增加,摄取血液中大量的维生素D进入脂肪组织中,导致肥胖人群血液中维生素D含量降低,因此需大量补充维生素D以满足机体需要。西安市儿童医院对198例超重和肥胖儿童进行维生素D补充观察试验,结果发现,肥胖儿童血液中维生素D含量升高,但对维生素D补充反应性仍较差[4]。目前,国内外有关于维生素D和甘油二酯分别治疗肥胖、促进骨骼发育的相关报道,而关于甘油二酯与维生素D协同作用的研究还未见报道。因此,本试验以肥胖SD大鼠为模型动物,以鸭油甘油二酯、维生素D3为试验材料,观察其对肥胖SD大鼠器官指数、血液25羟基维生素D3含量、胫骨发育指标及肝脏VDR和PPARα基因表达量的影响,旨在确定鸭油甘油二酯与维生素D3的协同作用,为治疗和预防肥胖人群骨质疏松提供理论依据。
1 材料与方法 1.1 试验试剂鸭油甘油二酯为本试验室自制(含量≥90%),维生素D3购自上海源叶生物科技有限公司,037A cDNA反转录试剂盒、SYBR Premix Ee Taq Ⅱ试剂盒均购自日本TaKaRa公司,25羟基维生素D3、骨源性碱性磷酸酶(BALP)试剂盒均购自南京建成生物工程研究所。
1.2 试验仪器主要仪器包括IMARK全自动酶标仪(美国Bio-Rad公司)、XS-204电子分析天平(瑞士梅特勒-托利多集团)、WH-2微型旋涡混合仪(上海沪西分析仪器有限公司)、Osteocoer 3数字闪烁式锥形扫描骨密度仪(法国MEDILINK公司)、WD-1型电子万能测验机(长春第二试验机厂)。
1.3 试验设计和饲粮选取60只体重相近的4周龄刚断奶的健康雄性SD大鼠(青岛大任富城有限公司),适应性喂养3 d。动物房室内温度控制在(20±2) ℃,相对湿度为50%~60%,室内通风良好,光照12 h(07:00—19:00)。试验期间大鼠自由采食、饮水。试验期6周,每周测1次体重。试验分2个阶段。
1) 造模阶段:试验1~3周,大鼠按照体重随机分为2个组,分别为对照组(Ⅰ组)和模型组。其中,对照组每组3个重复,每个重复5只;模型组每组9个重复,每个重复5只。对照组饲喂基础饲粮,模型组饲喂高脂饲粮进行造模。
2) 灌胃+饲养阶段:试验4~6周,造模成功后,模型组分为3个组,即肥胖模型组(Ⅱ组)、维生素D3组(Ⅲ组)和鸭油甘油二酯+维生素D3组(Ⅳ组),每组3个重复,每个重复5只。具体的试验设计见表 1。
|
|
表 1 试验设计 Table 1 Experiment design |
试验饲粮均购于德州诺唯实生物技术有限公司,试验饲粮组成及营养水平见表 2。
|
|
表 2 试验饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of experimental diets (air-dry basis) |
试验结束后,解剖大鼠取心脏、肝脏、脾脏、肾脏,将其用生理盐水清洗干净,电子天平准确称重后计算器官指数。
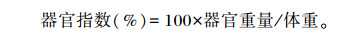
|
分别在灌胃前(0周末)和灌胃后的1、2、3周末分别采血,采用酶联免疫试剂盒检测血液25羟基维生素D3含量。
1.4.3 胫骨发育指标灌胃试验结束后,取大鼠胫骨,采用Osteocoer3数字闪烁式锥形扫描骨密度仪测定骨密度,采用WD-1型电子万能测验机测定骨强度,采用试剂盒测定血液骨源性碱性磷酸酶活性。
1.4.4 肝脏VDR、PPARα基因表达量取50 mg大鼠肝脏组织,加入液氮充分研磨,使用TaKaRa公司的RNAiso抽提组织总RNA。取500 ng总RNA用反转录试剂盒反转录成cDNA。cDNA合成条件为37 ℃,15 min;85 ℃ 5 s。按照TaKaRa公司的SYBR Premix Ex Taq Ⅱ试剂盒的说明,采用SYBR Green Ⅰ嵌合荧光法进行靶基因表达量的检测。荧光定量PCR(FQ-PCR)反应体系见表 3,反应条件为95 ℃,30 s;95 ℃,3 s;60 ℃,30 s。共循环40次,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因,引物由生工生物工程(上海)公司合成。采用2-ΔΔCt法计算VDR、PPARα基因相对于内参基因GAPDH的表达量。基因引物序列见表 4
|
|
表 3 荧光定量PCR反应体系 Table 3 Reaction system of FQ-PCR |
|
|
表 4 基因引物序列 Table 4 Gene primer sequence |
采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),并采用LSD法进行多重比较,数据采用平均值和均值标准误(SEM)表示,P<0.05为差异显著。
2 结果与分析 2.1 高脂饲粮诱导肥胖大鼠模型的建立由表 5可知,饲喂高脂饲粮3周后,模型组体重高于正常组的1.2倍,表示肥胖大鼠模型建立成功[5-6]。
|
|
表 5 高脂饲粮对建模阶段大鼠体重的影响 Table 5 Effects of high-fat diet on body weight of rats in modeling period |
由表 6可知,与Ⅰ组相比,Ⅱ组、Ⅲ组、Ⅳ组的心脏、脾脏、肾脏指数无显著差异(P>0.05),肝脏指数显著增加(P < 0.05);与Ⅱ组相比,Ⅳ组的肝脏指数显著降低(P < 0.05),Ⅲ组的肝脏指数无显著差异(P>0.05)。
|
|
表 6 鸭油甘油二酯与维生素D3协同对肥胖大鼠器官指数的影响 Table 6 Effects of combination of duck oil diacylglycerol and vitamin D3 on organ indexes of obese rats |
以上结果表明,鸭油甘油二酯与维生素D3协同能够显著降低肥胖所引起的大鼠肝脏重量的增加,对其他器官指数无显著影响。
2.3 鸭油甘油二酯与维生素D3协同对肥胖大鼠血液25羟基维生素D3含量的影响由表 7可知,与Ⅰ组相比,0周末Ⅱ组、Ⅲ组、Ⅳ组的血液25羟基维生素D3含量显著降低(P < 0.05);Ⅱ组、Ⅲ组、Ⅳ组之间无显著差异(P>0.05)。与Ⅰ组相比,1周末Ⅱ组、Ⅲ组、Ⅳ组的血液25羟基维生素D3含量显著降低(P < 0.05);与Ⅱ组相比,Ⅲ组、Ⅳ组显著增加(P>0.05);Ⅲ组、Ⅳ组之间无显著差异(P>0.05)。与Ⅰ组相比,2周末Ⅱ组、Ⅲ组、Ⅳ组的血液25羟基维生素D3含量显著降低(P < 0.05);与Ⅱ组相比,Ⅳ组显著增加(P < 0.05),Ⅲ组无显著差异(P>0.05);与Ⅲ组相比,Ⅳ组显著增加(P < 0.05)。与Ⅰ组相比,3周末Ⅱ组、Ⅲ组、Ⅳ组的血液25羟基维生素D3含量显著降低(P < 0.05);与Ⅱ组相比,Ⅲ组、Ⅳ组显著增加(P>0.05);与Ⅲ组相比,Ⅳ组显著增加(P < 0.05)。
|
|
表 7 鸭油甘油二酯与维生素D3协同对肥胖大鼠血液25羟基维生素D3含量的影响 Table 7 Effects of combination of duck oil diacylglycerol and vitamin D3 on blood 25 hydroxyl vitamin D3 content of obese rats |
以上结果表明,与单独添加维生素D3相比,鸭油甘油二酯与维生素D3协同能够显著提高1、2、3周末肥胖大鼠血液25羟基维生素D3含量。
2.4 鸭油甘油二酯与维生素D3协同对肥胖大鼠胫骨发育指标的影响由表 8可知,与Ⅰ组相比,Ⅱ组、Ⅲ组、Ⅳ组的骨密度、骨强度显著降低(P < 0.05);与Ⅱ组相比,Ⅳ组显著增加(P < 0.05),Ⅲ组无显著差异(P>0.05)。与Ⅰ组相比,Ⅱ组、Ⅲ组的血液骨源性碱性磷酸酶活性显著升高(P < 0.05),Ⅳ组无显著差异(P>0.05);与Ⅱ组相比,Ⅲ组、Ⅳ组显著降低(P < 0.05)。
|
|
表 8 鸭油甘油二酯与维生素D3协同对肥胖大鼠胫骨发育指标的影响 Table 8 Effects of combination of duck oil diacylglycerol and vitamin D3 on tibia development indexes of obese rats |
以上结果表明,鸭油甘油二酯与维生素D3协同能够减轻肥胖大鼠的骨质疏松。
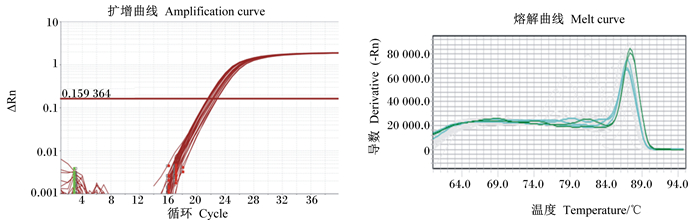
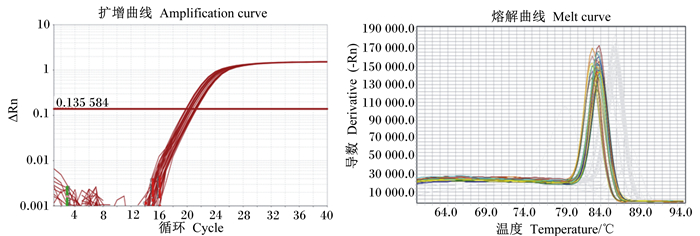
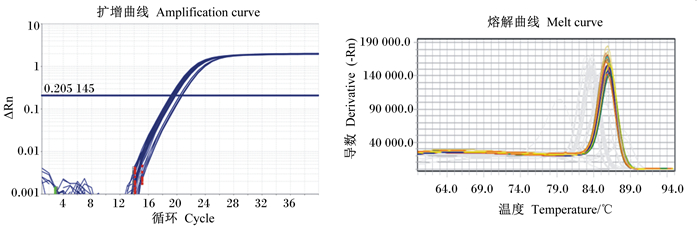
2.5 肥胖大鼠肝脏中VDR、PPARα基因的检测以cDNA为模板,进行PCR扩增,VDR、PPARα基因和内参基因(GAPDH)的扩增曲线(amplification curve)和熔解曲线(melt curve)分别如图 1、图 2和图 3所示,由图可知,基因的扩增曲线走势正常,循环数较好,表明基因表达量较高;熔解曲线显示单峰且峰值单一,说明PCR参数恰当,引物特异性比较好,检测体系比较稳定,可靠性高。
|
图 1 VDR基因的扩增曲线和熔解曲线 Fig. 1 Amplification curve and melt curve of VDR gene |
|
图 2 PPARα基因的扩增曲线和熔解曲线 Fig. 2 Amplification curve and melt curve of PPARα gene |
|
图 3 GAPDH基因的扩增曲线和熔解曲线 Fig. 3 Amplification curve and melt curve of GAPDH gene |
由表 9可知,与Ⅰ组相比,Ⅱ组、Ⅲ组、Ⅳ组的肝脏VDR、PPARα基因表达量显著降低(P < 0.05);与Ⅱ组相比,Ⅳ组的肝脏VDR、PPARα基因表达量显著增加(P < 0.05),Ⅲ组无显著差异(P>0.05)。
|
|
表 9 鸭油甘油二酯与维生素D3协同对肥胖大鼠肝脏VDR、PPARα基因表达量的影响 Table 9 Effects of combination of duck oil diacylglycerol and vitamin D3 on liver VDR and PPARα gene expressions of obese rats |
以上结果表明,鸭油甘油二酯与维生素D3协同能够显著提高VDR、PPARα基因表达量,促进脂肪酸β氧化和与体内维生素D3结合发挥生物学功能。
3 讨论 3.1 鸭油甘油二酯与维生素D3协同对肥胖大鼠器官指数的影响脏器指数可以反映脏器的功能和疾病状态。高脂饲粮会引起大鼠肝脏病变形成脂肪肝,导致肝脏重量增加。贺可琳[7]研究表明,甘油二酯可显著降低肥胖大鼠肝脏指数,并且对其他器官指数没有显著影响。李熠阳等[8]研究发现,甘油二酯对肝脏、肾脏、脾脏、小肠、胃等脏器的大小、形状、颜色均未产生异常影响。本试验发现,鸭油甘油二酯协同维生素D3能够显著降低肥胖大鼠的肝脏指数,对其他器官指数无显著影响。这表明鸭油甘油二酯协同维生素D3可减少肥胖引起的脂肪肝风险性,对其他器官无伤害。
3.2 鸭油甘油二酯与维生素D3协同对肥胖大鼠血液25羟基维生素D3含量的影响25羟基维生素D3半衰期为3周,时间较1,25二羟基维生素D3[1, 25(OH)2D3]长[9],临床上通过测定25羟基维生素D3含量以评估体内维生素D3含量[10]。本试验发现,1周末鸭油甘油二酯协同维生素D3开始显著提高肥胖大鼠血液25羟基维生素D3含量,2、3周末鸭油甘油二酯与维生素D3协同显著提高肥胖大鼠血液25羟基维生素D3含量,且与维生素D3组差异显著。Hansen等[11]研究发现,非肥胖组的女性血液25羟基维生素D3含量高于肥胖组。黄金华等[12]研究发现,随着人体血液25羟基维生素D3含量的下降,肥胖、糖尿病、高甘油三酯血症、代谢综合征、脂肪肝患病率升高。Rock等[13]研究发现,肥胖人群比基础体重减轻超过10%的人,血液中维生素D3含量增加5.0 ng/mL,表明体重减轻与血液维生素D3含量升高有关。上述研究结果与本试验结果相符,表明鸭油甘油二酯与维生素D3协同可以有效提高肥胖大鼠血液中维生素D3含量。
3.3 鸭油甘油二酯与维生素D3协同对肥胖大鼠胫骨发育指标的影响研究发现,高脂饲粮会造成大鼠骨量降低、骨强度下降[14]。骨源性碱性磷酸酶是一种成骨细胞合成的酶类,当体内钙离子减少时可导致成骨细胞转化成活性成骨细胞,以致患者血液骨源性碱性磷酸酶活性显著上升,因此其活性可反映骨组织早期病变[15]。本试验发现,鸭油甘油二酯与维生素D3协同能够显著增加肥胖大鼠胫骨的骨密度和骨强度,降低血液骨源性碱性磷酸酶活性。Choi等[16]研究发现,在肥胖大鼠高脂饲粮中加入甘油二酯与加入甘油三酯后相比较,骨密度较高,骨微观结构参数较好,对骨骼和骨代谢有较好的影响。陈福兰[17]研究发现,经强化钙、维生素D干预,中小学生的骨矿含量、骨密度以及面积均高于对照组,其骨钙素、血液25羟基维生素D3含量也高于对照组,有利于儿童的骨组织生长发育。上述研究与本试验研究结果一致,表明鸭油甘油二酯与维生素D3协同能够减轻肥胖大鼠的骨质疏松。
3.4 鸭油甘油二酯与维生素D3协同对肥胖大鼠肝脏中VDR、PPARα基因表达量的影响体内维生素D系主要通过与VDR结合发挥生物学功能。VDR的基因表达量也反映维生素D的生物活性。过氧化物酶体增殖物激活受体(PPAR)是配基活化的受体超家族,也是一种核转录因子,研究发现,PPARα能够调节脂肪酸的β氧化,已经证明控制脂肪酸代谢的酶至少有7个是依赖PPARα[18]。Cianferotti等[19]发现,将VDR基因敲除的小鼠骨髓基质细胞及同源正常的基质细胞分别进行体外培养,VDR基因敲除细胞组其分泌型卷曲相关蛋白2(frizzled-related protein 2,SFRP2)及dickkopf 1(DKK1)表达均明显增加。而SFRP2和DKK1可进一步抑制Wnt信号通路,最终导致小鼠骨髓基质细胞分化为前脂肪细胞[20-22]。本试验发现,鸭油甘油二酯与维生素D协同可以显著上调肝脏VDR和PPARα基因表达量,与上述研究结果基本一致,表明鸭油甘油二酯与维生素D3协同能够上调肝脏PPARα基因表达量,促进脂肪酸β氧化;同时上调肝脏VDR基因表达量,从而促进维生素D3与之结合在体内发挥生物功能。
4 结论① 鸭油甘油二酯与维生素D3协同能够降低肥胖大鼠肝脏指数,对其他器官指数无显著影响,还能够提高肥胖大鼠血液25羟基维生素D3含量。
② 鸭油甘油二酯与维生素D3协同能够提高胫骨的骨密度、骨强度,降低骨源性碱性磷酸酶活性,从而提高成骨细胞的活性,促进胫骨发育。
③ 鸭油甘油二酯与维生素D3协同能够显著上调肥胖大鼠的肝脏VDR、PPARα基因表达量。
| [1] |
LEARY P F, ZAMFIROVA I, AU J, et al. Effect of latitude on vitamin D levels[J]. The Journal of the American Osteopathic Association, 2017, 117(7): 433-439. DOI:10.7556/jaoa.2017.089 |
| [2] |
SULISTYONINGRUM D C, GREEN T J, LEAR S A, et al. Ethnic-specific differences in vitamin D status is associated with adiposity[J]. PLoS One, 2012, 7(8): e43159. DOI:10.1371/journal.pone.0043159 |
| [3] |
WACKER M, HOLICK M F. Sunlight and vitamin D:a global perspective for health[J]. Dermato-Endocrinology, 2013, 5(1): 51-108. DOI:10.4161/derm.24494 |
| [4] |
刘瑞萍, 武海滨, 孙宏利, 等. 维生素D补充对超重和肥胖儿童的效果观察[J]. 中国妇幼健康研究, 2018, 29(12): 1566-1569. DOI:10.3969/j.issn.1673-5293.2018.12.015 |
| [5] |
焦海涛.维生素D对大鼠单纯性肥胖的干预作用[D].硕士学位论文.济南: 山东大学, 2014. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y2597248
|
| [6] |
NAGAI N, MORITANI T. Effect of physical activity on autonomic nervous system function in lean and obese children[J]. International Journal of Obesity, 2004, 28(1): 27-33. DOI:10.1038/sj.ijo.0802470 |
| [7] |
贺可琳.鸭油甘油二酯微胶囊对肥胖大鼠成长指数、血液生化指标及抗氧化能力的影响[D].硕士学位论文.青岛: 青岛农业大学, 2016.
|
| [8] |
李熠阳.甘油二酯对试验小鼠生理机能与肠道微生物的影响[D].硕士学位论文.长沙: 湖南农业大学, 2012.
|
| [9] |
DEL VALLE E, NEGRI A L, AGUIRRE C, et al. Prevalence of 25(OH) vitamin D insufficiency and deficiency in chronic kidney disease stage 5 patients on hemodialysis[J]. Hemodialysis International, 2007, 11(3): 315-321. DOI:10.1111/j.1542-4758.2007.00186.x |
| [10] |
ZERWEKH J E. Blood biomarkers of vitamin D status[J]. The American Journal of Clinical Nutrition, 2008, 87(4): 1087S-1091S. DOI:10.1093/ajcn/87.4.1087S |
| [11] |
HANSEN B M, TUCKER L A. Fitness and bone density in women:the role of age, weight, calcium, vitamin D, and menopause[J]. The Journal of Sports Medicine and Physical Fitness, 2016, 56(9): 1047-1059. |
| [12] |
黄金华, 鲁翠红. 非体力劳动健康体检人群血清25羟维生素D水平与糖脂代谢的相关性[J]. 海南医学, 2019, 30(8): 990-993. DOI:10.3969/j.issn.1003-6350.2019.08.012 |
| [13] |
ROCK C L, EMOND J A, FLATT S W, et al. Weight loss is associated with increased serum 25-hydroxyvitamin D in overweight or obese women[J]. Obesity, 2012, 20(11): 2296-2301. DOI:10.1038/oby.2012.57 |
| [14] |
XIAO Y, CUI J, LI Y X, et al. Dyslipidemic high-fat diet affects adversely bone metabolism in mice associated with impaired antioxidant capacity[J]. Nutrition, 2011, 27(2): 214-220. DOI:10.1016/j.nut.2009.11.012 |
| [15] |
胡芯源. 骨源性碱性磷酸酶预测骨质疏松骨折患者再骨折的意义[J]. 中国骨质疏松杂志, 2014, 20(6): 640-643. |
| [16] |
CHOI H S, PARK S J, LEE Z H, et al. The effects of a high fat diet containing diacylglycerol on bone in C57BL/6J mice[J]. Yonsei Medical Journal, 2015, 56(4): 951-960. DOI:10.3349/ymj.2015.56.4.951 |
| [17] |
陈福兰. 强化钙、维生素D饮品用于儿童骨组织生长发育的作用研究[J]. 当代医学, 2018, 24(13): 102-103. DOI:10.3969/j.issn.1009-4393.2018.13.045 |
| [18] |
胡琴, 李隆贵. 心肌脂肪酸氧化酶的基因调控机制及PPARα的作用[J]. 中国病理生理杂志, 2002, 18(12): 1552-1556. DOI:10.3321/j.issn:1000-4718.2002.12.027 |
| [19] |
CIANFEROTTI L, DEMAY M B. VDR-mediated inhibition of DKK1 and SFRP2 suppresses adipogenic differentiation of murine bone marrow stromal cells[J]. Journal of Cellular Biochemistry, 2007, 101(1): 80-88. DOI:10.1002/jcb.21151 |
| [20] |
赵喜.蛇床子素经PPARα/γ信号通路治疗大鼠高脂性脂肪性肝炎的研究[D].博士学位论文.苏州: 苏州大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10285-1016225879.htm
|
| [21] |
SCHOONJANS K, STAELS B, AUWERX J. The peroxisome proliferator activated receptors (PPARs) and their effects on lipid metabolism and adipocyte differentiation[J]. Biochimica et Biophysica Acta:Lipids and Lipid Metabolism, 1996, 1302(2): 93-109. DOI:10.1016/0005-2760(96)00066-5 |
| [22] |
CAMPBELL F M, KOZAK R, WAGNER A, et al. A role for peroxisome proliferator-activated receptor α (PPARα) in the control of cardiac malonyl-CoA levels:reduced fatty acid oxidation rates and increased glucose oxidation rates in the hearts of mice lacking PPARα are associated with higher concentrations of malonyl-CoA and reduced expression of malonyl-CoA decarboxylase[J]. The Journal of Biological Chemistry, 2002, 277(6): 4098-4103. DOI:10.1074/jbc.M106054200 |




