2. 湖南省畜禽安全生产协同创新中心, 长沙 410128
2. Hunan Co-Innovation Center of Animal Production Safety, Changsha 410128, China
内质网(endoplasmic reticulum,ER)由分支小管和扁平的网状囊膜组成,存在于所有真核细胞中,并延伸到细胞质中与核膜包围。内质网分为布满核糖体的粗面内质网和包含丰富的脂质合成酶的滑面内质网2种类型。内质网不仅参与可溶性蛋白质和膜蛋白质的生物合成、折叠、加工和修饰,而且还是调节钙离子存储和脂类(胆固醇、类固醇)合成代谢的重要场所[1]。当细胞内外环境的应激因素(如营养物质缺乏、代谢紊乱、病原入侵、缺血缺氧)对内质网产生刺激时,内质网中未折叠和错误折叠的蛋白质数量异常增多,并且导致钙离子水平失衡,进而诱发内质网应激(endoplasmic reticulum stress,ERS)[2]。值得一提的是,适度的ERS是一种保护自身真核细胞免受损害的应激反应,但长期或严重的ERS会造成细胞凋亡。
1 未折叠蛋白质反应(unfolded protein response,UPR)在ERS期间,为维持细胞稳态和内质网功能的正常,内质网做出了一系列调节性反应,以减少未折叠或错误折叠蛋白质的过量积累,其中最为经典的信号通路为UPR[3],其主要目的是减少蛋白质合成并加速蛋白质的正确折叠,并通过改变细胞的转录和翻译程序来解决在应激条件下蛋白质的折叠不足[4]。而在动物细胞中,UPR信号通路主要由肌醇需求酶1(inositol requiringen zyme 1,IRE1)、蛋白激酶受体样内质网激酶(protein kinase receptor like endoplasmic reticulum kinase,PERK)和活化转录因子6(activating transcription factor 6,ATF6)[5-6]3个内质网跨膜蛋白质感受器启动(图 1)。在非应激条件下,属于内质网膜定位Ⅰ型跨膜蛋白的IRE1和PERK,以及属于Ⅱ型跨膜蛋白的ATF6[7],以上三者与内质网上的分子伴侣蛋白——结合免疫球蛋白(binding immunoglobulin protein,BiP),亦称葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)结合,阻断了与UPR的信号通路。由于内质网腔中大量积聚的未折叠或错误折叠蛋白质导致应激发生,感受器IRE1、PERK和ATF6随之与GRP78/BiP解离并被相应激活[8],进而UPR和下游级联信号通路被启动[9]。大量的研究表明,在肠上皮细胞中发生ERS时,常常伴随GRP78/BiP表达量的显著升高[10-11]。因此,在研究中普遍将分子伴侣GRP78/BiP的上调作为反映ERS发生的标志。
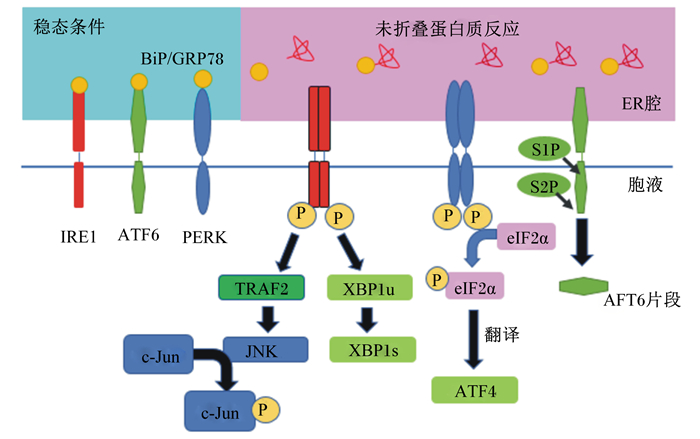
|
BiP:结合免疫球蛋白binding immunoglobulin protein;GRP78:葡萄糖调节蛋白78 glucose regulated protein 78;IRE1:肌醇需求酶1 inositol requiringen zyme 1;ATF6:活化转录因子6 activating transcription factor 6;PERK:蛋白激酶受体样内质网激酶protein kinase receptor like endoplasmic reticulum kinase;TRAF2:肿瘤坏死因子-α受体相关因子2 TNF-α receptor associated factor 2;XBP1u:X-盒结合蛋白1 X-box binding protein 1u;eIF2α:真核翻译起始因子2 translational initiation factor 2α ineukaryotes;S1P:丝氨酸位点1蛋白酶site-1 protease;S2P:丝氨酸位点2蛋白酶site-2 protease;ATF4:活化转录因子4 activating transcription factor 4;JNK:c-Jun N末端激酶c-Jun N-terminal kinase;P:磷phosphorus。 图 1 ERS与3种UPR的信号通路 Fig. 1 Signaling pathway of ERS with three UPR[12] |
在动物细胞中,IRE1有IRE1α和IRE1β 2种细胞亚型,前者普遍存在于各种细胞中,同时也是UPR中的主要参与者,而后者则主要存在于消化道上皮细胞中[13-14]。一旦感测到未折叠或错误折叠蛋白质,GRP78/Bip与IRE1α解离,并通过同源二聚化和反式-自磷酸化机制促进IRE1α的活化[15]。活化的IRE1α利用其内切核糖核酸酶活性切割IRE1α下游转录因子XBP1,去除其mRNA中26对bp片段,并产生功能活性的XBP1同种型(XBP1s)[16]。XBP1s是可诱导蛋白质折叠、分泌和磷脂合成的转录因子,其调节内质网伴侣蛋白编码,是内质网腔中相关蛋白质降解成员[9]。因此,IRE1-XBP1信号通路的激活可使内质网转位酶、糖基化酶、二硫化物异构酶和参与脂质生物合成组分的基因表达上调,以此减少蛋白质的合成,减轻蛋白质在内质网腔中的积累。由此可见,IRE1-XBP1信号通路在UPR缓解ERS中起着关键作用。此外,IRE1α的核酸内切酶结构域可以靶向降解XBP1 mRNA外其他mRNA,该现象称为调节性IRE1α依赖降解(regulated IRE1α dependent decay,RIDD),从而通过受调节的IRE1依赖性衰变抑制新生蛋白质的合成,减轻内质网转运负担,直至ERS减轻[17]。此外,当ERS加重时,UPR中的IRE1将激活肿瘤坏死因子-α受体相关因子2(TRAF2),二者相应结合并以复合体的形式招募c-Jun N末端激酶(c-Jun N-terminal kinase,JNK),导致其发生磷酸化反应,进而激活细胞凋亡信号通路,促成响应ERS的炎性促凋亡信号传导[4]。据报道,IRE1α还与凋亡B细胞淋巴瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)和Bcl-2拮抗剂/杀伤细胞(Bak)相互作用,此途径有助于细胞凋亡[18-19]。
1.2 PERK-真核翻译起始因子2α(translational initiation factor 2α ineukaryotes,eIF2α)-活化转录因子4(activating transcription factor 4,ATF4)信号通路PERK属于丝氨酸/苏氨酸蛋白激酶,与IRE1同为Ⅰ型跨膜蛋白质并具有结构相似性,当在ER腔中感测到错误折叠或未折叠蛋白质时,PERK与BiP/GRP78解离发生解离,并形成二聚体,然后引发反式-自磷酸化机制,从而激活下游信号通路[20]。活化的PERK与eIF2α结合,促使其发生磷酸化反应,导致eIF2α组装80S核糖体的功能得到抑制,蛋白质的合成减少。此传导途径可有效衰减内质网中蛋白质合成和错误折叠蛋白质超负荷积累[21]。值得一提的是,磷酸化后的eIF2α可选择性地增强ATF4的翻译和蛋白质的折叠[22]。ATF4随之上调CCAAT/增强子结合蛋白同源蛋白(CHOP)。上述提到当细胞未能解决蛋白质折叠缺陷、恢复内质网平衡,UPR将通过剔除产生错误折叠或失灵蛋白质应激细胞启动细胞凋亡,以保护机体。CHOP不仅是UPR中PERK和ATF6 2条信号通路的下游因子,而且还是ERS诱导细胞凋亡的主要介质。CHOP可与ATF4相互作用并激活参与蛋白质合成机制的基因,从而在ERS细胞中引起能量耗竭和凋亡[23],其主要通过下调Bcl-2以及转录内质网氧化酶1α(Ero1α)来调控钙离子介导的细胞凋亡[7]。
1.3 ATF6信号通路ATF6是辅助肠上皮细胞应对ERS的关键转录因子,属于Ⅱ型跨膜蛋白,在哺乳动物细胞中鉴定出ATF6拥有2种同源蛋白:ATF6α和ATF6β[24]。当出现ERS时,与BiP/GRP78发生解离的ATF6随后向高尔基体转移。在高尔基体内,拥有剪切能力的丝氨酸位点1蛋白酶(site-1 protease,S1P)和丝氨酸位点2蛋白酶(site-2 protease,S2P)将ATF6裂解为具有活性的转录调节因子——ATF6片段(ATFf),并进入核内进行相关基因的调节表达。ATF6f结合DNA细胞核和转录上调参与蛋白质折叠的靶基因,以恢复内质网稳态或诱导严重ERS条件下的细胞死亡[25]。
综上所述,当发生ERS时,UPR主要通过激活3个跨膜感受器所参与的信号通路来缓解ERS。在IRE1-XBP1、PERK-eIF2α-ATF4以及ATF6所介导的通路中,IRE1-XBP1和ATF6不仅能激活相应的基因转录,提高内质网中蛋白质的折叠能力,而且还能降解内质网腔中的未折叠蛋白质。而PERK-eIF2α-ATF4通路可限制非折叠蛋白质的合成,使内质网有充足的时间对错误折叠蛋白质进行重新折叠。此外,若ERS状态严重超过细胞自身机制的调节能力时,细胞凋亡途径被激活,进而启动细胞凋亡程序。由此可见,三者相互作用、相互配合得以恢复内质网稳态。
1.4 未折叠蛋白质相关通路激活核转录因子-κB(nuclear transcription factor-κB,NF-κB)NF-κB作为Rel家族转录因子的一员,在炎症并发症中是主要参与者,在调节机体免疫、细胞分化以及炎症反应等有关基因的转录方面有着不可忽视的作用[26]。由于NF-κB与NF-κB抑制蛋白(inhibitor of NF-κB,IκB)结合,而在正常生理状况下表现无活性状态。一旦炎性刺激产生,IκB自身磷酸化的发生并伴随NF-κB解离,得到释放的NF-κB被激活而易位至细胞核,暴露的核定位信号致使其诱导更多的炎症基因转录[27]。此前研究表明,在内质网腔中蛋白质折叠负荷增加以及UPR涉及的3条信号通路均能导致NF-κB的活化(图 2)。
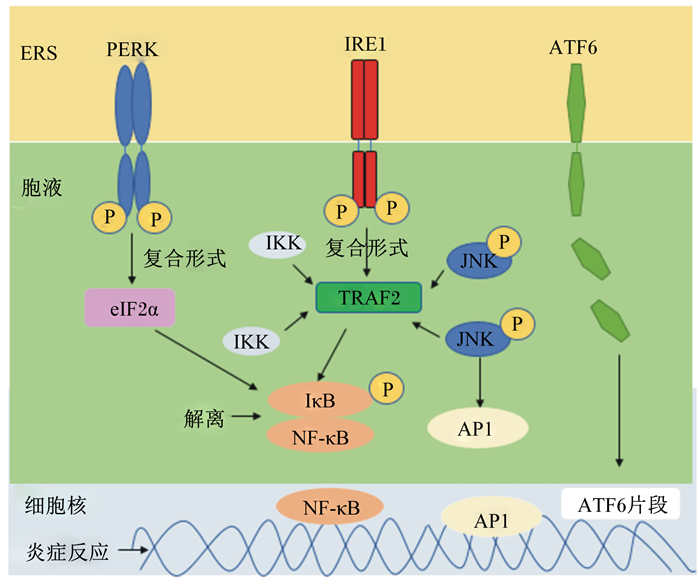
|
ERS:内质网应激endoplasmic reticulum stress;PERK:蛋白激酶受体样内质网激酶protein kinase receptor like endoplasmic reticulum kinase;IRE1:肌醇需求酶1 inositol requiringen zyme 1;ATF6:活化转录因子6 activating transcription factor 6;eIF2α:真核翻译起始因子2α translational initiation factor 2α ineukaryotes;TRAF2:肿瘤坏死因子-α受体相关因子2 TNF-α receptor associated factor 2;NF-κB:核转录因子-κB nuclear transcription factor-κB;IκB:NF-κB抑制蛋白inhibitor of NF-κB;IKK:IκB激酶IκB kinase;P:磷phosphorus;JNK:c-Jun N末端激酶c-Jun N-terminal kinase;AP1:激活蛋白1 activator protein 1。 图 2 细胞ERS与炎症反应 Fig. 2 Cell ERS and inflammatory response[28] |
首先,IRE1α是将ERS信号与炎症反应信号通路串联起来的关键因子。IRE1α的自身磷酸化诱导其胞质结构域的构象变化,并与衔接蛋白质TRAF2结合[29],以IRE1α-TRAF2的复合形式招募IκB激酶(IKK),而NF-κB通过IκB的自身磷酸化,完全得到解离释放并成功转移入核,进而诱发炎症基因转录[28]。此外,IRE1α-TRAF2还可以招募蛋白激酶JNK。作为炎症介质的磷酸化转录因子激活蛋白1(activator protein 1,AP1)不仅可激活血管紧张素Ⅱ、表皮细胞生长因子、内皮素-1等相关的炎症因子,还可使活化的JNK移位至细胞核进行炎症基因转录[30]。AP1是一类重要的真核细胞转录因子,在生理或病理信号的刺激下,会激活c-Jun并增强其转录活性,加快炎症基因的表达[31]。研究表明,将小鼠中的IRE1α基因敲除后,在小鼠胚胎成纤维细胞中,ERS所诱导的NF-κB活性、JNK活化以及炎性细胞因子肿瘤坏死因子-α(TNF-α)的产生显著降低[28]。由此可见,IRE1α可能是提供ERS和炎症联系的关键桥梁;进一步说明,ERS激活JNK和NF-κB时IRE1α-TRAF2的重要性。此外,由于NF-κB的半衰期远长于IκB,并且PERK介导的翻译衰减会使IκB与NF-κB的比例增加,而PERK-eIF2α途径可通过介导翻译衰减的方式直接促进NF-κB活化,为NF-κB易位至细胞核提供条件。ATF6同样能激活NF-κB[32],在ATF6 mRNA处理时,蛋白激酶B(Akt)磷酸化得到抑制,作为下游信号因子的NF-κB表达被活化,进而一系列炎症反应被激活[33]。至于Akt和NF-κB二者如何协同调节炎症代谢以及细胞存活和凋亡的具体机制还有待进一步研究。
2 ERS与肠道炎症的互作机制 2.1 ERS影响肠上皮细胞并诱发肠道炎症畜禽生产中动物的肠上皮细胞对各种细胞应激高度敏感,ERS通常发生在动物早期快速生长的肠道中,比如早期断奶仔猪腹泻的机制,除了外界环境的压力、饲粮的改变等原因外,目前比较清楚的是断奶仔猪诱导肠道炎症及肠细胞凋亡,而肠道上皮细胞具有发达的内质网结构,并且已有研究证实ERS在炎性肠病中发挥重要作用。洪盼[34]研究表明,在仔猪早期断奶时期,随着断奶天数的增加,仔猪小肠各肠段的GRP78、XBP1和CHOP mRNA表达量显著增加,表明ERS的发生。同时,测得血清和小肠各肠段的白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、TNF-α的含量极显著高于对照组。Kaser等[35]将小鼠肠上皮细胞的XBP1基因敲除后,GRP78 mRNA表达量增加,ERS发生。最终导致JNK磷酸化和嗜酸性粒细胞趋化因子配体1(CXCL1)分泌过多,使肠上皮细胞对微生物或细胞因子敏感性增加,同时通过病理活检发现缺失XBP1基因的小鼠存在隐窝缺陷并伴随溃烂形成,这有力的证明了ERS与肠道炎症有着密不可分的联系。但目前关于ERS在早期断奶仔猪及其他畜禽肠道腹泻中的作用还未有研究。
肠道内稳态的形成依赖于内质网功能进行适当的蛋白质折叠、修饰和分泌,从而肠上皮细胞在维持肠内稳态中起重要作用。肠内稳态由其复杂的黏液层保护,外源或内源风险因子可干扰内质网功能并损害肠屏障功能,进而激活宿主中的炎症反应。胃肠上皮细胞有众多细胞群,如Paneth细胞、杯状细胞、肠内分泌细胞和吸收性肠细胞,不仅是哺乳动物将宿主与外部环境隔开的最大屏障,也是维持肠内稳态的关键因素[25]。而肠上皮中主要的分泌细胞Paneth细胞和杯状细胞作为主要细胞群,前者可分泌各种抗微生物肽并调节肠道微生物群[36];而杯状细胞是负责产生黏蛋白,是肠黏液层的主要组分,可防止肠腔内容物与肠上皮细胞直接接触[37]。它们还可以分泌防御素、溶菌酶、抗菌凝集素、聚集蛋白和少量黏蛋白2(MUC2)[38]。在正常生理条件下,二者依赖于内质网功能进行蛋白质折叠和分泌,可保持肠上皮细胞和内质网稳态的动态平衡[39]。
早前报道,通过条件性敲除小鼠肠上皮细胞的IRE1α和同种型的IRE1β均能诱发小鼠自发性肠炎[40-41]。而Kaser等[35]类似的研究表明,将小鼠肠上皮细胞中的XBP1敲除后,通过病理活检发现,肠道呈现隐窝脓肿、白细胞浸润和明显溃疡迹象,引发小鼠产生自发性肠炎。进一步研究发现,XBP1和亚型XBP1s等位基因的缺失均将导致Paneth细胞数量减少约30%。由于减少的Paneth细胞导致分泌的抗菌肽物质严重不足,肠道抗菌功能受损加重,肠炎的易感性增加,甚至诱导Paneth细胞死亡[42]。此外,在肠上皮细胞中缺失XBP1基因的条件下发现肠上皮细胞沿着隐窝和绒毛轴加速迁移,从而证明XBP1基因缺失不仅影响Paneth细胞,而且还影响肠上皮细胞更新的整体动态,与此同时GRP78上调,JNK活化增多,IRE1活性升高,一系列迹象表明ERS发生,进一步证实ERS与肠道炎症密切相关[43]。由此可见,XBP1可以发挥部分代偿作用,抑制促炎信号传导,维持黏膜稳态,从而维持小鼠Paneth细胞功能。同时也证明IRE1-XBP1信号通路对肠上皮细胞稳态的重要性。
XBP1基因缺失除了影响Paneth细胞外,对产生黏蛋白的杯状细胞也是如此。研究发现,在肠上皮细胞中XBP1功能的丧失将导致杯状细胞数量的减少,而杯状细胞缺乏或功能障碍是溃疡性结肠炎(UC)的标志[38]。但与Paneth细胞不同,在正常生理条件下,杯状细胞可在肠道中产生大量细胞表面黏蛋白,黏蛋白的主要功能是阻止细菌、真菌、病毒和相关毒性副产物渗入。MUC2就是其中之一,不仅是肠道黏液层的主要成分,更是一种重要的分泌蛋白,其经内质网中的N-糖基化和高尔基体中的O-糖基化进行细胞内加工后分泌到肠腔中[44]。Kawashima[45]研究表明,将小鼠肠道中的MUC2敲除后,伴随着杯状细胞MUC2表达的缺失引起小鼠自发性结肠炎和结肠癌,表明杯状细胞所分泌的黏蛋白在肠内稳态中的重要性。总之,以上研究表明,杯状细胞既可能是炎症背景下的ERS的目标,也可能是ERS导致的炎症发展的直接参与者,但杯状细胞、ERS和炎症三者之间的关系机制尚不完全明确,有待进一步研究。
2.2 肠道炎症刺激ERS动物体内慢性过量的代谢因子(如脂质、葡萄糖、细胞因子)和神经递质均可在生理或病理环境中引发炎症,甚至还可以引发ERS,机体代谢功能进一步被破坏,从而引发更多的炎症。据报道,炎性细胞因子可引起ERS,TNF-α可引起激活纤维肉瘤细胞中的IRE1α、PERK和ATF6[46],从而激活UPR。Zhang等[47]研究表明,TNF-α、IL-1β和IL-6可在肝细胞中诱导ERS,导致环磷酸腺苷应答元件结合蛋白H(cAMP response element binding protein H,CREBH)活化,其作为类似于ATF6的内质网跨膜蛋白,在ERS发生时,可从内质网移位至高尔基体,经蛋白酶S1P和S2P将其剪切后,释放氨基端进入胞质,与激活的ATF6形成二聚体并转运到核内,CREBH进而介导急性期反应[48]。除了细胞因子外,过量的代谢性因素(如胆固醇、非酯化脂肪酸、葡萄糖、高半胱氨酸和神经递质)可以通过靶向细胞中的线粒体和内质网来刺激蛋白质合成。因而蛋白质折叠需求增多,钙信号传导从内质网腔中释放,并伴随自由基[如活性氧(ROS)和活性氮(RNS)]的产生,钙和自由基的信号传导诱导UPR和炎症反应信号传导,导致基因的转录,其产物可以诱导ERS并触发多种细胞类型(动脉粥样硬化、肥胖、2型糖尿病和神经衰退行性疾病)的炎症反应,甚至导致脂质和葡萄糖代谢受损、胰岛素抵抗和细胞凋亡[49-53]。
此外,细胞内钙浓度和自由基对于炎症反应诱发ERS至关重要。其中,钙浓度与多肽折叠以及分子伴侣功能有着紧密联系。内质网中的钙浓度比细胞溶胶中的钙浓度高几千倍[54],其调节方式主要通过ATP依赖性摄取钙进入内质网和肌醇-三磷酸受体介导释放钙来调节[55]。从内质网释放的钙浓缩在线粒体基质中,导致线粒体内膜去极化,破坏电子传递,导致更多的ROS产生并积累到毒性水平,从而进一步加剧内质网中钙的释放[56]。蛋白质折叠是一种产生ROS的氧化过程。ROS可以靶向分子伴侣并对内质网中钙的释放通道进行干预,致使钙从内质网释放到胞质溶胶和ERS信号传导中。一方面,内质网中钙稳态的扰动可以破坏内质网中的蛋白质折叠过程,进而引起ERS,诱导UPR并产生更多的ROS。由于线粒体中的ROS使得内质网中钙释放通道变得异常敏感,导致错误折叠蛋白质显著增多;另一方面,除ROS外,RNS还会导致炎症和ERS。一氧化氮(NO)是一种高反应性、但不带电荷并可穿透过膜的分子,其与超氧化物反应形成过氧亚硝酸盐,进而以盐的形式与蛋白质中的硫醇和金属中心反应形成亚硝酰加合物[57]。这在许多调节过程(如血管扩张、免疫反应和神经传递)中起到信号传导的作用。过量产生NO可以改变内质网氧化状态和钙浓度,扰乱电子传输链,与二硫化物键的形成干扰,并导致错误折叠的蛋白质积累在内质网[58],引发ERS和ROS产生[59-60]。此外,内质网中的氧化蛋白质在折叠期间,还原当量从蛋白质折叠基质中的硫醇基团转移到分子氧,从而产生膜可渗透的过氧化氢(H2O2)。通过以上钙的释放、ROS的产生和错误折叠蛋白质效应来共同将钙依赖性蛋白激酶、JNK和NF-κB信号通路激活,导致炎症反应甚至引发细胞凋亡[61]。
以上研究表明,ERS或线粒体代谢的病理状况均能导致UPR慢性激活,激活后的UPR通过活化JNK和NF-κB 2种信号分子,从而促使肠道炎症的发生。反之,局部炎症反应伴随ROS、炎性因子(如TNF-α)以及代谢因素紊乱的发生,进而引起ERS以及UPR。由此可见,肠上皮细胞ERS的发生,不仅与遗传易感性有关,还与炎症自身有关,且在ERS的作用下促使炎症损伤持续不断。肠上皮细胞ERS与炎症性肠病(IBD)的发病机制主要通过损害黏膜屏障功能,并调节宿主细胞的先天或获得性免疫反应。其中,遗传因素、环境因素以及肠道微生物群与宿主免疫应答之间的相互作用促成了炎症疾病的发病[62]。以上发现将内质网和IBD联系起来,从而推进了对IBD发病机制的理解,并通过恢复肠上皮细胞中的内质网功能提出了新的治疗策略。
3 小结综上所述,在动物生产过程中,有诸多因素均可引发ERS,导致肠屏障及黏膜损伤,如温度变化、断奶应激以及饲料中营养元素缺失等因素。同时ERS和UPR信号传导,贯穿于IBD的起始和发展,可见二者与易感性肠道炎症有着密切联系。在过去的10年中,研究已证实,肠上皮细胞中适当的ERS是维持体内平衡所必需的。通过纠正或消除ERS相关信号传导通路、减少氧化损伤、减轻细胞凋亡和改善肠上皮细胞的炎症反应,以此重建肠内稳态正在成为IBD潜在的治疗靶点。针对动物肠上皮细胞ERS的靶向调控可能会成为肠道炎症的重要治疗措施之一。因此,目前亟待解决的问题有:1)考虑到蛋白质折叠、翻译后的修饰和运输是涉及各种生理和病理过程的基本生物过程,如何在不引起严重副作用的情况下操纵ERS信号对患有IBD的畜禽进行干预防治;2)ERS在一定程度上是机体的一种保护机制,而在ERS发生时,如何做到选择性。
| [1] |
MANFORD A G, STEFAN C J, YUAN H L, et al. ER-to-plasma membrane tethering proteins regulate cell signaling and ER morphology[J]. Developmental Cell, 2012, 23(6): 1129-1140. DOI:10.1016/j.devcel.2012.11.004 |
| [2] |
RAN W, MONIRUZZAMAN M, SHUFFLE E, et al. Immune regulation of the unfolded protein response at the mucosal barrier in viral infection[J]. Clinical & Translational Immunology, 2018, 7(4): e1014. |
| [3] |
CORAZZARI M, GAGLIARDI M, FIMIA G M, et al. Endoplasmic reticulum stress, unfolded protein response, and cancer cell fate[J]. Frontiers in Oncology, 2017, 7: 78. DOI:10.3389/fonc.2017.00078 |
| [4] |
CAO S S, KAUFMAN R J. Endoplasmic reticulum stress and oxidative stress in cell fate decision and human disease[J]. Antioxidants & Redox Signaling, 2014, 21(3): 396-413. |
| [5] |
GARDNER B M, PINCUS D, GOTTHARDT K, et al. Endoplasmic reticulum stress sensing in the unfolded protein response[J]. Cold Spring Harbor Perspectives in Biology, 2013, 5(3): a013169. |
| [6] |
BENKO S, BROWN M, MCCARTHY M, et al. Abstract 2857:the yeast homolog of the mammalian oncogene, Bax inhibitor-1, regulates the unfolded protein response by altering the ER microenvironment[J]. Cancer Research, 2016, 76(Suppl.14): 2857-2857. |
| [7] |
PLUQUET O, POURTIER A, ABBADIE C. The unfolded protein response and cellular senescence.A review in the theme:cellular mechanisms of endoplasmic reticulum stress signaling in health and disease[J]. American Journal of Physiology:Cell Physiology, 2015, 308(6): C415-C425. DOI:10.1152/ajpcell.00334.2014 |
| [8] |
FERNÁNDEZ-BAUTISTA N, FERNÁNDEZ-CALVINO L, MUÑOZ A, et al. HOP3, a member of the HOP family in Arabidopsis, interacts with BiP and plays a major role in the ER stress response[J]. Plant, Cell & Environment, 2017, 40(8): 1341-1355. |
| [9] |
PARK K W, KIM G E, MORALES R, et al. The endoplasmic reticulum chaperone GRP78/BiP modulates prion propagation in vitro and in vivo[J]. Scientific Reports, 2017, 7: 44723. DOI:10.1038/srep44723 |
| [10] |
REMONDELLI P, Renna M. The endoplasmic reticulum unfolded protein response in neurodegenerative disorders and its potential therapeutic significance[J]. Frontiers in Molecular Neuroscience, 2017, 10: 187. DOI:10.3389/fnmol.2017.00187 |
| [11] |
CAO S S. Endoplasmic reticulum stress and unfolded protein response in inflammatory bowel disease[J]. Inflammatory Bowel Diseases, 2015, 21(3): 636-644. DOI:10.1097/MIB.0000000000000238 |
| [12] |
SUNDARAM A, APPATHURAI S, PLUMB R, et al. Dynamic changes in complexes of IRE1α, PERK, and ATF6α during endoplasmic reticulum stress[J]. Molecular Biology of the Cell, 2018, 29(11): 1376-1388. DOI:10.1091/mbc.E17-10-0594 |
| [13] |
MA X S, DAI Z L, SUN K J, et al. Intestinal epithelial cell endoplasmic reticulum stress and inflammatory bowel disease pathogenesis:an update review[J]. Frontiers in Immunology, 2017, 8: 1271. DOI:10.3389/fimmu.2017.01271 |
| [14] |
ALMANZA A, CARLESSO A, CHINTHA C, et al. Endoplasmic reticulum stress signaling-from basic mechanisms to clinical applications[J]. The FEBS Journal, 2018, 286(2): 241-278. |
| [15] |
IURLARO R, MUÑOZ-PINEDO C. Cell death induced by endoplasmic reticulum stress[J]. The FEBS Journal, 2016, 283(14): 2640-2652. DOI:10.1111/febs.13598 |
| [16] |
MEYEROVICH K, ORTIS F, ALLAGNAT F, et al. Endoplasmic reticulum stress and the unfolded protein response in pancreatic islet inflammation[J]. Journal of Molecular Endocrinology, 2016, 57(1): R1-R17. DOI:10.1530/JME-15-0306 |
| [17] |
TESKE B F, WEK S A, BUNPO P, et al. The eIF2 kinase PERK and the integrated stress response facilitate activation of ATF6 during endoplasmic reticulum stress[J]. Molecular Biology of the Cell, 2011, 22(22): 4390-4405. DOI:10.1091/mbc.e11-06-0510 |
| [18] |
ISHIKAWA T, KASHIMA M, NAGANO A J, et al. Unfolded protein response transducer IRE1-mediated signaling independent of XBP1 mRNA splicing is not required for growth and development of medaka fish[J]. eLife, 2017, 6: e26845. DOI:10.7554/eLife.26845 |
| [19] |
CARRERAS-SUREDA A, PIHÁN P, HETZ C. The unfolded protein response:at the intersection between endoplasmic reticulum function and mitochondrial bioenergetics[J]. Frontiers in Oncology, 2017, 7: 55. |
| [20] |
KIKUCHI D, TANIMOTO K, NAKAYAMA K. CREB is activated by ER stress and modulates the unfolded protein response by regulating the expression of IRE1α and PERK[J]. Biochemical and Biophysical Research Communications, 2016, 469(2): 243-250. DOI:10.1016/j.bbrc.2015.11.113 |
| [21] |
CAO S S, ZIMMERMANN E M, CHUANG B, et al. The unfolded protein response and chemical chaperones reduce protein misfolding and colitis in mice[J]. Gastroenterology, 2013, 144(5): 989-1000. DOI:10.1053/j.gastro.2013.01.023 |
| [22] |
HETZ C. The unfolded protein response:controlling cell fate decisions under ER stress and beyond[J]. Nature Reviews Molecular Cell Biology, 2012, 13(2): 89-102. DOI:10.1038/nrm3270 |
| [23] |
KOZEL C, THOMPSON B, HUSTAK S, et al. Overexpression of eIF5 or its protein mimic 5MP perturbs eIF2 function and induces ATF4 translation through delayed re-initiation[J]. Nucleic Acids Research, 2016, 44(18): 8704-8713. DOI:10.1093/nar/gkw559 |
| [24] |
HAN J, BACK S H, HUR J, et al. ER-stress-induced transcriptional regulation increases protein synthesis leading to cell death[J]. Nature Cell Biology, 2013, 15(5): 481-490. DOI:10.1038/ncb2738 |
| [25] |
HUANG J Y, WAN L, LU H P, et al. High expression of active ATF6 aggravates endoplasmic reticulum stress-induced vascular endothelial cell apoptosis through the mitochondrial apoptotic pathway[J]. Molecular Medicine Reports, 2018, 17(5): 6483-6489. |
| [26] |
COLGAN S P, CURTIS V F, CAMPBELL E L. The inflammatory tissue microenvironment in IBD[J]. Inflammatory Bowel Diseases, 2013, 19(10): 2238-2244. DOI:10.1097/MIB.0b013e31828dcaaf |
| [27] |
GARG A D, KACZMAREK A, KRYSKO O, et al. ER stress-induced inflammation:does it aid or impede disease progression?[J]. Trends in Molecular Medicine, 2012, 18(10): 589-598. DOI:10.1016/j.molmed.2012.06.010 |
| [28] |
ZHA X, YUE Y, DONG N, et al. Endoplasmic reticulum stress aggravates viral myocarditis by raising inflammation through the IRE1-associated NF-κB pathway[J]. Canadian Journal of Cardiology, 2015, 31(8): 1032-1040. DOI:10.1016/j.cjca.2015.03.003 |
| [29] |
RUTKOWSKI D T. Liver function and dysfunction—a unique window into the physiological reach of ER stress and the unfolded protein response[J]. The FEBS Journal, 2019, 286(2): 356-378. DOI:10.1111/febs.14389 |
| [30] |
DAVIS R. Signal transduction by stress-activated map kinases[J]. Journal of the Peripheral Nervous System, 2010, 5(3): 170. |
| [31] |
MANALO R V M, MEDINA P M B. The endoplasmic reticulum stress response in disease pathogenesis and pathophysiology[J]. Egyptian Journal of Medical Human Genetics, 2017, 19(2): 59-68. |
| [32] |
HOSOMI S, KASER A, BLUMBERG R S. Role of endoplasmic reticulum stress and autophagy as interlinking pathways in the pathogenesis of inflammatory bowel disease[J]. Current Opinion in Gastroenterology, 2015, 31(1): 81-88. DOI:10.1097/MOG.0000000000000144 |
| [33] |
NAKAJIMA S, HIRAMATSU N, HAYAKAWA K, et al. Selective abrogation of BiP/GRP78 blunts activation of NF-κB through the ATF6 branch of the UPR:involvement of C/EBPβ and mTOR-dependent dephosphorylation of akt[J]. Molecular and Cellular Biology, 2011, 31(8): 1710-1718. DOI:10.1128/MCB.00939-10 |
| [34] |
洪盼.β-胡萝卜素对早期断奶仔猪肠道内质网应激及其信号通路的影响[D].博士学位论文.长春: 吉林农业大学, 2018.
|
| [35] |
KASER A, LEE A H, FRANKE A, et al. XBP1 links ER stress to intestinal inflammation and confers genetic risk for human inflammatory bowel disease[J]. Cell, 2008, 134(5): 743-756. DOI:10.1016/j.cell.2008.07.021 |
| [36] |
POTT J, HORNEF M. Innate immune signalling at the intestinal epithelium in homeostasis and disease[J]. Embo Reports, 2012, 13(8): 684-698. DOI:10.1038/embor.2012.96 |
| [37] |
龙振昼, 聂青和. 潘氏细胞及其抗微生物肽与肠道黏膜免疫[J]. 世界华人消化杂志, 2017, 25(3): 209-219. |
| [38] |
FLYNN J M, DAVID N, DUNITZ J M, et al. Evidence and role for bacterial mucin degradation in cystic fibrosis airway disease[J]. PLOS Pathogens, 2016, 12(8): e1005846. DOI:10.1371/journal.ppat.1005846 |
| [39] |
CAO S S. Epithelial ER stress in Crohn's disease and ulcerative colitis[J]. Inflammatory Bowel Diseases, 2016, 22(4): 984-993. DOI:10.1097/MIB.0000000000000660 |
| [40] |
KURASHIMA Y, KIYONO H. Mucosal ecological network of epithelium and immune cells for gut homeostasis and tissue healing[J]. Annual Review of Immunology, 2017, 35: 119-147. DOI:10.1146/annurev-immunol-051116-052424 |
| [41] |
BERTOLOTTI A, WANG X Z, NOVOA I, et al. Increased sensitivity to dextran sodium sulfate colitis in IRE1β-deficient mice[J]. Journal of Clinical Investigation, 2001, 107(5): 585-593. DOI:10.1172/JCI11476 |
| [42] |
ZHANG Z, LIU Z H. Paneth cells:the hub for sensing and regulating intestinal flora[J]. Science China Life Sciences, 2016, 59(5): 463-467. DOI:10.1007/s11427-016-5018-5 |
| [43] |
NUNES T, BERNARDAZZI C, DE SOUZA H S. Cell death and inflammatory bowel diseases:apoptosis, necrosis, and autophagy in the intestinal epithelium[J]. BioMed Research International, 2014, 2014: 218493. |
| [44] |
COBO E R, KISSOON-SINGH V, MOREAU F, et al. MUC2 mucin and butyrate contribute to the synthesis of the antimicrobial peptide cathelicidin in response to Entamoeba histolytica and dextran sodium sulfate-induced colitis[J]. Infection & Immunity, 2017, 85(3): e00905-16. |
| [45] |
KAWASHIMA H. Roles of the gel-forming MUC2 mucin and its O-glycosylation in the protection against colitis and colorectal cancer[J]. Biological and Pharmaceutical Bulletin, 2012, 35(10): 1637-1641. DOI:10.1248/bpb.b12-00412 |
| [46] |
XUE X, PIAO J H, NAKAJIMA A, et al. Tumor necrosis factor α (TNFα) induces the unfolded protein response (UPR) in a reactive oxygen species (ROS)-dependent fashion, and the UPR counteracts ROS accumulation by TNFα[J]. Journal of Biological Chemistry, 2005, 280(40): 33917-33925. DOI:10.1074/jbc.M505818200 |
| [47] |
ZHANG K Z, SHEN X H, WU J, et al. Endoplasmic reticulum stress activates cleavage of CREBH to induce a systemic inflammatory response[J]. Cell, 2006, 124(3): 587-599. DOI:10.1016/j.cell.2005.11.040 |
| [48] |
FERNANDEZ A, MATIAS N, FUCHO R, et al. ASMase is required for chronic alcohol induced hepatic endoplasmic reticulum stress and mitochondrial cholesterol loading[J]. Journal of Hepatology, 2013, 59(4): 805-813. DOI:10.1016/j.jhep.2013.05.023 |
| [49] |
JI Y, LUO X, YANG Y, et al. Endoplasmic reticulum stress-induced apoptosis in intestinal epithelial cells:a feed-back regulation by mechanistic target of rapamycin complex 1(mTORC1)[J]. Journal of Animal Science and Biotechnology, 2018, 9: 38. DOI:10.1186/s40104-018-0253-1 |
| [50] |
CNOP M. High fat feeding exacerbates endoplasmic reticulum stress and beta cell demise[J]. European Journal of Lipid Science and Technology, 2012, 114(3): 229-232. DOI:10.1002/ejlt.201200058 |
| [51] |
MCALPINE C S, BOWES A J, KHAN M I, et al. Endoplasmic reticulum stress and glycogen synthase kinase-3β activation in apolipoprotein E-deficient mouse models of accelerated atherosclerosis[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2012, 32(1): 82-91. DOI:10.1161/ATVBAHA.111.237941 |
| [52] |
SOLIMAN E, VAN DROSS R, DANELL A S. Abstract 2919:a novel J-series prostamide mediates anandamide-induced endoplasmic reticulum stress-apoptosis in tumorigenic keratinocytes[J]. Cancer Research, 2015, 75(Suppl.15): 2919-2919. |
| [53] |
ZHAO Y, PAN Z, ZHANG Y, et al. The actin-related protein2/3 complex regulates mitochondrial-associated calcium signaling during salt stress in Arabidopsis[J]. The Plant Cell, 2013, 25(11): 4544-4559. DOI:10.1105/tpc.113.117887 |
| [54] |
QI H, SHUAI J W. Alzheimer's disease via enhanced calcium signaling caused by the decrease of endoplasmic reticulum-mitochondrial distance[J]. Medical Hypotheses, 2016, 89: 28-31. DOI:10.1016/j.mehy.2016.01.022 |
| [55] |
KAKIHANA T, NAGATA K, SITIA R. Peroxides and peroxidases in the endoplasmic reticulum:integrating redox homeostasis and oxidative folding[J]. Antioxidants & Redox Signaling, 2012, 16(8): 763-771. |
| [56] |
GRIEVINK H, ZELTCER G, DRENGER B, et al. Protection by nitric oxide donors of isolated rat hearts is associated with activation of redox metabolism and ferritin accumulation[J]. PLoS One, 2016, 11(7): e0159951. DOI:10.1371/journal.pone.0159951 |
| [57] |
KHODAGHOLI F, DIGALEH H, MOTAMEDI F, et al. Nitric oxide and protein disulfide isomerase explain the complexities of unfolded protein response following intra-hippocampal Aβ injection[J]. Cellular and Molecular Neurobiology, 2016, 36(6): 873-881. DOI:10.1007/s10571-015-0271-x |
| [58] |
CABALLANO-INFANTES E, TERRON-BAUTISTA J, BELTRÁN-POVEA A, et al. Regulation of mitochondrial function and endoplasmic reticulum stress by nitric oxide in pluripotent stem cells[J]. World Journal of Stem Cells, 2017, 9(2): 26-36. DOI:10.4252/wjsc.v9.i2.26 |
| [59] |
HU L, WANG J, ZHU H, et al. Ischemic postconditioning protects the heart against ischemia-reperfusion injury via neuronal nitric oxide synthase in the sarcoplasmic reticulum and mitochondria[J]. Cell Death and Disease, 2016, 7(5): e2222. DOI:10.1038/cddis.2016.108 |
| [60] |
QIU T, HE Y Y, ZHANG X, et al. Novel role of ER stress and mitochondria stress in serum-deprivation induced apoptosis of rat mesenchymal stem cells[J]. Current Medical Science, 2018, 38(2): 229-235. DOI:10.1007/s11596-018-1870-9 |
| [61] |
WU F L, LIU W Y, VAN POUCKE S, et al. Targeting endoplasmic reticulum stress in liver disease[J]. Expert Review of Gastroenterology & Hepatology, 2016, 10(9): 1041-1052. |
| [62] |
LUO K, CAO S S. Endoplasmic reticulum stress in intestinal epithelial cell function and inflammatory bowel disease[J]. Gastroenterology Research and Practice, 2015, 2015: 328791. |




