2. 广西扬翔股份有限公司, 贵港 537000;
3. 生猪健康养殖协同中心, 武汉 430070
2. Guangxi YangXiang Joint Stock Co., Ltd., Guigang 537000, China;
3. The Cooperative Innovation Center for Sustainable Pig Production, Wuhan 430070, China
精液品质包括射精量、精子密度、精子活力和形态等,决定了公猪的繁殖能力,同时影响人工授精时母猪的受胎率和繁殖性能[1-2]。研究发现,许多常量元素如钙、镁等和微量元素如锌、铜、铁、锰等能够参与生殖系统中酶的组成[3-4],构成生殖系统的重要载体及电子传递系统[5],或通过减少自由基反应和过氧化作用对生殖系统造成损害等方式影响雄性动物精子发生和精液品质[6]。另外,铅、镉等非必需元素具有毒性,动物体内铅、镉等元素的存在可影响雄性生殖系统[7-9]。毒理学研究表明,铅暴露会对小鼠精子的生理参数产生不良影响,并损害精子DNA结构和完整性[10]。Tvrdá等[11]发现精浆中铅和镉元素含量与精子活力、过氧化氢酶活性和谷胱甘肽含量呈显著负相关,但与丙二醛含量呈显著正相关。虽然已有研究报道公猪的肝脏、肾脏和精液中的铅、镉元素含量,但这些毒性元素与精液品质之间的关系尚未得到很好的阐明。本研究主要通过检测纯种长白公猪血清和精浆中营养元素和毒性元素的含量,分析长白公猪血清和精浆中元素含量与精液品质的相关性,探讨血清和精浆中营养元素和毒性元素对公猪精液品质的影响。
1 材料与方法 1.1 试验方法2016年6—8月于广西扬翔股份有限公司人工授精站选取107头健康纯种长白公猪作为试验对象,检测试验公猪每次射精的精液品质,并统计分析试验猪群精液品质记录。根据试验公猪3个月内每次射精的精液品质参数指标(2016年6—8月,共有1 402次采精记录),计算每头试验公猪各项指标的均值作为该公猪平均精液品质参数。同时,根据《种猪常温精液》(GB 23238—2009)标准,判断试验公猪每次射精的精子活力≥70%,且精子畸形率≤20%的精液可以用于授精,基于此标准计算每头试验公猪3个月内的精液可利用率,将公猪群按照精液可利用率划分为3组:低利用率组(利用率<60%,n=21)、中等利用率组(60%≤利用率≤80%,n=27)和高利用率组(利用率>80%,n=59),分析不同精液利用率的试验公猪血清和精浆元素含量差异。将精浆铅元素含量分为5组,分别为0 μg/L(n=29)、0~2.5 μg/L(n=20)、2.5~5.0 μg/L(n=22)、5.0~10.0 μg/L(n=25)和>10.0 μg/L(n=11)组。
1.2 饲养管理与试验饲粮猪场实行规模化生产,科学规范防疫及管理。试验公猪的猪舍内采用单栏饲养(0.79 m×2.40 m),混凝土地板覆盖。舍内环境温度保持在19.8~25.4 ℃,当自然光不能满足12 h光照条件时,提供额外的光照。基础饲粮组成及营养水平见表 1,试验公猪采食量限制为2.5 kg/d,充足饮水。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验公猪精液通过徒手采精法采集,采精频率为每2周3次。采集新鲜精液后分别测定射精量、精子密度、精子活力和精子畸形率。
射精量:使用电子天平检测精液重量,转化为精液体积(1 g约为1 mL);
精子密度:使用精子密度仪(富士平工业株式会社,日本)检测[12];
有效精子数:当次射精的总精子数×精子活力×(1-精子畸形率)[13-14];
精子活力:新鲜精液与精液稀释剂(金力畜牧设备有限公司)等温等比例(1 : 1)稀释,取10 μL稀释后精液样品置于预热的37 ℃载玻片上,200倍相差显微镜(ML-210JZ,南宁松金天伦生物科技有限公司)下随机选取5个视野,记录200个以上精子的活力[15]。
精子畸形率:苏木精-伊红染色法染色后,400倍显微镜(ML-210JZ,南宁松金天伦生物科技有限公司)下观察稀释后精液样品中至少200个精子的形态学结构[16]。精子畸形包括头部异常、尾部异常、中端折断、卷尾、断尾、原生质滴等[17]。
1.3.2 血清和精浆元素含量每头试验公猪精液品质测定后,于2016年9月采集试验公猪的血清和精浆样品。试验公猪禁食至少12 h,经静脉穿刺取血样,室温1 500×g离心10 min后取上层血清,分装保存。精液样品与血液样品同时采集,取新鲜精液5 mL,1 500×g离心10 min后,分离精浆。血清和精浆保存于-80 ℃,直至分析。
血清和精浆样品中元素含量的测定参照Aguiar等[18]的方法,并进行适当修改。取200 μL血清或精浆样品置于10 mL聚乙烯管中,加入400 μL浓硝酸溶液,在通风橱中冷消化过夜。随后,将样品于80 ℃水浴加热消化至溶液澄清透明,约4 h。样品消化后取出,冷却至室温,用超纯水将血清样品1 : 50稀释,精浆样品1 : 25稀释,混合过滤后上机检测。血清和精浆样品中元素的含量采用电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry,ICP-MS,安捷伦7900型,安捷伦科技有限公司,日本)测定。钪、锗、铑、铋作为内部标准液添加到所有样品中,最终浓度达到10 μg/L,用以监测和矫正仪器检测过程中的稳定性。仪器检测采用碰撞反应界面测量44Ca、56Fe和78Se,以减少常见的多原子干扰;其他元素包括24Mg、63Cu、64Zn、55Mn、208Pb和111Cd在ICP-MS正常灵敏度模式下分析其含量。所有使用的试验器具都经过10%硝酸处理24 h,然后用蒸馏去离子水充分冲洗3次,以消除可能的金属痕迹。
1.4 数据统计分析参数统计分析首先采用Shapiro-Wilk检验数据的正态性分布特征,对于正态分布数据,结果中以平均值±标准差表示,而非正态分布数据以中位数[25位四分位数~75位四分位数]表示。试验数据的组间比较采用ANOVA过程(正态分布数据)或Kruskal-Wallis过程(非正态分布数据)分析。血清和精浆中单个元素含量与各个精液品质参数之间的相关性分析采用Pearson(正态分布数据)或Spearman rank过程(非正态分布数据)统计相关系数和相关系数的显著性P值。所有试验数据的统计分析采用SAS 9.2软件,P < 0.05为差异显著,P < 0.01为差异极显著。结果中的图形采用Origin 8.0进行绘制。
2 结果与分析 2.1 长白公猪饲粮和饮水中元素含量由表 2可知,饲粮中钙、镁、铜、铁、锌、锰、硒元素的含量分别为7 600.03、2 069.02、17.78、271.63、295.71、83.36、0.32 mg/kg。饲粮中毒性元素铅和镉的含量分别为0.14和0.03 mg/kg,然而在饮水中并没有发现这2种毒性元素。
|
|
表 2 长白公猪饲粮和饮水中元素含量 Table 2 Element contents in diets and drinking water of Landrace boars |
由表 3可知,不同精液利用率组长白公猪的有效精子数、精子活力和精子畸形率有极显著差异(P < 0.01);低利用率组的有效精子数极显著低于中等利用率和高利用率组(P < 0.01)。不同精液利用率组间长白公猪的精子活力排序为:低利用率组 < 中等利用率组 < 高利用率组(P < 0.01),精子畸形率排序为:低利用率组>中等利用率组>高利用率组(P < 0.01)。结果表明,采用精液利用率指标分组能够明确反映猪群的精液品质。
|
|
表 3 不同精液利用率组长白公猪的精液品质参数 Table 3 Semen quality parameters of Landrace boars in different semen utilization groups |
由表 4可知,不同精液利用率组间长白公猪的血清和精浆元素含量无显著差异(P>0.05)。
|
|
表 4 不同精液利用率组长白公猪血清和精浆元素含量 Table 4 Element contents in serum and seminal plasma of Landrace boars in different semen utilization groups |
由表 5可知,长白公猪的精浆铅元素含量与精子活力呈显著负相关(P < 0.05),与精子畸形率呈显著正相关(P < 0.05),其他血清和精浆元素含量与精液品质参数无显著相关性(P>0.05)。
|
|
表 5 长白公猪血清和精浆元素含量与精液品质参数的相关性 Table 5 Correlation between element contents in serum and seminal plasma and semen quality parameters of Landrace boars |
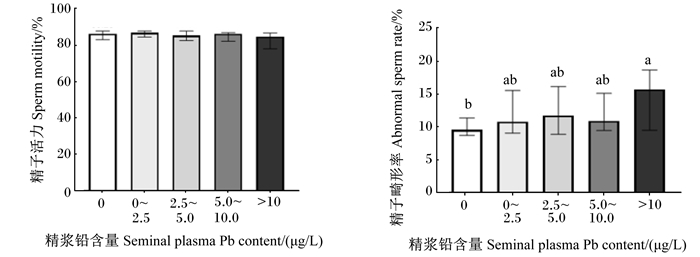
由图 1可知,不同精浆铅元素含量组间长白公猪的精子活力无显著差异(P>0.05),但精浆0 μg/L铅元素含量组的精子畸形率显著低于精浆>10.0 μg/L铅元素含量组(P < 0.05),精子畸形率降低约6.11%(15.67% vs. 9.56%)。
|
数据柱肩标相同或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05)。 Data column with the same or no letter superscripts mean no significant difference (P>0.05), and with different small letter superscripts mean significant difference (P < 0.05). 图 1 长白公猪精浆铅元素含量对精子活力和精子畸形率的影响 Fig. 1 Effects of seminal plasma Pb element content on sperm motility and abnormal sperm rate of Landrace boars |
适宜范围的必需营养元素含量对维持正常的精子生成和精子功能具有重要作用。例如,铜元素是铜/锌超氧化物歧化酶、细胞色素C氧化酶等多种酶的功能所必需的,这些铜依赖酶能够参与细胞能量供应,保护细胞免受自由基损伤[19],但铜含量过高时会对精子形态和活力有一定的负面影响[20]。而铁元素被认为是合成核酸和蛋白质、电子传输、细胞呼吸、增殖和分化必不可少的物质[21],能够参与细胞氧化还原过程,并作为许多酶和金属蛋白化合物的组分,影响精子发生和精子代谢[22]。本课题组前期研究发现,杜洛克公猪血清铜元素过量或血清铁、锰元素缺乏时会降低精子活力,增加精子畸形率,降低精液利用率[23]。对于大白公猪来说,同样发现血清铁元素缺乏会降低精液品质[24]。但本试验中未发现长白公猪血清铜、铁元素或其他营养元素与精液品质参数之间存在相关性。Fry等[25]研究指出,不同品种奶牛对微量元素的吸收和代谢存在差异。推测长白公猪血清和精浆中元素含量与精液品质参数无显著相关性可能是由于长白公猪机体元素含量处于适宜范围,未出现元素含量过高或过低的现象。例如,杜洛克公猪血清铁元素含量均值为1.20 mg/L,大白公猪血清铁元素含量均值为1.26 mg/L,而长白公猪血清铁元素含量最高,达到1.33 mg/L;对于杜洛克公猪和大白公猪来说,高精液利用率组公猪血清铁元素含量也分别仅为1.24和1.34 mg/L[23-24]
3.2 长白公猪血清和精浆中毒性元素含量对精液品质的影响铅和镉是雄性生殖系统中2种常见的毒性元素,可以通过呼吸道、消化道或皮肤进入动物体内,并在机体细胞内形成复合物,增加其存留持久性和细胞毒性[26]。重金属污染对生殖系统损伤明显,研究指出,铅元素能够通过直接作用于下丘脑-垂体-性腺轴系统影响生殖激素的生成[27],对雄性动物睾丸和精子也有直接的毒性作用,铅化合物能够诱发氧自由基产生,启动脂质过氧化反应,引起精子膜脂质过氧化[28]。同时铅元素还能通过竞争性取代超氧化物歧化酶活性中心的必需元素锌和铜进而抑制酶活性等方式,降低组织和细胞的抗氧化能力,进一步加强脂质过氧化的危害[29]。许多研究报道了暴露于铅后精子总数、精子活力、精子形态和精子代谢受损[10, 30-31]。Li等[10]研究指出,成年雄性小鼠饮水中铅元素的存在(0.25%、0.50%和1.00%醋酸铅)不仅会降低精子活力,增加精子畸形率,还会损害精子DNA结构和完整性,可能导致雄性动物生育能力下降。Taha等[30]通过对正常男性和不育男性精液中铅和镉元素含量的调查也发现,不育男性精液中铅和镉元素含量显著升高,精液铅和镉元素含量与精子活力、形态呈显著负相关,且精液铅和镉元素含量与精液活性氧(ROS)水平呈线性正相关关系。本试验中,虽然不同精液利用率组间长白公猪精浆中铅元素含量差异不显著,但精浆铅元素含量与精子活力呈负相关,与精子畸形率呈正相关;当精浆铅元素含量由0 μg/L增加至10.0 μg/L以上时,长白公猪的精子畸形率显著增加,精子畸形率增加约6.11%。这与大白公猪的研究结果一致,精浆中铅元素的存在会损害精液品质,且暴露于有毒元素的精子受到的损害可能比营养元素缺乏和过量的影响更大[24]。另外,镉元素的排泄率也很低(生物半衰期为20~40年),可以在男性生殖器官睾丸中积聚[32],影响男性精子参数和生育能力[9, 30, 33]。大鼠短期摄入镉元素会导致严重的睾丸和附睾组织学损伤,损害精子形成和精子形态[34]。一项流行病学研究发现,精液中镉元素含量与精子浓度和精子活力呈显著负相关[9]。在杜洛克公猪的研究中也发现,精浆镉元素含量增加也会损害精液品质。但是在长白公猪和大白公猪的研究中并未发现精浆中镉元素含量与精液品质参数间的相关性。然而这并不代表精浆中镉元素对长白公猪和大白公猪的精液品质无危害作用,可能是由于不同品种公猪对精浆镉元素的吸收和耐受性不同导致的。例如,杜洛克公猪精浆中镉元素含量的中位数为0.08 μg/L,但长白公猪和大白公猪的精浆中镉元素含量的中位数分别为0.03和0.00 μg/L[23-24]。
4 结论长白公猪精浆中毒性元素铅的存在会通过损害精子活力和形态,影响公猪精液品质。精浆中铅元素含量由0 μg/L增加至10.0 μg/L以上时,长白公猪的精子畸形率显著增加约6.11%。
致谢:
感谢华中农业大学理学院李胜清教授对样品元素含量检测提供的仪器协助和大力支持。
| [1] |
TSAKMAKIDIS I A, LYMBEROPOULOS A G, KHALIFA T A A. Relationship between sperm quality traits and field-fertility of porcine semen[J]. Journal of Veterinary Science, 2010, 11(2): 151-154. |
| [2] |
BROEKHUIJSE M L W J, ŠOŠTARI C ' E, FEITSMA H, et al. The value of microscopic semen motility assessment at collection for a commercial artificial insemination center, a retrospective study on factors explaining variation in pig fertility[J]. Theriogenology, 2012, 77(7): 1466-1479. |
| [3] |
BEUTLER E, BLAISDELL R K. Iron enzymes in iron deficiency.Ⅱ.Catalase in human erythrocytes[J]. The Journal of Clinical Investigation, 1958, 37(6): 833-835. |
| [4] |
BANSAL A K. Manganese:a potent antioxidant in semen[J]. Iranian Journal of Applied Animal Science, 2013, 3(2): 217-221. |
| [5] |
ARREDONDO M, N U ' ÑEZ M T. Iron and copper metabolism[J]. Molecular Aspects of Medicine, 2005, 26(4/5): 313-327. |
| [6] |
LETELIER M E, SÁNCHEZ-JOFRÉ S, PEREDO-SILVA L, et al. Mechanisms underlying iron and copper ions toxicity in biological systems:pro-oxidant activity and protein-binding effects[J]. Chemico-Biological Interactions, 2010, 188(1): 220-227. |
| [7] |
WADI S A, AHMAD G. Effects of lead on the male reproductive system in mice[J]. Journal of Toxicology and Environmental Health:Part A-Current Issues, 1999, 56(7): 513-521. |
| [8] |
MONSEFI M, ALAEE S, MORADSHAHI A, et al. Cadmium-induced infertility in male mice[J]. Environmental Toxicology, 2010, 25(1): 94-102. |
| [9] |
PANT N, KUMAR G, UPADHYAY A D, et al. Correlation between lead and cadmium concentration and semen quality[J]. Andrologia, 2015, 47(8): 887-891. |
| [10] |
LI C L, ZHAO K, ZHANG H P, et al. Lead exposure reduces sperm quality and DNA integrity in mice[J]. Environmental Toxicology, 2018, 33(5): 594-602. |
| [11] |
TVRDÁ E, KÑAŽICKÁ Z, LUKÁ ČOVÁ J, et al. The impact of lead and cadmium on selected motility, prooxidant and antioxidant parameters of bovine seminal plasma and spermatozoa[J]. Journal of Environmental Science and Health:Part A-Toxic/Hazardous Substances and Environmental Engineering, 2013, 48(10): 1292-1300. |
| [12] |
WANG C, LI J L, WEI H K, et al. Effects of feeding regimen on weight gain, semen characteristics, libido, and lameness in 170-to 250-kilogram Duroc boars[J]. Journal of Animal Science, 2016, 94(11): 4666-4676. |
| [13] |
SMITAL J, DE SOUSA L L, MOHSEN A. Differences among breeds and manifestation of heterosis in AI boar sperm output[J]. Animal Reproduction Science, 2004, 80(1/2): 121-130. |
| [14] |
WOLF J, SMITAL J. Quantification of factors affecting semen traits in artificial insemination boars from animal model analyses[J]. Journal of Animal Science, 2009, 87(5): 1620-1627. |
| [15] |
BEORLEGUI N, CETICA P, TRINCHERO G, et al. Comparative study of functional and biochemical parameters in frozen bovine sperm[J]. Andrologia, 1997, 29(1): 37-42. |
| [16] |
KOZINK D M, ESTIENNE M J, HARPER A F, et al. Effects of dietary L-carnitine supplementation on semen characteristics in boars[J]. Theriogenology, 2004, 61(7/8): 1247-1258. |
| [17] |
SHIPLEY C F. Breeding soundness examination of the boar[J]. Journal of Swine Health and Production, 1999, 7(3): 117-120. |
| [18] |
AGUIAR G F M, BATISTA B L, RODRIGUES J L, et al. Determination of trace elements in bovine semen samples by inductively coupled plasma mass spectrometry and data mining techniques for identification of bovine class[J]. Journal of Dairy Science, 2012, 95(12): 7066-7073. |
| [19] |
URIU-ADAMS J Y, KEEN C L. Copper, oxidative stress, and human health[J]. Molecular Aspects of Medicine, 2005, 26(4/5): 268-298. |
| [20] |
MASSÁNYI P, TRANDZIK J, NAD P, et al. Concentration of copper, iron, zinc, cadmium, lead, and nickel in bull and ram semen and relation to the occurrence of pathological spermatozoa[J]. Journal of Environmental Science and Health:Part A-Toxic/Hazardous Substances and Environmental Engineering, 2004, 39(11/12): 3005-3014. |
| [21] |
LIEU P T, HEISKALA M, PETERSON P A, et al. The roles of iron in health and disease[J]. Molecular Aspects of Medicine, 2001, 22(1/2): 1-87. |
| [22] |
KASPERCZYK A, DOBRAKOWSKI M, CZUBA Z P, et al. Influence of iron on sperm motility and selected oxidative stress parameters in fertile males—a pilot study[J]. Annals of Agricultural and Environmental Medicine, 2016, 23(2): 292-296. |
| [23] |
WU Y H, LAI W, LIU Z H, et al. Serum and seminal plasma element concentrations in relation to semen quality in Duroc boars[J]. Biological Trace Element Research, 2019, 189(1): 85-94. |
| [24] |
WU Y H, GUO L L, LIU Z H, et al. Microelements in seminal and serum plasma are associated with fresh semen quality in Yorkshire boars[J]. Theriogenology, 2019, 132: 88-94. |
| [25] |
FRY R S, SPEARS J W, LLOYD K E, et al. Effect of dietary copper and breed on gene products involved in copper acquisition, distribution, and use in Angus and Simmental cows and fetuses[J]. Journal of Animal Science, 2013, 91(2): 861-871. |
| [26] |
TCHOUNWOU P B, YEDJOU C G, PATLOLLA A K, et al. Heavy metal toxicity and the environment[M]. LUCH A.Molecular, Clinical and Environmental Toxicology.Basel, Switzerland: Springer, 2012: 133-164.
|
| [27] |
SOKOL R Z, WANG S, WAN Y J Y, et al. Long-term, low-dose lead exposure alters the gonadotropin-releasing hormone system in the male rat[J]. Environmental Health Perspectives, 2002, 110(9): 871-874. |
| [28] |
GOMES M, GONÇALVES A, ROCHA E, et al. Effect of in vitro exposure to lead chloride on semen quality and sperm DNA fragmentation[J]. Zygote, 2015, 23(3): 384-393. |
| [29] |
LAWTON L J, DONALDSON W E. Lead-induced tissue fatty acid alterations and lipid peroxidation[J]. Biological Trace Element Research, 1991, 28(2): 83-97. |
| [30] |
TAHA E A, SAYED S K, GHANDOUR N M, et al. Correlation between seminal lead and cadmium and seminal parameters in idiopathic oligoasthenozoospermic males[J]. Central European Journal of Urology, 2013, 66(1): 84-92. |
| [31] |
BONDE J P, JOFFE M, APOSTOLI P, et al. Sperm count and chromatin structure in men exposed to inorganic lead:lowest adverse effect levels[J]. Occupational and Environmental Medicine, 2002, 59(4): 234-242. |
| [32] |
CHENG C Y, MRUK D D. The blood-testis barrier and its implications for male contraception[J]. Pharmacological Reviews, 2012, 64(1): 16-64. |
| [33] |
MENDIOLA J, MORENO J M, ROCA M, et al. Relationships between heavy metal concentrations in three different body fluids and male reproductive parameters:a pilot study[J]. Environmental Health, 2011, 10(1): 6. |
| [34] |
PAŘÍZEK J, ZÁHOŘ Z. Effect of cadmium salts on testicular tissue[J]. Nature, 1956, 177(4518): 1036. |




