光照是家畜生长、生产和繁殖的一个重要环境因素,是畜禽环境的重要组成部分,其信号可通过视网膜将神经冲动传递给下丘脑室交叉上核(superior chiasmal nucleus, SCN),然后经过室旁核(paraventricular nucleus, PVN),最后传递到松果体(pineal gland,PG)[1],促使松果体分泌褪黑素(melatonin, MLT),进而影响家畜的生理机能和生产性能。
光周期对于机体的影响主要体现在MLT分泌量的多少和分泌时间的长短。MLT是一种多功能分子,在其广泛的功能中,缓解氧化应激和调节免疫功能使其成为近年来该领域的热点研究对象[2-3]。据报道,不同季节的MLT水平的日变化可以显著影响哺乳动物的免疫系统和自由基清除能力,其作用可能是通过受体信号传递以及抗氧化[4-5]和抗凋亡机制[6]介导的。MLT在缓解氧化应激方面非常有效,外源MLT注射提高了小鼠和鸡组织中谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)、总超氧化物歧化酶(total superoxide dismutase, T-SOD)活性[7-8],提高了过氧化氢酶(catalase, CAT)活性[9]。相反,切除松果体的啮齿动物会降低组织中GPx活性[10]。此外,MLT可能直接作用于免疫细胞,释放细胞因子,产生免疫调节作用。研究表明,MLT能提高人外周血单个核细胞白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-2(interleukin-2, IL-2)、白细胞介素-6(interleukin-6, IL-6)和γ-干扰素(interferon-γ, IFN-γ)的含量[11]。
然而,通过改变光周期使血液中MLT含量产生变化,进而影响反刍动物免疫和抗氧化功能的研究鲜有报道,因此,本试验选择内蒙古绒山羊为试验动物,研究光周期变化对MLT分泌、免疫和抗氧化功能和相关基因表达的影响,为揭示光周期变化对绒山羊免疫和抗氧化功能的影响机制提供依据。
1 材料及方法 1.1 试验设计本试验于2018年4月18日至2018年6月16日在内蒙古呼和浩特市内蒙古农业大学试验农场进行,历时60 d,在此期间每天自然光照时间逐渐增长。将18只体重相近[(13.57±0.66) kg]的6月龄雌性绒山羊随机分为3组,每组6头,分别饲养在3个光照控制舍内。对照(CG)组山羊接受自然光照;短光照(SDPP)组每天从10:00到18:00接受8 h光照、16 h黑暗(8L : 16D);渐减光照(SIPP)组由每天16 h光照、8 h黑暗(16L : 8D)开始,每经过1周,每天光照时间缩短1 h,直至试验结束时达到每天8 h光照、16 h黑暗(8L : 16D),试验前期自然光消失后由日光灯补充光照。3组试验羊在10:00和17:00各饲喂1次,饲粮营养水平符合NRC(2007)标准。
1.2 测定指标及方法 1.2.1 样品的采集与测定于试验第1、30和60天05:00用非抗凝采血管采集血样,静置凝固后在3 000×g离心10 min收集血清,-20 ℃冷冻。血清MLT含量和免疫指标[免疫球蛋白G(immunoglobulin G, IgG)、免疫球蛋白A(immunoglobulin A, IgA)、免疫球蛋白M(immunoglobulin M, IgM)、IL-1β、IL-2和肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)含量]采用酶联免疫吸附(ELISA)试剂盒(瑞星生物)测定。抗氧化指标[总抗氧化能力(total antioxidant capacity, T-AOC)、T-SOD、CAT、GPx活性和丙二醛(malondialdehyde, MDA)含量]采用南京建成生物工程研究所的试剂盒测定。
1.2.2 基因相对表达量测定于试验第30和60天05:00用含有乙二胺四乙酸(EDTA)的抗凝采血管采集血液,随后在3 000×g离心15 min后收集中间层白细胞,之后与Trizol(TaKaRa,大连宝生物公司)混合,并存于液氮中。总RNA的提取采用RNAIisoTM PLUS裂解液法,用紫外分光光度计在260和280 nm对RNA进行定量和定性测定。采用0.8%琼脂糖凝胶电泳检测RNA的完整性。cDNA的合成按照试剂盒PrimeScriptTM RT reagent Kit(Perfect Real Time)的说明书进行。实时荧光相对定量PCR反应按照试剂盒TB Premix Dimer EraserTM进行操作,扩增条件:第1步95 ℃,30 s,共1个循环;第2步95 ℃,5 s;60 ℃,30 s,共40个循环;第3步95 ℃,15 s;60 ℃,30 s;95 ℃,30 s,共1个循环。山羊超氧化物歧化酶1(SOD)、SOD2、GPx1、GPx4、核转录因子2(nuclear factor erythroid-2-related factor 2, Nrf2)、CAT、IL-1β、IL-2、IL-6和TNF-α引物序列如表 1所述,由上海生工设计合成。以β-肌动蛋白(β-actin)、β2-微球蛋白(B2M)和酪氨酸3/色氨酸5-单加氧酶激活蛋白(YWHAZ)为内参基因,计算3个内参基因的几何平均Ct值,并检测各基因相对表达量,目的基因相对表达量用2-△△Ct值表示[12]。
|
|
表 1 引物序列 Table 1 Primer sequences |
试验数据经Excel 2010整理后,采用SAS 9.4软件分析程序进行方差分析,并进行Duncan氏多重比较,P>0.05表示差异不显著,P < 0.05表示差异显著。试验结果表示为平均值(M)±标准差(SD)。
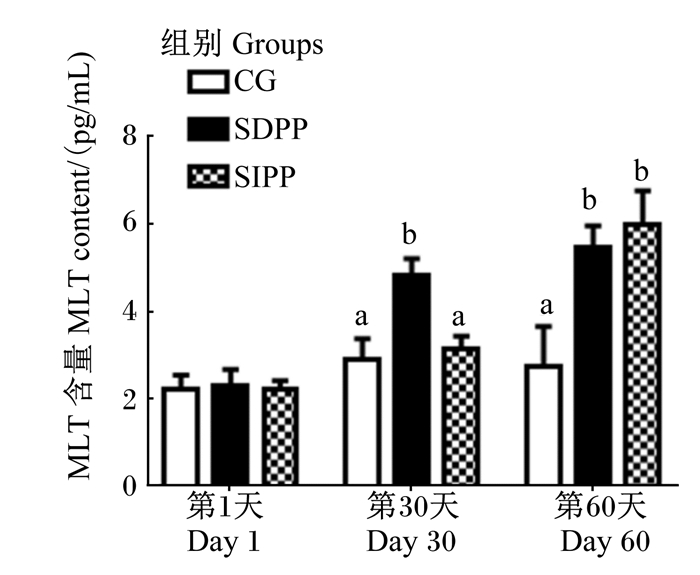
2 结果与分析 2.1 光周期变化对山羊血清中MLT含量的影响调控光周期对山羊血清中MLT含量的影响如图 1所示,在试验第30天,SDPP组血清MLT含量显著高于其他2组(P < 0.05);在试验第60天,与对照组相比,SDPP和SIPP均显著提高了血清MLT含量(P < 0.05)。
|
数据柱标注不同字母表示组间差异显著(P < 0.05)。下图同。 Data bars with different superscripts mean significant difference between groups (P < 0.05). The same as below. 图 1 光周期变化对山羊血清中MLT含量的影响 Fig. 1 Effects of photoperiod change on serum MLT content of goats |
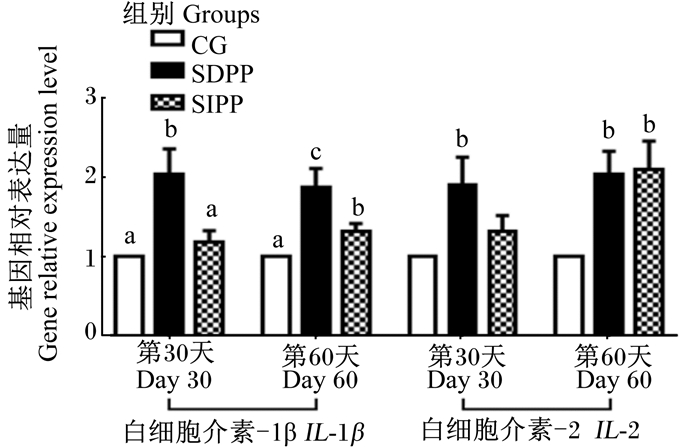
光周期变化对山羊血清免疫指标及相关基因表达的影响分别如表 2和图 2所示,与对照组相比,在试验第30天,SDPP显著提高了血清IgG、IL-1β、IL-2含量(P < 0.05),并且显著上调了白细胞中IL-1β和IL-2的基因相对表达量(P < 0.05),而SIPP组与对照组相比无显著差异(P>0.05)。与对照组相比,在试验第60天,SDPP和SIPP显著提高了血清中IgG含量(P < 0.05),同时,SDPP显著提高了血清中IL-1β、IL-2和TNF-α含量(P < 0.05),SIPP组血清中IL-1β含量也显著升高(P < 0.05);此外,在试验第60天,SDPP和SIPP均显著上调了白细胞中IL-1β和IL-2的基因相对表达量(P < 0.05)。
|
|
表 2 光周期变化对山羊血清免疫指标的影响 Table 2 Effects of photoperiod change on serum immune indexes of goats |
|
图 2 光周期变化对山羊白细胞中IL-1β和IL-2基因相对表达量的影响 Fig. 2 Effects of photoperiod change on gene relativeexpression level of IL-1β and IL-2 in leukocytes of goats |
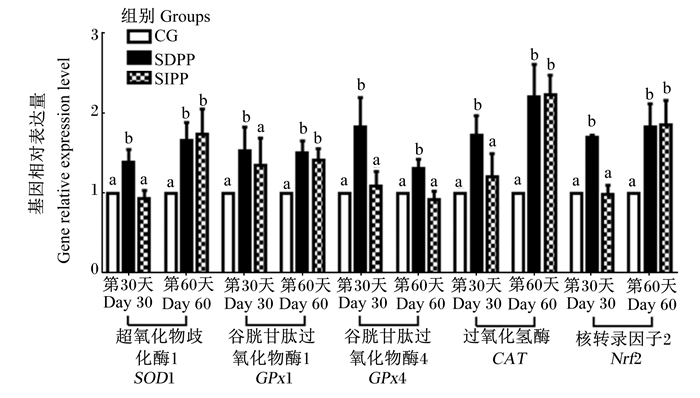
光周期变化对山羊血清抗氧化能力及相关基因表达的影响分别见表 3和图 3,与对照组相比,在试验第30天,SDPP显著提高了血清T-SOD、GPx和CAT活性(P < 0.05),显著降低了MDA含量(P < 0.05),同时显著上调了白细胞中SOD1、GPx1、GPx4、CAT和Nrf2的基因相对表达量(P < 0.05)。与对照组相比,在试验期第60天,SDPP组和SIPP组血清T-SOD、GPx和CAT活性显著升高(P < 0.05),并且MDA含量显著降低(P < 0.05)。此外,与对照组相比,SDPP显著上调了白细胞中SOD1、GPx1、GPx4、CAT和Nrf2的基因相对表达量(P < 0.05),SIPP显著上调了白细胞中SOD1、GPx1、CAT和Nrf2的基因相对表达量(P < 0.05)。
|
|
表 3 光周期变化对山羊血清抗氧化指标的影响 Table 3 Effects of photoperiod change on serum antioxidant indexes of goats |
|
图 3 光周期变化对山羊白细胞中SOD1、GPx1、GPx4、CAT和Nrf2基因相对表达量的影响 Fig. 3 Effects of photoperiod change on gene relative expression levels of SOD1, GPx1, GPx4, CAT and Nrf2 in leukocytes of goats |
光照在视网膜上被转换成电信号,然后电信号被传输到下丘脑的视神经,之后传递到松果体,除了视神经,多个中枢和外周交感神经元还向松果体传递信息[13]。晚上,电信号被传输到松果体,这导致去甲肾上腺素从神经节后交感神经末梢释放到松果体,继而通过β1肾上腺素能受体[14]维持MLT状态。许多研究表明,光周期可以直接影响MLT的分泌,并使其显示出显著的昼夜节律变化[15],夜间褪黑素的分泌量是白天的5~10倍,且在02:00—03:00达到峰值。此外,MLT含量全年也有波动,与夏季相比,冬季夜间MLT分泌增多且分泌时间更长。因此,MLT在夜间处于高水平的持续时间代表了夜晚的长度,这可以发出季节变化的信号并调节季节活动[16]。
人工改变光周期可以使内分泌水平发生变化。研究发现,周期性改变光照时间,可以使MLT水平发生周期性的变化,这种变化与自然状态下季节性节律相似[17]。此外,将母羊从短光照转移到长光照10 d左右,MLT的分泌水平会受到抑制;而将长日照绵羊转移到短日照条件下,使其出现高MLT分泌水平则需要20~30 d的时间[18]。
3.2 光周期变化对山羊抗氧化功能及相关基因相对表达的影响光周期显著影响MLT含量,进而改变免疫和抗氧化功能。分子氧对有氧生物生存至关重要,然而,当机体受到刺激时,氧代谢物可能会形成具有毒性的超氧阴离子自由基(O2-·)和过氧化氢(H2O2),增加各种组织的氧化应激[19]。氧化应激可损害包括细胞脂质、蛋白质、氨基酸和脱氧核糖核酸在内的生物分子物质,从而抑制它们的正常功能[20]。SOD可以防御超氧阴离子自由基损伤及其活性产物损伤[21]。研究表明,冬季和夏季的印度山羊血清抗氧化酶活性的日变化均与MLT含量有关[22]。同样,Albarrán等[23]发现冬季SOD活性与MLT含量有平行反应。此外,不同季节的MLT含量和SOD活性的相关性也已在不同动物的不同组织上有过报道。除季节性差异外,抗氧化活性也有昼夜节律,这与MLT含量的昼夜节律密切相关[24]。这说明MLT含量的变化足以改变抗氧化功能,主要反映在抗氧化酶的活性水平上。
此外,另外2种抗氧化酶:CAT和GPx也参与细胞环境中H2O2的去除。CAT主要存在于过氧化物酶体中,可将2个H2O2分子转化为水和双原子氧[25]。有趣的是,CAT的活性与MLT的含量存在平行关系。之前的试验表明,外源MLT能提高硫酸铝刺激的Wistar白化大鼠红细胞中CAT的活性,且活性随MLT含量的增加而增加[26]。此外,其他试验表明,MLT可以增加大鼠血液中CAT的活性,这与目前的研究结果[27]是一致的。GPx是一种广泛存在于体内的重要过氧化物降解酶,可将过氧化物还原为羟基化合物,从而保护细胞膜的结构和功能免受过氧化物的干扰和破坏。在本研究中,SDPP组中的山羊血清GPx活性在试验中期开始上升,并一直保持在较高水平,直到试验后期,这可能是由于MLT的含量升高,这一现象在SIPP组中得到证实。此外,外源MLT会减轻阿霉素诱导的氧化应激并增加仓鼠血浆和心脏中GPx的活性[28]。然而,松果体切除降低了大鼠几种组织中GPx活性水平[10]。此外,夜间持续光照会降低仔鸡GPx的活性,这与夜间MLT含量下降有关[29]。
MDA是脂质过氧化物最常见的分解产物,是细胞过氧化损伤的标志之一[30]。已经证明,MLT可以抑制由MDA诱导的细胞毒性效应,并减少哺乳动物细胞中的脂质过氧化[31]。在本试验中,当血清中MLT含量较高时,MDA含量降低,这表明MLT可以抑制脂质过氧化,这与以前的报道一致,即MLT可以剂量依赖性地降低血清中MDA含量[32]。此外,MLT可降低急性有机磷中毒的兔红细胞和肾脏MDA的含量[33]。在本试验中,褪黑激素对脂质的保护可以解释为预防性抗氧化剂。
光周期变化诱导松果体分泌的MLT在许多生理功能中起重要作用,是一种有效的自由基清除剂[34]。研究表明,MLT能够激活Nrf2/ARE抗氧化途径来对抗外部环境或紫外线诱导的损伤,这表明该途径是保护机体免受氧化损伤的机制之一[35]。Nrf2是一个重要转录因子,可以调节氧化还原反应,从而调控氧化应激[36]。抗氧化酶(包括SOD、CAT和GPx)的表达水平是由Nrf2与抗氧化反应元件的结合诱导的[37]。根据以前的研究,MLT可以通过激活Nrf2途径减轻脑损伤,并调节创伤性脑损伤试验模型中抗氧化酶(AOE)基因的表达[38]。同样,在卟啉诱导的损伤下,MLT可以调节大脑皮层和泪腺中AOE基因的表达。本研究结果表明,MLT能够在非氧化应激状态下诱导Nrf2、SOD1、CAT和GPx基因的表达,提高抗氧化酶的活性。这可能支持这样的假设,即MLT以多种方式作为抗氧化剂,例如含量或持续时间,可以诱导相关基因表达,增强相关酶活性,或直接作为活性氧清除剂。
3.3 光周期变化对山羊免疫功能及相关基因相对表达的影响血清免疫球蛋白是初级免疫应答中最持久和最重要的抗体,用于促进单核细胞和巨噬细胞的吞噬作用,中和细菌毒素的毒性,并与病毒抗原结合以防止病毒感染宿主细胞。先前的研究表明,MLT可以增强人体的体液免疫[30]。Negrette等[39]用灭活的委内瑞拉马脑脊髓炎免疫小鼠,并从免疫前3天至免疫后14天进行皮下注射MLT,在免疫后第7、14和21天测定血清IgM含量。结果表明,免疫14 d后,免疫球蛋白含量高于对照组。此外,Akbulu等[40]发现外源性MLT注射液可以促进28个月大的Wistar大鼠血清中IgG和IgM含量的增加。在本试验中,SDPP组中的山羊血清IgG含量在试验中期和后期均高于对照组;同样,SIPP提高了试验后期血清IgG含量。与目前的发现相似,Demas等[41]发现短光照低温组小鼠的血清IgG含量高于长光高温组。
白细胞介素(ILs)是一种在免疫系统中发挥重要作用的细胞因子。其中,IL-1β通过1)促进胸腺细胞和成熟T细胞的增殖和分化来介导免疫应答;2)增强B细胞分化;3)抑制肿瘤细胞的生长;4)诱导T细胞产生IL-2,IL-2是一种具有免疫调节活性的关键细胞因子[42]。在本研究中,结果表明MLT可能直接作用于免疫细胞,释放细胞因子,产生免疫调节作用。Pioli等[43]认为,MLT能促进小鼠脾巨噬细胞IL-1和TNF-α的产生,试验组的含量分别是对照组的2.2倍和1.2~4.8倍。此外,松果体切除小鼠血浆IL-2含量显著降低,外源MLT处理后,IL-2含量升高[44]。TNF-α是另一种细胞因子,通常有昼夜节律,在夜间含量高,可能受MLT的影响,早上注射外源MLT显示TNF-α含量普遍上调[45]。
近年来,许多研究报告了MLT与包括人类在内的动物免疫系统之间的关系。1973年,Vaughan等[46]发现短光照可以增加田鼠的胸腺重量。从那时起,许多报道证实MLT峰值与血液中淋巴细胞的数量有关[47]。此外,切除松果体的动物会降低免疫功能,这一理论已经在小鼠中得到证实[48]。MLT在免疫系统中的另一个功能是调节脾脏、胸腺和淋巴结中细胞因子的基因表达。在C57小鼠中,MLT上调腹腔巨噬细胞中TNF-α、转化生长因子-β和干细胞因子的基因表达水平,以及脾细胞中IL-1β、TNF-α和干细胞因子的含量[8]。在本研究中,MLT上调了白细胞中IL-1β、IL-2、TNF-α的基因表达量。
4 结论在本研究中,短光照处理可以提高山羊血清中MLT含量,这表明改变光周期可以改变血液中的激素水平;同时,MLT含量的增加会增强抗氧化和免疫功能及上调相关基因表达。
| [1] |
MOORE R Y. Neural control of pineal function in mammals and birds[J]. Journal of Neural Transmission Supplementum, 1978(13): 47-58. |
| [2] |
GALANO A, TAN D X, REITER R J. Melatonin as a natural ally against oxidative stress:a physicochemical examination[J]. Journal of Pineal Research, 2011, 51(1): 1-16. DOI:10.1111/j.1600-079X.2011.00916.x |
| [3] |
RODRIGUEZ C, MAYO J C, SAINZ R M, et al. Regulation of antioxidant enzymes:a significant role for melatonin[J]. Journal of Pineal Research, 2010, 36(1): 1-9. |
| [4] |
MAYO J C, SAINZ R M, ANTOLÍN I, et al. Melatonin regulation of antioxidant enzyme gene expression[J]. Cellular and Molecular Life Sciences, 2002, 59(10): 1706-1713. DOI:10.1007/PL00012498 |
| [5] |
HE Y M, DENG H H, SHI M H, et al. Melatonin modulates the functions of porcine granulosa cells via its membrane receptor MT2 in vitro[J]. Animal Reproduction Science, 2016, 172: 164-172. DOI:10.1016/j.anireprosci.2016.07.015 |
| [6] |
TAN D X, MANCHESTER L C, LIU X Y, et al. Mitochondria and chloroplasts as the original sites of melatonin synthesis:a hypothesis related to melatonin's primary function and evolution in eukaryotes[J]. Journal of Pineal Research, 2013, 54(2): 127-138. DOI:10.1111/jpi.12026 |
| [7] |
REITER R J. Oxidative processes and antioxidative defense mechanisms in the aging brain[J]. The FASEB Journal, 1995, 9(7): 526-533. DOI:10.1096/fasebj.9.7.7737461 |
| [8] |
LIU F, NG T B. Effect of pineal indoles on activities of the antioxidant defense enzymes superoxide dismutase, catalase, and glutathione reductase, and levels of reduced and oxidized glutathione in rat tissues[J]. Biochemistry and Cell Biology, 2000, 78(4): 447-453. DOI:10.1139/o00-018 |
| [9] |
CHOUDHARY P K, ISHWAR A K, KUMAR R, et al. Effect of exogenous melatonin and different photoperiods on oxidative status and antioxidant enzyme activity in Chhotanagpuri ewe[J]. Veterinary World, 2018, 11(2): 130-134. DOI:10.14202/vetworld.2018.130-134 |
| [10] |
BAYDAS G, GURSU M F, YILMAZ S, et al. Daily rhythm of glutathione peroxidase activity, lipid peroxidation and glutathione levels in tissues of pinealectomized rats[J]. Neuroscience Letters, 2002, 323(3): 195-198. DOI:10.1016/S0304-3940(02)00144-1 |
| [11] |
LISSONI P, BOLIS S, BRIVIO F, et al. A phase Ⅱ study of neuroimmunotherapy with subcutaneous low-dose IL-2 plus the pineal hormone melatonin in untreatable advanced hematologic malignancies[J]. Anticancer Research, 2000, 20(3B): 2103-2105. |
| [12] |
VANDESOMPELE J, DE PRETER K, PATTYN F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology Research, 2002, 3(7): :research0034.1. |
| [13] |
HASTINGS M H, MAYWOOD E S, REDDY A B. Two decades of circadian time[J]. Journal of Neuroendocrinology, 2010, 20(6): 812-819. |
| [14] |
MARONDE E, STEHLE J H. The mammalian pineal gland:known facts, unknown facets[J]. Trends in Endocrinology & Metabolism, 2007, 18(4): 142-149. DOI:10.1016/j.tem.2007.03.001 |
| [15] |
SWEENEY T, DONOVAN A, ROCHE J F, et al. Variation in the ability of a long day followed by a short day photoperiod signal to initiate reproductive activity in ewes at different times of the year[J]. Journal of Reproduction and Fertility, 1997, 109(1): 121-127. DOI:10.1530/jrf.0.1090121 |
| [16] |
YELLON S M, FOSTER D L. Alternate photoperiods time puberty in the female lamb[J]. Endocrinology, 1985, 116(5): 2090-2097. DOI:10.1210/endo-116-5-2090 |
| [17] |
BITTMAN E L, KARSCH F J. Nightly duration of pineal melatonin secretion determines the reproductive response to inhibitory day length in the ewe[J]. Biology of Reproduction, 1984, 30(3): 585-593. DOI:10.1095/biolreprod30.3.585 |
| [18] |
LINCOLN G A, LINCOLN C E, MCNEILLY A S. Seasonal cycles in the blood plasma concentration of FSH, inhibin and testosterone, and testicular size in rams of wild, feral and domesticated breeds of sheep[J]. Reproduction, 1990, 88(2): 623-633. DOI:10.1530/jrf.0.0880623 |
| [19] |
RAO G N, BERK B C. Active oxygen species stimulate vascular smooth muscle cell growth and proto-oncogene expression[J]. Circulation Research, 1992, 70(3): 593-599. DOI:10.1161/01.RES.70.3.593 |
| [20] |
FANG Y Z, YANG S, WU G Y. Free radicals, antioxidants, and nutrition[J]. Nutrition, 2002, 18(10): 872-879. DOI:10.1016/S0899-9007(02)00916-4 |
| [21] |
MICHIELS C, RAES M, TOUSSAINT O, et al. Importance of SE-glutathione peroxidase, catalase, and CU/ZN-SOD for cell survival against oxidative stress[J]. Free Radical Biology and Medicine, 1994, 17(3): 235-248. DOI:10.1016/0891-5849(94)90079-5 |
| [22] |
SINGH A K, GHOSH S, BASU P, et al. Daily variation in melatonin level, antioxidant activity and general immune response of peripheral blood mononuclear cells and lymphoid tissues of Indian goat Capra hircus during summer and winter[J]. Indian Journal of Experimental Biology, 2014, 52(5): 467-477. |
| [23] |
ALBARRÁN M T, LÓPEZ-BURILLO S, PABLOS M I, et al. Endogenous rhythms of melatonin, total antioxidant status and superoxide dismutase activity in several tissues of chick and their inhibition by light[J]. Journal of Pineal Research, 2010, 30(4): 227-233. |
| [24] |
DÍAZ-MUÑOZ M, HERNÁNDEZ-MUÑOZ R, SUÁREZ J, et al. Day-night cycle of lipid peroxidation in rat cerebral cortex and their relationship to the glutathione cycle and superoxide dismutase activity[J]. Neuroscience, 1985, 16(4): 859-863. DOI:10.1016/0306-4522(85)90100-9 |
| [25] |
MATÉS J. Effects of antioxidant enzymes in the molecular control of reactive oxygen species toxicology[J]. Toxicology, 2000, 153(1/2/3): 83-104. |
| [26] |
STANA L G, MUSELIN F, CRETESCU I, et al. The influence of Sempervivum tectorum and melatonin administration on erythrocyte catalase in rats exposed to aluminium sulphate[J]. Animal Science & Biotechnologies, 2012, 45(2): 133. |
| [27] |
SANKARAN M, KANDHAN K, GANESAN D, et al. Melatonin attenuates lipid peroxidation and enhances circulatory antioxidants during mammary carcinogenesis in rats[J]. Journal of Biochemical Technology, 2010, 2: 171-174. |
| [28] |
OZTURK M, OZLER M, KURT Y G, et al. Efficacy of melatonin, mercaptoethylguanidine and 1400W in doxorubicin- and trastuzumab-induced cardiotoxicity[J]. Journal of Pineal Research, 2015, 50(1): 89-96. |
| [29] |
PABLOS M I, REITER R J, ORTIZ G G, et al. Rhythms of glutathione peroxidase and glutathione reductase in brain of chick and their inhibition by light[J]. Neurochemistry International, 1998, 32(1): 69-75. DOI:10.1016/S0197-0186(97)00043-0 |
| [30] |
XU Y Q, WANG Z Q, QIN Z, et al. Effects of chitosan addition on growth performance, diarrhoea, anti-oxidative function and serum immune parameters of weaned piglets[J]. South African Journal of Animal Science, 2018, 48(1): 142-150. DOI:10.4314/sajas.v48i1.16 |
| [31] |
SUBRAMANIAN P, MIRUNALINI S, PANDI-PERUMAL S R, et al. Melatonin treatment improves the antioxidant status and decreases lipid content in brain and liver of rats[J]. European Journal of Pharmacology, 2007, 571(2/3): 116-119. |
| [32] |
CHAKRAVARTY S, RIZVI S I. Day and night GSH and MDA levels in healthy adults and effects of different doses of melatonin on these parameters[J]. International Journal of Cell Biology, 2011, 2011: 404591. |
| [33] |
BAYIR A, KARA H, KOYLU O, et al. The effects of melatonin on erythrocyte and brain cholinesterase, nitric oxide and MDA levels in acute organophosphate toxicity[J]. Toxicology Letters, 2011, 205(Suppl.1): S227. |
| [34] |
XIE Z Z, CHEN F, LI W A, et al. A review of sleep disorders and melatonin[J]. Neurological Research, 2017, 39(6): 559-565. DOI:10.1080/01616412.2017.1315864 |
| [35] |
CHEN L Y, RENN T Y, LIAO W C, et al. Melatonin successfully rescues hippocampal bioenergetics and improves cognitive function following drug intoxication by promoting Nrf2-ARE signaling activity[J]. Journal of Pineal Research, 2017, 63(2): e12417. DOI:10.1111/jpi.12417 |
| [36] |
NITURE S K, KASPAR J W, SHEN J, et al. Nrf2 signaling and cell survival[J]. Toxicology and Applied Pharmacology, 2010, 244(1): 37-42. DOI:10.1016/j.taap.2009.06.009 |
| [37] |
SANGOKOYA C, TELEN M J, CHI J T. MicroRNA miR-144 modulates oxidative stress tolerance and associates with anemia severity in sickle cell disease[J]. Blood, 2010, 116: 4338-4348. |
| [38] |
DING K, WANG H D, XU J G, et al. Melatonin stimulates antioxidant enzymes and reduces oxidative stress in experimental traumatic brain injury:the Nrf2-ARE signaling pathway as a potential mechanism[J]. Free Radical Biology and Medicine, 2014, 73: 1-11. DOI:10.1016/j.freeradbiomed.2014.04.031 |
| [39] |
NEGRETTE B, BONILLA E, VALERO N, et al. Melatonin treatment enhances the efficiency of mice immunization with venezuelan equine encephalomyelitis virus TC-83[J]. Neurochemical Research, 2001, 26(7): 767-770. DOI:10.1023/A:1011645400123 |
| [40] |
AKBULUT K G, AKBULUT K G, GÖNÜL B, et al. The effects of melatonin on humoral immune responses of young and aged rats[J]. Immunological Investigations, 2001, 30(1): 17-20. DOI:10.1081/IMM-100103687 |
| [41] |
DEMAS G E, NELSON R J. Exogenous melatonin enhances cell-mediated, but not humoral, immune function in adult male deer mice (Peromyscus maniculatus)[J]. Journal of Biological Rhythms, 1998, 13(3): 245-252. DOI:10.1177/074873098129000084 |
| [42] |
YIN Y L, TANG Z R, SUN Z H, et al. Effect of galacto-mannan-oligosaccharides or chitosan supplementation on cytoimmunity and humoral immunity in early-weaned piglets[J]. Asian-Australasian Journal of Animal Sciences, 2008, 21(5): 723-731. DOI:10.5713/ajas.2008.70408 |
| [43] |
PIOLI C, CAROLEO M C, NISTICO G, et al. Melatonin increases antigen presentation and amplifies specific and non specific signals for T-cell proliferation[J]. International Journal of Immunopharmacology, 1993, 15(4): 463-468. DOI:10.1016/0192-0561(93)90060-C |
| [44] |
MAESTRONI G J. The immunoneuroendocrine role of melatonin[J]. Journal of Pineal Research, 2010, 14(1): 1-10. |
| [45] |
HABBAL O A, AL-JABRI A A. Circadian rhythm and the immune response:a review[J]. International Reviews of Immunology, 2009, 28(1/2): 93-108. |
| [46] |
VAUGHAN M K, VAUGHAN G M, REITER R J. Effect of ovariectomy and constant dark on the weight of reproductive and certain other organs in the female vole, Microtus montanus[J]. Journal of Reproduction and Fertility, 1973, 32(1): 9-14. DOI:10.1530/jrf.0.0320009 |
| [47] |
HALDAR C, SINGH R, GUCHHAIT P. Relationship between the annual rhythms in melatonin and immune system status in the tropical palm squirrel, Funambulus pennanti[J]. Chronobiology International, 2001, 18(1): 61-69. DOI:10.1081/CBI-100001174 |
| [48] |
MCKINNEY T D, VAUGHAN M K, REITER R J. Pineal influence on intermale aggression in adult house mice[J]. Physiology & Behavior, 1975, 15(2): 213-216. DOI:10.1016/0031-9384(75)90238-3 |




