2. 甘肃奥林贝尔生物科技集团有限公司, 张掖 734000;
3. 甘肃省肉羊繁育生物技术工程实验室, 民勤 733300
2. Gansu Olin Bell Biotechnology Group Limited Company, Zhangye 734000, China;
3. Engineering Laboratory of Mutton Sheep Breeding and Reproduction Biotechnology in Gansu Province, Minqin 733300, China
众所周知,抗生素可提高家禽[1]、猪[2-3]和反刍动物[4-5]的生长性能和免疫力。王加启[6]研究表明,在奶牛饲粮中添加拉沙里菌素和莫能菌素可显著提高产奶量,主要是因为拉沙里菌素和莫能菌素可以促使瘤胃发酵趋于丙酸发酵模式,提高丙酸含量,进而提高产奶量。但抗生素的过度滥用会造成药物残留、环境污染、食品安全等一系列问题,很多国家和地区已经严禁抗生素作为饲料添加剂使用[7-8],因此,寻找抗生素替代物已成为动物营养研究的热点问题之一。抗菌肽(antimicrobial peptides,AMPs)是真菌、细菌、免疫细胞、组织等分泌的具备广谱抗菌能力的活性多肽,主要对与本体有较近亲缘关系的原核生物起作用,有利于真核生物的自身免疫[9]。已有研究表明,在机体内大多数AMPs都能被分解,因此在动物产品中无残留,可作为抗生素替代物[10-12]。此外,AMPs主要作用靶点是细菌的细胞膜,抑制其DNA和蛋白质的合成,因此与抗生素相比产生药物耐药性的可能性较小[10-13]。
蜜蜂肽是一种重要的AMPs,主要从被感染的西方蜜蜂(Apis mellifera)淋巴液中提取而来,具有AMPs的全部特性,能抑制消化道中有害菌的生长与繁殖,增加有益菌的数量,同时对革兰氏阴性菌有较强的抑制作用,可调节反刍动物瘤胃微生物发酵,提高机体对营养物质的消化吸收,进而提高生长性能[14-15]。目前,在提高奶牛生长性能和治疗奶牛乳房炎等方面已有一些AMPs产品的应用,但关于其对育肥湖羊瘤胃的作用机理还鲜有研究报道[16-18]。因此,本试验通过研究不同蜜蜂肽添加量对育肥湖羊生长性能、瘤胃发酵模式及微生物区系的影响,旨在为蜜蜂肽在湖羊育肥生产中的应用提供理论依据。
1 材料与方法 1.1 试验设计选择体况良好、遗传背景相近的湖羊公羔180只,采用单因素试验设计,随机分为5组,每组6个重复,每个重复6只羊。对照组饲喂基础饲粮,试验组分别在基础饲粮中添加100、200、400和800 g/t蜜蜂肽。试验所用蜜蜂肽由甘肃奥林贝尔生物科技集团有限公司提供,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
每天饲喂2次(08:00和18:00),自由饮水,自由采食。预试期14天,正试期63天。在正试期第21、42、63天晨饲前称重,记录其体重及采食量,用于平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)的计算。
1.3 样品采集在试验正试期最后2 d于晨饲后2~4 h通过口腔采集试验动物瘤胃液[19],将瘤胃液彻底混合并通过4层纱布过滤,将滤液分成2部分,一部分装在50 mL螺口离心管,-20 ℃保存,用于后期瘤胃微生物DNA的提取和测定;另一部分取5 mL瘤胃液装在加有2 mL 25%偏磷酸的10 mL螺口离心管中,-20 ℃保存,用于测定瘤胃液挥发性脂肪酸(VFA)含量。
1.4 测定方法 1.4.1 VFA含量参照Liang等[20]的方法,利用气相色谱(Thermo Scientific,TRACE 1300,Milan,意大利)测定瘤胃液VFA含量。测定条件:色谱分析柱为DB-FFAP毛细管色谱柱(30 m×0.32 mm×0.25 μm,Agilent,美国),进样口和检测器温度均为240 ℃,温度设置为以25 ℃/min的速率将温度从50 ℃升高到190 ℃保留2 min,再以10 ℃/min的升温速率升高到200 ℃保留5 min,最后以10 ℃/min的升温速率升高到220 ℃保留5 min,进样量为1 μL,空气流率为350 mL/min,氢气流率为35 mL/min,载气(氮气)流率为20 mL/min,分流比为50 : 1。
1.4.2 瘤胃液细菌DNA的提取和定量分析解冻瘤胃液样品,用试剂盒(Omega,美国)提取DNA,具体操作参考说明书步骤。通过Bio-Rad CFX96 Real-Time System(Bio-Rad Laboratories,Hercules,美国)对瘤胃细菌进行定量分析。反应在96孔板中进行,总体系是20 μL,包括10 μL SYBR Green Ⅱ(北京全式金生物技术有限公司),7.8 μL ddH2O,0.6 μL上、下游引物和1 μL瘤胃细菌DNA。使用以下程序扩增所有细菌DNA:94 ℃预变性3 min,94 ℃变性15 s,60.0 ℃退火30 s,72 ℃延伸20 s,循环数为40,参照金迪[21]的方法对所有细菌进行绝对定量。引物序列见表 2。
|
|
表 2 引物序列 Table 2 Primer sequence |
每组选择9只试验动物的微生物DNA样品,通过Illumina HiSeq 2500平台(北京百迈客生物科技有限公司)进行16S rDNA基因测序,分析瘤胃微生物多样性及其门、科、属水平丰度。
1.5 数据分析通过Excel 2010对数据进行初步整理,应用SPSS 21.0软件进行单因素方差分析(one-way ANOVA),试验数据以平均值和均值标准误(SEM)表示,P < 0.05表示差异显著,P>0.05表示无显著差异。
2 结果与分析 2.1 蜜蜂肽对育肥湖羊生长性能的影响由表 3可以看出,蜜蜂肽添加量对育肥湖羊的第42天体重、第63天体重、ADG、ADFI和F/G有显著影响(P < 0.05)。400、800 g/t组的第42天体重和第63天体重显著高于对照组和100 g/t组(P < 0.05)。200、400、800 g/t组的ADG显著高于对照组和100 g/t组(P < 0.05),其中400 g/t组的ADG最高。400和800 g/t组的ADFI显著高于100 g/t组(P < 0.05)。400 g/t组的F/G最低,显著低于对照组(P < 0.05)。
|
|
表 3 蜜蜂肽对育肥湖羊生长性能的影响 Table 3 Effects of honeybee peptide on growth performance of fattening Hu sheep |
由表 4可以看出,各组之间瘤胃液总挥发性脂肪酸(TVFA)含量无显著差异(P>0.05),但蜜蜂肽添加量对瘤胃液乙酸、丙酸比例和乙酸/丙酸有显著影响(P < 0.05)。400 g/t组的瘤胃液乙酸比例显著高于对照组(P < 0.05),而丙酸比例显著低于对照组(P < 0.05)。400 g/t组的瘤胃液乙酸/丙酸最高,显著高于对照组(P < 0.05)。
|
|
表 4 蜜蜂肽对育肥湖羊瘤胃液VFA组成的影响 Table 4 Effects of honeybee peptide on rumen fluid VFA composition of fattening Hu sheep |
由表 5可以看出,蜜蜂肽添加量对育肥湖羊瘤胃反刍兽新月单胞菌(Selenomonas ruminantium)、普雷沃氏菌(Prevotella brevis)、产琥珀酸丝状杆菌(Fibrobacter succinogenes)和嗜淀粉瘤胃杆菌(Ruminobacter amylophilus)数量有显著影响(P < 0.05)。100、200和400 g/t组的瘤胃Selenomonas ruminantium数量显著高于对照组(P < 0.05)。200 g/t组的瘤胃Prevotella brevis数量显著高于对照组(P < 0.05),但800 g/t组的瘤胃Prevotella brevis数量显著低于其他各组(P < 0.05)。400和800 g/t组的瘤胃Fibrobacter succinogenes数量显著低于对照组和100 g/t组(P < 0.05)。200和400 g/t组的瘤胃Ruminobacter amylophilus数量显著高于对照组和100 g/t组(P < 0.05)。
|
|
表 5 蜜蜂肽对育肥湖羊瘤胃细菌数量的影响 Table 5 Effects of honeybee peptide on rumen bacteria numbers of fattening Hu sheep |
通过16S rRNA测序对瘤胃微生物丰度进行测定,结果如表 6所示。100 g/t组对微生物丰度均无显著影响,故不对该组进行分析。由表可以看出,蜜蜂肽添加量对瘤胃OUT数量及ACE、Chao1指数有显著影响(P < 0.05)。200、400和800 g/t组的瘤胃OUT数量和Chao1指数显著高于对照组(P < 0.05)。200和400 g/t组的瘤胃ACE指数显著高于800 g/t组(P < 0.05),且800 g/t组显著高于对照组(P < 0.05)。各组之间瘤胃Simpson和Shannon指数无显著差异(P>0.05)。
|
|
表 6 蜜蜂肽对育肥湖羊瘤胃微生物多样性的影响 Table 6 Effects of honeybee peptide on rumen microbial diversity of fattening Hu sheep |
由图 1可以看出,各组之间离散的越远,说明各组差异越大。在本试验中,200、400和800 g/t组均与对照组相距较远,说明对照组和各试验组瘤胃微生物区系存在着差异,也进一步可以说明蜜蜂肽的添加可以使育肥湖羊瘤胃微生物群落结构发生改变。
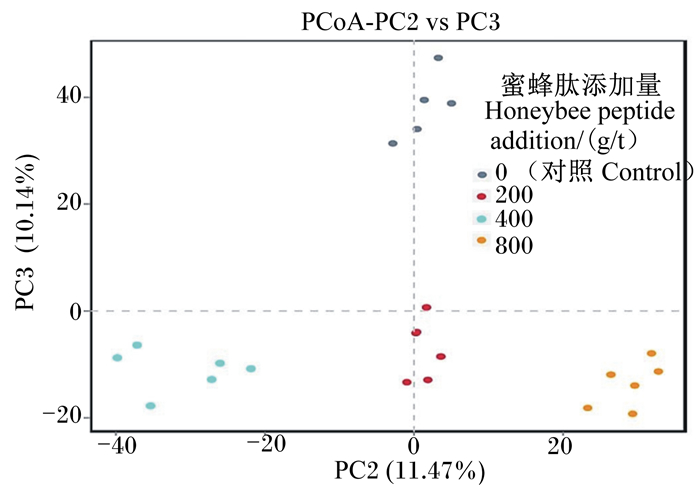
|
图 1 各组主坐标分析 Fig. 1 PCoA of each group |
由表 7可以看出,在瘤胃微生物门水平上,蜜蜂肽添加量对瘤胃厚壁菌门(Firmicutes)丰度有显著影响(P < 0.05),400和800 g/t组的瘤胃Firmicutes丰度显著高于200 g/t组(P < 0.05)。蜜蜂肽添加量对瘤胃其他各菌门丰度均无显著影响(P>0.05)。
|
|
表 7 蜜蜂肽对育肥湖羊瘤胃微生物门水平丰度的影响 Table 7 Effects of honeybee peptide on rumen microbial abundance at phylum level of fattening Hu sheep |
由表 8可以看出,在瘤胃微生物科、属水平上,普氏菌属_1(Prevotella_1)是瘤胃内优势菌属,蜜蜂肽添加量对丁酸弧菌属_2(Butyrivibrio_2)、毛螺菌科_NK3A20(Lachnospiraceae_NK3A20)和瘤胃球菌属_2(Ruminococcus_2)有显著影响(P < 0.05)。800 g/t组的瘤胃Butyrivibrio_2丰度显著高于对照组和200 g/t组(P < 0.05)。800 g/t组的瘤胃Lachnospiraceae_NK3A20丰度显著高于其他各组(P < 0.05),200和400 g/t组与对照组无显著差异(P>0.05)。400 g/t组的瘤胃Ruminococcus_2丰度显著高于对照组和200 g/t组(P < 0.05)。
|
|
表 8 蜜蜂肽对育肥湖羊瘤胃微生物科、属水平丰度的影响 Table 8 Effects of honeybee peptide on rumen microbial abundance at family and genus level of fattening Hu sheep |
研究表明,饲粮中添加AMPs可以显著提高动物的生长性能。Peng等[26]研究发现,断奶仔猪饲粮中添加5 g/(d·头)的β-防御素2可以显著提高动物ADG和ADFI,并且降低F/G。张江等[27]以荷斯坦黑白花奶牛作为试验动物(n=30),对照组饲喂基础饲粮,试验组饲喂添加30 g/(d·头)肽乐新的基础饲粮,结果表明试验组奶牛平均产奶量提高了1.5 kg/(d·头)。Liu等[28]以幼龄山羊作为研究对象,在饲粮中添加AMPs(重组猪防御素和蝇AMPs以1 : 1混合),添加方式为每300 g精料中添加3 g AMPs或每600 g精料中添加3 g AMPs,结果发现AMPs显著增加了体重和ADG。在本试验中,蜜蜂肽添加量对育肥湖羊ADG、ADFI和F/G有显著影响,随着蜜蜂肽添加量的增加体重、ADG先增加后降低,F/G先降低后升高的,且400 g/t组效果最好,这与前人的研究结果基本一致。蜜蜂肽提高动物生长性能可能原因是它可以抑制肠道内或饲粮中有害菌生长,提高饲料品质[29-30]。此外,有研究表明AMPs可以减少瘤胃蛋白质降解,增强瘤胃细菌利用氨生成菌体蛋白的能力,进而提高了蛋白质效率,促进了动物生长[31]。
3.2 蜜蜂肽对育肥湖羊瘤胃液VFA组成的影响碳水化合物在瘤胃微生物的作用下会降解成VFA,主要包括乙酸、丙酸和丁酸,占TVFA的95%以上[32]。研究表明,Prevotella brevis、Ruminobacter amylophilus和Selenomonas ruminantium主要发酵产物是乙酸[33]。在本研究中,随着蜜蜂肽添加量的增加瘤胃液乙酸比例先增加后降低,这可能是由于Prevotella brevis、Ruminobacter amylophilus和Selenomonas ruminantium数量增加的原因。Jalc等[34]通过连续6 d的瘤胃微生物体外发酵试验,添加乳链菌肽2 mg/(L·d),结果表明添加乳链菌肽使半纤维素的降解程度增加,并提高了瘤胃液乙酸比例。此外,本试验中,试验组的瘤胃液丙酸比例均低于对照组,这与前人研究结果不同。高爽等[16]研究发现,在山羊饲粮中添加复合AMPs对瘤胃液丙酸比例无显著影响。这可能是由于2个研究中使用的AMPs不同,在该研究中使用的AMPs是蜜蜂肽,该AMPs主要抑制革兰氏阴性菌生长与繁殖,可以促使瘤胃发酵模式趋于乙酸发酵,增加瘤胃液乙酸比例,降低丙酸比例。
3.3 蜜蜂肽对育肥湖羊瘤胃微生物区系的影响Alpha多样性分析主要用于反映瘤胃微生物群落的丰度及多样性。由本试验结果可知,在育肥湖羊饲粮中添加蜜蜂肽显著增加了瘤胃OTU数量及ACE、Chao1指数,这表明蜜蜂肽可以增加瘤胃内微生物群落的丰富度和多样性。通过β多样性分析可得对照组与各蜜蜂肽添加组在主坐标分析图上离散均较远,这也说明蜜蜂肽改变了微生物群落多样性,这与陈芸等[35]的研究结果基本相同。陈芸等[35]以雄性(未阉割)川中黑山羊作为研究对象,在饲粮中添加3 g/(d·头)复合AMPs,结果发现添加复合AMPs组山羊瘤胃多样性要显著高于对照组。Kim等[36]研究发现,莫能菌素补充剂降低革兰氏阳性Firmicutes的比例,同时增加革兰氏阴性拟杆菌门的比例。然而,莫能菌素补充剂没有降低革兰氏阳性菌所有属的比例,但降低了革兰氏阴性菌一些属的比例[37]。此结果与本研究得出的结果不太一致,蜜蜂肽增加了瘤胃Firmicutes丰度,降低了普氏菌属丰度,可能的原因是莫能菌素主要对革兰氏阳性菌起抑制作用,而蜜蜂肽主要抑制革兰氏阴性菌的生长与繁殖。研究发现,在反刍动物饲粮中添加AMPs可以使降解纤维的菌属(瘤胃球菌属、琥珀酸菌属)丰度增加[35]。这与本研究结果一致,饲粮中添加蜜蜂肽提高了瘤胃Ruminococcus_2丰度。这可能是因为蜜蜂肽能使瘤胃发酵模式趋于乙酸发酵,有利于纤维分解菌生长与繁殖。
4 结论① 育肥湖羊饲粮中添加蜜蜂肽可以提高生长性能,且400 g/t组效果最好。
② 育肥湖羊饲粮中添加能增加瘤胃微生物群落丰富度和多样性,同时抑制革兰氏阴性菌生长与繁殖,促使瘤胃发酵模式趋于乙酸发酵,提高乙酸比例及乙酸/丙酸,降低丙酸比例。
| [1] |
王莉, 陈晓, 王书全. 天蚕素抗菌肽对817肉杂鸡生长性能及免疫功能的影响[J]. 中国畜牧兽医, 2017, 44(8): 2354-2359. |
| [2] |
侯改凤, 李瑞, 韦良开, 等. 抗菌肽对育肥猪生长性能及血液生理生化指标的影响[J]. 中国饲料, 2017(12): 24-26, 44. |
| [3] |
卜艳玲, 陈静, 李建涛, 等. 饲粮中添加肠杆菌肽对断奶仔猪生产性能和血清生化指标的影响[J]. 动物营养学报, 2018, 30(2): 696-706. DOI:10.3969/j.issn.1006-267x.2018.02.035 |
| [4] |
杨晋辉, 周凌云, 赵芸君, 等. 反刍动物抗生素替代物的研究进展[J]. 中国畜牧兽医, 2011, 38(7): 162-167. |
| [5] |
SHEN J S, LIU Z, YU Z T, et al. Monensin and nisin affect rumen fermentation and microbiota differently in vitro[J]. Frontiers in Microbiology, 2017(8): 1111. |
| [6] |
王加启. 现代奶牛养殖科学[M]. 北京: 中国农业出版社, 2006.
|
| [7] |
靳纯嘏, 叶耿坪, 唐新仁. 反刍动物饲用抗生素替代物研究进展[J]. 中国畜牧兽医, 2018, 45(1): 77-85. |
| [8] |
SEAL B S, LILLEHOJ H S, DONOVAN D M, et al. Alternatives to antibiotics:a symposium on the challenges and solutions for animal production[J]. Animal Health Research Reviews, 2013, 14(1): 78-87. DOI:10.1017/S1466252313000030 |
| [9] |
MARKOSSIAN K A, ZAMYATNIN A A, KURGANOV B I. Antibacterial proline-rich oligopeptides and their target proteins[J]. Biochemistry (Moscow), 2004, 69(10): 1082-1091. DOI:10.1023/B:BIRY.0000046881.29486.51 |
| [10] |
葛琳, 刘晓志, 高健, 等. 抗菌肽抗菌机制及与抗生素协同作用的研究进展[J]. 中国抗生素杂志, 2018, 43(12): 1474-1481. DOI:10.3969/j.issn.1001-8689.2018.12.004 |
| [11] |
SANG Y M, BLECHA Y. Antimicrobial peptides and bacteriocins:alternatives to traditional antibiotics[J]. Animal Health Research Reviews, 2008, 9(2): 227-235. DOI:10.1017/S1466252308001497 |
| [12] |
LI W F, MA G X, ZHOU X X. Apidaecin-type peptides:biodiversity, structure-function relationships and mode of action[J]. Peptides, 2006, 27(9): 2350-2359. DOI:10.1016/j.peptides.2006.03.016 |
| [13] |
JOUANY J P, MORGAVI D P. Use of 'natural' products as alternatives to antibiotic feed additives in ruminant production[J]. Animal, 2007, 1(10): 1443-1466. DOI:10.1017/S1751731107000742 |
| [14] |
华婷.蜜蜂抗菌肽Apidaecins在不同表达系统中融合表达的研究[D].硕士学位论文.北京: 中国农业科学院, 2017.
|
| [15] |
HANCOCK R E W, ROZEK A. Role of membranes in the activities of antimicrobial cationic peptides[J]. FEMS Microbiology Letters, 2002, 206(2): 143-149. DOI:10.1111/j.1574-6968.2002.tb11000.x |
| [16] |
高爽, 邓俊良, 陈芸, 等. 复合抗菌肽对山羊瘤胃发酵和酶活性的影响[J]. 动物营养学报, 2017, 29(7): 2548-2555. DOI:10.3969/j.issn.1006-267x.2017.07.040 |
| [17] |
LUO C C, YIN D Y, GAO X J, et al. Goat mammary gland expression of cecropin B to inhibit bacterial pathogens causing mastitis[J]. Animal Biotechnology, 2013, 24(1): 66-78. DOI:10.1080/10495398.2012.745417 |
| [18] |
徐名能, 黄木家, 李永新, 等. 日粮添加抗菌肽制剂对荷斯坦牛乳中体细胞数的影响[J]. 中国奶牛, 2011(16): 41-43. DOI:10.3969/j.issn.1004-4264.2011.16.012 |
| [19] |
KLEEN J L, CANNIZZO C. Incidence, prevalence and impact of SARA in dairy herds[J]. Animal Feed Science and Technology, 2012, 172(1/2): 4-8. |
| [20] |
LIANG Y S, LI G Z, LI X Y, et al. Growth performance, rumen fermentation, bacteria composition, and gene expressions involved in intracellular pH regulation of rumen epithelium in finishing Hu lambs differing in residual feed intake phenotype[J]. Journal of Animal Science, 2017, 95(4): 1727-1738. |
| [21] |
金迪.不同粗饲料及蛋白质来源日粮条件下奶牛瘤胃细菌群落多样性变化[D].硕士学位论文.北京: 中国农业科学院, 2013.
|
| [22] |
KOIKE S, KOBAYASHI Y. Development and use of competitive PCR assays for the rumen cellulolytic bacteria:Fibrobacter succinogenes, Ruminococcus albus and Ruminococcus flavefaciens[J]. FEMS Microbiology Letters, 2001, 204(2): 361-366. DOI:10.1111/j.1574-6968.2001.tb10911.x |
| [23] |
KHAFIPOUR E, LI S C, PLAIZIER J C, et al. Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis[J]. Applied and Environmental Microbiology, 2009, 75(22): 7115-7124. DOI:10.1128/AEM.00739-09 |
| [24] |
STEVENSON D M, WEIMER P J. Dominance of Prevotella and low abundance of classical ruminal bacterial species in the bovine rumen revealed by relative quantification real-time PCR[J]. Applied Microbiology and Biotechnology, 2009, 83(5): 987-988. DOI:10.1007/s00253-009-2033-5 |
| [25] |
BENCHAAR C, LETTAT A, HASSANAT F, et al. Eugenol for dairy cows fed low or high concentrate diets:effects on digestion, ruminal fermentation characteristics, rumen microbial populations and milk fatty acid profile[J]. Animal Feed Science and Technology, 2012, 178(3/4): 139-150. |
| [26] |
PENG Z X, WANG A R, XIE L Q, et al. Use of recombinant porcine β-defensin 2 as a medicated feed additive for weaned piglets[J]. Scientific Reports, 2016, 6: 26790. DOI:10.1038/srep26790 |
| [27] |
张江, 丁洪军, 张婷婷, 等. 微生态和抗菌肽复合制剂对奶牛产奶量及乳品质的影响[J]. 饲料博览, 2015(1): 1-4. DOI:10.3969/j.issn.1001-0084.2015.01.001 |
| [28] |
LIU Q, YAO S H, CHEN Y, et al. Use of antimicrobial peptides as a feed additive for juvenile goats[J]. Scientific Reports, 2017, 7: 12254. DOI:10.1038/s41598-017-12394-4 |
| [29] |
马卫明, 佘锐萍, 胡艳欣, 等. 猪小肠抗菌肽对雏鸡的促生长作用及其机理初探[J]. 中国农业科学, 2006, 39(8): 1723-1728. DOI:10.3321/j.issn:0578-1752.2006.08.029 |
| [30] |
陈晓生, 张辉华, 周庆国, 等. 抗菌肽对肉鸭雏鸭期肠道主要微生物菌落的影响[J]. 兽药与饲料添加剂, 2006, 11(4): 1-2. |
| [31] |
MOALLEM U, LEHRER H, LIVSHITZ L, et al. The effects of live yeast supplementation to dairy cows during the hot season on production, feed efficiency, and digestibility[J]. Journal of Dairy Science, 2009, 92(1): 343-351. DOI:10.3168/jds.2007-0839 |
| [32] |
李文.瘤胃液pH值、渗透压、挥发性脂肪酸(VFAs)浓度对绵羊瘤胃上皮VFAs吸收影响的研究[D].硕士学位论文.泰安: 山东农业大学, 2014.
|
| [33] |
RUSSELL J B, RYCHLIK J L. Factors that alter rumen microbial ecology[J]. Science, 2001, 292(5519): 1119-1122. DOI:10.1126/science.1058830 |
| [34] |
JALC D, LAUKOVÁ A. Effect of nisin and monensin on rumen fermentation in the artificial rumen[J]. Berliner Und Münchener Tierärztliche Wochenschrift, 2002, 115(1/2): 6-10. |
| [35] |
陈芸, 刘旗, 邓俊良, 等. 复合抗菌肽对山羊瘤胃菌群结构的影响[J]. 浙江农业学报, 2017, 29(11): 1800-1808. DOI:10.3969/j.issn.1004-1524.2017.11.05 |
| [36] |
KIM M, FELIX T L, LOERCH S C, et al. Effect of haylage and monensin supplementation on ruminal bacterial communities of feedlot cattle[J]. Current Microbiology, 2014, 69(2): 169-175. DOI:10.1007/s00284-014-0564-1 |
| [37] |
HOOK S E, NORTHWOOD K S, WRIGHT A D G, et al. Long-term monensin supplementation does not significantly affect the quantity or diversity of methanogens in the rumen of the lactating dairy cow[J]. Applied and Environmental Microbiology, 2009, 75(2): 374-380. DOI:10.1128/AEM.01672-08 |




