2. 上海海洋大学水产与生命学院, 上海 201306;
3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 青岛 266237
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China
植物蛋白质通常缺乏1种或多种必需氨基酸,因此,研究氨基酸需求量对于评估植物蛋白质替代鱼粉具有重要意义[1-2]。在组成蛋白质的氨基酸中,有10种被认为是鱼类的必需氨基酸,其中赖氨酸是大部分植物蛋白质的第一限制性氨基酸,当植物蛋白质替代鱼粉时,经常会由于缺乏赖氨酸而影响肉食性鱼类的生长和饲料利用[3-4]。此外,赖氨酸除参加蛋白质合成外,还可以作为肉碱的合成底物,参与脂肪代谢[5]。目前,国内外学者已经对多种鱼类包括花鲈(Lateolabrax japonicus)[6]、大黄鱼(Pseudosciaena crocea R)[7]、大菱鲆(Scophthalmus maximus)[8]、团头鲂(Megalobrama amblycephala)[9]、虹鳟(Oncorhynchus mykiss)[10]等进行赖氨酸需求量的研究。
红鳍东方鲀(Takifugu rubripes)隶属于硬骨鱼纲,鲀形目,鲀科,东方鲀属,俗称河豚,是我国北方重要的海水养殖品种之一,具有较高的经济价值。近年来,随着我国有条件开放红鳍东方鲀养殖政策的实施,红鳍东方鲀的养殖产业得到进一步发展,但是目前关于红鳍东方鲀赖氨酸需求量的研究未见报道。本试验通过研究不同水平赖氨酸对红鳍东方鲀生长性能、体组成、肝脏和血清生化指标的影响,确定红鳍东方鲀幼鱼对饲料赖氨酸需求量,为开发红鳍东方鲀配合饲料提供基础数据。
1 材料与方法 1.1 试验饲料在基础饲料中分别添加0、0.8%、1.6%、2.4%、3.2%和4.0%的L-赖氨酸。以谷氨酸作为赖氨酸的等氮替代物,配制成6种不同赖氨酸水平的等氮等脂的半精制饲料,试验饲料组成及营养水平、氨基酸组成分别见表 1和表 2,其中饲料蛋白质和脂肪水平的设定分别参照Kim等[11]和Kikuchi等[12]的研究,氨基酸混合物的添加参考红鳍东方鲀肌肉氨基酸组成[13]。所有饲料原料经粉碎过80目筛,然后根据饲料配方制成直径3.5 mm的颗粒饲料,55 ℃烘干后,保存于-20 ℃冰箱中备用。经测定,各组饲料的实际赖氨酸水平分别为1.65%、2.58%、3.18%、4.01%、4.80%和5.52%。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
|
|
表 2 试验饲料的氨基酸组成(干物质基础) Table 2 Amino acid composition of experiment diets (DM basis) |
红鳍东方鲀幼鱼购自海阳黄海水产有限公司。试验开始前,投喂所有组混合后的饲料暂养1周,使其适应饲料及养殖环境。试验开始时,饥饿24 h,挑选体质健康、体格均匀的鱼,称重后放入18个桶(500 L)中,每个桶中放入30尾鱼[平均体重为(13.83±0.61) g],然后,每种饲料随机饲喂3个桶,即3个重复。试验期间,每天分别于07:00、12:00、16:00和20:00进行手动投喂达到饱食,摄食结束后,清除残饵,每2 d刷桶1次,保持桶壁和桶底清洁,试验持续67 d。
养殖用水为浅井海水,经二级沉淀和砂率后进入蓄水池,采用室内流水养殖系统;试验期间,采取适当的措施降低室内光线强度,溶氧含量高于6 mg/L,试验期间,水温为22~27 ℃,盐度为24‰~26‰,pH为7.90~8.05。
1.3 试验取样试验开始前随机取10尾红鳍东方鲀幼鱼作为初始鱼,用于常规营养成分分析。试验结束后,饥饿24 h,然后对每桶鱼进行计数、称重。每桶随机取4尾试验鱼-20 ℃保存,用于体成分分析。每桶随机另取6尾鱼,尾静脉取血,静置后3 000 r/min离心获得血清;随后解剖取肝脏和肌肉,迅速放入液氮中速冻。之后所有样品转移到-80 ℃冰箱保存,用于试验相关指标的测定。
1.4 指标分析饲料原料、试验饲料和鱼体的粗蛋白质、粗脂肪、粗灰分和水分含量的测定均参照AOAC(1984)[14]方法进行。水分含量采用105 ℃烘干至恒重后失重法测定;粗灰分含量采用马弗炉550 ℃高温灼烧法16 h后测定;粗脂肪含量采用索氏抽提法测定(所用仪器为FOSS脂肪测定仪SOXTEC 2050,瑞典);粗蛋白质含量采用凯氏定氮法测定(所用仪器为UDK142凯氏定氮仪,意大利)。饲料氨基酸组成采用6 mol/L的盐酸在110 ℃下水解22~24 h,用全自动氨基酸分析仪(日立L-8900全自动生化分析仪,日本)测定。血清生化指标采用全自动生化分析仪(BeckmanLX-20全自动生化分析仪,美国)测定。肝脏谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性均采用南京建成生物工程研究所试剂盒,按照试剂盒说明书的方法测定。
1.5 计算公式

|

|
试验数据以平均值±标准误(mean±SE)表示,使用SPSS 17.0统计软件进行单因素方差分析(one-way ANOVA),当差异达到显著水平(P < 0.05),进行Duncan氏多重比较。
2 结果 2.1 饲料赖氨酸水平对红鳍东方鲀生长性能的影响饲料赖氨酸水平对红鳍东方鲀生长性能的影响如表 3所示。饲料赖氨酸水平显著影响红鳍东方鲀的SR、SGR、FI、FE和PPV(P<0.05)。SR、SGR、FE和PPV在各组之间变化趋势相似,均随着赖氨酸水平的提高呈先增高后降低的趋势:SR为74.44%~96.67%,在4.01%赖氨酸组达到了最高,显著高于1.65%和2.58%赖氨酸组(P<0.05),但与其他各组无显著差异(P>0.05);SGR在4.80%赖氨酸组达到最高,显著高于1.65%和5.52%赖氨酸组(P<0.05),与其他各组无显著差异(P>0.05);FE在4.80%赖氨酸组达到最高,显著高于1.65%赖氨酸组(P<0.05),与其他各组无显著差异(P>0.05);PPV在4.80%赖氨酸组达到最高,与4.01%赖氨酸组无显著差异(P>0.05),但显著高于其他各组(P<0.05)。FI随红鳍东方鲀饲料赖氨酸水平的提高呈现降低的趋势,在4.80%和5.52%赖氨酸组显著低于其他各组(P<0.05)。PER在各组之间无显著差异(P>0.05)。另外,饲料赖氨酸水平对CF无显著影响(P>0.05),但HSI和VSI均在1.65%赖氨酸组显著高于其他各组(P<0.05)。
|
|
表 3 饲料赖氨酸水平对红鳍东方鲀生长性能的影响 Table 3 Effects of dietary lysine level on growth performance of Takifugu rubripes |
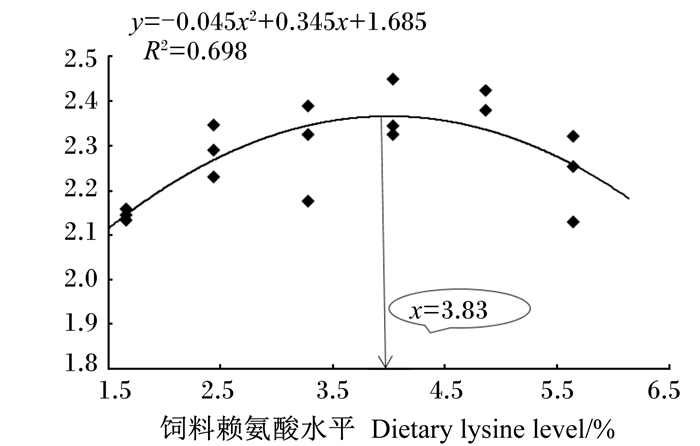
将红鳍东方鲀的SGR与饲料赖氨酸水平进行二次曲线拟合分析,得到SGR(y)与饲料赖氨酸水平(x)的二次曲线关系为:y=-0.045x2+0.345x+1.685(R2=0.698)。由图 1可知,当赖氨酸水平为3.83%,即占饲料蛋白质的7.66%时,红鳍东方鲀的SGR达到最高。
|
图 1 红鳍东方鲀特定生长率与饲料赖氨酸水平的二次曲线关系 Fig. 1 Second-order polynomial relationship between SGR and dietary lysine levels of Takifugu rubripes |
饲料赖氨酸水平对红鳍东方鲀鱼体成分的影响如表 4所示。饲料赖氨酸水平对鱼体水分和粗蛋白质含量无显著影响(P>0.05);红鳍东方鲀的粗脂肪含量在1.65%赖氨酸组时最高,显著高于其他各组(P<0.05);粗灰分含量随着赖氨酸水平的提高呈现出了依次降低的趋势,在5.52%赖氨酸组最低,显著低于除4.80%赖氨酸组以外的其他各组(P<0.05)。
|
|
表 4 饲料赖氨酸水平对红鳍东方鲀鱼体成分的影响(湿重基础) Table 4 Effects of dietary lysine level on body composition of Takifugu rubripes (wet weight basis) |
饲料赖氨酸水平对红鳍东方鲀肌肉氨基酸组成的影响如表 5所示。肌肉中的必需氨基酸苏氨酸、精氨酸和苯丙氨酸及非必需氨基酸丝氨酸、谷氨酸、半胱氨酸、天冬氨酸和甘氨酸含量均呈现先升高再趋于平稳的趋势,在4.01%赖氨酸组达到最大值,显著高于2.58%赖氨酸组(P<0.05);肌肉中组氨酸、蛋氨酸、异亮氨酸、缬氨酸、亮氨酸、丙氨酸、酪氨酸及脯氨酸含量在各组之间无显著差异(P>0.05)。
|
|
表 5 饲料赖氨酸水平对红鳍东方鲀肌肉氨基酸组成的影响(干物质基础) Table 5 Effects of dietary lysine level on amino acid composition of muscle of Takifugu rubripes (DM basis) |
饲料赖氨酸水平对红鳍东方鲀血清和肝脏生化指标的影响如表 6所示。随着赖氨酸水平的提高,肝脏和血清GOT活性呈现先升高后降低的趋势,肝脏中的GOT活性在4.80%赖氨酸组达到最高,显著高于1.65%和2.58%赖氨酸组(P<0.05),与其他各组无显著差异(P>0.05),血清中的GOT活性在4.01%赖氨酸组达到最高,显著高于除3.18%赖氨酸组以外的其他各组(P<0.05);血清总蛋白(TP)含量呈现先升高后趋于平缓的趋势,在3.18%赖氨酸组达到了最高,显著高于1.65赖氨酸组(P<0.05);血清高密度脂蛋白胆固醇(HDL-C)含量随着赖氨酸水平的升高而升高,在4.80%和5.52%赖氨酸组显著高于其他各组(P<0.05)。饲料赖氨酸水平对肝脏及血清GPT活性,血清甘油三酯(TG)、总胆固醇(CHOL)、低密度脂蛋白胆固醇(LDL-C)、葡萄糖(GLU)及总胆汁酸(TBA)含量无显著影响(P>0.05)。
|
|
表 6 饲料赖氨酸水平对红鳍东方鲀血清和肝脏生化指标的影响 Table 6 Effects of dietary lysine level on biochemical parameters in serum and liver of Takifugu rubripes |
剂量-效应法是评价鱼类营养需求最常用的方法,目前大部分鱼类的赖氨酸需求量都是采用该方法得到的[15]。本试验在研究红鳍东方鲀赖氨酸需求量时,也采用同样的方法进行评价。根据红鳍东方鲀生长性能的结果,饲料不同赖氨酸水平均显著影响了红鳍东方鲀的末重、增重率、SR、SGR、FE、FI和PPV,且除FI外,均呈现先升高后降低的趋势。因此,本试验以对生长具有综合评价效果的SGR为评价指标做二次回归曲线拟合分析,得出初始体重为13.83 g的红鳍东方鲀幼鱼的饲料赖氨酸需求量为占饲料干物质的3.83%,占饲料蛋白质的7.66%。以赖氨酸占饲料蛋白质的百分比计算,发现红鳍东方鲀幼鱼对饲料赖氨酸的需求量高于大菱鲆(5.00%)、花鲈(5.80%)、大黄鱼(5.77%)、卵形鲳鲹(Trachinotus ovatus)(6.70%)、军曹鱼(Rachycentron canadum)(5.30%)、石斑鱼(Epinephelus coioides)等海水鱼类[6-8, 16-18],这表明在海水鱼类中,红鳍东方鲀对饲料赖氨酸具有较高的需求量。另外,本试验发现一个非常有趣的结果是红鳍东方鲀的SR也随着饲料赖氨酸水平的提高,呈现先升高后降低的趋势,由于饲料赖氨酸水平对大部分海水鱼类的存活率均无显著影响[6-8, 16],而红鳍东方鲀在养殖过程中存在严重的残食行为导致养殖的成活率较低,因此,是否存在饲料中适宜的赖氨酸水平能部分减缓红鳍东方鲀的残食而提高成活率的情况值得在今后的研究中进一步进行相关的试验进行验证。
3.2 饲料不同赖氨酸水平对鱼体成分及肌肉氨基酸组成的影响赖氨酸可与蛋氨酸一起作为前体参与肉碱的合成,而肉碱是脂肪代谢的重要物质,参与长链脂肪酸从细胞质转运至线粒体进行β-氧化的过程[19]。因此,本试验分析了赖氨酸水平对鱼体脂肪含量及HSI和VSI的影响,结果表明未添加赖氨酸的1.65%赖氨酸组的鱼体粗脂肪含量显著高于添加赖氨酸的其他各组,同时,HSI和VSI也在1.65%赖氨酸组显著升高,该结果与之前在布氏鲳鲹(Trachinotus blochii)、大黄鱼、花鲈、军曹鱼、大西洋鳕鱼(Gadus morhua)等鱼类的研究结果[6-7, 15]类似,这表明红鳍东方鲀在饲料赖氨酸缺乏时,可能会影响其体内肉碱的合成,导致脂肪氧化分解减弱而引起体内脂肪异常沉积,从而增加鱼体、肝脏及内脏的脂肪含量。
此外,与在花鲈和胭脂鱼(Myxocyprinus asiaticus)的结果[6, 20]类似,本研究还发现肌肉中的赖氨酸含量随着饲料赖氨酸水平的提高呈现先增加后趋于平稳的趋势,且肌肉中的苏氨酸、精氨酸、丝氨酸、谷氨酸、半胱氨酸、天冬氨酸和甘氨酸含量也呈现与赖氨酸相似的变化趋势。Mai等[6]认为,饲料中不同赖氨酸水平对肌肉中赖氨酸含量的影响可作为判定氨基酸需求量的一个重要参考指标,而本试验中,包括赖氨酸在内,肌肉中大部分产生差异的氨基酸的转折点在4.01%赖氨酸组,即饲料赖氨酸水平为4.01%时,这与本试验以SGR为评价指标,得到红鳍东方鲀赖氨酸需求量为3.83%接近,因此,本试验结果进一步验证了Mai等[6]提出观点的正确性。
3.3 饲料不同赖氨酸水平对血清和肝脏生化指标的影响GOT和GPT是鱼类氨基酸分解代谢的2个重要酶,GOT催化将天冬氨酸和α-酮戊二酸生成谷氨酸和草酰乙酸,GPT催化将丙氨酸和α-酮戊二酸生成谷氨酸和丙酮酸,而草酰乙酸和丙酮酸可以进入三羧酸循环参与能量代谢,因此,GOT和GPT活性升高,既表明肝脏中转氨基酸活性增强,又表明这些氨基酸参与能量代谢的活力增强[21-23]。本试验中,尽管GPT活性在各组无显著变化,但GOT活性在肝脏4.80%赖氨酸组和血清4.01%赖氨酸组显著高于1.65%赖氨酸组,说明饲料中适宜赖氨酸水平,可能会提高机体的转氨基活性,并增强能量代谢。另外,饲料赖氨酸水平显著影响血清TP和HDL-C的含量,其中TP的含量随着饲料赖氨酸水平的提高呈现先升高后趋于平缓的趋势,这与在黑鲷(Sparus macrocephalus)、军曹鱼和石斑鱼的研究结果[16-17, 24]类似,表明适量增加饲料赖氨酸水平会提高血清TP含量。Leszczynski等[25]报道机体摄入过多的赖氨酸可能会引起高胆固醇血症,而本试验中,HDL-C含量随饲料赖氨酸水平的提高而显著升高,高密度脂蛋白在体内的重要作用是参与胆固醇代谢,将外周组织中的胆固醇通过HDL-C形式转运至肝脏,然后由肝脏排泄出体外[26],因此,本试验中血清HDL-C在赖氨酸过量的4.80%和5.52%赖氨酸组显著升高,可能表示机体通过提高HDL的转运能力,从而增强对胆固醇的排泄,这可能是鱼体调节过量赖氨酸的一种自我保护机制,同时,该结果也再一次证明当饲料赖氨酸水平在4.80%和5.52%时,可能已经超过了红鳍东方鲀对赖氨酸的最适需求量,因此,这一结果也间接证明本试验通过SGR得到的赖氨酸适宜需求量3.83%的正确性。
4 结论本研究结果表明,红鳍东方鲀对赖氨酸的需求量以占饲料蛋白质的比例计算,高于大部分现有的海水养殖鱼类,即以SGR为评价指标,经过二次回归曲线分析得到初始体重为13.83 g的红鳍东方鲀幼鱼对饲料中的赖氨酸需求量为3.83%,占饲料蛋白质的7.66%。
| [1] |
GATLIN Ⅲ D M, BARROWS F T, BROWN P, et al. Expanding the utilization of sustainable plant products in aquafeeds:a review[J]. Aquaculture Research, 2007, 38(6): 551-579. DOI:10.1111/j.1365-2109.2007.01704.x |
| [2] |
KAUSHIK S J, SEILIEZ I. Protein and amino acid nutrition and metabolism in fish:current knowledge and future needs[J]. Aquaculture Research, 2010, 41(3): 322-332. DOI:10.1111/j.1365-2109.2009.02174.x |
| [3] |
ABIMORAD E G, DUCATTI C, CASTELLANI D, et al. The use of stable isotopes to investigate the effects of supplemental lysine and methionine on protein turnover and amino acid utilization in pacu, Piaractus mesopotamicus, juveniles[J]. Aquaculture, 2014, 433: 119-124. DOI:10.1016/j.aquaculture.2014.06.006 |
| [4] |
LI P, MAI K, TRUSHENSKI J, et al. New developments in fish amino acid nutrition:towards functional and environmentally oriented aquafeeds[J]. Amino Acids, 2009, 37(1): 43-53. DOI:10.1007/s00726-008-0171-1 |
| [5] |
HARPAZ S. L-carnitine and its attributed functions in fish culture and nutrition—a review[J]. Aquaculture, 2005, 249(1/2/3/4): 3-21. |
| [6] |
MAI K S, ZHANG L, AI Q H, et al. Dietary lysine requirement of juvenile Japanese seabass, Lateolabrax japonicus[J]. Aquaculture, 2006, 258(1/2/3/4): 535-542. |
| [7] |
ZHANG C X, AI Q H, MAI K S, et al. Dietary lysine requirement of large yellow croaker, Pseudosciaena crocea R[J]. Aquaculture, 2008, 283(1/2/3/4): 123-127. |
| [8] |
PERES H, OLIVA-TELES A. Lysine requirement and efficiency of lysine utilization in turbot (Scophthalmus maximus) juveniles[J]. Aquaculture, 2008, 275(1/2/3/4): 283-290. |
| [9] |
廖英杰.团头鲂幼鱼对蛋氨酸、赖氨酸和精氨酸需要量的研究[D].硕士学位论文.南京: 南京农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016038587.htm
|
| [10] |
KIM K L, KAYES T B, AMUNDSON C H. Requirements for lysine and arginine by rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1992, 106(3/4): 333-344. |
| [11] |
KIM S S, LEE K J. Dietary protein requirement of juvenile tiger puffer (Takifugu rubripes)[J]. Aquaculture, 2009, 287(1/2): 219-222. |
| [12] |
KIKUCHI K, FURUTA T, IWATA N, et al. Effect of dietary lipid levels on the growth, feed utilization, body composition and blood characteristics of tiger puffer Takifugu rubripes[J]. Aquaculture, 2009, 298(1/2): 111-117. |
| [13] |
高露姣, 黄艳青, 夏连军, 等. 不同养殖模式下红鳍东方鲀的品质比较[J]. 水产学报, 2011, 35(11): 1668-1676. |
| [14] |
AOAC.Official methods of analysis.Association of official analytical chemists[M]. 14th ed.Arlington: AOAC, 1984.
|
| [15] |
EBENEEZAR S, VIJAYAGOPAL P, SRIVASTAVA P P, et al. Dietary lysine requirement of juvenile Silver pompano, Trachinotus blochii (Lacepede, 1801)[J]. Aquaculture, 2019, 511: 734234. DOI:10.1016/j.aquaculture.2019.734234 |
| [16] |
LUO Z, LIU Y J, MAI K S, et al. Quantitative L-lysine requirement of juvenile grouper Epinephelus coioides[J]. Aquaculture Nutrition, 2006, 12(3): 165-172. DOI:10.1111/j.1365-2095.2006.00392.x |
| [17] |
ZHOU Q C, WU Z H, CHI S Y, et al. Dietary lysine requirement of juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2007, 273(4): 634-640. DOI:10.1016/j.aquaculture.2007.08.056 |
| [18] |
杜强, 林黑着, 牛津, 等. 卵形鲳鲹幼鱼的赖氨酸需求量[J]. 动物营养学报, 2011, 23(10): 1725-1732. DOI:10.3969/j.issn.1006-267x.2011.10.012 |
| [19] |
WU G Y. Functional amino acids in nutrition and health[J]. Amino Acids, 2013, 45(3): 407-411. DOI:10.1007/s00726-013-1500-6 |
| [20] |
林郁葱.胭脂鱼幼鱼对赖氨酸和蛋氨酸的最适需要量[D].硕士学位论文.武汉: 华中农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10504-1012458007.htm
|
| [21] |
BROSNAN M E, BROSNAN J T. Hepatic glutamate metabolism:a tale of 2 hepatocytes[J]. The American Journal of Clinical Nutrition, 2009, 90(3): 857S-861S. DOI:10.3945/ajcn.2009.27462Z |
| [22] |
OWEN O E, KALHAN S C, HANSON R W. The key role of anaplerosis and cataplerosis for citric acid cycle function[J]. Journal of Biological Chemistry, 2002, 277(34): 30409-30412. DOI:10.1074/jbc.R200006200 |
| [23] |
SOOKOIAN S, PIROLA C J. Alanine and aspartate aminotransferase and glutamine-cycling pathway:their roles in pathogenesis of metabolic syndrome[J]. World Journal of Gastroenterology, 2012, 18(29): 3775-3781. DOI:10.3748/wjg.v18.i29.3775 |
| [24] |
ZHOU F, SHAO J, XU R, et al. Quantitative L-lysine requirement of juvenile black sea bream (Sparus macrocephalus)[J]. Aquaculture Nutrition, 2010, 16(2): 194-204. DOI:10.1111/j.1365-2095.2009.00651.x |
| [25] |
LESZCZYNSKI D E, KUMMEROW F A. Excess dietary lysine induces hypercholesterolemia in chickens[J]. Experientia, 1982, 38(2): 266-267. DOI:10.1007/BF01945105 |
| [26] |
EREN E, YILMAZ N, AYDIN O. High density lipoprotein and it's dysfunction[J]. The Open Biochemistry Journal, 2012, 6(1): 78-93. DOI:10.2174/1874091X01206010078 |




