环磷酸腺苷(cAMP)-蛋白激酶A(PKA)信号通路是调控机体葡萄糖和脂质代谢的关键信号通路之一。研究发现,cAMP-PKA介导的信号通路通过cAMP反应元件结合蛋白(CREB)及其转录激活因子CRTC共同介导调控下游靶基因的转录和翻译[1]。CRTC3是CRTC家族中的一员,在脂肪组织中高度表达,参与了脂肪组织的发育、分化的过程[2]。但目前关于猪CRTC3的研究报道较少,主要集中在其全长基因克隆和遗传序列表征上[3-4],关于其在猪脂质代谢中的功能还未见报道。此外,还有很多脂肪沉积相关基因参与调控脂肪代谢,如CCAAT/增强子结合蛋白α(C/EBPα)和过氧化物酶体增殖体激活受体γ(PPARγ)基因调控脂肪细胞分化聚酯[5],固醇调节元件结合蛋白-1(SREBP-1)基因调控胆固醇生物合成和脂肪酸合成[6-7];PPARγ基因还调控脂肪酸的合成[8],参与脂肪酸结合蛋白4(FABP4)转运,促进脂肪酸合成,进而增加机体的脂肪储存量[9]。过表达脂联素(ADIPOQ)可以促进游离脂肪酸的氧化和葡萄糖的吸收[10],瘦素(leptin,LEP)表达量升高可消耗脂肪,抑制脂滴生成[11]。脂滴是脂质储存的重要调节剂,围脂滴蛋白(perilipin,PLIN)包裹在成熟脂肪细胞的脂滴周围,维持脂质代谢的动态平衡[12]。
在哺乳动物中有3种脂肪细胞:白色、棕色和米色,其中米色脂肪细胞常见于棕色化的白色脂肪组织中。棕色脂肪细胞和米色脂肪细胞含有大量的线粒体且表达较高的解偶联蛋白1(UCP1)。目前的研究结果表明,猪体内缺乏功能性的棕色脂肪组织和UCP1基因[13-14],但冷刺激可以调控猪体内米色脂肪细胞生成和解偶联蛋白3(UCP3)等棕色化相关基因表达[13]。线粒体解偶联蛋白2(UCP2)和UCP3位于线粒体内膜,能促进机体产热消耗能量,从而加快糖脂消耗,减少脂肪沉积量[15]。白色脂肪组织棕色化是一种重要的脂质代谢调控机制,可降低血浆甘油三酯和胆固醇水平,影响脂肪沉积[16]。Forskolin是一种cAMP-PKA信号通路激活剂,能促进白色脂肪组织棕色化[17]。白色脂肪组织棕色化相关基因过氧化物酶体增殖物激活受体-γ共激活因子-1α(PGC-1α)可与CREB和核呼吸因子(NRFs)相互作用并调节二者的活性[18];PRDM16(PRD1-BF1-RIZ1 homologous domain containing 16)可控制棕色脂肪细胞的发育,调控棕色脂肪组织和白色脂肪组织与骨骼肌肌肉组织的形成及相互转化,进而影响脂肪和肌肉细胞的形成和发育[19]。但是目前关于猪白色脂肪组织棕色化相关基因表达的品种差异及forskolin对它们的影响还鲜见报道。
因此,本试验以杜长大猪和我国著名的肉脂型地方品种猪莱芜猪为动物模型,利用Western blot、实时荧光定量PCR和免疫荧光染色等技术,研究CRTC3及脂质代谢相关基因在不同品种猪脂肪和肌肉组织中的表达差异及其与脂肪沉积之间的关系,并进一步通过细胞试验探究forskolin处理对猪皮下脂肪前体细胞分化聚酯和CRTC3及脂质代谢相关基因表达的影响。
1 材料与方法 1.1 试验动物选取体重在(110.0±2.5) kg的莱芜猪和杜长大猪各5头,屠宰取背最长肌、腰大肌、皮下脂肪、腹部脂肪组织样品,液氮速冻后保存于-80 ℃冰箱。选取2头3日龄的杜长大仔猪,用于分离皮下脂肪组织中的前体脂肪细胞。
1.2 试验方法 1.2.1 Western blot用细胞裂解液提取组织和细胞中的总蛋白质,通过二喹啉甲酸(BCA)试剂盒测定每个样品的蛋白质浓度,以确保每个蛋白质样品上样量相同。配制分离胶浓度为10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶,进行SDS-PAGE分离,然后将蛋白质印迹转移至硝酸纤维素膜上。使用5%脱脂牛奶室温封闭1 h,4 ℃一抗孵育过夜;第2天用TBST洗膜3次,每次5 min,然后二抗室温孵育1 h后,洗膜曝光。
1.2.2 实时荧光定量PCR使用Trizol法提取组织和细胞中的总RNA,之后用核酸分析仪检测样品RNA浓度,选取A260 nm/A280 nm值为1.8~2.0的RNA作为模板,按照反转录试剂盒(PrimeScriptTM RT Reagent Kit)的操作说明,合成cDNA。使用Primer 6.0设计引物,引物序列见表 1。内参基因为18S rDNA。然后按照实时荧光定量PCR试剂盒进行目的基因mRNA表达水平检测。
|
|
表 1 引物序列 Table 1 Primer sequences |
取3日龄杜长大猪皮下脂肪组织,剪碎后用1%胶原酶Ⅰ消化液37 ℃水浴消化60 min,过滤,离心,弃上清,沉淀用DMEM培养基漂洗后过滤,用含10%小牛血清的DMEM完全培养基(DMEM+10%胎牛血清+青霉素-链霉素)重悬,接种于培养瓶,采用差速贴壁法纯化细胞,获得猪皮下脂肪前体细胞,将猪皮下脂肪前体细胞放置在37 ℃、5% CO2培养箱中培养,每隔1 d换1次培养基。
1.2.4 猪皮下脂肪前体细胞诱导分化和forskolin处理将培养的猪皮下脂肪前体细胞接种于12孔细胞培养板,待完全融合后用MDI成脂诱导培养基[DMEM完全培养基+0.25 mmol/L磷酸二酯酶抑制剂(IBMX)+100 nmol/L地塞米松(DEX)+500 nmol/L胰岛素(insulin)+100 nmol/L罗格列酮(ROS)]诱导4 d,然后用分化培养基(DMEM完全培养基+500 nmol/L insulin)继续诱导4 d,完成诱导分化。Forskolin组在诱导分化的第1天即加入forskolin,使其终浓度为10 μmol/L,对照组则加入同浓度的二甲基亚砜(DMSO)进行诱导分化。
1.2.5 免疫荧光染色细胞用磷酸盐缓冲溶液(PBS)洗涤3次后进行免疫荧光染色,具体步骤参见文献[4]。
1.2.6 油红O染色称取0.5 g油红O溶于100 mL异丙醇中配好保存,使用时将其同蒸馏水按3 : 2稀释为工作液,通过定性滤纸过滤。将细胞培养板的培养液吸出,加入固定液15 min,弃掉固定液,加入油红O工作液染色15 min,然后用PBS洗涤后拍照观察。
1.3 统计分析实时荧光定量PCR数据结果用“平均值±标准误(mean±SE)”表示。采用Graphpad软件进行显著性分析和作图,P<0.01表示差异极显著,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果 2.1 CRTC3在不同品种猪肌肉组织中的表达差异Western blot结果表明,莱芜猪背最长肌和腰大肌中CRTC3的蛋白表达水平均高于杜长大猪(图 1-A、图 1-B)。同时,莱芜猪背最长肌中CRTC3的mRNA表达水平显著高于杜长大猪(P<0.05,图 1-C),而在腰大肌中2个品种猪之间无显著差异(P>0.05,图 1-D)。这表明在肌肉组织中,猪CRTC3的表达在不同品种猪间存在差异。
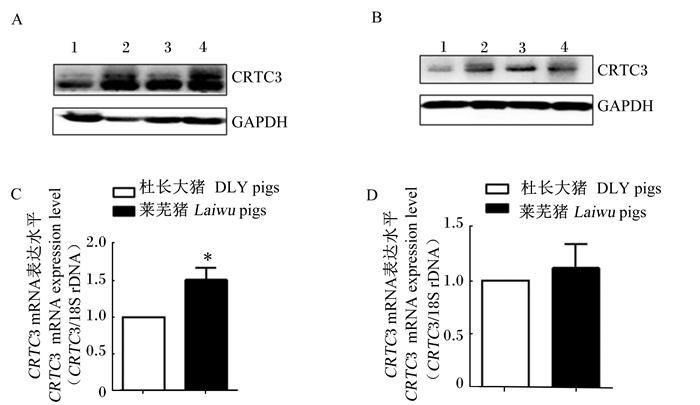
|
A:杜长大猪和莱芜猪背最长肌中CRTC3的蛋白表达水平(1、3为杜长大猪,2、4为莱芜猪);B:杜长大猪和莱芜猪腰大肌中CRTC3的蛋白表达水平(1、3为杜长大猪,2、4为莱芜猪);C:杜长大猪和莱芜猪背最长肌中CRTC3的mRNA表达水平(n=5);D:杜长大猪和莱芜猪腰大肌中CRTC3的mRNA表达水平(n=5)。*:差异显著(P < 0.05)。 A: the protein expression level of CRTC3 in longissimus dorsi muscle (LDM) of DLY pigs (1, 3) and Laiwu pigs (2, 4); B: the protein expression level of CRTC3 in psoas major (PMM) muscle of DLY pigs (1, 3) and Laiwu pigs (2, 4); C: the mRNA expression level of CRTC3 in LDM of DLY pigs and Laiwu pigs (n=5); D: the mRNA expression level of CRTC3 in PMM of DLY pigs and Laiwu pigs (n=5). *: significant difference (P < 0.05). 图 1 猪肌肉组织中CRTC3表达的品种差异 Fig. 1 Breed difference of CRTC3 expression in muscle tissue of pigs |
Western blot结果表明,莱芜猪皮下脂肪组织中CRTC3的蛋白表达水平高于杜长大猪(图 2-A),同时,莱芜猪皮下脂肪组织中CRTC3的mRNA表达水平显著高于杜长大猪(P<0.05,图 2-B)。此外,莱芜猪皮下脂肪组织中脂质沉积相关基因如PPARγ、FABP4、C/EBPα和PLIN的mRNA表达水平显著高于杜长大猪(P<0.05,图 2-C),LEP的mRNA表达水平极显著高于杜长大猪(P<0.01,图 2-C);莱芜猪皮下脂肪组织中脂肪棕色化相关基因如PRDM16、UCP2和UCP3的mRNA表达水平显著低于杜长大猪(P<0.05,图 2-D),NRF1和PGC-1α的mRNA表达水平极显著低于杜长大猪(P<0.01,图 2-D)。
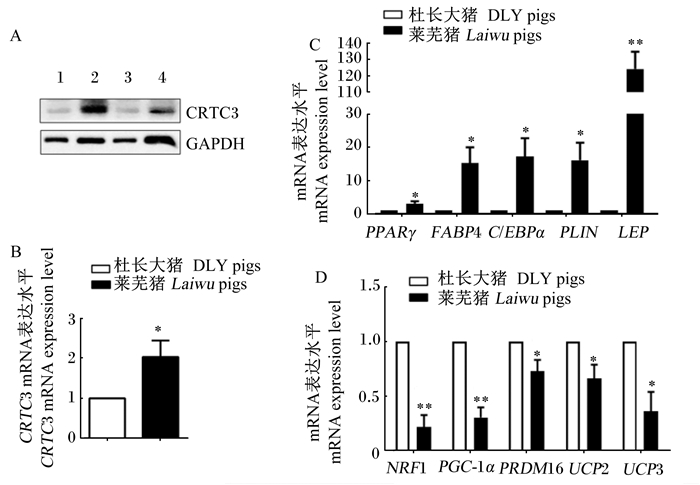
|
A:杜长大猪和莱芜猪皮下脂肪组织中CRTC3的蛋白表达水平(1、3为杜长大猪,2、4为莱芜猪);B:杜长大猪和莱芜猪皮下脂肪组织中CRTC3的mRNA表达水平(n=5);C:杜长大猪和莱芜猪皮下脂肪组织中脂肪沉积相关基因的mRNA表达水平(n=5);D:杜长大猪和莱芜猪皮下脂肪组织中脂肪棕色化相关基因的mRNA表达水平(n=5)。*:差异显著(P < 0.05);* *:差异极显著(P < 0.01)。 A: the protein expression level of CRTC3 in subcutaneous adipose tissue (SAT) of DLY pigs (1, 3) and Laiwu pigs (2, 4); B: the mRNA expression level of CRTC3 in SAT of DLY pigs and Laiwu pigs (n=5); C: the mRNA expression levels of adipose deposition related genes in SAT of DLY pigs and Laiwu pigs (n=5); D: the mRNA expression levels of adipose browning related genes in SAT of DLY pigs and Laiwu pigs (n=5). *: significant difference (P < 0.05); * *: extremely significant difference (P < 0.01). 图 2 猪皮下脂肪组织中CRTC3及脂质代谢相关基因表达的品种差异 Fig. 2 Breed difference of expression of CRTC3 and lipid metabolism related genes in subcutaneous adipose tissue |
与杜长大猪相比,莱芜猪内脏脂肪组织中CRTC3的蛋白表达水平更高(图 3-A),CRTC3的mRNA表达水平显著高于杜长大猪(P<0.05,图 3-B)。莱芜猪内脏脂肪组织中PPARγ、LEP的mRNA表达水平极显著高于杜长大猪(P<0.01,图 3-C),FABP4、C/EBPα和PLIN的mRNA表达水平均显著高于杜长大猪(P<0.05,图 3-C);而莱芜猪内脏脂肪组织中NRF1、PGC-1α、PRDM16和UCP3的mRNA表达水平均显著低于杜长大猪(P<0.0,图 3-D),UCP2的mRNA表达水平极显著低于杜长大猪(P<0.01,图 3-D)。
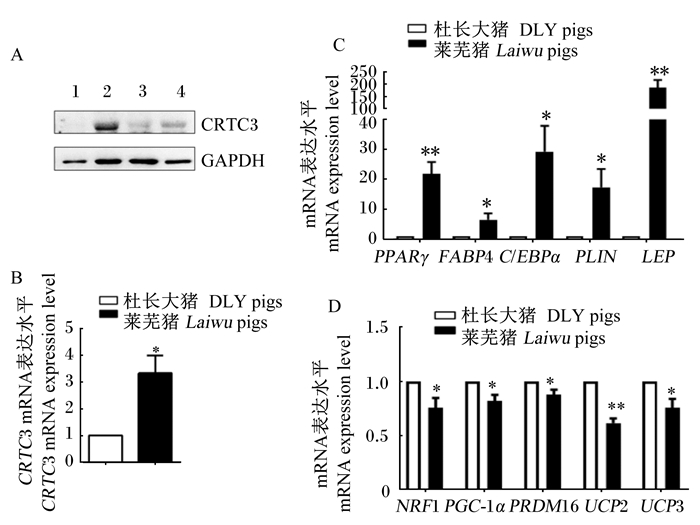
|
A:杜长大猪和莱芜猪内脏脂肪组织中CRTC3的蛋白表达水平(1、3为杜长大猪,2、4为莱芜猪);B:杜长大猪和莱芜猪内脏脂肪组织中CRTC3的mRNA表达水平(n=5);C:杜长大猪和莱芜猪内脏脂肪组织中脂肪沉积相关基因的mRNA表达水平(n=5);D:杜长大猪和莱芜猪内脏脂肪组织中脂肪棕色化相关基因的mRNA表达水平(n=5)。*:差异显著(P < 0.05);* *:差异极显著(P < 0.01)。 A: the protein expression level of CRTC3 in visceral adipose tissue (VAT) of DLY pigs (1, 3) and Laiwu pigs (2, 4); B: the mRNA expression level of CRTC3 in VAT of DLY pigs and Laiwu pigs (n=5); C: the mRNA expression levels of adipose deposition related genes in VAT of DLY pigs and Laiwu pigs (n=5); D: the mRNA expression levels of adipose browning related genes in VAT of DLY pigs and Laiwu pigs (n=5). *: significant difference (P < 0.05); * *: extremely significant difference (P < 0.01). 图 3 猪内脏脂肪组织中CRTC3及脂质代谢相关基因表达的品种差异 Fig. 3 Breed difference of expression of CRTC3 and lipid metabolism related genes in visceral adipose tissue of pigs |
由分化前后的照片发现,猪皮下脂肪前体细胞分化后聚集了大量的脂滴(图 4-A),分化后CRTC3和磷酸化CREB(p-CREB)的蛋白表达水平有明显提高(图 4-B)。与分化前相比,猪皮下脂肪前体细胞分化后CRTC3和CREB的mRNA表达水平极显著升高(P<0.01,图 4-C、图 4-D)。此外,分化后的脂肪前体细胞中PPARγ、FABP4、C/EBPα、PLIN、SREBP-1、ADIPOQ和LEP的mRNA表达水平极显著高于分化前的脂肪前体细胞(P<0.01,图 4-E),同时NRF1、PGC-1α、PRDM16、UCP2和UCP3的mRNA表达水平在分化后也极显著升高(P<0.01,图 4-F)。
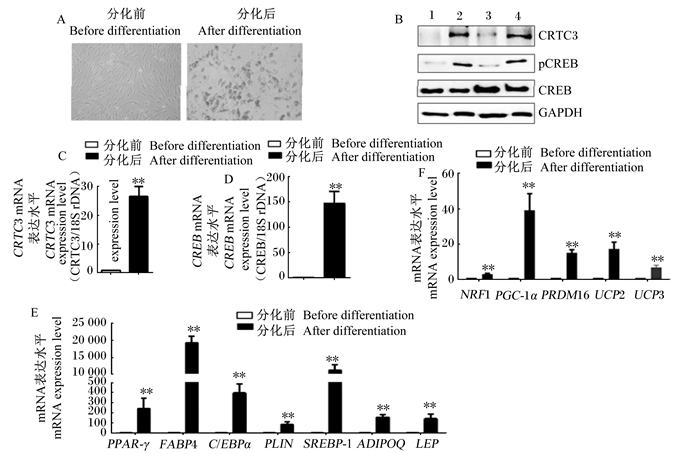
|
A:猪皮下脂肪前体细胞分化前后的照片;B:猪皮下脂肪前体细胞分化前后CRTC3、pCREB、CREB的蛋白表达水平(1、3:分化前;2、4:分化后);C:猪皮下脂肪前体细胞分化前后CRTC3的mRNA表达水平(n=4);D:猪皮下脂肪前体细胞分化前后CREB的mRNA表达水平(n=4);E:猪皮下脂肪前体细胞分化前后脂肪沉积相关基因的mRNA表达水平(n=4);F:猪皮下脂肪前体细胞分化前后脂肪棕色化相关基因的mRNA表达水平(n=4)。*:差异显著(P < 0.05);* *:差异极显著(P < 0.01)。 A: the image of porcine subcutaneous preadipocytes before and after differentiation; B: the protein expression level ofCRTC3, pCREB and CREB in porcine subcutaneous preadipocytes before (1, 3) and after differentiation (2, 4) (n=4); C: the mRNA expression level of CRTC3 in porcine subcutaneous preadipocytes before and after differentiation (n=4); D: the mRNA expression level of CREB in porcine subcutaneous preadipocytes before and after differentiation (n=4); E: the mRNA expression levels of adipose deposition related genes in porcine subcutaneous preadipocytes before and after differentiation (n=4); F: the expression mRNA levels of adipose browning related genes in porcine subcutaneous preadipocytes before and after differentiation (n=4). *: significant difference (P < 0.05); * *: extremely significant difference (P < 0.01). 图 4 猪皮下脂肪前体细胞分化前后CRTC3及脂质代谢相关基因的表达变化 Fig. 4 Expression changes of CRTC3 and lipid metabolism related genes in porcine subcutaneous preadipocytes before or after differentiation |
通过免疫荧光染色发现,在一般情况下,CRTC3定位在293T细胞的细胞质和细胞核内,forskolin处理促进了猪皮下脂肪前体细胞中CRTC3蛋白由细胞质进入细胞核内(图 5-A)。由图 5-B的油红O染色可见,forskolin处理后脂滴较对照组明显减少,且猪皮下脂肪前体细胞中CREB的mRNA表达水平极显著高于对照组(P<0.01,图 5-C),同时PGC-1α、PRDM16、UCP2和UCP3的mRNA表达水平极显著高于对照组(P<0.01),UCP3的mRNA表达水平显著高于对照组(P<0.05),NRF1的mRNA表达水平与对照组相比有升高的趋势但差异不显著(P>0.05,图 5-D)。而Forskolin组猪皮下脂肪前体细胞中CRTC3在蛋白和mRNA表达水平上均较对照组极显著降低(P<0.01,图 5-E、图 5-F),同时PPARγ、FABP4、C/EBPα、PLIN和LEP的mRNA表达水平也极显著低于对照组(P<0.01,图 5-G)。
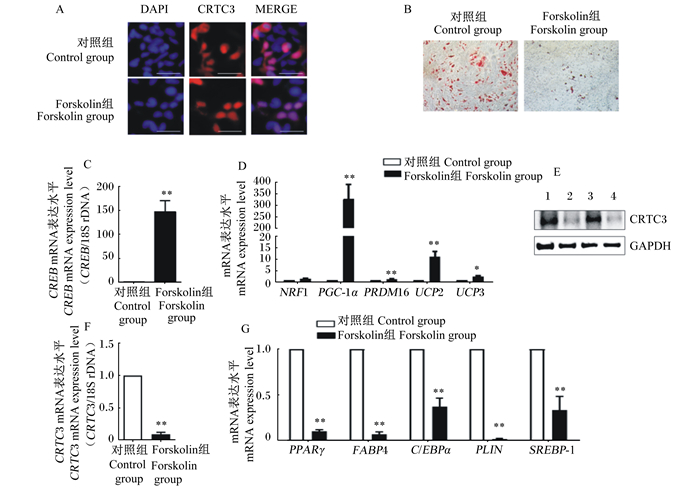
|
A:经(Forskolin组)和不经forskolin处理(对照组)时293T细胞中CRTC3定位的免疫荧光图像;B:经和不经forskolin处理时猪皮下脂肪前体细胞分化后的油红O染色图片;C:经和不经forskolin处理时猪皮下脂肪前体细胞中CREB的mRNA表达水平(n=4);D:经和不经forskolin处理时猪皮下脂肪前体细胞中脂肪棕色化相关基因的mRNA表达水平(n=4);E:经和不经forskolin处理时猪皮下脂肪前体细胞中CRTC3的蛋白表达水平(1、3:对照组;2、4:Forskolin组);F:经和不经forskolin处理时猪皮下脂肪前体细胞中CRTC3的mRNA表达水平(n=4);G:经和不经forskolin处理时猪皮下脂肪前体细胞中脂肪沉积相关基因的mRNA表达水平(n=4)。*:差异显著(P < 0.05);* *:差异极显著(P < 0.01)。 A: the immunofluorescence images of localization of CRTC3 in 293T cells with (Forskolin group) or without forskolin treatment (control group); B: the oil-red O staining maps of porcine subcutaneous preadipocytes with or without forskolin treatment; C: the mRNA expression level of CREB in porcine subcutaneous preadipocytes with or without forskolin treatment (n=4); D: the mRNA expression levels of adipose browning related genes in porcine subcutaneous preadipocytes with or without forskolin treatment (n=4); E: the mRNA expression level of CRTC3 in porcine subcutaneous preadipocytes with (2, 4) or without (1, 3) forskolin treatment (n=4); F: the protein expression level of CRTC3 in porcine subcutaneous preadipocytes with or without forskolin treatment (n=4); G: the mRNA expression levels of adipose deposition related genes in porcine subcutaneous preadipocytes with or without forskolin treatment. *: significant difference (P < 0.05); * *: extremely significant difference (P < 0.01). 图 5 Forskolin处理对猪CRTC3定位、表达和皮下脂肪前体细胞分化的影响 Fig. 5 Effects of forskolin treatment on localization and expression of porcine CRTC3 and differentiation of subcutaneous preadipocytes |
脂肪沉积的关键信号网络需要机体糖脂代谢相关基因的参与,CRTC3是一个重要的糖脂代谢基因。大量研究表明CRTC3可能通过与糖脂代谢相关基因的互作,调节激素的分泌、能量代谢和脂肪酸代谢反应,进而影响机体肌肉和脂肪组织的脂肪沉积[2]。全身敲除CRTC3基因后,小鼠体内棕色脂肪组织量增加,能量消耗量更大,说明CRTC3基因的缺失促进了白色脂肪组织的脂解作用;在高脂饮食条件下,全身敲除CRTC3基因小鼠较野生型小鼠明显瘦小,研究者发现这是由于CRTC3受到脂肪组织中的β-肾上腺素能受体信号的调控,从而促进脂肪沉积[1]。而关于CRTC3在脂肪和肌肉中的表达模式及功能的研究甚少。本试验比较了杜长大猪和地方品种猪莱芜猪间背最长肌和腰大肌CRTC3基因的表达差异,发现CRTC3基因在莱芜猪中的表达水平更高;通过比较皮下脂肪和内脏脂肪组织中CRTC3的mRNA表达水平发现,莱芜猪的CRTC3基因表达水平均高于杜长大猪,同时发现,莱芜猪的PPARγ、FABP4、C/EBPα、PLIN、LEP等脂肪沉积相关基因的mRNA表达水平显著或极显著高于杜长大猪,而莱芜猪中NRF1、PGC-1α、PRDM16、UCP2、UCP3等白色脂肪棕色化相关基因的mRNA表达水平显著或极显著低于杜长大猪,表明品种间脂质代谢和米色脂肪细胞数目可能存在差别。有研究表明,猪体内虽然没有功能性的UCP1基因和棕色脂肪[13-14],但存在米色脂肪细胞[13],当猪受到冷刺激时可以通过调控米色脂肪细胞生成和UCP3等相关基因表达调控脂质代谢和产热[13]。也有研究表明,CRTC家族中的CRTC2能够促进PGC-1α和线粒体基因在肌肉细胞中的表达[20],进而推测CRTC家族可能会调控白色脂肪棕色化及相关基因表达。而关于CRTC3是否可以调控猪皮下脂肪组织中棕色化相关基因表达还有待于进一步研究。细胞试验研究还发现,分化后的皮下脂肪前体细胞生成大量的脂滴,检测到CRTC3和聚酯相关基因PPARγ、FABP4、C/EBPα、PLIN和LEP的mRNA表达水平在分化后得到极显著升高,同时脂肪棕色化特异性基因NRF1、PGC-1α、PRDM16、UCP2、UCP3的mRNA表达水平也极显著升高。这些结果表明,猪CRTC3基因表达与猪脂肪沉积及相关基因表达可能存在密切的关系,其表达水平可能影响猪的脂质代谢和脂肪沉积,但其具体功能还有待于进一步研究。
3.2 Forskolin调控猪皮下脂肪前体细胞分化聚酯和CRTC3等基因表达Forskolin是一种腺苷酸环化酶的激活剂,可以提高cAMP水平,进而调控cAMP-PKA信号通路。通过PKA和细胞外信号调节激酶(ERK)信号通路协同增加胆囊收缩素(CCK)基因转录,激活CREB促使其磷酸化,促进CRTC3的进核[21]。我们前期的研究结果表明,CRTC3的亚细胞定位与糖脂代谢和脂肪沉积密切相关[2, 13, 22]。CREB可通过不同的识别位点激活启动子,并响应cAMP和血清介导细胞色素c转录,从而影响细胞线粒体的呼吸作用,进而促进脂质代谢[18]。本试验中,在猪皮下脂肪前体细胞诱导分化的过程中加入forskolin,油红O染色发现forskolin处理显著抑制了脂滴的形成,CREB的mRNA表达水平显著升高。有研究发现,CREB通过抑制PPARγ和诱导PGC-1α协调空腹时肝脏脂质和葡萄糖代谢的能力,促进葡萄糖异生和脂肪酸氧化,从而促进糖脂的代谢,降低脂肪的沉积[23]。与该报道一致,本试验中,forskolin处理后猪皮下脂肪前体细胞中UCP2等线粒体相关基因的mRNA表达水平显著或极显著升高,而CRTC3和脂肪沉积相关基因的mRNA和蛋白表达水平极显著下降。这些结果表明,CRTC3在猪脂质代谢和脂肪沉积中发挥重要的调控作用。但是,关于CRTC3是如何调控猪脂质代谢和脂肪沉积的还有待于进一步研究。
4 结论CRTC3的mRNA和蛋白表达水平在地方品种猪莱芜猪的肌肉和脂肪组织中显著高于外来杂交品种猪杜长大猪;诱导猪皮下脂肪前体细胞分化可以促进CRTC3基因的表达,而forskolin处理能抑制猪皮下脂肪前体细胞分化聚酯和降低CRTC3等基因表达。这些结果表明,猪CRTC3可能在参与了脂质代谢的调控过程,并且在猪的脂质代谢和脂肪沉积过程中发挥重要的作用。
| [1] |
SONG Y, ALTAREJOS J, GOODARZI M O, et al. CRTC3 links catecholamine signalling to energy balance[J]. Nature, 2010, 468(7326): 933-939. DOI:10.1038/nature09564 |
| [2] |
LIU J Q, XU Z Y, WU W C, et al. Regulation role of CRTC3 in skeletal muscle and adipose tissue[J]. Journal of Cellular Physiology, 2018, 233(2): 818-821. DOI:10.1002/jcp.25917 |
| [3] |
LEE S H, HUR M H, LEE E A, et al. Genomic characterization of the porcine CRTC3 and the effects of a non-synonymous mutation p.V515F on lean meat production and belly fat[J]. Meat Science, 2018, 137: 211-215. DOI:10.1016/j.meatsci.2017.11.019 |
| [4] |
LIU J Q, YOU W J, XU Z Y, et al. Rapid communication:porcine CRTC3 gene clone, expression pattern, and its regulatory role in intestinal epithelial cells[J]. Journal of Animal Science, 2018, 96(7): 2622-2628. DOI:10.1093/jas/sky205 |
| [5] |
LEE J E, SCHMIDT H, LAI B, et al. Transcriptional and epigenomic regulation of adipogenesis[J]. Molecular and Cellular Biology, 2019, 39(11): e00601-18. |
| [6] |
PARRAGA A, BELLSOLELL L, FERRÉ-D'AMARÉ A R, et al. Co-crystal structure of sterol regulatory element binding protein 1a at 2.3 åresolution[J]. Structure, 1998, 6(5): 661-672. DOI:10.1016/S0969-2126(98)00067-7 |
| [7] |
MENÉNDEZ-HURTADO A, VEGA-NÚÑEZ E, SANTOS A, et al. Regulation by thyroid hormone and retinoic acid of the CCAAT/enhancer binding protein α and β genes during liver development[J]. Biochemical and Biophysical Research Communications, 1997, 234(3): 605-610. DOI:10.1006/bbrc.1997.6635 |
| [8] |
BERGER J, MOLLER D E. The mechanisms of action of PPARs[J]. Annual Review of Medicine, 2002, 53: 409-435. DOI:10.1146/annurev.med.53.082901.104018 |
| [9] |
徐秋良, 张庆莉, 陈玉林. 绵羊脂肪细胞型脂肪酸结合蛋白基因(FABP4)cDNA的克隆、表达及其结构模拟分析[J]. 农业生物技术学报, 2011, 19(3): 483-489. |
| [10] |
HU E, LIANG P, SPIEGELMAN B M. AdipoQ is a novel adipose-specific gene dysregulated in obesity[J]. Journal of Biological Chemistry, 1996, 271(18): 10697-10703. DOI:10.1074/jbc.271.18.10697 |
| [11] |
李宏睿, 孙文夏, 潘杰. 瘦素功能研究进展[J]. 中国动脉硬化杂志, 2004, 12(1): 108-112. DOI:10.3969/j.issn.1007-3949.2004.01.031 |
| [12] |
LONDOS C, SZTALRYD C, TANSEY J T, et al. Role of PAT proteins in lipid metabolism[J]. Biochimie, 2005, 87(1): 45-49. DOI:10.1016/j.biochi.2004.12.010 |
| [13] |
LIN J, CAO C W, TAO C, et al. Cold adaptation in pigs depends on UCP3 in beige adipocytes[J]. Journal of Molecular Cell Biology, 2017, 9(5): 364-375. DOI:10.1093/jmcb/mjx018 |
| [14] |
ZHENG Q T, LIN J, HUANG J J, et al. Reconstitution of UCP1 using CRISPR/Cas9 in the white adipose tissue of pigs decreases fat deposition and improves thermogenic capacity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(45): E9474-E9482. DOI:10.1073/pnas.1707853114 |
| [15] |
RICQUIER D, BOUILLAUD F. The uncoupling protein homologues:UCP1, UCP2, UCP3, StUCP and AtUCP[J]. Biochemical Journal, 2000, 345(2): 161-179. DOI:10.1042/bj3450161 |
| [16] |
姚旋, 张颖, 单仕芳, 等. 褐色脂肪组织研究的最新进展和科学意义[J]. 中国细胞生物学学报, 2011, 33(3): 227-236. |
| [17] |
SEAMON K B, DALY J W. Forskolin:a unique diterpene activator of cyclic AMP-generating systems[J]. Journal of Cyclic Nucleotide Research, 1981, 7(4): 201-224. |
| [18] |
VERCAUTEREN K, PASKO R A, GLEYZER N, et al. PGC-1-related coactivator:immediate early expression and characterization of a CREB/NRF-1 binding domain associated with cytochrome c promoter occupancy and respiratory growth[J]. Molecular and Cellular Biology, 2006, 26(20): 7409-7419. DOI:10.1128/MCB.00585-06 |
| [19] |
郭晓强, 王晓红, 边巍. PRDM16和棕色脂肪细胞分化[J]. 生命的化学, 2009, 29(0): 29-32. |
| [20] |
WU Z D, HUANG X M, FENG Y J, et al. Transducer of regulated CREB-binding proteins (TORCs) induce PGC-1α transcription and mitochondrial biogenesis in muscle cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(39): 14379-14384. DOI:10.1073/pnas.0606714103 |
| [21] |
罗献梅, 陈代文. 棕色脂肪组织的生理功能及影响因素[J]. 饲料工业, 2007, 28(19): 22-26. DOI:10.3969/j.issn.1001-991X.2007.19.007 |
| [22] |
SHAN T Z, XIONG Y, ZHANG P P, et al. Lkb1 controls brown adipose tissue growth and thermogenesis by regulating the intracellular localization of CRTC3[J]. Nature Communications, 2016, 7: 12205. DOI:10.1038/ncomms12205 |
| [23] |
HERZIG S, HEDRICK S, MORANTTE I, et al. CREB controls hepatic lipid metabolism through nuclear hormone receptor PPAR-γ[J]. Nature, 2003, 426(6963): 190-193. DOI:10.1038/nature02110 |




