2. 石河子大学动物科技学院, 石河子 832000
2. College of Animal Science and Technology, Shihezi University, Shihezi 832000, China
腹泻是动物常见的一类疾病,对幼龄动物的生长发育和后期生产性能有较大影响。该病通常由病毒、细菌、寄生虫等感染肠道引起,表现出食欲不振、排便行为异常、精神萎靡、体温升高等症状。治疗腹泻的常规药剂是抗生素,其疗效最明显,见效最快,但由于长期、大量、不规范用药,抗生素暴露出越来越多的问题,如抗生素残留、环境污染和耐药性等[1]。
为了解决病原物的耐药性,对抗生素替代品的研究日渐被人们所重视,其中抗菌肽物质已成为研究热点。已有研究发现鳞翅目、膜翅目、双翅目等昆虫体内普遍存在抗菌肽,尤其是蝇蛆,凭借自身强大的免疫功能,可以长期生活在病原物大量滋生的环境中,体内常因病原物的差异获得不同抗菌肽,可作为替代抗生素类物质进行动物疾病治疗机制与应用的研究。周钢等[2]通过灭活沙门氏菌诱导蝇蛆,提高了其体内抗菌肽的表达量,而且该抗菌肽的抗菌性能较强;高磊等[3]研究表明蝇蛆抗菌肽粗提物对铜绿假单胞菌毒力因子绿脓菌素(PCN)具有显著的抑制作用;刘玉等[4]利用白痢鸡粪培养蝇蛆抗菌肽治疗白痢鸡后,治愈率为43.33%,与抗生素治疗组差异不显著。可见,从蝇蛆体内提取的抗菌肽可以增强动物的免疫力且效果较理想[5]。
除抗菌肽外,蝇蛆体内还含有丰富的蛋白质、脂肪酸、氨基酸、几丁质以及多种维生素、矿物元素和抗菌活性物质[6]。如只提取蝇蛆抗菌肽,大大降低了其利用率。虽然已有部分学者研究了蝇蛆粉和蝇蛆蛋白对凡纳滨对虾[7-13]、中华鳖[14-16]、青鱼[17]等水产养殖动物生长性能和免疫功能的影响,但在哺乳动物上的相关研究却很少。鉴于腹泻对哺乳动物免疫力和消化功能的负面影响,本研究拟在腹泻小鼠日常饲粮中添加蝇蛆粉,通过计数其回肠、盲肠和结肠中大肠杆菌和总菌数量,测定其血液中可以清除机体内氧自由基、保护细胞膜结构和功能完整的抗氧化酶[超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽硫转移酶(GST)]和消化系统中的关键酶[乳酸脱氢酶(LDH)、淀粉酶(AMS)、脂肪酶(LPS)]的活性,明确蝇蛆粉在腹泻小鼠免疫力提高和消化吸收功能恢复中的作用,为进一步开发蝇蛆粉饲料添加剂提供理论依据。
1 材料与方法 1.1 蝇蛆粉的制备将饲养于石河子大学农学院生防实验室的蝇蛆低温处死,用流动水清洗其表面杂物,在35 ℃烘箱中烘干至恒重,磨粉备用。所制备的蝇蛆粉水分、粗蛋白质、粗脂肪、粗灰分、钙、磷含量分别为9.2%、52.6%、13.1%、8.4%、1.2%和1.1%,粗提液抗菌肽浓度为22.23 μg/mL[18]。
1.2 主要试验材料昆明种小鼠和基础饲粮,由石河子大学实验动物中心提供,将基础饲粮(具体组成见表 1)粉碎,分别加入8.0%、5.0%和2.5%的蝇蛆粉制成混合饲粮,将基础饲粮和混合饲粮重新制成颗粒后饲喂,基础饲粮和混合饲粮营养水平见表 2;大肠杆菌标准菌株(ATCC),由石河子大学生命科学学院微生物实验室提供;氯化钠(NaCl),为天津市化学试剂三厂产品。琼脂粉、酵母浸提物和蛋白胨,均为北京奥博星生物技术有限公司产品;SOD、POD、CAT、GST、LDH、AMS、LPS检测试剂盒,均为南京建成生物工程研究所产品。
|
|
表 1 小鼠基础饲粮组成(风干基础) Table 1 Composition of mouse basal diet (air-dry basis) |
|
|
表 2 基础饲粮和混合饲粮营养水平(风干基础) Table 2 Nutrient levels of basal diet and mixed diets (air-dry basis) |
选取体重为(20±2) g的3~4周龄健康雄性昆明种小鼠75只,随机分为5组,每组3个重复,每个重复5只。模型组、8.0%蝇蛆粉组、5.0%蝇蛆粉组、2.5%蝇蛆粉组连续5 d腹腔注射0.02 mL/g的3×108 CFU/mL的大肠杆菌菌悬液建立腹泻模型,空白组小鼠则腹腔注射等剂量的无菌生理盐水,造模期间各组均饲喂基础饲粮。造模成功后进行为期10 d的治疗,治疗期内,8.0%蝇蛆粉组、5.0%蝇蛆粉组、2.5%蝇蛆粉组小鼠分别饲喂2 g蝇蛆粉添加剂量为8.0%、5.0%、2.5%的混合饲粮,模型组和空白组小鼠饲喂2 g基础饲粮,待各组小鼠取食完相应的2 g饲粮后,再自由采食基础饲粮。
1.4 指标测定治疗期结束后,在各组的3个重复中分别选取3只健康状态相近的小鼠,用少量乙醚将其迷晕,采用2 mL的注射器穿透心脏采血,血液置于2 mL的无菌EP管中,立即在4 000 r/min离心10 min,取血清,放于4 ℃的冰箱中,待用相关试剂盒测定血清中SOD、POD、CAT、GST、AMS、LPS、LDH活性。采血结束后,解剖小鼠并取出整个肠道,根据解剖学特征依次截取回肠、盲肠、结肠,用无菌手术刀刮取内容物,并收集每只小鼠的盲肠内容物于无菌的2 mL EP管中,置于-80 ℃冰箱中待测,大肠杆菌、总菌分别采用伊红美蓝培养基、琼脂培养基培养,测定步骤与方法参考周琼等[19]的试验。
1.5 数据统计与分析所有原始数据在Excel 2007中进行整理,试验数据用平均值±标准差表示,采用SPSS 20.0统计软件进行方差分析和多重比较(LSD法),P<0.05为差异显著。
2 结果 2.1 蝇蛆粉对腹泻小鼠肠道大肠杆菌和总菌数量的影响 2.1.1 蝇蛆粉对腹泻小鼠肠道大肠杆菌数量的影响治疗结束后,对空白组、模型组、8.0%蝇蛆粉组、5.0%蝇蛆粉组和2.5%蝇蛆粉组小鼠回肠、盲肠和结肠中的大肠杆菌进行计数,结果(表 3)显示:模型组小鼠回肠、结肠和盲肠中大肠杆菌数量均显著高于其他各组(P<0.05),其盲肠中大肠杆菌数量最高,达到244.4×106 CFU/mL;小鼠回肠、盲肠、结肠中大肠杆菌数量均随着蝇蛆粉添加剂量的增加呈现不同程度的减少;8.0%蝇蛆粉组小鼠回肠、盲肠、结肠中大肠杆菌数量与空白组相比均差异不显著(P>0.05),与模型组和2.5%蝇蛆粉组相比均显著降低(P<0.05),且结肠中大肠杆菌数量比空白组低了17.12×104 CFU/mL。
|
|
表 3 蝇蛆粉对腹泻小鼠肠道大肠杆菌数量的影响 Table 3 Effects of fly maggot powder on intestinal Escherichia coli count of diarrhea mice |
治疗结束后,对空白组、模型组、8.0%蝇蛆粉组、5.0%蝇蛆粉组和2.5%蝇蛆粉组小鼠回肠、盲肠和结肠中的总菌进行计数,结果(表 4)显示:模型组小鼠回肠、盲肠和结肠中总菌数量均最高,盲肠中总菌数量达到575.10×106 CFU/mL,是空白组的8.3倍;随着蝇蛆粉添加剂量的增加,腹泻小鼠回肠、盲肠和结肠中总菌数量均下降;8.0%蝇蛆粉组小鼠回肠、结肠和盲肠中总菌数量与空白组差异不显著(P>0.05),且均显著低于模型组和2.5%蝇蛆粉组(P<0.05)。
|
|
表 4 蝇蛆粉对腹泻小鼠肠道总菌数量的影响 Table 4 Effects of fly maggot powder on intestinal total bacteria count of diarrhea mice |
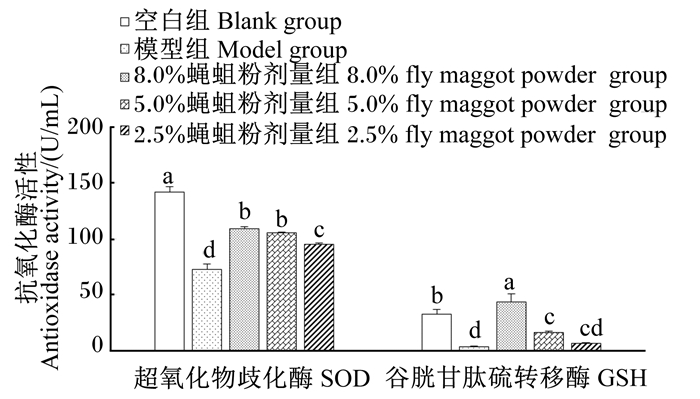
治疗结束后,对空白组、模型组、8.0%蝇蛆粉组、5.0%蝇蛆粉组和2.5%蝇蛆粉组小鼠血清中SOD和GST活性进行测定,结果(图 1)显示:模型组小鼠血清中SOD和GST活性与空白组相比均显著降低(P<0.05);8.0%蝇蛆粉组、5.0%蝇蛆粉组、2.5%蝇蛆粉组小鼠血清中SOD和GST活性均显著高于模型组(P<0.05),且这2种酶的活性均随着饲粮中蝇蛆粉添加剂量的增加而提高,其中8.0%蝇蛆粉组和5.0%蝇蛆粉组之间SOD活性无显著差异(P>0.05),且均显著高于2.5%蝇蛆粉组(P<0.05);8.0%蝇蛆粉组小鼠GST活性显著高于空白组(P<0.05)。
|
数据柱上标不同小写字母表示差异显著(P < 0.05)。下图同。 Data columns with different small letters indicated significant difference (P < 0.05). The same as below. 图 1 蝇蛆粉对腹泻小鼠血清中SOD、GST活性的影响 Fig. 1 Effects of fly maggot powder on serum SOD and GST activities of diarrhea mice |
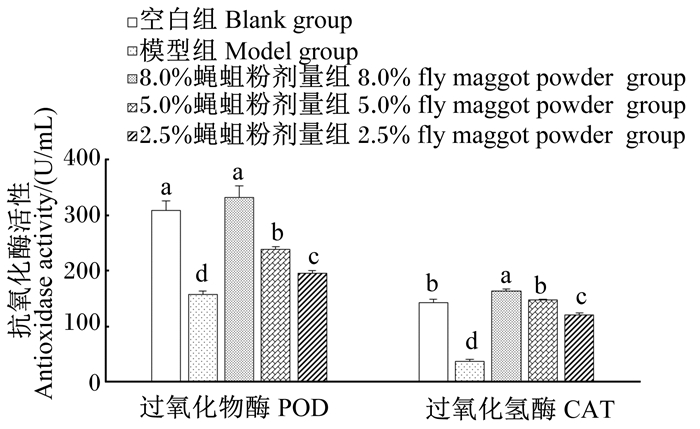
治疗结束后,对空白组、模型组、8.0%蝇蛆粉组、5.0%蝇蛆粉组和2.5%蝇蛆粉组的血清中POD和CAT活性进行测定,结果(图 2)表明:模型组小鼠血清中POD和CAT活性与空白组相比显著降低(P<0.05);8.0%蝇蛆粉组、5%蝇蛆粉组、2.5%蝇蛆粉组小鼠血清中POD和CAT活性均显著高于模型组(P<0.05),且这2种酶的活性均随着饲粮中蝇蛆粉添加剂量的增加而提高,其中8.0%蝇蛆粉组POD活性显著高于5.0%蝇蛆粉组和2.5%蝇蛆粉组(P<0.05),5.0%蝇蛆粉组POD活性显著高于2.5%蝇蛆粉组(P<0.05);8.0%蝇蛆粉组小鼠血清中CAT活性显著高于空白组(P<0.05),5.0%蝇蛆粉组小鼠血清中CAT活性则与空白组差异不显著(P>0.05)。
|
图 2 蝇蛆粉对腹泻小鼠血清中POD、CAT活性的影响 Fig. 2 Effects of fly maggot powder on serum POD and CAT activities of diarrhea mice |
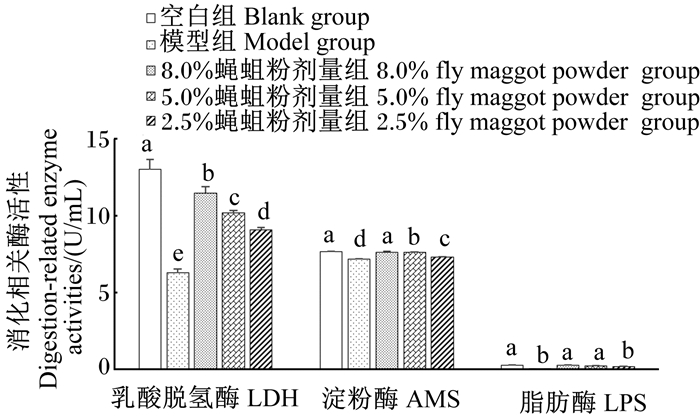
治疗结束后,对空白组、模型组、8.0%蝇蛆粉组、5.0%蝇蛆粉组和2.5%蝇蛆粉组小鼠血清中AMS、LPS和LDH活性进行测定,结果(图 3)显示:模型组小鼠血清中AMS、LPS、LDH活性显著低于空白组(P<0.05);8.0%蝇蛆粉组与5.0%蝇蛆粉组小鼠血清中AMS、LPS、LDH活性以及2.5%蝇蛆粉组小鼠血清中LPS、LDH活性均显著高于模型组(P<0.05),且小鼠血清中这3种酶的活性均随着饲粮中蝇蛆粉添加剂量的增加而提高,其中8.0%蝇蛆粉组、5.0%蝇蛆粉组血清中AMS活性与空白组差异不显著(P>0.05);8.0%蝇蛆粉组小鼠血清中LPS活性与空白组差异不显著(P>0.05),且小鼠血清中LPS活性随着饲粮中蝇蛆粉添加剂量的增加显著提高(P<0.05);8.0%蝇蛆粉组、5.0%蝇蛆粉组和2.5%蝇蛆粉组小鼠血清中LDH活性均显著低于空白组(P<0.05),但小鼠血清中LDH活性随着蝇蛆粉添加剂量增加显著提高(P<0.05)。
|
图 3 蝇蛆粉对腹泻小鼠血清中LDH、AMS、LPS活性的影响 Fig. 3 Effects of fly maggot powder on serum LDH, AMS and LPS activities of diarrhea mice |
病原性腹泻具有传染性,是影响新生和哺乳期动物健康状况的关键病因。大肠杆菌作为引起动物幼崽腹泻的主要病原体之一,主要通过在动物体内大量繁殖,分泌产肠毒素,激活肠道上皮细胞上氯离子通道,致使氯离子外流,导致水样腹泻[20]。另外,脂多糖作为大肠杆菌外膜的主要成分,高剂量时可以穿过肠道黏膜屏障进入血液循环[21],降低血液中SOD、谷胱甘肽过氧化物酶(GSH-Px)活性,增加空肠中丙二醛(MDA)含量,降低机体的抗氧化水平,最终引起全身性炎症。此外,动物腹泻时,极易带来生长发育缓慢、饲料报酬率低、成活率低等问题。申红等[22]研究表明,饲料中添加2%的蝇蛆可以提高白痢鸡血清中总蛋白、白蛋白和球蛋白含量。本研究在预试验也发现蝇蛆粉添加量在一定范围内会对小鼠生长表现出促进作用,为了提高蝇蛆粉利用率,本研究设置8.0%、5.0%和2.5%3个蝇蛆粉添加剂量,研究蝇蛆粉不同添加剂量对腹泻小鼠肠道大肠杆菌数量及血清中抗氧化酶和消化相关酶活性的影响。
动物肠道中菌群失调与炎症性肠道疾病有较大的关系,平衡被打破时,条件致病菌会失去制约而大量繁殖。研究表明,黏附侵袭性大肠埃希菌增加会影响肠道通透性,改变肠道微生物群的多样性和组成,并通过调节炎性基因的表达诱导炎症反应,从而导致肠道炎症发生[23]。活动性克罗恩病患者肠道中黏附侵袭性大肠埃希菌的数量为38%,而健康受试者肠道中黏附侵袭性大肠埃希菌数量仅为6%[24]。炎症的发生会影响正常的肠道功能,如阪崎肠杆菌会引发肠炎而引起腹泻[25]。本研究结果表明,腹泻会引起小鼠肠道中大肠杆菌菌群平衡破坏,回肠、盲肠和结肠中大肠杆菌和总菌数量增加,在小鼠饲粮中添加蝇蛆粉可以降低小鼠肠道中大肠杆菌的数量。
当动物发生病原性腹泻时,体内会产生大量对机体有害的超氧自由基、巯基,而抗氧化酶可以将其转换为毒害较低或无害的物质。SOD和GST是动物体内2种关键的抗氧化酶,其中SOD可以把有害的超氧自由基转化为过氧化氢,再通过CAT和POD作用将其分解为完全无害的水,形成了一个完整的防氧化链条;而GST作为动物体内一种重要的抗氧化剂,可以保护许多蛋白质和酶等分子中的巯基。程逍妹等[26]研究表明,饲粮中添加20%蝇蛆蛋白显著提高了对虾血清SOD、碱性磷酸酶、酸性磷酸酶、酚氧化物酶和溶菌酶的活性。刘黎等[27]研究表明,饲粮中添加4.2%的蝇蛆粉可显著提高青鱼血清中SOD、GSH-Px和CAT活性。张海琪等[28]研究表明,蝇蛆蛋白粉替代饲粮中鱼粉能显著增强试验鳖血清中酸性磷酸酶和碱性磷酸酶活性。本研究结果表明,8.0%蝇蛆粉组、5.0%蝇蛆粉组、2.5%蝇蛆粉组小鼠血清中SOD、POD、CAT和GST活性均显著高于模型组,且随着饲粮中蝇蛆粉添加剂量的增加,小鼠血清中各抗氧化酶活性升高,其中8.0%蝇蛆粉组血清中POD、CAT活性和5.0%蝇蛆粉组血清中CAT活性与空白组差异不显著,且8.0%蝇蛆粉组血清中GST活性显著高于空白组,这表明在小鼠饲粮中添加不同剂量的蝇蛆粉均可以提高腹泻小鼠的抗氧化能力,以添加剂量为8.0%时效果最好。
动物腹泻时,常伴随着食物消化不良、生长发育缓慢等问题,这与其体内参与食物中脂肪水解的LPS活性,多糖化合物降解的AMS活性和糖酵解与糖异生工程中催化乳酸和丙酮酸之间氧化还原反应的LDH活性有较大关系。本试验发现,小鼠发生腹泻时,其血清中LPS、AMS和LDH活性显著降低,饲喂蝇蛆粉含量分别为8.0%、5.0%和2.5%的饲粮后,腹泻小鼠这3种消化相关酶的活性得到有效提高,其中8.0%蝇蛆粉组和5.0%蝇蛆粉组血清中LPS、AMS和LDH活性均显著高于模型组,2.5%蝇蛆粉组血清中LPS和LDH活性也显著高于模型组,这表明蝇蛆粉作为饲料添加剂可以有效改善腹泻小鼠的消化机能,以添加剂量为8.0%和5.0%时效果较好。
4 结论蝇蛆粉作为饲料添加剂可以降低腹泻小鼠肠道中大肠杆菌和总菌的数量,提高腹泻小鼠血清中抗氧化酶和消化相关酶活性,对腹泻小鼠的消化机能和抗氧化功能均有一定程度的提高,以添加剂量为8.0%时效果最好。
| [1] |
SPELLBERG B, BARTLETT J G, GILBERT D N. The future of antibiotics and resistance[J]. The New England Journal of Medicine, 2013, 368(4): 299-302. DOI:10.1056/NEJMp1215093 |
| [2] |
周钢, 申红, 王俊刚, 等. 蝇蛆抗菌肽的诱导及其抗菌性能研究[J]. 中国畜牧兽医, 2013, 40(7): 120-123. DOI:10.3969/j.issn.1671-7236.2013.07.029 |
| [3] |
高磊, 王军, 张琨, 等. 蝇蛆抗菌肽粗提物对铜绿假单胞菌毒力因子绿脓菌素(PCN)合成的影响[J]. 陕西农业科学, 2017, 63(4): 50-52, 57. DOI:10.3969/j.issn.0488-5368.2017.04.015 |
| [4] |
刘玉, 赞哈尔, 何晓辉, 等. 白痢鸡粪培养蝇蛆抗菌肽对白痢沙门菌感染雏鸡的疗效观察[J]. 西北农林科技大学学报(自然科学版), 2015, 43(7): 24-28. |
| [5] |
CHERNYSH S I, GORDJA N A. The immune system of maggots of the blow fly (Calliphora vicina) as a source of medicinal drugs[J]. Journal of Evolutionary Biochemistry and Physiology, 2011, 47(6): 524-533. DOI:10.1134/S0022093011060032 |
| [6] |
HARRIS D L G, BEXFIELD A, NIGAM Y, et al. Disruption of Staphylococcus epidermidis biofilms by medicinal maggot Lucilia sericata excretions/secretions[J]. The International Journal of Artificial Organs, 2009, 32(9): 555-564. DOI:10.1177/039139880903200904 |
| [7] |
曹俊明, 严晶, 王国霞, 等. 家蝇蛆粉替代鱼粉对凡纳滨对虾消化酶、转氨酶活性和肝胰腺组织结构的影响[J]. 南方水产科学, 2012, 8(5): 72-79. DOI:10.3969/j.issn.2095-0780.2012.05.011 |
| [8] |
李志杰, 赵述建, 李贵生. 蝇蛆蛋白粉对凡纳滨对虾生长的影响[J]. 生态科学, 2012, 31(4): 418-423. DOI:10.3969/j.issn.1008-8873.2012.04.013 |
| [9] |
王娓, 冯江, 王振堂, 等. 对虾暴发性流行病的群体感染及投饲蝇幼的抗病机制研究[J]. 应用生态学报, 2002, 13(6): 728-730. DOI:10.3321/j.issn:1001-9332.2002.06.020 |
| [10] |
陈冰, 曹俊明, 陈平洁, 等. 家蝇抗菌肽对凡纳滨对虾生长性能及免疫相关指标的影响[J]. 中国水产科学, 2010, 17(2): 258-266. |
| [11] |
曹俊明, 严晶, 黄燕华, 等. 家蝇蛆粉替代鱼粉对凡纳滨对虾生长、抗氧化和免疫指标的影响[J]. 水产学报, 2012, 36(4): 529-537. |
| [12] |
严晶, 曹俊明, 王国霞, 等. 家蝇蛆粉替代鱼粉对凡纳滨对虾肌肉营养成分、氨基酸和肌苷酸含量的影响[J]. 中国水产科学, 2012, 19(2): 265-274. |
| [13] |
邓田方, 吴玉刚, 刘慧玲. 蝇蛆粉替代鱼粉对凡纳滨对虾生长的影响[J]. 渔业现代化, 2012, 39(1): 46-50. DOI:10.3969/j.issn.1007-9580.2012.01.009 |
| [14] |
程逍妹, 黄启成, 王方海, 等. 蝇蛆蛋白对中华鳖生长性能及营养品质的影响[J]. 水产科学, 2018, 37(1): 51-58. |
| [15] |
何中央, 周凡, 张海琪, 等. 蝇蛆蛋白粉在中华鳖日本品系饲料中应用效果初探[J]. 中国饲料, 2013(3): 30-32, 40. DOI:10.3969/j.issn.1004-3314.2013.03.010 |
| [16] |
程逍妹, 黄启成, 王方海, 等. 蝇蛆蛋白对中华鳖血清生化指标及非特异性免疫功能的影响[J]. 水产科学, 2017, 36(6): 768-772. |
| [17] |
明建华, 叶金云, 张易祥, 等. 蝇蛆粉和L-肉碱对青鱼生长、免疫与抗氧化指标及抗病力的影响[J]. 中国粮油学报, 2013, 28(2): 80-86. DOI:10.3969/j.issn.1003-0174.2013.02.018 |
| [18] |
黄春凤, 申红, 夏欢, 等. 蝇蛆抗菌肽对小鼠金黄色葡萄球菌性乳腺炎治疗效果的研究[J]. 石河子大学学报:自然科学版, 2018, 36(5): 631-636. |
| [19] |
周琼, 吴珍泉, 李忠荣, 等. 美洲大蠊粉对腹泻小鼠肠道修复的影响[J]. 福建农业学报, 2008, 23(2): 125-131. DOI:10.3969/j.issn.1008-0384.2008.02.002 |
| [20] |
DUBREUIL J D, ISAACSON R E, SCHIFFERLI D M. Animal enterotoxigenic Escherichia coli[J]. EcoSal Plus, 2016, 7(1): 1-47. |
| [21] |
ZHU H L, PI D G, LENG W B, et al. Asparagine preserves intestinal barrier function from LPS-induced injury and regulates CRF/CRFR signaling pathway[J]. Innate Immunity, 2017, 23(6): 546-556. DOI:10.1177/1753425917721631 |
| [22] |
申红, 王俊刚, 秦文彬, 等. 饲喂蝇蛆抗菌肽对白痢鸡血液生化指标的影响[J]. 石河子大学学报(自然科学版), 2011, 29(5): 566-569. DOI:10.3969/j.issn.1007-7383.2011.05.008 |
| [23] |
AHMED I, ROY B C, KHAN S A, et al. Microbiome, metabolome and inflammatory bowel disease[J]. Microorganisms, 2016, 4(2): 20. DOI:10.3390/microorganisms4020020 |
| [24] |
MARTINEZ-MEDINA M, ALDEGUER X, LOPEZ-SILES M, et al. Molecular diversity of Escherichia coli.in the human gut:new ecological evidence supporting the role of adherent-invasive E.coli (AIEC) in Crohn's disease[J]. Inflammatory Bowel Diseases, 2009, 15(6): 872-882. DOI:10.1002/ibd.20860 |
| [25] |
裴晓燕, 刘秀梅. 阪崎肠杆菌的生物学性状与健康危害[J]. 中国食品卫生杂志, 2004, 16(6): 550-555. DOI:10.3969/j.issn.1004-8456.2004.06.023 |
| [26] |
程逍妹, 陈子廷, 颜志波, 等. 蝇蛆蛋白对凡纳滨对虾生长、免疫及肌肉成分的影响[J]. 水产科学, 2018, 37(3): 324-329. |
| [27] |
刘黎, 叶金云, 吴成龙, 等. 饲料中添加蝇蛆粉对青鱼非特异性免疫和抗氧化性能的影响[J]. 浙江海洋学院学报(自然科学版), 2013, 32(2): 103-108, 118. DOI:10.3969/j.issn.1008-830X.2013.02.003 |
| [28] |
张海琪, 周凡, 王卫平, 等. 蝇蛆蛋白粉替代鱼粉对中华鳖日本品系生长、肌肉品质、免疫及抗氧化指标的影响[J]. 浙江农业学报, 2013, 25(2): 225-229. DOI:10.3969/j.issn.1004-1524.2013.02.04 |




