2. 周口市动物卫生监督所, 周口 466000
2. Zhoukou Animal Health Supervision, Zhoukou 466000, China
肠道损伤模型的成功建立是研究动物肠道损伤修复的基础。动物出现腹泻、消化吸收能力下降、免疫能力下降等情况都可能与动物的肠道损伤有关,而动物肠道在生长阶段也会因为不同的生存环境而出现不同程度和不同方面的损伤,因此,建立不同的肠道损伤模型有利于更深层次地研究动物肠道损伤及修复的机制,进而可以起到防治的作用。建立肠道损伤模型的方法有多种,不同的模型所表现的病理特征不尽相同。除病原体诱导肠炎腹泻致肠道损伤外,常见的化学诱导肠道损伤模型的方法有脂多糖(LPS)诱导、肠道缺血再灌注和乙醇刺激等。肠道缺血再灌注法对动物的肾脏、肠脏和肝脏损伤都有重要影响,通常会引发局部或全身严重的炎症反应,加剧缺血损伤,还会引起血管渗漏,并引发组织白细胞滞留和氧化应激[1-2]。LPS诱导法是在动物营养研究中常见的一种模型构建方法,健康动物体内LPS含量较低,并不会引发炎症应激反应,但当LPS含量升高时会破坏肠道屏障功能和形态,增加肠道的通透性,还会对肝脏产生不良影响[3-4]。乙醇刺激法主要是损伤肝脏,破坏肝脏和肠道联系,进而破坏肠道菌群的平衡,导致肠道革兰氏阴性菌的增长,增加肠道通透性,与肠道炎症氧化应激有关[5]。
近年来利用阿司匹林在人类药物研究中构建肠道模型开展了一些研究工作。阿司匹林又称乙酰水杨酸,具有解热镇痛的作用,在临床应用中发现还具有抗血栓、抗炎、预防肿瘤等新功效[6]。口服阿司匹林可能会出现胃肠道出血、小肠黏膜损伤、胃溃疡等不良症状[7-8]。由于阿司匹林的损伤部位主要是在动物的胃和十二指肠以及后端肠道部位,影响动物的肠道黏膜、肠道结构形态以及机体免疫功能,而阿司匹林在体内最后集聚在小肠部位,不会对机体的其他部位造成持续性损伤,用阿司匹林建立肠道损伤模型可以更加有效地研究损伤机制,因此阿司匹林可以用于建立肠道损伤模型[9]。国外在阿司匹林的研究层次多为探索阿司匹林损伤胃肠道的机制和抑制并治疗的方法,但目前国内采用阿司匹林建立肠道损伤模型的研究较少,并且主要是用于评价人类药物的疗效与副作用等方面的研究,很少有关于阿司匹林的损伤机制及其在动物营养方面应用的研究,并且利用其建立肠道损伤模型的剂量以及作用时间都不确定。本试验拟用阿司匹林构建大鼠肠道损伤模型,为动物营养研究中动物肠道损伤、修复以及动物营养保健等方面的研究提供参考。
1 材料与方法 1.1 试验材料试验用SD大鼠从河南省试验动物中心购买,实验动物生产许可证号为SCXK(豫)2017-0001;大鼠饲粮购自河南省实验动物中心,类型为生长常规饲料,许可证号为SCXK(豫)2015-0005;阿司匹林购自河南丰牧生物科技有限公司,纯度为98%。
大鼠分泌性免疫球蛋白A(sIgA)酶联免疫吸附测定(ELISA)试剂盒(JYM0312Ra)、白细胞介素-2(IL-2)ELISA试剂盒(JYM0648Ra)、大鼠溶菌酶(LZM)ELISA试剂盒(JYM0877Ra)为武汉基因美科技有限公司产品,苏木素(H8070)、伊红染色液(G1100)、碱性品红(G8350)为北京索莱宝科技有限公司产品。
切片机(YD-202A),金华市益迪医疗设备有限公司产品;高速离心机(2018113100),上海卢湘仪离心机仪器有限公司产品;正置倒置一体荧光显微镜(RVL-100-G),美国Echo公司产品;酶标仪(1711012817),帝肯奥地利有限责任公司产品。
1.2 动物分组和饲养18只6周龄无特定病原体(SPF)级雄性SD大鼠,体重为150~180 g,经过7 d的适应性饲养后,随机分为3组,每组6只,单笼饲喂。模型1组灌胃50 mg/kg阿司匹林、模型2组灌胃200 mg/kg阿司匹林,正常对照组灌胃等量生理盐水,灌胃持续14 d。饲养过程中大鼠自由采食和饮水,每天更换饮水,每2 d更换1次垫料。
1.3 检测指标 1.3.1 体增重、肝脏指数和脾脏指数的计算大鼠在试验开始时称重并记录初始体重,结束前1天进行断料不断水处理,称重并记录终末体重,解剖取肝脏和脾脏并称重,计算大鼠整个试验期间的体增重、肝脏指数和脾脏指数。

|
大鼠进行摘眼球取血,室温自然凝固,在2 000~3 000 r/min下离心20 min后收集上清液即为血清,测定血清LZM活性、IL-2含量,具体操作方法严格按照LZM、IL-2 ELISA试剂盒说明书进行。
1.3.3 肠道绒毛形态及绒毛高度(VH)和隐窝深度(CD)的测量大鼠解剖后选取空肠中段5 cm保存于10%福尔马林中,经过石蜡包埋、苏木精-伊红(HE)染色后,用显微镜观察肠道绒毛形态,测量VH和CD,并对二者的比值(VH/CD)进行计算[10]。
1.3.4 肠道黏液量的测定选取肠道距幽门10 cm处取5 cm进行匀浆,加入1 mL的磷酸盐缓冲溶液(PBS),成悬浮状。在4 ℃时,以15 000 r/min离心15 min。在高碘酸(0.1%,100 μL)中37 ℃下孵育2 h,加入100 μL希夫试剂,室温下孵育30 min后在555 nm的波长下测量吸光度(OD)值[11],以OD值表示黏液量。
1.3.5 肠道黏膜sIgA含量的测定截取5 cm靠近十二指肠的空肠组织,在纱布上剪开铺平,用玻璃片刮取肠道黏膜置于离心管中,存放于-80 ℃,采用ELISA法检测肠道黏膜sIgA含量[12],按照sIgA ELISA试剂盒说明书进行操作。
1.4 统计分析试验数据采用SAS 9.1统计软件来进行单因素方差分析,以P<0.05作为差异显著性标准。结果以平均值±标准差表示。
2 结果 2.1 体增重、脾脏指数和肝脏指数由表 1可知,试验结束时模型1组和模型2组的体增重均显著低于空白对照组(P<0.05),随着阿司匹林灌胃剂量的增加,体增重降低,模型1组和模型2组的体增重分别较空白对照组降低了5.29%和12.82%;模型1组和模型2组的脾脏指数与空白对照组相比均有一定程度的降低,与体增重降低趋势不同的是,模型1组降低了17.39%,而模型2组降低了13.04%,但各组间并没有显著差异(P>0.05);模型1组的肝脏指数与空白对照组相比下降了1.41%,但差异显著(P>0.05),而模型2组的肝脏指数与空白对照组相比下降了12.94%,差异显著(P<0.05)。
|
|
表 1 体增重、脾脏指数和肝脏指数的测定结果 Table 1 Determination results of BWG, spleen index and liver index |
由表 2可知,模型1组和模型2组的血清IL-2含量均显著低于空白对照组(P<0.05),分别较空白对照组减少了9.29%和21.76%,并且模型1组与模型2组之间也存在显著差异(P<0.05);模型2组的血清LZM活性显著低于空白对照组(P<0.05),与空白对照组相比降低了28.60%,模型1组的血清LZM活性虽然较空白对照组下降了15.21%,但差异未达显著水平(P>0.05)。
|
|
表 2 血清IL-2含量和LZM活性的测定结果 Table 2 Determination results of serum IL-2 content and LZM activity |
图 1是大鼠小肠绒毛形态的显微镜照片,从图中可明显观察到空白对照组的肠道形态完整,绒毛结构清晰无紊乱,而模型1组的肠道绒毛形态发生变化,与空白对照组相比绒毛形态不完整,绒毛结构稍紊乱,但与模型2组相比坏死程度较低,模型2组的肠道绒毛形态已经被破坏,绒毛结构紊乱,坏死程度较高。
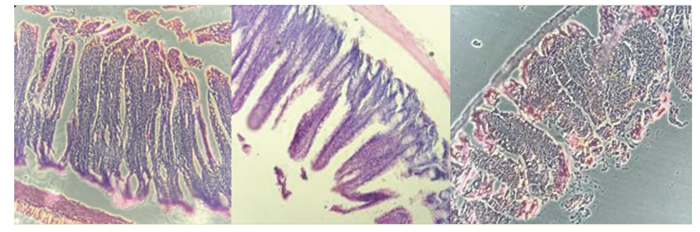
|
从左至右依次为空白对照组、模型1组和模型2组。 From left to right: blank control group, model 1 group and model 2 group. 图 1 肠道绒毛形态 Fig. 1 Intestinal villous morphology (100×) |
由表 3可知,与空白对照组相比,模型1组和模型2组的肠道VH、CD和VH/CD均有不同程度降低。其中,模型2组的VH较空白对照组降低了32.53%,CD降低了21.27%,VH/CD降低了14.40%,差异均达到显著水平(P<0.05);模型1组的VH较空白对照组降低了11.00%,CD降低了8.72%,VH/CD降低了2.83%,虽然模型1组与模型2组的变化规律相同,但是与空白对照组的差异没有达到显著水平(P>0.05)。
|
|
表 3 肠道绒毛高度、隐窝深度以及绒毛高度与隐窝深度比值的测定结果 Table 3 Determination results of intestinal VH, CD and VH/CD |
由表 4可知,虽然模型1组和模型2组的肠道黏液量与空白对照组相比分别降低了13.65%和15.36%,但差异均未达显著水平(P>0.05)。肠道黏膜sIgA含量与肠道黏液量的变化趋势相同,与空白对照组相比,模型1组和模型2组分别降低了12.52%和12.19%,均显著低于空白对照组(P<0.05)。
|
|
表 4 肠道黏液量、肠道黏膜sIgA含量的测定结果 Table 4 Determination results of intestinal mucus volume and intestinal mucosa sIgA content |
肠道损伤模型的建立在研究动物肠道损伤和修复机制方面具有重要的意义。不同的损伤模型其由于其病理特征差异,可用于不同疾病、药物等不同目的的研究,同时也具有不同的优缺点。本研究中建立肠道损伤模型所采用的阿司匹林诱导方法与其他化学诱导方法如LPS诱导、肠道缺血再灌注和乙醇刺激等方法相比,虽然都会造成肠道损伤,但该方法导致的损伤部位主要是胃肠道,破坏肠道黏膜的完整性。采用阿司匹林建立肠道损伤模型主要是用来探讨药物对黏膜损伤的保护作用以及其可能的机制,阿司匹林可以很容易被胃与十二指肠分解,进而导致胃肠道中的水杨酸含量升高,不仅会加重胃和小肠黏膜的损伤,还会导致远端小肠出现损伤情况,增加肠道的通透性,同时阿司匹林也会抑制内源性前列腺素的生产,破坏上皮屏障功能,但阿司匹林会通过肠道血液聚集在小肠,刺激小肠黏膜细胞,所以对动物机体造成的其他损伤较小。徐林芳等[13]采用50 mg/kg的阿司匹林分别灌胃大鼠7和14 d,2个试验组的组织学病理评分和小肠组织一氧化氮(NO)含量均高于空白对照组,但是灌胃7 d的试验组的损伤效果与灌胃14 d的试验组相比较差。杨成等[14]采用150 mg/kg阿司匹林灌胃14 d来造成肠道损伤,与空白对照组相比肠道通透性明显升高,炎症指标髓过氧化物酶表达量升高。因此,本试验采用50和200 mg/kg剂量的阿司匹林来建立肠道损伤模型,并通过大鼠的生长性能、肠道绒毛指标、血清免疫指标、肠道黏膜指标来判断大鼠肠道损伤模型构建是否成功,以确定灌胃阿司匹林的剂量和时间。
动物肠道损伤会直接体现在体重降低,最直接的原因就是肠道绒毛的坏死影响了动物对饲料的消化利用。体增重表明了动物的生长性能,而生长性能可以比较直观反映出动物的生长和营养状态。本试验中的大鼠体增重下降可能是因为阿司匹林进入肠道,增加了肠道的通透性,破坏了绒毛完整性,进而降低了肠道对营养物质的吸收利用。Saitoha等[15]在研究SD大鼠肠道损伤试验中,利用60 mg/kg伊立替康进行损伤,损伤状态下的SD大鼠的体增重低于空白对照组,与空白对照组相比降低了13%左右。完整的肠道形态对于机体的肠道屏障功能和对营养物质的吸收是至关重要的,肠道VH直接关系到肠道的吸收面积,CD反映出肠道绒毛细胞的成熟率,VH/CD主要体现出肠道对营养物质的消化吸收率,本试验中2个模型组肠道VH/CD均较空白对照组下降,肠道绒毛形态的坏死表明阿司匹林破坏了肠道绒毛的完整性,降低了大鼠对营养物质的消化利用率,这一变化与试验期间大鼠体增重变化相对应。这与李红梅等[16]利用LPS诱导大鼠肠道损伤后出现的肠道绒毛变化趋势一致,LPS导致肠道损伤后肠道VH降低了18.91%。同时,还有试验以LPS来致小鼠急性肺损伤和心脏损伤,李波等[17]和白静纯等[18]利用LPS分别诱导心肌细胞损伤和急性肺损伤,这也表明LPS不但会导致动物肠道损伤,还会对机体的心脏和肺脏造成影响,而阿司匹林导致的肠道损伤并不会出现这种情况。本试验中模型2组的大鼠体增重和肠道VH分别降低了23.82%和21.27%,与Saitoha等[15]和李红梅等[16]的肠道损伤结果相似,模型2组大鼠的肠道损伤程度与上述试验程度接近。
动物肠道损伤除肠道绒毛形态发生变化外,一些细胞因子、黏液、免疫蛋白的分泌也会随之发生变化。IL-2与胸腺细胞有关,IL-2主要参与机体的免疫应答和免疫调节,肠道损伤会导致IL-2含量下降;肠道黏液量在黏膜免疫系统中至关重要,而肠道黏膜sIgA是由淋巴细胞分泌产生的,具有抗体活性,可以在动物体内转化为抗体,肠道损伤会破坏黏膜免疫系统,降低动物的免疫力,降低肠道黏膜sIgA的分泌量;LZM可以有效地水解致病菌的黏多糖,进而溶解细菌,肠道损伤同样会影响LZM的活性。在本试验中,模型2组的血清IL-2含量与LZM活性以及肠道黏膜sIgA含量的显著降低均表明阿司匹林可以降低大鼠的免疫力,进而破坏肠道的黏膜屏障。郑荣[19]在建立结肠炎模型试验中,利用灌胃2, 4, 6-三硝基苯磺酸(TNBS)来导致肠道损伤,肠道黏膜sIgA含量下降了33.33%,降低了sIgA对细菌黏附细胞的抑制作用。何建伟等[20]在急性损伤大鼠进行的干预试验中,提出LZM活性量的升高可以降低炎症因子对机体的损伤程度。肝脏指数和脾脏指数也可以直观地反映出机体的解毒功效和免疫能力。肝脏指数和脾脏指数可以体现出肝脏和脾脏的病变情况,而肝脏和脾脏在机体免疫应答中作用巨大,宋俊杰等[21]在肝缺血再灌注损伤模型建立时提出肝脏指数和脾脏指数降低反映出了机体免疫解毒能力的下降。王喜红等[22]在环磷酰胺致小鼠氧化应激试验中,模型组的肝脏指数与空白对照组相比降低了17.33%,脾脏指数降低了31.03%。同样,肠缺血再灌注作为最为常用的肠道损伤模型也存在一些问题,肠缺血再灌注会对机体的肝脏、肺脏和脑都会有影响,这样就会导致不能排除这些组织对试验的影响,本试验所采用的阿司匹林,其影响位置只有胃肠道,不会对肺脏等组织造成损伤,减少了这些因素对试验的影响,可以更好地研究肠道损伤机制。本试验中,与空白对照组相比,2个模型组的肠道黏膜sIgA含量均降低了12%左右,模型2组的肝脏指数和脾脏指数均降低了13%左右,并且血清LZM活性的降低也与其他研究结果的变化趋势一致,表明了本试验所建立的大鼠肠道损伤模型的细胞因子、免疫蛋白以及肝脏指数和脾脏指数的变化也与损伤肠道特征变化相同。
在本试验中,2个模型组大鼠所检测的各个指标均低于空白对照组的正常大鼠,这与肠道损伤特征相一致;并且,模型2组的各个指标均显著低于空对照白组,其中肝脏指数,血清IL-2含量,肠道VH、CD和VH/CD还显著低于模型1组,表明相对模型1组,模型2组建立的肠道损伤模型更成功。
4 结论在本试验研究条件下,采用200 mg/kg的阿司匹林灌胃大鼠14 d降低了体增重和肝脏指数,破坏了肠道绒毛的完整性,降低了肠道VH、CD和VH/CD,并降低了血清IL-2含量、LZM活性以及肠道黏膜sIgA含量,降低了免疫能力,符合动物肠道损伤特征,表明成功建立了大鼠肠道损伤模型。
| [1] |
BARZEGAR M, KAUR G, GAVINS F N E, et al. Potential therapeutic roles of stem cells in ischemia-rePerfusion injury[J]. Stem Cell Research, 2019, 37: 101421. DOI:10.1016/j.scr.2019.101421 |
| [2] |
KANAZAWA H, FUJIMOTO Y, TERATANI T, et al. Bone marrow-derived mesenchymal stem cells ameliorate hepatic ischemia reperfusion injury in a rat model[J]. PLoS One, 2011, 6(4): e19195. DOI:10.1371/journal.pone.0019195 |
| [3] |
吴杰, 邓波, 李孝辉, 等. 丁酸梭菌抑制脂多糖致急性应激大鼠肠道损伤的效果研究[J]. 动物营养学报, 2018, 30(4): 1530-1537. DOI:10.3969/j.issn.1006-267x.2018.04.038 |
| [4] |
KAHLER S, RENNER L, KLUESS J, et al. Effects of deoxynivalenol-feed contamination on circulating LPS in pigs[J]. Innate Immunity, 2019, 25(3): 168-175. DOI:10.1177/1753425919829552 |
| [5] |
AMARAL G P, DOBRACHINSKI F, DE CARVALHO N R, et al. Multiple mechanistic action of Rosmarinus officinalis L. extract against ethanol effects in an acute model of intestinal damage[J]. Biomedicine & Pharmacotherapy, 2018, 98: 454-459. |
| [6] |
谢江蓉. 阿司匹林肠溶片是把双刃剑[J]. 医药临床, 2019(8): 88. |
| [7] |
侯飞, 车宏伟, 张宇佳, 等. 阿司匹林临床应用研究进展[J]. 中国药物评价, 2018, 35(5): 349-352. DOI:10.3969/j.issn.2095-3593.2018.05.010 |
| [8] |
SUYAMA Y, HANDA O, NAITO Y, et al. Mucus reduction promotes acetyl salicylic acid-induced small intestinal mucosal injury in rats[J]. Biochemical and Biophysical Research Communications, 2018, 498(1): 228-233. DOI:10.1016/j.bbrc.2018.02.202 |
| [9] |
MORTENSEN B, MURPHY C, O'GRADY J, et al. Bifidobacterium breve Bif195 protects against small-intestinal damage caused by acetylsalicylic acid in healthy volunteers[J]. Gastroenterology, 2019, 157(3): 637-646. DOI:10.1053/j.gastro.2019.05.008 |
| [10] |
李婷治.肠黏膜损伤小鼠模型全身炎症反应及其致炎通路的研究[D].硕士学位论文.上海: 复旦大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10246-1015426690.htm
|
| [11] |
GARCIA M A S, YANG N, QUINTON P M. Normal mouse intestinal mucus release requires cystic fibrosis transmembrane regulator-dependent bicarbonate secretion[J]. Journal of Clinical Investigation, 2009, 119(11): 3497-3497. DOI:10.1172/JCI38662C1 |
| [12] |
邱杰, 唐合兰, 陈英, 等. 正加速度暴露下大鼠肠黏膜屏障损伤及sIgA水平的变化[J]. 解放军医学杂志, 2016, 41(10): 865-868. DOI:10.11855/j.issn.0577-7402.2016.10.14 |
| [13] |
徐林芳, 安敏, 沈曼茹, 等. 酪酸梭菌对阿司匹林致大鼠小肠黏膜损伤的影响及机制[J]. 山东医药, 2018, 58(24): 37-39. DOI:10.3969/j.issn.1002-266X.2018.24.010 |
| [14] |
杨成, 崔梅花, 梁君, 等. 瑞巴派特对阿司匹林损伤大鼠小肠黏膜通透性的保护作用[J]. 胃肠病学和肝病学杂志, 2017, 26(11): 1258-1262. DOI:10.3969/j.issn.1006-5709.2017.11.016 |
| [15] |
SAITOHA W, TAKADA S, HIRAO J, et al. Plasma citrulline is a sensitive safety biomarker for small intestinal injury in rats[J]. Toxicology Letters, 2018, 295: 416-423. DOI:10.1016/j.toxlet.2018.07.009 |
| [16] |
李红梅, 王一阳, 王华东, 等. 小檗碱和育亨宾对LPS诱导的小鼠肠道损伤和肠上皮细胞增殖抑制的影响[J]. 中国病理生理杂志, 2010, 26(5): 941-946. DOI:10.3969/j.issn.1000-4718.2010.05.022 |
| [17] |
李波, 郑植, 陈芃螈. APPL1减轻LPS诱导的心肌细胞损伤的实验研究[J]. 中国病理生理杂志, 2019, 35(8): 1526-1531. DOI:10.3969/j.issn.1000-4718.2019.08.028 |
| [18] |
白静纯, 姚玉杰, 刘涛, 等. 右美托咪定在LPS致大鼠心脏损伤中的保护作用及其相关机制研究[J]. 畜牧兽医学报, 2019, 50(9): 1920-1925. |
| [19] |
郑荣.三种仿刺参产品对肠道黏膜保护作用的研究[D].硕士学位论文.青岛: 中国海洋大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10423-1015717384.htm
|
| [20] |
何建伟, 刘学谦, 吴朱艳, 等. 远红外陶瓷微珠干预对急性损伤大鼠LZM、MPO、IL-8和IL-10指标影响的研究[J]. 广州大学学报(自然科学版), 2018, 17(5): 28-34. DOI:10.3969/j.issn.1671-4229.2018.05.004 |
| [21] |
宋俊杰, 陈英, 范军朝, 等. 山药多糖对小鼠肝缺血再灌注损伤中的肝脾组织的保护作用[J]. 实用医药杂志, 2018, 35(4): 343-346. |
| [22] |
王喜红, 朱利娟, 易想炼, 等. 桦木酸对环磷酰胺致小鼠肠道氧化损伤的影响[J]. 畜牧兽医学报, 2018, 49(4): 818-824. |




