脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),又称呕吐毒素,主要是由禾谷镰刀菌产生的一种B型单端孢霉稀族毒素[1]。DON及其衍生物15乙酰基脱氧雪腐镰孢菌烯醇(15-acetyldeoxynivaleno,15AC-DON)、3乙酰基脱氧雪腐镰孢菌烯醇(3-acetyldeoxynivaleno,3AC-DON)、脱氧雪腐镰孢菌烯醇-3-葡萄糖苷(deoxynivalenol-3-glucoside,DON-3-G)可致动物机体生长性能毒性、繁殖性能毒性、免疫毒性、细胞毒性以及肠道毒性,从而导致动物呕吐、生长性能降低、流产、死胎、对疾病的抵抗力降低、消化机能障碍[2-4]。玉米蛋白粉是家禽蛋白质饲料,其作为玉米副产物极易遭受DON污染。国内外学者[5-6]通过调研中国以及世界不同区域玉米及其副产物中DON含量,发现玉米和玉米蛋白粉中DON污染严重,检出率为59%~100%,超标率为31.20%~90.91%。研究发现,菌株来源不同,DON产量不同,并且禾谷镰刀菌在以小麦或玉米为培养基,水分为20%、30%,温度为20、25 ℃,培养时间为25、30、42 d,DON产生量均可达到高峰[7-11]。目前,国内外对豆粕霉变品质变化研究较多,有学者发现,豆粕随着霉变程度加深,其品质如粗脂肪、粗纤维、淀粉含量会下降[12-13]。玉米蛋白粉存储在有氧条件下,其品质变化规律、DON的毒素积累规律尚不明确。因此,本研究主要考察有氧条件下,禾谷镰刀菌接种量对玉米蛋白粉品质和DON、15AC-DOC含量变化的影响,明确玉米蛋白粉品质变化规律和DON、15AC-DOC的积累规律,为有氧条件下玉米蛋白粉中DON污染的防控及霉变玉米蛋白粉的利用提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 材料DON产毒菌株:禾谷镰刀菌14-62-1,由四川农业大学植物病理学教研室提供;玉米蛋白粉:购自漯河天嘉生化有限公司。
1.1.2 试剂DON标准对照品、15AC-DON标准对照品(上海源叶公司);甲醇、乙腈(色谱纯,美国Sigma公司);试验用水为纯水系统(美国Milipore公司)制备的18.2 MΩ·cm超纯水;浓硫酸、硼酸、乙醚、氢氧化钠、氢氧化钾、盐酸、无水乙醇等均为分析纯(成都科龙公司)。
1.1.3 仪器Agilent-1200-6430 Triple Quad液相色谱-串联质谱仪(美国Agilent公司);HPLC-e2695型高效液相色谱仪(美国Waters公司);UPLC H-Class型超高效液相色谱仪(美国Waters公司);3913型恒温恒湿培养箱(美国Thermo公司);L-8900型氨基酸自动分析仪(日本日立公司);BUCHIKjelFlex K-360型半自动凯氏定氮仪(瑞士BUCHI公司);A-2000220全自动纤维测定仪(美国Ankom公司);UV-300型紫外分光光度计(美国Thermo公司)。
1.2 试验方法 1.2.1 试验设计采用单因素试验设计,玉米蛋白粉中禾谷镰刀菌接种量设置3个处理,分别为1×105、1×106、1×107个/g,水分含量为22%,三角瓶有氧培养,每个处理20瓶,每个采样时间点采集样品后混合成3个平行样进行相关指标的测定和统计分析。
1.2.2 样品处理将确定为产毒菌的禾谷镰刀菌14-62-1接种于PDA平板上复壮培养5~7 d后,将菌丝接种于绿豆汤液体培养基中,产生分生孢子后,把分生孢子的浓度调整制成1×108个/mL的孢子悬液,并逐级稀释成浓度为1×107、1×106个/mL的孢子悬液,待用。
将原始水分为5.97%的玉米蛋白粉采用强度为10 kGy的60Co-γ射线辐照灭菌,加水制成水分含量为22%的样品,水分调制方法参照蔡静平等[14],根据已测定的玉米蛋白粉样品原始水分含量,计算所需加水量,计算公式如下:
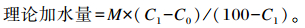
|
式中:M为样品的重量(g);C0为样品的原始水分(%);C1为样品所需要的水分(%)。调制水分后的玉米蛋白粉采用无菌的三角瓶分装,每瓶40 g,用孔径为0.20~0.22 μm、通氧量为1 020 m2/m3的透气膜封口。
各样品分别接种1×106、1×107和1×108个/mL浓度悬液各4 mL(该体积已计入水分含量调制计算),使样品的霉菌数分别为1×105、1×106、1×107个/g,每个接种量每个水分含量样品20瓶,试验总瓶数为60瓶。
1.2.3 指标测定方法将样品按照接种量不同放置于温度为(25±2) ℃,湿度为(75±5)%的控温控湿培养箱中培养,培养期间每天定时混匀样品,分别在培养的第0、5、10、15、20、30、60天的09:00,于无菌台中采样,从20瓶样品中各取5 g混匀,接种量间消毒后再采集,避免不同接种量间交差污染,粉碎后平行测定3个数值。霉菌总数采样后立即测定,其余样品放置于-80 ℃保存,用于营养素及DON含量测定。指标测定的方法见表 1。
|
|
表 1 指标及测定方法 Table 1 Indexes and determination methods |
本试验为单因素试验,其中接种量为质量因子,时间为该质量因子的数量因子,主要考察质量因子随时间变化的结果。数据采用SAS 9.4软件中PROC MIXED程序进行分析:
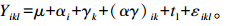
|
式中:Yijkl是因变量;μ是变量的总体平均值;αi是接种量水平(i=1×105、1×106、1×107个/g),γk是培养时间(k=0、5、10、15、20、30、60 d);(αγ)ik是影响因素之间的交互作用;tl是对各样品指标的重复测量;εikl是随机误差。方差分析显著者用Turkey法进行多重比较,P < 0.05作为显著性水平检验标准。
2 结果 2.1 接种禾谷镰刀菌后玉米蛋白粉品质变化规律 2.1.1 营养素变化规律 2.1.1.1 为禾谷镰刀菌提供氮源的营养素变化规律玉米蛋白粉各处理培养期间粗蛋白质和氨基酸含量变化见表 2至表 4。不同禾谷镰刀菌接种量组粗蛋白质和氨基酸含量随着培养时间的延长无显著变化(P>0.05)。必需氨基酸中苯丙氨酸(Phe)、蛋氨酸(Met)、组氨酸(His)、缬氨酸(Val)、亮氨酸(Leu)含量随着培养时间的延长均呈二次曲线变化(P < 0.01)。非必需氨基酸中半胱氨酸(Cys)、丙氨酸(Ala)、甘氨酸(Gly)、谷氨酸(Glu)、丝氨酸(Ser)、脯氨酸(Pro)含量随着培养时间的延长均呈二次曲线变化(P < 0.01)。
|
|
表 2 禾谷镰刀菌接种量对玉米蛋白粉中粗蛋白质含量变化的影响(干物质基础) Table 2 Effects of inoculum of Fusarium graminearum on CP content change in CGM (DM basis) |
|
|
表 3 禾谷镰刀菌接种量对玉米蛋白粉中必需氨基酸含量变化的影响(干物质基础) Table 3 Effects of inoculum of Fusarium graminearum on essential amino acid contents change in CGM (DM basis) |
|
|
表 4 禾谷镰刀菌接种量对玉米蛋白粉中非必需氨基酸含量变化的影响(干物质基础) Table 4 Effects of inoculum of Fusarium graminearum on non-essential amino acid contents in CGM (DM basis) |
玉米蛋白粉各处理培养期间粗脂肪、淀粉、粗纤维含量变化见表 5。禾谷镰刀菌接种量对粗脂肪、淀粉、粗纤维含量变化无显著影响(P>0.05)。粗脂肪、淀粉、粗纤维含量随着培养时间的延长呈线性降低(P < 0.01)。
|
|
表 5 禾谷镰刀菌接种量对玉米蛋白粉中粗脂肪、淀粉、粗纤维含量变化的影响(干物质基础) Table 5 Effects of inoculum of Fusarium graminearum on EE, starch and CF contents in CGM (DM basis) |
玉米蛋白粉各处理培养期间蛋白质溶解度、酸价、能量、霉菌总数变化见表 6和表 7。培养期间禾谷镰刀菌接种量是霉菌总数变化的主要影响因素,对蛋白质溶解度、酸价、能量变化无显著影响(P>0.05)。酸价随着培养时间的延长呈线性上升(P < 0.01),蛋白质溶解度、能量随着培养时间的延长呈线性降低(P < 0.01)。不同禾谷镰刀菌接种量组霉菌总数随着培养时间的延长呈二次曲线变化(P < 0.01)。
|
|
表 6 禾谷镰刀菌接种量对玉米蛋白粉中品质评价指标变化的影响(干物质基础) Table 6 Effects of inoculum of Fusarium graminearum on quality evaluation indexes in CGM (DM basis) |
|
|
表 7 禾谷镰刀菌接种量对玉米蛋白粉中霉菌总数变化的影响(鲜样基础) Table 7 Effects of Fusarium graminearum inoculum on total mold in CGM (FM basis) |
玉米蛋白粉各处理培养期间DON和15AC-DON含量变化见表 8。不同禾谷镰刀菌接种量组DON和15AC-DON含量随着培养时间的延长呈二次曲线变化(P < 0.01),禾谷镰刀菌接种量为1×105~1×107个/g时,玉米蛋白粉中DON和15AC-DON有积累规律,禾谷镰刀菌产DON和15AC-DON前期:0~10 d,DON的含量分别达到3.20、8.67、15.63 mg/kg,15AC-DON的含量分别达到11.51、18.61、53.76 mg/kg;产DON和15AC-DON中期:11~15 d,DON的含量分别达到5.64、38.36、63.72 mg/kg,15AC-DON的含量分别达到11.39、80.11、69.05 mg/kg;产DON和15AC-DON后期:16~60 d,DON的含量分别为6.17、18.27、23.51 mg/kg,15AC-DON的含量分别为13.71、18.82、21.42 mg/kg。产毒量从高到低依次为1×107>1×106>1×105个/g。
|
|
表 8 禾谷镰刀菌接种量对玉米蛋白粉中DON和15AC-DON含量变化的影响(干物质基础) Table 8 Effects of Fusarium graminearum inoculum on DON and 15AC-DON contents in CGM (DM basis) |
玉米蛋白粉培养期间毒素与品质之间的相关性见表 9。结果表明,DON与粗蛋白质、氨基酸含量无相关性,与蛋白质溶解度(r=-0.541,P=0.011,n=3)及粗脂肪(r=-0.574,P=0.007,n=3)、淀粉(r=-0.536,P=0.005,n=3)和粗纤维(r=-0.559,P=0.008,n=3)含量呈显著负相关,与酸价(r=0.594,P=0.004,n=3)、霉菌总数(r= 0.543,P=0.011,n=3)呈显著正相关。15AC-DON与粗蛋白质含量、蛋白质溶解度、氨基酸含量、霉菌总数无相关性,与粗脂肪(r=-0.488,P=0.025,n=3)、淀粉(r=-0.437,P=0.003,n=3)和粗纤维(r=-0.418,P=0.060,n=3)含量呈显著负相关,与酸价呈显著正相关(r=0.464,P=0.034,n=3)。
|
|
表 9 玉米蛋白粉中毒素与品质之间的相关性 Table 9 Correlation between quality and toxins in CGM |
玉米蛋白粉存在有氧存储条件,为了明确有氧存储条件下,禾谷镰刀菌接种量对玉米蛋白粉品质变化规律的影响开展本试验,结果发现,霉菌总数与禾谷镰刀菌接种量存在剂量依赖关系。并且,在有氧存储条件下,粗蛋白质含量无显著变化,与魏金涛等[12]、陈喜斌等[13]、王之盛等[25]研究结果一致。氨基酸中Phe、Leu、Met、His、Val、Ala、Glu、Ser、Ala、Gly含量总体呈下降趋势,说明以上氨基酸作为蛋白氮为禾谷镰刀菌提供了氮源。Cys含量总体呈上升趋势,说明禾谷镰刀菌生长时不消耗此氨基酸,同时产生的微生物菌体蛋白中可能包含此氨基酸。而Lys、Ile、Arg、Thr、Trp、Tyr、Asp含量,在整个培养过程中无变化,说明禾谷镰刀菌生长时未利用以上氨基酸,也未产生相应代谢物。在有氧存储条件下,禾谷镰刀菌接种量对玉米蛋白粉中霉变的影响存在剂量依赖关系,该结果证实了氧气的存在和菌种剂量增加可加速禾谷镰刀菌的生长,降低玉米蛋白粉的品质。
3.2 有氧条件下禾谷镰刀菌接种量对玉米蛋白粉毒素积累规律的影响及毒素积累和霉变的联系本试验发现玉米蛋白粉中,DON和15AC-DON含量在有氧条件下有积累规律,并存在剂量依赖关系,禾谷镰刀菌接种量越高毒素含量越高,说明氧气和禾谷镰刀菌接种量对毒素产生的影响大。通过将玉米蛋白粉中DON和15AC-DON含量与品质指标进行相关性分析,结果发现15AC-DON含量仅与酸价呈正相关,DON含量仅与霉菌总数、蛋白质溶解度和酸价呈正相关。Dyer等[26]、Hohn等[27]研究发现,禾谷镰刀菌在生长过程中会产生一种编码细胞色素P450的加氧酶TRI4,加氧酶TRI4在DON合成过程中具有C-1、C-11、C-13等多功能加氧作用,其基因缺失会导致突变体的致病力下降,无法形成DON,而本试验是在有氧条件下培养的,可能加剧加氧酶TRI4的产生,从而导致DON产量增加。在禾谷镰刀菌侵染玉米蛋白粉的过程中,需要利用玉米蛋白粉中的营养来保证自身的生长。碳源和氮源是影响禾谷镰刀菌生长的关键因素,有研究报道,碳源和氮源能够影响禾谷镰刀菌中DON的合成[28]。Gardiner等[29]研究发现,在禾谷镰刀菌生长过程中,以胺类物质作为氮源能够诱导TRI5基因的表达以及DON的合成。Gardiner等[30]通过基因芯片检测发现禾谷镰刀菌在氮诱导情况下,有很多基因表达受到影响,说明禾谷镰刀菌侵染玉米蛋白粉过程中,氮源能够诱导TRI基因的表达以及DON的合成。玉米蛋白粉霉菌总数升高加剧了样品中酸价的升高,从而导致样品pH偏酸性。pH在DON的合成中起着重要作用,其可通过影响菌体生长过程中铵的代谢来影响禾谷镰刀菌霉变过程中DON的合成。Gardiner等[30]、Prusky等[31]研究发现,氮源和pH能够调控DON的合成和TRI基因的表达,并且酸性条件下能够促进DON的合成和TRI基因的高表达。因此,DON和15AC-DON在禾谷镰刀菌适宜生长条件下有积累规律,受霉变的影响,与霉变程度和霉变性状相关。
综上所述,玉米蛋白粉在霉变期间品质下降,其品质不仅与霉变有关而且与霉菌毒素的含量有关。在玉米蛋白粉防霉和防毒素时,不仅要通过控制原料中水分含量来降低饲料原料霉变,同时饲料原料在储藏时应避免通氧和降低污染菌的量。
4 结论① 在有氧条件下,禾谷镰刀菌接种量对玉米蛋白粉营养素变化无影响,对霉变和毒素积累有影响,培养时间越长,禾谷镰刀菌接种量越高,玉米蛋白粉品质越差。玉米蛋白粉在30 d霉变最严重,DON和15AC-DON出现积累规律。
② 在有氧条件下,霉变程度与DON含量呈正相关,与15AC-DON含量无相关性,DON和15AC-DON含量与玉米蛋白粉品质变化呈负相关。
致谢:
感谢四川农业大学植物病理教研室陈华宝老师提供产毒的禾谷镰刀菌菌株,感谢四川省饲料站程传民老师在毒素测定工作中给予的指导和帮助,感谢江苏奥迈生物科技有限公司对本项目经费的支持。
| [1] |
KOSAWANG C, KARLSSON M, JENSEN D F, et al. Transcriptomic profiling to identify genes involved in Fusarium mycotoxin deoxynivalenol and zearalenone tolerance in the mycoparasitic fungus Clonostachys rosea[J]. BMC Genomics, 2014, 15(1): 55. DOI:10.1186/1471-2164-15-55 |
| [2] |
PRELUSKY D B, GERDES R G, UNDERHILL K L, et al. Effects of low-level dietary deoxynivalenol on haematological and clinical parameters of the pig[J]. Natural Toxins, 2010, 2(3): 97-104. |
| [3] |
AWAD W A, VAHJEN W, ASCHENBACH J R, et al. A diet naturally contaminated with the Fusarium mycotoxin deoxynivalenol (DON) downregulates gene expression of glucose transporters in the intestine of broiler chickens[J]. Livestock Science, 2011, 140(1/2/3): 72-79. |
| [4] |
TIEMANN U, VIERGUTZ T, JONAS L, et al. Influence of the mycotoxins α- and β-zearalenol and deoxynivalenol on the cell cycle of cultured porcine endometrial cells[J]. Reproductive Toxicology, 2003, 17(2): 209-218. DOI:10.1016/S0890-6238(02)00141-7 |
| [5] |
BRYŁA M, KSIENIEWICZ-WO Ź NIAK E, WA Ś KIEWICZ A, et al. Natural occurrence of nivalenol, deoxynivalenol, and deoxynivalenol-3-glucoside in polish winter wheat[J]. Toxins, 2018, 10(2): 81. DOI:10.3390/toxins10020081 |
| [6] |
LI M, SUN M N, HONG X, et al. Survey of deoxynivalenol contamination in agricultural products in the Chinese market using an ELISA Kit[J]. Toxins, 2019, 11: 6. |
| [7] |
武爱波, 李和平, 张静柏, 等. 中国与欧洲禾谷镰刀菌DON毒素HPLC定量比较分析[J]. 应用与环境生物学报, 2007, 13(1): 131-134. DOI:10.3321/j.issn:1006-687X.2007.01.029 |
| [8] |
陆鸣, 王裕中, 陈怀谷, 等. 禾谷镰刀菌产毒素培养条件及粗毒素提取法[J]. 江苏农业学报, 1992, 8(1): 30-34. |
| [9] |
BIRZELE B, PRANGE A, SCHÖNLING J, et al. Development of deoxynivalenol contents in relation to the PCR detection of potentially trichothecene producing Fusarium spp.during storage of wheat[J]. Mycotoxin Research, 2000, 16(Suppl.1): 46-49. |
| [10] |
姜云晶, 许伟, 陈晓芳, 等. 脱氧雪腐镰刀菌烯醇提取、纯化及含量检测[J]. 中国兽医学报, 2017, 37(9): 1771-1777. |
| [11] |
RAMIREZ M L, CHULZE S, MAGAN N. Temperature and water activity effects on growth and temporal deoxynivalenol production by two Argentinean strains of Fusarium graminearum on irradiated wheat grain[J]. International Journal of Food Microbiology, 2006, 106(3): 291-296. |
| [12] |
魏金涛, 张妮娅, 齐德生, 等. 四种常用饲料原料生霉后品质变化规律研究[J]. 中国粮油学报, 2007, 22(5): 119-124. |
| [13] |
陈喜斌, 丁斌鹰, 陈宏. 豆粕霉变过程中品质变化规律的研究[J]. 中国粮油学报, 2003, 18(1): 65-69, 73. DOI:10.3321/j.issn:1003-0174.2003.01.017 |
| [14] |
蔡静平, 魏鑫, 黄淑霞, 等. 温度对小麦安全储藏水分及霉菌活动的影响[J]. 粮食与饲料工业, 2012, 12(5): 18-21. DOI:10.3969/j.issn.1003-6202.2012.05.006 |
| [15] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB 30956—2014饲料中脱氧雪腐镰刀菌烯醇的测定免疫亲和柱净化-高效液相色谱法[S].北京: 中国标准出版社, 2015.
|
| [16] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB 13092—2006饲料中霉菌总数的测定[S].北京: 中国标准出版社, 2006.
|
| [17] |
国家质量技术监督局.GB 18246—2000饲料中氨基酸的测定[S].北京: 中国标准出版社, 2001.
|
| [18] |
国家市场监督管理总局, 国家标准化管理委员会.GB 6432—2018饲料中粗蛋白的测定凯氏定氮法[S].北京: 中国标准出版社, 2018.
|
| [19] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB 6433—2006饲料中粗脂肪的测定[S].北京: 中国标准出版社, 2006.
|
| [20] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB 6434—2006饲料中粗纤维的含量测定过滤法[S].北京: 中国标准出版社, 2006.
|
| [21] |
国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 5009.9—2016食品安全国家标准食品中淀粉的测定[S].北京: 中国标准出版社, 2017.
|
| [22] |
中华人民共和国国家卫生和计划生育委员会.GB 5009.229—2016食品安全国家标准食品中酸价的测定[S].北京: 中国标准出版社, 2017.
|
| [23] |
河北省质量技术监督局.DB13/T 812—2006[S].河北: 中国标准出版社, 2006.
|
| [24] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业出版社, 2007: 82-94.
|
| [25] |
王之盛, 何键, 周安国, 等. 储藏对配合饲料蛋白质营养价值的影响[J]. 四川农业大学学报, 2000, 18(3): 2565259. |
| [26] |
DYER R B, PLATTNER R D, KENDRA D F, et al. Fusariumgraminearum TRI14 is required for high virulence and DON production on wheat but not for DON synthesis in vitro[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9281-9287. DOI:10.1021/jf051441a |
| [27] |
HOHN T M, DESJARDINS A E, MCCORMICK S P. The Tri4 gene of Fusarium sporotrichioides encodes a cytochrome P450 monooxygenase involved in trichothecene biosynthesis[J]. Molecular and General Genetics, 1995, 248(1): 95-102. DOI:10.1007/BF02456618 |
| [28] |
STAJIĆ M, PERSKY L, FRIESEM D, et al. Effect of different carbon and nitrogen sources on laccase and peroxidases production by selected Pleurotus species[J]. Enzyme and Microbial Technology, 2006, 38(1/2): 65-73. |
| [29] |
GARDINER D M, KAZAN K, MANNERS J M. Nutrient profiling reveals potent inducers of trichothecene biosynthesis in Fusarium graminearum[J]. Fungal Genetics and Biology, 2009, 46(8): 604-613. DOI:10.1016/j.fgb.2009.04.004 |
| [30] |
GARDINER D M, OSBORNE S, KAZAN K, et al. Low pH regulates the production of deoxynivalenol by Fusarium graminearum[J]. Microbiology, 2009, 155(9): 3149-3156. DOI:10.1099/mic.0.029546-0 |
| [31] |
PRUSKY D, YAKOBY N. Pathogenic fungi:leading or led by ambient pH[J]. Molecular Plant Pathology, 2010, 4(6): 509-516. |




