肠道上皮不仅是营养物质的主要消化和吸收组织,也是机体和外界环境直接接触的部位,是机体抵抗病原体、毒素和抗原入侵的重要物理屏障[1]。饲养环境以及饲粮中的致病或非致病因素会使机体产生大量的炎性细胞因子[2],后者会激活炎症信号通路,使肠黏膜受损,肠道内的病原穿过肠黏膜进入机体,导致机体出现全身性感染症状,损害机体健康[3]。因此,胃肠道健康对机体的重要性不言而喻。目前,肠道损伤的机理还不甚清楚,近年来研究发现,肠道损伤往往涉及肠黏膜细胞死亡信号。细胞死亡方式有凋亡、自噬[4]、程序性坏死以及焦亡[5]。细胞凋亡、自噬和焦亡都与肠道损伤密切相关[6]。
营养调控肠道健康已是现代营养学研究的热点。研究发现,香菇多糖是一种从香菇菌丝中提取的高分子葡聚糖,主要成分为含有β-(1, 6)分支的β-(1,3)-葡聚糖,还含有少量的甘露糖、岩藻糖、木糖、半乳糖、阿拉伯糖等[7],具有抗肿瘤、抗癌、抗病毒、抗凝血和免疫的作用[8]。香菇多糖已经被全球公认为药物和食品的补充剂[9]。此外,香菇多糖可通过减少炎症细胞因子和炎性细胞浸润来缓解肠道炎症[10]。已有研究表明,断奶仔猪饲粮中添加香菇多糖可提高机体抗氧化能力,改善肠道形态,维持肠道屏障功能,降低肠道通透性及缓解仔猪腹泻[11-12]。在多糖对细胞凋亡、自噬的研究中,灵芝多糖可通过恢复丝裂原活化蛋白激酶(MAPK)和腺苷酸激活蛋白激酶(AMPK)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路以及线粒体功能的恢复,防止棕榈酸引起的猪肠道上皮细胞的凋亡和自噬[13]。对于上皮细胞损伤及死亡,已有文献表明脂多糖(LPS)可引起上皮细胞死亡基因半胱天冬酶(Caspase)-3和Caspase-8 mRNA的表达[14]。目前,香菇多糖对肠道损伤保护作用的机理研究较少。因此,本试验旨在用LPS刺激来建立炎症损伤模型,研究香菇多糖对断奶仔猪肠道损伤的保护作用。
1 材料与方法 1.1 试验设计选取24头健康的28日龄“杜×长×大”三元杂交断奶仔猪,平均体重为(8.12±0.19) kg,按照体重、窝别随机分为4组,每组6个重复,每个重复1头仔猪。试验采用2×2因子设计,主因子包括:饲粮处理(基础饲粮或基础饲粮中添加0.02%的香菇多糖)和免疫应激处理(注射生理盐水或LPS)。香菇多糖纯度为50%,由陕西森弗天然制品有限公司提供。LPS,大肠杆菌血清型O55 : B5,美国Sigma公司提供。试验期为28 d。基础饲粮参照NRC(2012)仔猪营养需要量配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
在试验第28天,免疫应激组仔猪腹膜注射LPS(100 μg/kg体重),其余组注射等量生理盐水,4 h后屠宰,取空肠中段样品,生理盐水冲洗,剪取2 cm组织置于4%多聚甲醛固定,用于肠黏膜形态学的观察。另取空肠中段10 cm,排净食糜,生理盐水清洗,刮取肠黏膜置于液氮中冻存,随后转移至-80 ℃冰箱保存。
1.3 检测指标 1.3.1 肠黏膜形态学观察将固定的空肠组织常规石蜡包埋、切片和苏木精-伊红(HE)染色,显微镜下观察肠黏膜形态学变化。具体方法参照陈逢[15]。
1.3.2 mRNA表达分析mRNA的表达量采用实时荧光定量PCR(real-time PCR)法测定,具体方法参照陈逢[15]。根据NCBI数据库所提供的猪的基因组序列为模板,利用Primer Premier 6.0软件设计引物,引物由武汉擎科生物技术有限公司合成,引物序列详见表 2。以3-磷酸甘油醛脱氢酶(GAPDH)为内参基因,目的基因[受体互作蛋白激酶1(RIP1)、受体互作蛋白激酶3(RIP3)、混合系列蛋白激酶结构域样蛋白(MLKL)、Fas死亡结构域相关蛋白(FADD)、磷酸甘油酸变位酶5(PGAM5)、凋亡相关点状蛋白(ASC)、核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)、消皮素D(GSDMD)、白细胞介素-18(IL-18)、自噬相关基因12(Atg12)、自噬相关基因16-L1(Atg16L1)、微管相关蛋白1轻链3(LC3)、Unc-51样激酶1(ULK1)、mTOR、多聚泛素结合蛋白p62(SQSTM1)、B淋巴细胞瘤-2相关X蛋白(Bax)、原癌基因蛋白xl(Bcl-xl)、自杀相关因子配体(Fasl)、动力相关蛋白1(Drp1)、Caspase-1、Caspase-3、Caspase-8、Caspase-9]的mRNA表达量采用2-ΔΔCT法[16]计算。
|
|
表 2 基因引物序列 Table 2 Primer sequences of genes |
试验结果采用SPSS 17.0统计软件进行双因素方差分析。模型主效应包括饲粮处理、免疫应激处理以及二者的互作效应。有互作效应时,采用Duncan氏法进行多重比较。P < 0.05表示具有显著性差异,0.05≤P < 0.10表示具有显著性趋势。
2 结果与分析 2.1 饲粮添加香菇多糖对LPS刺激仔猪空肠黏膜形态的影响由图 1可知,对照组和香菇多糖组空肠绒毛形态完整。LPS刺激可导致肠绒毛萎缩,肠上皮脱落(图 1-C),肠黏膜固有层出血。饲粮添加香菇多糖可缓解LPS刺激所导致的肠道损伤,表现为肠黏膜上皮轻度脱落,黏膜固有层少量出血(图 1-D)。
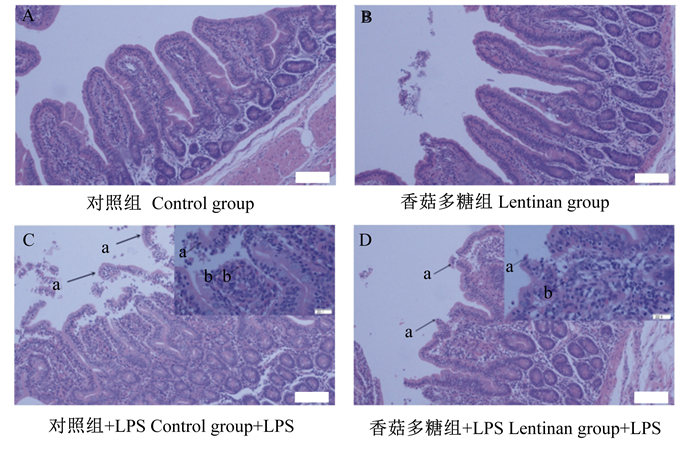
|
C、D图右上图为400×。箭头a表示肠上皮脱落,箭头b表示肠黏膜固有层出血。 The top right pictures of C and D were 400×. Arrow a indicated exfoliation of intestinal epithelium, arrow b indicated hemorrhage of lamina propria in intestinal mucosa. 图 1 饲粮添加香菇多糖对LPS刺激仔猪空肠黏膜形态的影响 Fig. 1 Effects of dietary lentinan supplementation on jejunum mucosa morphology of piglets challenged with LPS (100×) |
由表 3可知,LPS刺激显著提高了RIP3 mRNA的相对表达量(P < 0.05),显著降低了Drp1和MLKL mRNA的相对表达量(P < 0.05)。饲粮添加香菇多糖显著降低了RIP1和FADD mRNA的相对表达量(P < 0.05)。饲粮添加香菇多糖和LPS刺激对空肠程序性坏死关键基因mRNA的相对表达量无显著互作效应(P>0.05)。
|
|
表 3 饲粮添加香菇多糖对LPS刺激仔猪空肠程序性坏死信号通路关键基因mRNA相对表达量的影响 Table 3 Effects of dietary lentinan supplementation on mRNA relative expressions of jejunal necroptosis signaling pathway key genes of piglets challenged with LPS |
由表 4可知,LPS刺激显著提高了NLRP3和GSDMD mRNA的相对表达量(P < 0.05),显著降低了ASC、Caspase-1和IL-18 mRNA的相对表达量(P < 0.05)。饲粮添加香菇多糖显著降低了NLRP3 mRNA的相对表达量(P < 0.05)。饲粮添加香菇多糖和LPS刺激对空肠NLRP3 mRNA的相对表达量存在显著互作效应(P < 0.05),即在LPS刺激下,饲粮添加香菇多糖缓解了LPS刺激所导致的NLRP3 mRNA相对表达量的增加。
|
|
表 4 饲粮添加香菇多糖对LPS刺激仔猪空肠焦亡信号通路关键基因mRNA相对表达量的影响 Table 4 Effects of dietary lentinan supplementation on mRNA relative expressions of jejunal pyroptosis signaling pathway key genes of piglets challenged with LPS |
由表 5可知,LPS刺激显著降低了Caspase-9和Bax mRNA的相对表达量(P < 0.05),显著提高了Caspase-8 mRNA的相对表达量(P < 0.05)。饲粮添加香菇多糖显著降低了Caspase-9和Bcl-xl mRNA的相对表达量(P < 0.05)。饲粮添加香菇多糖和LPS刺激对空肠Caspase-9和Caspase-8 mRNA的相对表达量存在显著互作效应(P < 0.05),即在LPS刺激下,饲粮添加香菇多糖可降低Caspase-9和Caspase-8 mRNA的表达。
|
|
表 5 饲粮添加香菇多糖对LPS刺激仔猪空肠凋亡信号通路关键基因mRNA相对表达量的影响 Table 5 Effects of dietary lentinan supplementation on mRNA relative expression of jejunal apoptosis signaling pathway key genes of piglets challenged with LPS |
由表 6可知,LPS刺激显著降低了Atg12、LC3、mTOR和ULK1 mRNA的相对表达量(P < 0.05)。饲粮添加香菇多糖显著降低了Atg12、LC3和ULK1 mRNA的相对表达量(P < 0.05)。饲粮添加香菇多糖和LPS刺激对空肠LC3 mRNA的相对表达量存在显著互作效应(P < 0.05),即在LPS刺激下,饲粮添加香菇多糖可降低LC3 mRNA的表达。
|
|
表 6 饲粮添加香菇多糖对LPS刺激仔猪空肠自噬信号通路关键基因mRNA相对表达量的影响 Table 6 Effects of dietary lentinan supplementation on mRNA relative expressions of jejunal autophagy signaling pathway key genes of piglets challenged with LPS |
腹膜内注射LPS被广泛用作内毒素诱导的急性肠损伤研究的试验模型,LPS刺激可引起黏膜损伤,细菌移位,产生强烈的肠道炎症反应[3, 17]。本试验发现,在LPS刺激4 h后,仔猪肠绒毛萎缩,肠上皮脱落,肠黏膜固有层出血,这与Wang等[17]和Zhu等[18]的研究相似。饲粮添加香菇多糖则可以缓解LPS刺激导致的肠道损伤,维持肠黏膜结构完整性[19]。一般认为,香菇多糖可以通过降低炎性细胞因子的释放缓解肠道炎症,但具体作用的分子机理仍不清楚[22]。因此,本试验研究了饲粮中添加香菇多糖对仔猪肠道损伤的保护作用以及作用机理。
肠道损伤往往涉及肠黏膜细胞的死亡。程序性坏死是一种由死亡信号调控的不依赖Caspase的细胞死亡方式[21]。激活程序性坏死信号通路可导致细胞膜破裂,胞质外溢,从而引发炎症及细胞损伤[22]。与程序性坏死类似,激活焦亡信号通路也会导致细胞膜肿胀破裂形成小孔,内容物释放,白细胞介素-1β(IL-1β)和IL-18前体裂解并诱导其他炎性因子等的合成和释放,诱发局部到全身的炎症反应[23]。Welz等[24]发现,程序性坏死和肠上皮细胞损伤有关。坏死性肠炎的发生往往与焦亡信号通路激活有关[25]。因此,激活程序性坏死和焦亡信号通路往往导致肠道炎症和损伤,调节程序性坏死及焦亡信号通路关键因子可缓解细胞损伤。大量研究表明,LPS可以激活程序性坏死信号通路[26-27]。本试验研究发现,LPS刺激提高了程序性坏死信号通路RIP3及焦亡信号通路NLRP3和GSDMD mRNA的相对表达量,激活了程序性坏死及焦亡信号通路,导致了肠道炎症和损伤;饲粮中添加0.02%的香菇多糖降低了程序性坏死信号通路关键基因(RIP1、FADD)和焦亡信号通路关键基因(NLRP3)mRNA的相对表达量。Wang等[12]研究表明,香菇多糖可以缓解LPS刺激导致的炎症及损伤,这与本试验的研究结果一致。目前,未见香菇多糖对程序性坏死及焦亡信号通路的报道,因此,香菇多糖是通过抑制程序性坏死及焦亡信号通路缓解LPS刺激导致的肠道炎症及损伤。
细胞死亡方式往往是相互联系的,细胞凋亡主要由Bcl-2家族、Caspase家族、抑癌基因p53以及癌基因如C-myc等控制,它是机体维持内环境稳定而采用的一种特殊细胞死亡类型,具有重要的生物学意义[28]。凋亡和自噬存在着联系,自噬先于凋亡而发生,凋亡和自噬存在着互相拮抗的作用[29-30]。自噬依赖于mTOR信号通路介导,mTOR信号通路对自噬活化激酶ULK进行负调控,是细胞组分自我降解的过程[31-32]。Li等[33]研究发现,关键基因mTOR mRNA的相对表达量降低,自噬信号通路激活,导致肠道损伤;而抑制自噬,则可以缓解肠道损伤。大量研究证实,LPS主要通过刺激机体产生炎性细胞因子而导致肠道受损,而本试验发现LPS也降低了自噬信号通路关键基因mTOR mRNA的相对表达量,说明LPS刺激导致肠道受损也与激活的自噬信号通路有关。此外,LPS还降低了凋亡启动基因Caspase-9以及凋亡上游关键基因Bax和Fas1 mRNA的相对表达量,抑制了凋亡信号通路。有趣的是,在体外试验中,Jiang等[34]发现LPS可诱导肠上皮细胞凋亡。体内细胞凋亡是一个复杂的生理生化过程,启动凋亡信号需要LPS作用一定的时间。本试验中,仔猪注射LPS 4 h后,虽然导致肠道损伤,但此时并未激活凋亡信号通路。香菇多糖对自噬信号通路相关基因表达的研究尚未见报道,但大量研究表明香菇多糖可诱导肿瘤细胞凋亡。本研究表明,饲粮中添加0.02%的香菇多糖降低自噬信号通路关键基因Atg12、LC3、ULK1 mRNA的相对表达量及凋亡信号通路关键基因Caspase-9和Bcl-xl mRNA的相对表达量,抑制自噬及凋亡信号通路,缓解肠道损伤,维持肠黏膜完整性。
4 结论饲粮中添加0.02%的香菇多糖可缓解LPS诱导的肠道损伤,香菇多糖是通过调控程序性坏死、焦亡和自噬信号通路的关键基因的表达,来维持肠道完整性。
| [1] |
ZHU C, WU Y P, JIANG Z Y, et al. Dietary soy isoflavone attenuated growth performance and intestinal barrier functions in weaned piglets challenged with lipopolysaccharide[J]. International Immunopharmacol, 2015, 28(1): 288-294. DOI:10.1016/j.intimp.2015.04.054 |
| [2] |
陈少魁, 刘玉兰, 王海波, 等. 亚麻籽油对脂多糖刺激仔猪肝脏Toll样受体4和核苷酸结合寡聚化结构域信号通路关键基因表达的影响[J]. 动物营养学报, 2016, 28(3): 891-898. DOI:10.3969/j.issn.1006-267x.2016.03.031 |
| [3] |
LIU Y L, CHEN F, ODLE J, et al. Fish oil enhances intestinal integrity and inhibits TLR4 and NOD2 signaling pathways in weaned pigs after LPS challenge[J]. The Journal of Nutrition, 2012, 142(11): 2017-2024. DOI:10.3945/jn.112.164947 |
| [4] |
LUEDDE T, KAPLOWITZ N, SCHWABE R F. Cell death and cell death responses in liver disease:mechanisms and clinical relevance[J]. Gastroenterology, 2014, 147(4): 765-783.e4. DOI:10.1053/j.gastro.2014.07.018 |
| [5] |
汪龙梅.香菇多糖对脂多糖刺激的断奶仔猪肠道损伤的调控作用[D].硕士学位论文.武汉: 武汉轻工大学, 2018.
|
| [6] |
GÜNTHER C, MARTINI E, WITTKOPF N, et al. Caspase-8 regulates TNF-α-induced epithelial necroptosis and terminal ileitis[J]. Nature, 2011, 477(7364): 335-339. DOI:10.1038/nature10400 |
| [7] |
秦令祥, 崔胜文, 周婧琦, 等. 香菇多糖的提取技术研究进展[J]. 食品研究与开发, 2018, 39(18): 214-218. DOI:10.3969/j.issn.1005-6521.2018.18.038 |
| [8] |
XU W T, ZHANG F F, LUO Y B, et al. Antioxidant activity of a water-soluble polysaccharide purified from Pteridium aquilinum[J]. Carbohydrate Research, 2009, 344(2): 217-222. DOI:10.1016/j.carres.2008.10.021 |
| [9] |
ZHANG Y Y, LI S, WANG X H, et al. Advances in lentinan:isolation, structure, chain conformation and bioactivities[J]. Food Hydrocolloids, 2011, 25(2): 196-206. DOI:10.1016/j.foodhyd.2010.02.001 |
| [10] |
NISHITANI Y, ZHANG L, YOSHIDA M, et al. Intestinal anti-inflammatory activity of lentinan:influence on IL-8 and TNFR1 expression in intestinal epithelial cells[J]. PLoS One, 2013, 8(4): e62441. DOI:10.1371/journal.pone.0062441 |
| [11] |
MAO X B, HU H Y, XIAO X C, et al. Lentinan administration relieves gut barrier dysfunction induced by rotavirus in a weaned piglet model[J]. Food & Function, 2019, 10(4): 2094-2101. |
| [12] |
WANG X Y, WANG W J, WANG L M, et al. Lentinan modulates intestinal microbiota and enhances barrier integrity in a piglet model challenged with lipopolysaccharide[J]. Food & Function, 2019, 10(1): 479-489. |
| [13] |
LIANG Z E N, YUAN Z H, GUO J J, et al. Ganoderma lucidum polysaccharides prevent palmitic acid-evoked apoptosis and autophagy in intestinal porcine epithelial cell line via restoration of mitochondrial function and regulation of MAPK and AMPK/Akt/mTOR signaling pathway[J]. International Journal of Molecular Sciences, 2019, 20(3): 478. DOI:10.3390/ijms20030478 |
| [14] |
KUCUKGUL A, ERDOGAN S. Low concentration of oleic acid exacerbates LPS-induced cell death and inflammation in human alveolar epithelial cells[J]. Experimental Lung Research, 2017, 43(1): 1-7. DOI:10.1080/01902148.2016.1267823 |
| [15] |
陈逢.鱼油通过TLR4和NOD信号通路对脂多糖诱导的仔猪肠道、肝脏损伤和肌肉蛋白质降解的调控作用[D].硕士学位论文.武汉: 武汉轻工大学, 2013.
|
| [16] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [17] |
WANG X Y, LIU Y L, LI S, et al. Asparagine attenuates intestinal injury, improves energy status and inhibits AMP-activated protein kinase signalling pathways in weaned piglets challenged with Escherichia coli lipopolysaccharide[J]. British Journal of Nutrition, 2015, 114(4): 553-565. DOI:10.1017/S0007114515001877 |
| [18] |
ZHU H L, LIU Y L, CHEN S K, et al. Fish oil enhances intestinal barrier function and inhibits corticotropin-releasing hormone/corticotropin-releasing hormone receptor 1 signalling pathway in weaned pigs after lipopolysaccharide challenge[J]. British Journal of Nutrition, 2016, 115(11): 1947-1957. DOI:10.1017/S0007114516001100 |
| [19] |
VAN NEVEL C J, DECUYPERE J A, DIERICK N, et al. The influence of Lentinus edodes (shiitake mushroom) preparations on bacteriological and morphological aspects of the small intestine in piglets[J]. Archives of Animal Nutrition, 2003, 57(6): 399-412. DOI:10.1080/0003942032000161054 |
| [20] |
YOSUKE N, LING Z, MASARU Y, et al. Intestinal anti-inflammatory activity of lentinan:influence on IL-8 and TNFR1 expression in intestinal epithelial cells[J]. PLoS One, 2013, 8(4): e62441. DOI:10.1371/journal.pone.0062441 |
| [21] |
李先根.细胞程序性坏死在脂多糖诱导的仔猪肝脏损伤中的作用[D].硕士学位论文.武汉: 武汉轻工大学, 2019.
|
| [22] |
于辛, 陈丽香, 周晓辉. 程序性细胞坏死及其信号通路[J]. 微生物与感染, 2015, 10(1): 61-66. |
| [23] |
胡艳红, 张凡, 张楚焌, 等. 程序性细胞死亡形式研究进展[J]. 辽宁中医药大学学报, 2018, 20(12): 85-89. |
| [24] |
WELZ P S, WULLAERT A, VLANTIS K, et al. FADD prevents RIP3-mediated epithelial cell necrosis and chronic intestinal inflammation[J]. Nature, 2011, 477(7364): 330-334. DOI:10.1038/nature10273 |
| [25] |
LI Z Y, JIA Y Y, FENG Y, et al. Methane alleviates sepsis-induced injury by inhibiting pyroptosis and apoptosis:in vivo and in vitro experiments[J]. Aging, 2019, 11(4): 1226-1239. DOI:10.18632/aging.101831 |
| [26] |
申兵冰. 程序性坏死研究进展[J]. 重庆医学, 2018, 47(3): 406-409. DOI:10.3969/j.issn.1671-8348.2018.03.039 |
| [27] |
VANDEN BERGHE T, LINKERMANN A, JOUAN-LANHOUET S, et al. Regulated necrosis:the expanding network of non-apoptotic cell death pathways[J]. Nature Reviews Molecular Cell Biology, 2014, 15(2): 135-147. DOI:10.1038/nrm3737 |
| [28] |
汪洋.程序性坏死信号通路在脂多糖诱导的仔猪肠道损伤中的作用[D].硕士学位论文.武汉: 武汉轻工大学, 2019.
|
| [29] |
王月霞, 陈敏. 自噬性细胞死亡及其与细胞凋亡、坏死关系研究进展[J]. 中国公共卫生, 2016, 32(10): 1433-1436. DOI:10.11847/zgggws2016-32-10-36 |
| [30] |
LIAO A J, HU R, LI Y C, et al. The study of FTY720 on inducing apoptosis and autophagy in multiple myeloma cell line U266[J]. Journal of Hematology, 2011, 32(32): 664-667. |
| [31] |
白晓, 万多, 宋晓宇. 凋亡、自噬与程序性细胞坏死的信号关联网络[J]. 解剖科学进展, 2017, 23(4): 430-432, 435. |
| [32] |
HE C C, KLIONSKY D J. Regulation mechanisms and signaling pathways of autophagy[J]. Annual Review of Genetics, 2009, 43: 67-93. DOI:10.1146/annurev-genet-102808-114910 |
| [33] |
LI B C, YAO X, LUO Y H, et al. Inhibition of autophagy attenuated intestinal injury after intestinal I/R via mTOR signaling[J]. Journal of Surgical Research, 2019, 243: 363-370. DOI:10.1016/j.jss.2019.05.038 |
| [34] |
JIANG Q, LIU G, CHEN J S, et al. Crosstalk between nuclear glucose-regulated protein 78 and tumor protein 53 contributes to the lipopolysaccharide aggravated apoptosis of endoplasmic reticulum stress-responsive porcine intestinal epithelial cells[J]. Cellular Physiology and Biochemistry, 2018, 48: 2441-2455. DOI:10.1159/000492682 |




