2. 中国农业大学动物科技学院, 北京 100193
2. College of Animal Science and Technology, China Agricultural University, Beijing 100193, China
色氨酸属于中性氨基酸,于1902年首次在酪蛋白中分离得到,是人和动物所必需的8种氨基酸之一,天然存在的仅有L型色氨酸,呈白色或略带黄色的叶片状结晶或粉末,无臭或微臭,微甜,可溶于热吡啶,微溶于乙醇,不溶于氯仿和乙醚。
色氨酸在猪饲粮中通常为第二或第三限制性氨基酸。色氨酸是动物体内唯一通过非共价键与血清白蛋白结合的氨基酸,广泛参与蛋白质合成和核酸合成,可以通过肝门静脉进入肝脏,调控蛋白质的沉积和代谢,具有促进蛋白质合成、提高采食量、缓解应激和促进生长的作用,其含量不足会降低畜禽对蛋白质的吸收利用率和机体免疫功能,增加畜禽对疾病的易感性[1-2]。同时,色氨酸在调节动物情绪和行为方面也可以发挥重要作用[3]。有研究发现,饲粮中添加色氨酸,可明显减少仔猪间争斗的时间和次数,增加趴卧时间,降低断奶仔猪混群后的应激反应[4-5]。此外,色氨酸含量与机体一些炎症反应有关[6],当猪发生慢性肺炎时,体内色氨酸含量会低于正常水平[7]。
1 色氨酸的分解代谢色氨酸的分解代谢主要有3个途径:犬尿氨酸途径、5-羟色胺(5-HT)途径和肠道菌群途径[8-9]。色氨酸沿犬尿氨酸途径的代谢量约占摄入量的95%[8, 10],主要在吲哚胺2, 3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)或色氨酸2, 3-双加氧酶(tryptophan 2, 3-dioxygenase,TDO)的作用下生成犬尿氨酸;色氨酸沿5-HT途径分解代谢的产物为5-HT和褪黑激素;色氨酸沿肠道菌群途径分解代谢的产物为芳基烃受体(AhR,包括吲哚及吲哚衍生物)的配体。色氨酸的分解代谢过程如图 1所示。
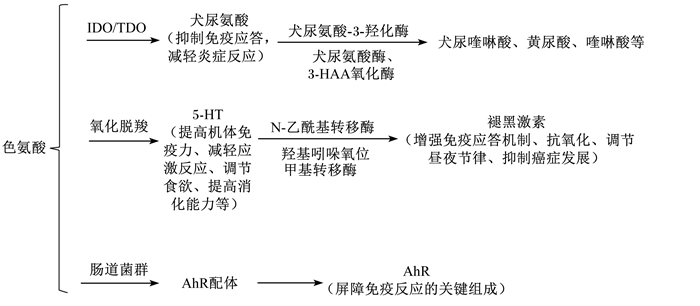
|
IDO:吲哚胺2, 3-双加氧酶indoleamine 2,3-dioxygenase;TDO:色氨酸2, 3-双加氧酶tryptophan 2, 3-dioxygenase;5-HT:5-羟色胺5-hydroxytryptamine;AhR:芳基烃受体aryl hydrocarbon receptor。 图 1 色氨酸的分解代谢过程 Fig. 1 Tryptophan catabolism process |
TDO和IDO是犬尿氨酸分解代谢途径的2种限速酶。TDO主要在肝脏中降解色氨酸,IDO主要在肝脏以外的组织中降解色氨酸。有研究发现,TDO缺陷小鼠注射脂多糖后机体内毒素含量增加,造成小鼠休克[11]。IDO是一种免疫负调节酶,主要是由固有免疫系统细胞(如树突状细胞和单核巨噬细胞)分泌产生,能催化吲哚环氧化裂解并促进色氨酸沿犬尿氨酸途径分解代谢[12-13]。IDO在小肠中高水平表达,其表达量与体内促炎细胞因子[如干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)等]的含量有关[14],在缓解机体肠道炎症反应方面发挥重要作用[15-16]。
当机体发生炎症反应时,炎症组织中IDO活性升高,犬尿氨酸代谢途径增强,而犬尿氨酸能抑制炎症因子分化,缓解炎症反应[17]。当IDO活性被抑制或者IDO缺陷时,肠道炎症的严重程度高于正常机体[18-19]。
2.2 色氨酸沿5-HT途径分解的调节因子色氨酸在羟化酶和脱羧酶的氧化脱羧作用下生成5-HT,其中色氨酸羟化酶是合成5-HT的重要限速酶。有研究表明,神经系统中色氨酸羟化酶活性降低时,可以引起5-HT的合成量下降,进而影响动物的情绪及行为,造成动物活动量减少;而机体氨基酸脱羧酶活性受到抑制时,色氨酸的氧化脱羧途径受阻,动物表现为采食量降低、发育迟缓和运动障碍等[20-21]。
2.3 色氨酸沿肠道菌群途径分解的调节因子肠道内色氨酸在肠道菌群的作用下分解代谢为吲哚及吲哚衍生物。肠道菌群结构可以影响动物体的营养平衡、物质代谢、免疫系统的成熟和激活等。有研究发现,肠道菌群可以参与色氨酸的分解代谢过程,肠道中的大肠杆菌、变形杆菌、拟杆菌等代谢色氨酸的主要产物为吲哚,而梭状芽胞杆菌、拟杆菌和罗伊氏乳杆菌代谢色氨酸的主要产物为吲哚-3-乙酸、吲哚-3-丙酸和吲哚乳酸[10, 22]。色氨酸沿肠道菌群分解产生的芳基烃受体AhR信号被认为是屏障免疫反应的受体,对肠道内稳态起到至关重要的作用,有助于更新肠道上皮细胞,维持肠道黏膜屏障的完整性。
3 色氨酸分解代谢的主要产物 3.1 色氨酸沿犬尿氨酸途径分解代谢的主要产物色氨酸在IDO/TDO的作用下沿犬尿氨酸途径生成的犬尿氨酸,发挥抑制免疫应答和T细胞增殖、调节免疫细胞凋亡和细胞分化等作用[23]。犬尿氨酸负向调节树突状细胞的免疫原性,促进初始T细胞分化为调节性T细胞[24]。Bauer等[25]开展了体外同种异体树突细胞刺激大鼠淋巴细胞的试验,测定了T细胞的增殖情况,结果表明犬尿氨酸能强烈抑制T细胞增殖并诱导T细胞凋亡。
犬尿氨酸在犬尿氨酸-3-羟化酶、犬尿氨酸酶及3-HAA氧化酶的催化作用下,可以生成具有免疫活性的喹啉酸。喹啉酸是一种内源性神经毒素,主要在树突状细胞和巨噬细胞中分泌合成。同时,喹啉酸具有介导N-甲基-D-天冬氨酸神经元损伤和功能障碍的潜力,当机体有炎症反应时,色氨酸沿犬尿氨酸分解代谢途径加强,使得喹啉酸含量升高以降低炎症反应[26-27]。
3.2 色氨酸沿5-HT途径分解代谢的主要产物色氨酸沿5-HT途径氧化脱羧生成的5-HT主要存在于脑组织和胃肠壁中,少量分布于血液中。5-HT作为一种神经递质,具有调节动物采食量、睡眠、血压及内分泌等功能。当饲粮中色氨酸含量过高时,猪的趴卧时间增加,采食量减少,这与5-HT的中枢安定效应有关[28]。5-HT也是一种外周激素,主要由肠中的嗜铬细胞、肥大细胞利用色氨酸产生并储存在血小板中,参与心血管运动、止血功能和免疫应答的控制[29-30]。同时,5-HT作为参与运动和分泌机制的主要神经介质,作用于肠壁内外的神经纤维引起肌肉收缩,从而调节肠道的蠕动[2, 31]。外周组织中的5-HT不能穿过血脑屏障,因此外周组织和中枢神经中的5-HT各自成为一个独立的系统。
5-HT在N-乙酰基转移酶和羟基吲哚氧位甲基转移酶的作用下生成褪黑激素。褪黑激素是一种松果体激素,也是一种高效抗氧化剂和昼夜节律调节剂,在抑制肿瘤增殖、抑制癌症发展、调节膜兴奋性等方面发挥重要作用。因此,可以通过调控色氨酸含量进而影响褪黑激素的产生,进而刺激多种免疫细胞(T淋巴细胞、单核细胞、自然杀伤细胞、巨噬细胞)的活动来增强免疫应答机制,并刺激干扰素、白细胞介素、TNF-α等细胞因子的产生[32]。
3.3 色氨酸沿肠道菌群途径分解代谢的主要产物色氨酸沿肠道菌群途径分解代谢的主要代谢产物是吲哚和吲哚衍生物,如吲哚-3-乙酸、吲哚-3-乙醛、吲哚-3-丙酸、吲哚乳酸及吲哚丙烯酸等。吲哚作为一种微生物信号分子,具有维持动物肠道健康和抗炎作用。有研究表明,色氨酸介导的吲哚及吲哚衍生物能诱导肠上皮细胞紧密连接蛋白和黏附蛋白相关基因的表达,进而增强肠道的免疫屏障功能,同时增加白细胞介素-10(IL-10)的表达量,降低致病性大肠杆菌的黏附性[33-35]。
4 色氨酸对猪生长性能、血液指标和肠道功能的影响 4.1 色氨酸对猪生长性能的影响饲粮添加适宜剂量的色氨酸,可以改善断奶仔猪和肥育猪的生长性能[36-38]。有研究表明,断奶仔猪对于饲粮的色氨酸含量较肥育猪更为敏感,过量添加色氨酸可能对仔猪的采食量存在负面影响[39-40]。目前,关于色氨酸对猪生长性能的研究主要集中在低蛋白质饲粮领域,因其饲粮的粗蛋白质含量降低幅度较高时,色氨酸的含量也相应降低,因此需要额外在饲粮中补充工业合成色氨酸,才能满足动物对于氨基酸的需要量,进而实现与正常蛋白质组生猪相近的生长性能[41-42]。近年来,关于色氨酸在母猪阶段应用的研究报道较少,但也有研究表明,饲粮中补充适宜剂量的色氨酸可以增加母猪采食量和泌乳量,减少泌乳期间的母猪体重损失[43-44]。饲粮添加色氨酸对猪生长性能的影响见表 1。
|
|
表 1 饲粮添加色氨酸对猪生长性能的影响 Table 1 Effects of dietary tryptophan on growth performance of pigs |
饲粮中添加不同剂量的色氨酸可以影响猪的血液指标。其中,随着饲粮色氨酸含量的变化,血液中变化较为明显的指标为血清尿素氮和色氨酸含量。血清尿素氮是蛋白质分解代谢的终产物,反映机体的营养状态和饲粮氨基酸的平衡水平。当饲粮中的色氨酸含量接近生猪的实际色氨酸需要量时,猪的血清尿素氮含量最低[39-40],继续增加饲粮的色氨酸含量时,血清色氨酸含量随之升高[42, 45]。也有研究表明,与色氨酸缺乏组相比,在饲粮中添加色氨酸可以提高仔猪的血浆胰岛素和葡萄糖含量[46],同时在仔猪大肠杆菌攻毒后饲喂色氨酸含量充足的饲粮,可显著提高血液中免疫球蛋白A(IgA)的含量[36]。
4.3 色氨酸对猪肠道功能的影响肠道是机体消化吸收营养物质的主要器官,由于肠黏膜的特殊结构,其在应激条件下极易发生损伤,进而影响仔猪的正常生长[47]。李金龙[48]以三元断奶仔猪为试验对象,结果表明适宜剂量的色氨酸可以显著提高断奶仔猪的空肠杯状细胞数量和肠道蛋白质含量,改善回肠肠道形态,增加肠道有益菌相对丰度,改善微生物区系结构,进而提高仔猪的生长性能。颜莹莉[49]发现,与脂多糖组相比,饲粮添加0.2%或0.4%的色氨酸,可以改善断奶仔猪的小肠绒毛高度,增加空肠上皮细胞间的连接,进而缓解脂多糖诱导的肠道损伤。也有研究认为,肠道中的生孢梭菌可降解色氨酸,分泌产生的吲哚丙酸在血液中积累,同时加固动物肠壁,修复肠道损伤带来的负面影响[50]。
5 小结色氨酸是猪生长发育的必需氨基酸之一,在调节生长、行为和肠道免疫等发面发挥重要作用。饲粮中添加适宜剂量的色氨酸,可以提高猪的生长性能,缓解来自于环境或饲粮应激引起的肠道炎症反应。然而,目前关于色氨酸调控肠道免疫屏障的分子机制的研究较少,尚需要进一步探讨,进而为色氨酸在猪饲粮中的合理应用提供依据。
| [1] |
LE FLOC'H N, OTTEN W, MERLOT E. Tryptophan metabolism, from nutrition to potential therapeutic applications[J]. Amino Acids, 2011, 41(5): 1195-1205. DOI:10.1007/s00726-010-0752-7 |
| [2] |
WU G Y. Amino acids:metabolism, functions, and nutrition[J]. Amino Acids, 2009, 37(1): 1-17. DOI:10.1007/s00726-009-0269-0 |
| [3] |
NORGAARD J V, PEDERSEN T F, SOUMEH E A, et al. Optimum standardized ileal digestible tryptophan to lysine ratio for pigs weighing 7-14 kg[J]. Livestock Science, 2015, 175: 90-95. DOI:10.1016/j.livsci.2015.02.012 |
| [4] |
刘化伟, 石宝明, 娄蕾, 等. 饲粮中添加色氨酸对仔猪混群后行为及相关激素的影响[J]. 中国农业科学, 2012, 45(12): 2455-2461. DOI:10.3864/j.issn.0578-1752.2012.12.014 |
| [5] |
KOOPMANS S J, RUIS M, DEKKER R, et al. Surplus dietary tryptophan reduces plasma cortisol and noradrenaline concentrations and enhances recovery after social stress in pigs[J]. Physiology & Behavior, 2005, 85(4): 469-478. |
| [6] |
CAPURON L, SCHROECKSNADEL S, FÉART C, et al. Chronic low-grade inflammation in elderly persons is associated with altered tryptophan and tyrosine metabolism:role in neuropsychiatric symptoms[J]. Biological Psychiatry, 2011, 70(2): 175-182. DOI:10.1016/j.biopsych.2010.12.006 |
| [7] |
孔祥峰, 印遇龙, 伍国耀. 猪功能性氨基酸营养研究进展[J]. 动物营养学报, 2009, 21(1): 1-7. DOI:10.3969/j.issn.1006-267x.2009.01.001 |
| [8] |
KASZAKI J, ÉRCES D, VARGA G, et al. Kynurenines and intestinal neurotransmission:the role of N-methyl-D-aspartate receptors[J]. Journal of Neural Transmission, 2012, 119(2): 211-223. DOI:10.1007/s00702-011-0658-x |
| [9] |
AGUS A, PLANCHAIS J, SOKOL H. Gut microbiota regulation of tryptophan metabolism in health and disease[J]. Cell Host & Microbe, 2018, 23(6): 716-724. |
| [10] |
KESZTHELYI D, TROOST F J, MASCLEE A A M. Understanding the role of tryptophan and serotonin metabolism in gastrointestinal function[J]. Neurogastroenterology & Motility, 2009, 21(12): 1239-1249. |
| [11] |
BESSEDE A, GARGARO M, PALLOTTA M T, et al. Aryl hydrocarbon receptor control of a disease tolerance defence pathway[J]. Nature, 2014, 511(7508): 184-190. DOI:10.1038/nature13323 |
| [12] |
EBRAHIMI A, KARDAR G A, TOOLABI L T, et al. Inducible expression of indoleamine 2, 3-dioxygenase attenuates acute rejection of tissue-engineered lung allografts in rats[J]. Gene, 2016, 576(1): 412-420. DOI:10.1016/j.gene.2015.10.054 |
| [13] |
EL-ZAATARI M, KAO J Y. Role of dietary metabolites in regulating the host immune response in gastrointestinal disease[J]. Frontiers in Immunology, 2017, 8: 51. |
| [14] |
CIORBA M A. Indoleamine 2, 3 dioxygenase (IDO) in intestinal disease[J]. Current Opinion in Gastroenterology, 2013, 29(2): 146-152. DOI:10.1097/MOG.0b013e32835c9cb3 |
| [15] |
YEUNG A W S, TERENTIS A C, KING N J C, et al. Role of indoleamine 2, 3-dioxygenase in health and disease[J]. Clinical Science, 2015, 129(7): 601-672. DOI:10.1042/CS20140392 |
| [16] |
BERSTAD A, RAA J, VALEUR J. Tryptophan:'essential' for the pathogenesis of irritable bowel syndrome?[J]. Scandinavian Journal of Gastroenterology, 2014, 49(12): 1493-1498. DOI:10.3109/00365521.2014.936034 |
| [17] |
卞秀梅, 吴正祥. IDO在炎症性肠病中的研究进展[J]. 国际消化病杂志, 2014, 34(2): 106-109. DOI:10.3969/j.issn.1673-534X.2014.02.011 |
| [18] |
GURTNER G J, NEWBERRY R D, SCHLOEMANN S R, et al. Inhibition of indoleamine 2, 3-dioxygenase augments trinitrobenzene sulfonic acid colitis in mice[J]. Gastroenterology, 2003, 125(6): 1762-1773. DOI:10.1053/j.gastro.2003.08.031 |
| [19] |
JASPERSON L K, BUCHER C, PANOSKALTSIS-MORTARI A, et al. Indoleamine 2, 3-dioxygenase is a critical regulator of acute graft-versus-host disease lethality[J]. Blood, 2008, 111(6): 3257-3265. DOI:10.1182/blood-2007-06-096081 |
| [20] |
陈栘, 徐海霞, 朱明月, 等. 慢性低强度应激抑郁症模型大鼠组织中5-羟色胺和色氨酸羟化酶的表达变化[J]. 中国药房, 2017, 28(22): 3061-3064. DOI:10.6039/j.issn.1001-0408.2017.22.10 |
| [21] |
陈先睿, 许锦平, 陈玲. 芳香族L-氨基酸脱羧酶缺乏症2例报告及文献复习[J]. 临床儿科杂志, 2019, 37(5): 365-368. DOI:10.3969/j.issn.1000-3606.2019.05.010 |
| [22] |
SMITH E A, MACFARLANE G T. Formation of phenolic and indolic compounds by anaerobic bacteria in the human large intestine[J]. Microbial Ecology, 1997, 33(3): 180-188. DOI:10.1007/s002489900020 |
| [23] |
FRUMENTO G, ROTONDO R, TONETTI M, et al. Tryptophan-derived catabolites are responsible for inhibition of T and natural killer cell proliferation induced by indoleamine 2, 3-dioxygenase[J]. Journal of Experimental Medicine, 2002, 196(4): 459-468. DOI:10.1084/jem.20020121 |
| [24] |
NGUYEN N T, KIMURA A, NAKAHAMA T, et al. Aryl hydrocarbon receptor negatively regulates dendritic cell immunogenicity via a kynurenine-dependent mechanism[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(46): 19961-19966. DOI:10.1073/pnas.1014465107 |
| [25] |
BAUER T M, JIGA L P, CHUANG J J, et al. Studying the immunosuppressive role of indoleamine 2, 3-dioxygenase:tryptophan metabolites suppress rat allogeneic T-cell responses in vitro and in vivo[J]. Transplant International, 2005, 18(1): 95-100. DOI:10.1111/j.1432-2277.2004.00031.x |
| [26] |
HEYES M P, SAITO K, CROWLEY J S, et al. Quinolinic acid and kynurenine pathway metabolism in inflammatory and non-inflammatory neurological disease[J]. Brain, 1992, 115(5): 1249-1273. DOI:10.1093/brain/115.5.1249 |
| [27] |
白苗苗, 刘红南, 吴信, 等. 饲粮中色氨酸对畜禽的免疫调节作用[J]. 动物营养学报, 2016, 28(2): 361-368. DOI:10.3969/j.issn.1006-267x.2016.02.008 |
| [28] |
LI Y Z, KERR B J, KIDD M T, et al. Use of supplementary tryptophan to modify the behavior of pigs[J]. Journal of Animal Science, 2006, 84(1): 212-220. DOI:10.2527/2006.841212x |
| [29] |
尹靖东. 色氨酸对猪摄食和生长的调控作用及其机理[J]. 中国畜牧杂志, 2007, 43(1): 37-41. DOI:10.3969/j.issn.0258-7033.2007.01.013 |
| [30] |
WILLEMEN S A, CHE L, DEWILDE S, et al. Enteric and serological distribution of serotonin and its precursor tryptophan in perinatal low and normal weight piglets[J]. Animal, 2014, 8(5): 792-799. DOI:10.1017/S1751731114000317 |
| [31] |
李小兰, 江敏, 阮征, 等. 色氨酸及其代谢产物5-HT对肠道功能的作用综述[J]. 食品安全质量检测学报, 2014, 5(7): 1997-2002. |
| [32] |
CHAO Y H, WU K H, YEH C M, et al. The potential utility of melatonin in the treatment of childhood cancer[J]. Journal of Cellular Physiology, 2019, 234(11): 19158-19166. DOI:10.1002/jcp.28566 |
| [33] |
BANSAL T, ALANIZ R C, WOOD T K, et al. The bacterial signal indole increases epithelial-cell tight-junction resistance and attenuates indicators of inflammation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(1): 228-233. DOI:10.1073/pnas.0906112107 |
| [34] |
WHITFIELD-CARGILE C M, COHEN N D, CHAPKIN R S, et al. The microbiota-derived metabolite indole decreases mucosal inflammation and injury in a murine model of NSAID enteropathy[J]. Gut Microbes, 2016, 7(3): 246-261. DOI:10.1080/19490976.2016.1156827 |
| [35] |
VENKATESH M, MUKHERJEE S, WANG H W, et al. Symbiotic bacterial metabolites regulate gastrointestinal barrier function via the xenobiotic sensor PXR and Toll-like receptor 4[J]. Immunity, 2014, 41(2): 296-310. DOI:10.1016/j.immuni.2014.06.014 |
| [36] |
TREVISI P, MELCHIOR D, MAZZONI M, et al. A tryptophan-enriched diet improves feed intake and growth performance of susceptible weanling pigs orally challenged with Escherichia coli K88[J]. Journal of Animal Science, 2009, 87(1): 148-156. DOI:10.2527/jas.2007-0732 |
| [37] |
HENRY Y, SÈVE B, COLLÉAUX Y, et al. Interactive effects of dietary levels of tryptophan and protein on voluntary feed intake and growth performance in pigs, in relation to plasma free amino acids and hypothalamic serotonin[J]. Journal of Animal Science, 1992, 70(6): 1873-1887. DOI:10.2527/1992.7061873x |
| [38] |
ZHANG H W, YIN J D, LI D F, et al. Tryptophan enhances ghrelin expression and secretion associated with increased food intake and weight gain in weanling pigs[J]. Domestic Animal Endocrinology, 2007, 33(1): 47-61. DOI:10.1016/j.domaniend.2006.04.005 |
| [39] |
吴新连, 谭会泽, 冯定远. 低蛋白仔猪日粮色氨酸适宜水平的研究[J]. 饲料工业, 2004, 25(12): 42-43. DOI:10.3969/j.issn.1001-991X.2004.12.012 |
| [40] |
林映才, 蒋宗勇, 余德谦, 等. 断奶仔猪色氨酸需求参数的研究[J]. 动物营养学报, 1999, 11(3): 44-50. |
| [41] |
EDER K, PEGANOVA S, KLUGE H. Studies on the tryptophan requirement of piglets[J]. Archiv Für Tierernaehrung, 2001, 55(4): 281-297. DOI:10.1080/17450390109386198 |
| [42] |
苏有健, 李德发, 邢建军, 等. 在低蛋白日粮中添加色氨酸对仔猪生产性能及血清游离氨基酸和尿素氮的影响[J]. 中国畜牧杂志, 2005, 41(1): 26-28. DOI:10.3969/j.issn.0258-7033.2005.01.011 |
| [43] |
PAULICKS B R, PAMPUCH F G, ROTH-MAIER D A. Studies on the tryptophan requirement of lactating sows.Part 1:estimation of the tryptophan requirement by performance[J]. Journal of Animal Physiology and Animal Nutrition, 2006, 90(11/12): 474-481. |
| [44] |
LIBAL G W, UTTECHT D J, HAMILTON C R. Tryptophan needs of lactating sows fed diets supplemented with crystalline lysine[J]. Journal of Animal Science, 1997, 75(2): 417-422. DOI:10.2527/1997.752417x |
| [45] |
马文锋.猪肥育后期低氮日粮限制性氨基酸平衡模式的研究[D].博士学位论文.北京: 中国农业大学, 2015.
|
| [46] |
CORTAMIRA N O, SEVE B, LEBRETON Y, et al. Effect of dietary tryptophan on muscle, liver and whole-body protein synthesis in weaned piglets:relationship to plasma insulin[J]. British Journal of Nutrition, 1991, 66(3): 423-435. DOI:10.1079/BJN19910045 |
| [47] |
GILBERT H, RUESCHE J, MULLER N, et al. Responses to weaning in two pig lines divergently selected for residual feed intake depending on diet[J]. Journal of Animal Science, 2019, 97(1): 43-54. DOI:10.1093/jas/sky416 |
| [48] |
李金龙.日粮色氨酸促进抗菌肽表达对肠道微生物区系的调控和ETEC的预防作用[D].硕士学位论文.重庆: 西南大学, 2018.
|
| [49] |
颜莹莉.色氨酸缓解脂多糖诱导断奶仔猪肠道损伤的作用研究[D].硕士学位论文.广州: 华南农业大学, 2018.
|
| [50] |
DODD D, SPITZER M H, VAN TREUREN W, et al. A gut bacterial pathway metabolizes aromatic amino acids into nine circulating metabolites[J]. Nature, 2017, 551(7682): 648-652. DOI:10.1038/nature24661 |




