2. 中国农业科学院北京畜牧兽医研究所, 北京 100193;
3. 南京农业大学动物科学技术学院, 南京 210014
2. Institute of Animal Science and Veterinary, Chinese Academy of Agricultural Science, Beijing 100193, China;
3. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210014, China
奶牛乳腺炎是由病原微生物感染乳腺组织引起的一种炎症反应,造成奶牛产奶量和乳品质下降,给奶牛养殖业造成巨大经济损失[1]。数据显示,印度、美国、中国和全球乳腺炎每年造成的经济损失估计分别为11亿[2]、20亿[3]、5亿[4]和350亿美元[5]。此外,牛奶中的药物残留、抗生素滥用等问题对人类健康也产生不利影响[6]。奶牛乳腺炎主要是病原菌侵入乳头导管后,引发乳腺内感染产生的炎症反应。无乳链球菌(Streptococcus agalactiae, S. agalactiae)是一种革兰氏阳性菌,可引起70%以上的奶牛隐性乳腺炎[7]。S. agalactiae通常会导致奶牛乳腺低级别的持续感染,并且自身治愈率不高[8]。由S. agalactiae引起的乳腺炎在全球奶牛场中流行并且感染率呈现快速上升的趋势[9-10]。
机体的免疫系统在感染发生时具有重要的作用,其中先天性免疫主要在感染的早期发挥作用。通过先天性免疫系统机体可以快速识别病原菌,并通过机械屏障、巨噬细胞吞噬以及中性粒细胞和细胞因子的杀伤作用有效阻挡和清除病原菌[11-12]。奶牛乳腺上皮细胞(bMECs)是抵御病原微生物入侵的重要防线,能够表达多种模式识别受体,bMECs可通过模式识别受体(PRRs)感知病原体的分子成分,从而诱导多种炎性因子的释放,启动炎症反应[13-14]。Toll样受体(TLR)是PPRs中一种跨膜受体,且Toll样受体2(TLR2)分布比较广泛,对细菌、病毒等均有识别作用,尤其在识别革兰氏阳性菌方面发挥重要作用[15-16]。TLR2利用髓样分化因子88(MyD88)依赖型信号途径,募集并激活MyD88和白细胞介素-1(IL-1)受体相关激酶(IRAKs),随后活化肿瘤坏死因子受体相关因子6(TRAF6)[17],活化的TRAF6通过K63串联多泛素化激活转化生长因子激酶1(TAK1),最终导致核因子-κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)的快速协同激活[16, 18]。NF-κB和MAPK信号通路的激活会促进促炎细胞因子、趋化因子等的表达,导致乳腺炎症损伤的发生[19]。
尽管目前针对奶牛乳腺炎的疗法多种多样,但是抗生素治疗仍旧是针对奶牛乳腺炎的主流方法,但是其所带来的副作用,包括耐药性、药物残留和食品安全问题等[20],在近些年来越来越成为突出关注的问题。因此,寻找新的天然活性物代替抗生素治疗奶牛乳腺炎成为了重要的研究课题。壳聚糖(chitosan,CTS)是一种从甲壳素获得的天然生物聚合物,来源广泛,可从甲壳纲、真菌[21]和昆虫[22]中提取得到。CTS具有良好的吸附性、吸湿性、成膜性、通透性以及较好的生物相容性、生物降解性和低过敏等特性[23],还具有抗微生物[24]、抗肿瘤和低胆固醇血症等功能[25]。有报道显示,CTS对蜡状芽孢杆菌[26]、单核细胞增生李斯特菌[26-27]、金黄色葡萄球菌[27]、S. agalactiae[28]有很好的抗菌活性。此外,CTS能够抑制肿瘤坏死因子-α(TNF-α)引起的猪小肠上皮细胞系(IPEC-J2)的炎症反应[29]。然而,CTS对S. agalactiae刺激的bMECs的抗炎作用和分子机制仍不清楚。因此,本试验旨在研究CTS抑制S. agalactiae引起的bMECs炎性损伤作用及其机制。
1 材料与方法 1.1 试验材料bMECs来自于东北农业大学动物生物化学与分子生物学实验室的惠赠;S. agalactiae购自中国兽药监察所(CVCC3940);CTS购自济南海得贝海洋生物工程有限公司,分子质量为40 ku,脱乙酰度为95.27%;胎牛血清(FBS,10099141)、DMEM培养液(11995065)、F-12培养液(11765054)、Hank’s(14175095)、0.25%胰蛋白酶-乙二胺四乙酸(trypsin-EDTA)(25200056)、Pen Strep(15140122)购自美国Gibco公司;脑心浸出液(BHI)购自英国OXOID公司;总RNA提取试剂盒购自上海OMAGA公司;cDNA反转录试剂盒、TB GreenTM Premix Ex Taq Ⅱ购自日本TaKaRa公司;Western blot相关试验材料购自上海碧云天公司;一抗β微管蛋白(β-tubulin,2128)、NF-κB抑制蛋白(IκB,4814s)、磷酸化NF-κB-蛋白65(p-NF-κB-P65,3039s)、磷酸化蛋白38(p-p38,9215s)、磷酸化c-Jun氨基末端激酶(p-JNK,9164T)、磷酸化的细胞外信号调节激酶1/2(p-ERK1/2,4370T)购自美国CST公司;二抗购自北京兰博利德生物技术有限公司。
1.2 试验方法 1.2.1 bMECs的培养bMECs培养基为DMEM和F-12 1 : 1混合,加入10% FBS和1%青-链霉素,细胞在37 ℃、5% CO2细胞培养箱中培养。试验用不完全细胞培养基(2% FBS,不加青-链霉素)培养细胞。试验前称取100 g CTS溶解于不完全细胞培养基中,通过稀释调整CTS浓度分别为31.25、125.00和250.00 mg/mL,4 ℃备用。
1.2.2 S. agalactiae的培养S. agalactiae用BHI培养基培养。复苏S. agalactiae,37 ℃恒温摇床中培养18 h,稀释106倍后涂板于BHI固体培养基,37 ℃恒温培养箱中培养18 h,挑取单菌落进行扩增后涂板计数。试验前用不完全细胞培养基按感染复数(MOI)=50 : 1稀释菌液备用,称取100 g CTS溶解于BHI培养基中,通过稀释调整CTS浓度分别为15.625、31.250、62.500、125.000、250.000、500.000和1 000.000 mg/mL,4 ℃备用。
1.2.3 细菌活性检测分别取6 mL含不同浓度(0、15.625、31.250、62.5000、125.000、250.000、500.000和1 000.000 mg/mL)CTS的BHI培养基于15 mL洁净试管中,分别接种106个S. agalactiae后置于37 ℃恒温摇床中培养,在0、1、2、4、6、8、12和24 h时分别取100 μL菌液加入到96孔板中,每组3个重复,用酶标仪在600 nm处测定吸光度(OD)。
1.2.4 实时荧光定量PCR(RT-PCR)检测相关基因表达将bMECs接种于6孔板中,在37 ℃、5% CO2培养箱中培养至细胞达到90%融合以上,更换为含不同浓度(0、31.250、125.00和250.00 mg/mL)CTS的细胞培养液继续培养24 h,随后接种S. agalactiae(MOI=50 : 1)继续培养6 h。总RNA提取试剂盒提取细胞总RNA,然后采用cDNA合成试剂盒反转录为cDNA,反应条件为37 ℃,15 min;85 ℃,5s。RT-PCR反应采用两步法,条件为95 ℃预变性30 s,1个循环;95 ℃延伸5 s,60 ℃退火30 s,40个循环。基因的引物序列见表 1,由生工生物工程(上海)股份有限公司合成。
|
|
表 1 基因的引物序列 Table 1 Primer sequences of genes |
将bMECs接种于6孔板中,在37 ℃、5% CO2培养箱中培养至细胞达到90%融合以上,更换为含不同浓度(0、31.25、125.00和250.00 mg/mL)CTS的细胞培养液继续培养24 h,随后接种S. agalactiae(MOI=50 : 1)继续培养6 h。使用细胞裂解液加苯甲基磺酰氟(PMSF)提取细胞总蛋白,BCA法测定蛋白浓度。配制十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)凝胶,蛋白样品上样量为15 μL/孔,每孔36 μg蛋白。100 V恒压电泳,采用湿转法转膜,然后对膜进行封闭和抗体孵育,ECL显色后用萤光成像仪检测。用Gis软件分析条带的积分光密度(IOD)值。
1.3 数据分析和处理试验数据用Excel 2016进行初步整理,应用软件SPSS 20.0进行单因素方差分析(one-way ANOVA),试验结果用平均值±标准误表示,P < 0.05代表差异显著,P < 0.01代表差异极显著。
2 结果 2.1 CTS对S. agalactiae增殖的影响如图 1所示,在细菌培养6~8 h时,所有浓度的CTS表现出对S. agalactiae增殖呈浓度依赖性的抑制效果;当细菌培养12 h以上时,125.000、250.000、500.000和1 000.000 mg/mL的CTS表现出对S. agalactiae增殖呈浓度依赖性的抑制效果。
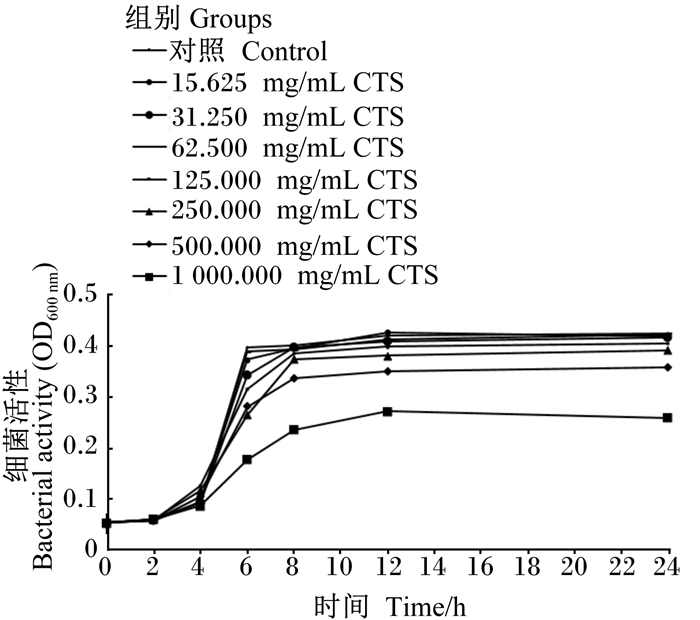
|
图 1 CTS对S. agalactiae增殖的影响 Fig. 1 Effects of CTS on proliferation of S. agalactiae |
由图 2可知,与对照组相比,S. agalactiae极显著提高了bMECs的IL-6、IL-1β、TNF-α和IL-8 mRNA表达量(P < 0.01)。但与S. agalactiae组相比,31.25和125.00 mg/mL的CTS极显著降低了bMECs的IL-6、IL-1β、TNF-α和IL-8 mRNA表达量(P < 0.01);250.00 mg/mL的CTS显著降低了bMECs的IL-1β mRNA表达量(P < 0.05),极显著降低了IL-6、TNF-α和IL-8 mRNA表达量(P < 0.01)。
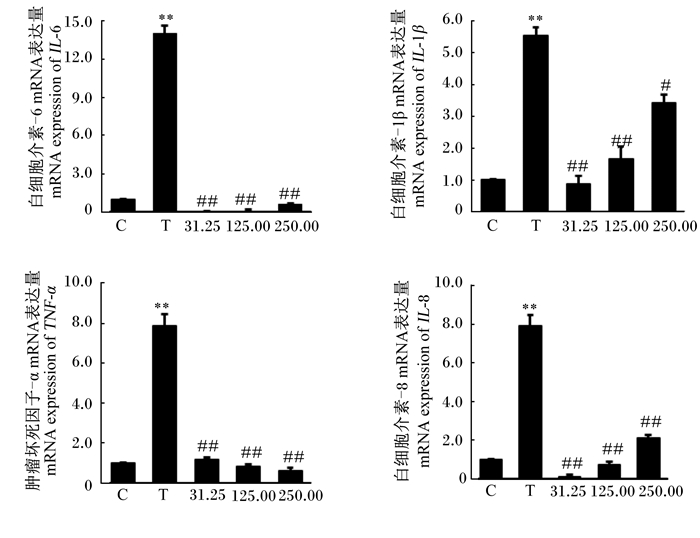
|
C代表对照组;T代表S. agalactiae组;31.25,125.00,250.00分别代表 31.25、125.00、250.00 mg/mL CTS组。与对照组相比,*表示差异显著(P < 0.05);* *表示差异极显著(P < 0.01)。与S. agalactiae组相比,#表示差异显著(P < 0.05);##表示差异极显著(P < 0.01)。下图同。 C represents the control group; T represents the S. agalactiae group; 31.25, 125.00, 250.00 represents 31.25, 125.00 and 250.00 mg/mL CTS groups, respectively. Compared with the control group, * means significant difference (P < 0.05), and * * means highly significant difference (P < 0.01). Compared with S. agalactiae group, # means significant difference (P < 0.05), and ## means highly significant difference (P < 0.01). The same as below. 图 2 CTS对S. agalactiae引起的bMECs炎性因子mRNA表达的影响 Fig. 2 Effects of CTS on mRNA expression of inflammatory factors in bMECs induced by S. agalactiae |
如图 3所示,与对照组相比,S. agalactiae极显著提高了bMECs的TLR2 mRNA表达量(P < 0.01),而31.25、125.00和250.00 mg/mL CTS均极显著降低了bMECs的TLR2 mRNA表达量(P < 0.01)。
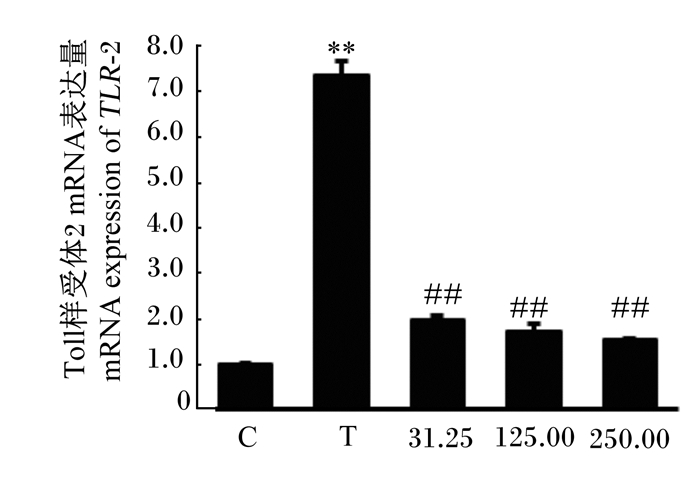
|
图 3 CTS对S. agalactiae引起的bMECs TLR2 mRNA表达的影响 Fig. 3 Effects of CST on mRNA expression of TLR2 in bMECs induced by S. agalactiae |
如图 4所示,与对照组相比,S. agalactiae极显著提高了bMECs的MyD88、IRAK4、TRAF6和TAK1 mRNA表达量(P < 0.01)。与S. agalactiae组相比,31.25 mg/mL的CTS极显著降低了bMECs的MyD88、IRAK4、TRAF6和TAK1的mRNA表达量(P < 0.01);125.00 mg/mL的CTS显著降低了bMECs的TRAF6的mRNA表达量(P < 0.05),极显著降低了bMECs的MyD88、IRAK4和TAK1 mRNA表达量(P < 0.01);250.00 mg/mL的CTS显著降低了bMECs的MyD88和TRAF6 mRNA表达量(P < 0.05),极显著降低了bMECs的IRAK4和TAK1 mRNA表达量(P < 0.01)。
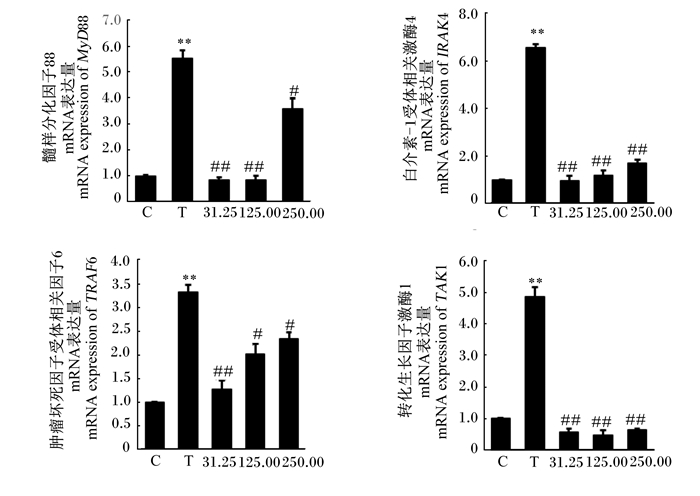
|
图 4 CTS对S. agalactiae引起的bMECs的MyD88、IRAK4、TRAF6和TAK1 mRNA表达的影响 Fig. 4 Effects of CTS on mRNA expression of MyD88, IRAK4, TRAF6 and TAK1 in bMECs induced by S. agalactiae |
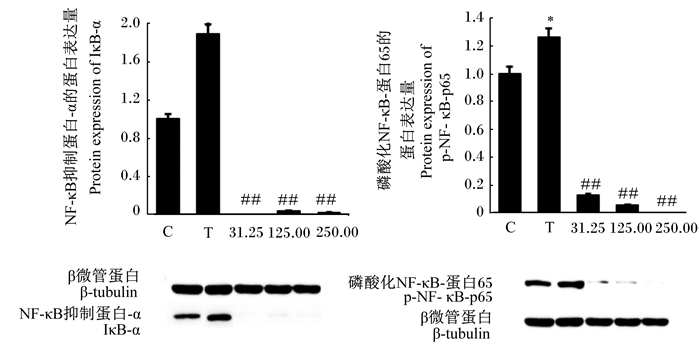
如图 5所示,与对照组相比,S. agalactiae显著提高了bMECs的IκB-α和p-NF-κB-p65的蛋白表达量(P < 0.05),而31.25、125.00和250.00 mg/mL的CTS均极显著降低了S. agalactiae引起的IκB-α和p-NF-κB-p65的蛋白表达量(P < 0.01)。
|
图 5 CTS对S. agalactiae引起的bMECs的IκB-α和p-NF-κB-p65蛋白表达的影响 Fig. 5 Effects of CTS on protein expression of IκB-α and p-NF-κB-p65 in bMECs induced by S. agalactiae |
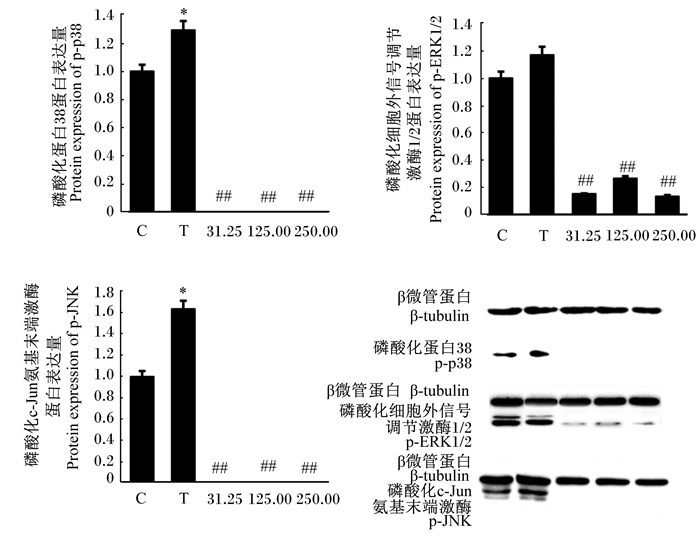
如图 6所示,与对照组相比,S. agalactiae显著提高了bMECs的p-p38和p-JNK蛋白表达量(P < 0.05),而31.25、125.00和250.00 mg/mL的CTS极显著降低了bMECs的p-p38、p-ERK1/2和p-JNK蛋白表达量(P < 0.01)。
|
图 6 CTS对S. agalactiae引起的bMECs的p-p38、p-ERK1/2和p-JNK蛋白表达的影响 Fig. 6 Effects of CTS on protein expression of p-p38, p-ERK1/2 and p-JNK in bMECs induced by S. agalactiae |
目前针对奶牛乳腺炎的首选方法仍旧是抗生素治疗[30],但由于抗生素的滥用导致的副作用使得寻找新的方法和途径治疗奶牛乳腺炎成为了兽医领域的重要研究方向。CTS是一种来源广泛的天然活性物质,在昆虫[22]、真菌[21]和甲壳类生物中含量丰富,性质稳定且易于提取。CTS和其衍生物具有众多优良生物化学特性,包括生物相容性、生物降解性和低过敏[23]以及抗菌和抗炎特性[24],但其对S. agalactiae的抑制作用以及对S. agalactiae引起的bMECs的炎性反应的影响还不清楚。本试验结果显示,在细菌培养6~8 h时,所有浓度的CTS表现出了对S. agalactiae增殖呈浓度依赖性的抑制效果;当细菌培养12 h以上时,125.00、250.00、500.00和1 000.00mg/mL的CTS表现出对S. agalactiae增殖呈浓度依赖性的抑制效果,说明CTS对S. agalactiae具有抑菌作用,且呈浓度依赖性。
在奶牛乳腺炎发生时,bMECs可以识别病原菌,分泌促炎细胞因子(如IL-6、IL-1β、TNF-α)和趋化因子(如IL-8),引发炎症反应[19]。IL-1β和TNF-α在早期炎症反应帮助宿主抵抗感染方面起着关键作用[31],而IL-6作为一种多功能细胞因子,在宿主防御、免疫应答等方面发挥重要作用[31]。IL-8是一种重要的趋化因子,其可以从血液中招募中性粒细胞到感染部位,清除病原体[32]。在本试验中,S. agalactiae刺激bMECs 6 h后,IL-6、IL-1β、TNF-α和IL-8的mRNA表达量显著上调,表明S. agalactiae诱导bMECs发生了炎性反应,促进了细胞分泌炎性因子启动免疫反应。而添加CTS显著抑制细胞因子的表达,31.25和125.00 mg/mL的CTS极显著降低了S. agalactiae引起的IL-6、IL-1β、TNF-α和IL-8的mRNA表达量;250.00 mg/mL的CTS显著降低了S. agalactiae引起的IL-1β的mRNA表达量,极显著降低了IL-6、TNF-α和IL-8的mRNA表达量。Yoon等[33]的研究也显示,CTS能够降低脂多糖刺激的小鼠巨噬细胞TNF-α和IL-6的表达,降低炎症反应的发生。因此,本试验结果表明,CTS可以抑制S. agalactiae引起的bMECs的炎性反应,降低细胞的损伤。
研究发现,TLR2在识别革兰氏阳性菌、启动细胞免疫反应方面发挥着重要作用[34],活化的TLR2通过MyD88依赖型信号途径,激活MyD88和IRAKs,随后使TRAF6活化并募集到IRAK4[17],活化的TRAF6通过K63串联多泛素化激活TAK1,最终导致激活NF-κB和MAPK[16, 18]。本研究结果显示,S. agalactiae可以活化bMECs的TLR2,而CTS极显著降低了S. agalactiae引起的TLR2的激活。此外,S. agalactiae极显著提高了bMECs的MyD88、IRAK4、TRAF6和TAK1的mRNA表达量,而31.25、125.00和250.00 mg/mL的CTS显著或极显著降低了MyD88、IRAK4、TRAF6和TAK1的mRNA表达量。这些结果表明,TLR2在bMECs识别S. agalactiae方面发挥作用,S. agalactiae可以通过TLR2受体信号转导通路诱导bMECs的炎症反应,而CTS可以抑制S. agalactiae引起的TLR2受体活化,进而有效降低细胞的炎症反应。
TLR2识别病原后触发下游的MyD88依赖型信号级联反应,激活NF-κB和MAPK及其相关信号通路,促进炎性介质的产生[35-37]。NF-κB的激活途径有2种,其中经典的信号转导途径中,NF-κB的p50/p65二聚体与抑制蛋白IκB-α结合,保持无活性的静息状态[38],当接收到上游传导的信号后,IKK被激活,继而使IκB-α磷酸化,随后IκB-α发生泛素化并降解,NF-κB被释放到核内发挥转录功能[39]。然而,NF-κB能够调节IκB-α的合成,活化的NF-κB会促进IκB-α的表达来负反馈调节自身,因此,NF-κB的活性保持在一个动态变化状态[40-42]。感染的发生也伴随着MAPK的活化,其下游的许多目的基因如AP-1,都与多种炎症因子的转录表达密切相关[43-44]。在本试验中,S. agalactiae感染bMECs 6 h后,IκB-α蛋白表达量和NF-κB-p65、p38和JNK的磷酸化水平发生了显著的上调,表明S. agalactiae激活了bMECs的NF-κB和MAPK信号通路。31.25、125.00和250.00 mg/mL的CTS显著降低了S. agalactiae引起的bMECs的IκB-α、p-NF-κB-p65、p-p38、p-ERK1/2和p-JNK的蛋白表达量,说明CTS可以抑制S. agalactiae诱导的NF-κB和MAPK信号通路的活化,从而控制细胞的炎症反应。
4 结论bMECs通过TLR2识别S. agalactiae,激活TLR2受体信号转导通路,引起细胞的炎症反应。CTS通过抑制TLR2受体信号转导通路的激活,降低NF-κB-p65、p38、ERK1/2和JNK的磷酸化水平,抑制了NF-κB和MAPK信号通路的转导,减少了炎性细胞因子IL-6、IL-1β、TNF-α和IL-8的mRNA表达,从而减弱S. agalactiae诱导的bMECs的炎性损伤作用。
| [1] |
AKERS R M, NICKERSON S C. Mastitis and its impact on structure and function in the ruminant mammary gland[J]. Journal of Mammary Gland Biology and Neoplasia, 2011, 16(4): 275-289. DOI:10.1007/s10911-011-9231-3 |
| [2] |
MIR A Q, BANSAL B K, GUPTA D K. Subclinical mastitis in machine milked dairy farms in Punjab:prevalence, distribution of bacteria and current antibiogram[J]. Veterinary World, 2014, 7(5): 291-294. DOI:10.14202/vetworld.2014.291-294 |
| [3] |
RASZEK M M, GUAN L L, PLASTOW G S. Use of genomic tools to improve cattle health in the context of infectious diseases[J]. Frontiers in Genetics, 2016, 7: 30. |
| [4] |
金尔光, 曾新华, 周木清, 等. 奶牛乳房炎研究概况[J]. 养殖与饲料, 2008(6): 69-72. DOI:10.3969/j.issn.1671-427X.2008.06.036 |
| [5] |
HUANG J M, WANG X G, JIANG Q, et al. Identification of CD14 transcript in blood polymorphonuclear neutrophil leukocytes and functional variation in Holsteins[J]. Genetics and Molecular Research, 2016, 15(2): gmr.15027932. |
| [6] |
VAN SOEST F J S, SANTMAN-BERENDS I M G A, LAM T J G M, et al. Failure and preventive costs of mastitis on Dutch dairy farms[J]. Journal of Dairy Science, 2016, 99(10): 8365-8374. DOI:10.3168/jds.2015-10561 |
| [7] |
ZADOKS R N, MIDDLETON J R, MCDOUGALL S, et al. Molecular epidemiology of mastitis pathogens of dairy cattle and comparative relevance to humans[J]. Journal of Mammary Gland Biology and Neoplasia, 2011, 16(4): 357-372. DOI:10.1007/s10911-011-9236-y |
| [8] |
OLIVER S P, LEWIS M J, KING S H, et al. Efficacy of a low concentration iodine postmilking teat disinfectant against contagious and environmental mastitis pathogens in two dairy herds[J]. Journal of Food Protection, 1991, 54(9): 737-742. DOI:10.4315/0362-028X-54.9.737 |
| [9] |
ALMEIDA A, ALVES-BARROCO C, SAUVAGE E, et al. Persistence of a dominant bovine lineage of group B Streptococcus reveals genomic signatures of host adaptation[J]. Environmental Microbiology, 2016, 18(11): 4216-4229. DOI:10.1111/1462-2920.13550 |
| [10] |
JØRGENSEN H J, NORDSTOGA A B, SVILAND S, et al. Streptococcus agalactiae in the environment of bovine dairy herds-rewriting the textbooks?[J]. Veterinary Microbiology, 2016, 184: 64-72. DOI:10.1016/j.vetmic.2015.12.014 |
| [11] |
WITZEL D A. Rhythmic contractions of the teat sphincter in the bovine[J]. Journal of Dairy Science, 1965, 48(2): 251-252. |
| [12] |
BOKOCH G M, KNAUS U G. NADPH oxidases:not just for leukocytes anymore![J]. Trends in Biochemical Sciences, 2003, 28(9): 502-508. DOI:10.1016/S0968-0004(03)00194-4 |
| [13] |
RINALDI M, LI R W, CAPUCO A V. Mastitis associated transcriptomic disruptions in cattle[J]. Veterinary Immunology and Immunopathology, 2010, 138(4): 267-279. DOI:10.1016/j.vetimm.2010.10.005 |
| [14] |
SCHUKKEN Y H, GVNTHER J, FITZPATRICK J, et al. Host-response patterns of intramammary infections in dairy cows[J]. Veterinary Immunology and Immunopathology, 2011, 144(3/4): 270-289. |
| [15] |
金伯泉. 固有免疫中模式识别受体及其信号转导——当代免疫学中最伟大的发现之一[J]. 细胞与分子免疫学杂志, 2006, 22(1): 1-3. DOI:10.3321/j.issn:1007-8738.2006.01.001 |
| [16] |
KUMAR H, KAWAI T, AKIRA S. Toll-like receptors and innate immunity[J]. Biochemical and Biophysical Research Communications, 2009, 388(4): 621-625. DOI:10.1016/j.bbrc.2009.08.062 |
| [17] |
MEADS M B, LI Z W, DALTON W S. A novel TNF receptor-associated factor 6 binding domain mediates NF-κB signaling by the common cytokine receptor β subunit[J]. Journal of Immunology, 2010, 185(3): 1606-1615. DOI:10.4049/jimmunol.0902026 |
| [18] |
HINES D J, CHOI H B, HINES R M, et al. Prevention of LPS-induced microglia activation, cytokine production and sickness behavior with TLR4 receptor interfering peptides[J]. PLoS One, 2013, 8(3): e60388. DOI:10.1371/journal.pone.0060388 |
| [19] |
CALZADO M A, BACHER S, SCHMITZ M L. NF-κB inhibitors for the treatment of inflammatory diseases and cancer[J]. Current Medicinal Chemistry, 2007, 14(3): 367-376. DOI:10.2174/092986707779941113 |
| [20] |
KERRO D O, OLIVER S P, ALMEIDA R A. Host-pathogen gene expression profiles during infection of primary bovine mammary epithelial cells with Escherichia coli strains associated with acute or persistent bovine mastitis[J]. Veterinary Microbiology, 2012, 155(2/3/4): 291-297. |
| [21] |
STREIT F, KOCH F, LARANJEIRA M C M, et al. Production of fungal chitosan in liquid cultivation using apple pomace as substrate[J]. Brazilian Journal of Microbiology, 2009, 40(1): 20-25. DOI:10.1590/S1517-83822009000100003 |
| [22] |
SONG C, YU H, ZHANG M, et al. Physicochemical properties and antioxidant activity of chitosan from the blowfly Chrysomya megacephala larvae[J]. International Journal of Biological Macromolecules, 2013, 60: 347-354. DOI:10.1016/j.ijbiomac.2013.05.039 |
| [23] |
ANITHA A, SOWMYA S, KUMAR P T S, et al. Chitin and chitosan in selected biomedical applications[J]. Progress in Polymer Science, 2014, 39(9): 1644-1667. DOI:10.1016/j.progpolymsci.2014.02.008 |
| [24] |
VERLEE A, MINCKE S, STEVENS C V. Recent developments in antibacterial and antifungal chitosan and its derivatives[J]. Carbohydrate Polymers, 2017, 164: 268-283. DOI:10.1016/j.carbpol.2017.02.001 |
| [25] |
CHIEN R C, YEN M T, MAU J L. Antimicrobial and antitumor activities of chitosan from shiitake stipes, compared to commercial chitosan from crab shells[J]. Carbohydrate Polymers, 2016, 138: 259-264. DOI:10.1016/j.carbpol.2015.11.061 |
| [26] |
TSAI G J, SU W H, CHEN H C, et al. Antimicrobial activity of shrimp chitin and chitosan from different treatments and applications of fish preservation[J]. Fisheries Science, 2002, 68(1): 170-177. DOI:10.1046/j.1444-2906.2002.00404.x |
| [27] |
LI J H, WU Y G, ZHAO L Q. Antibacterial activity and mechanism of chitosan with ultra high molecular weight[J]. Carbohydrate Polymers, 2016, 148: 200-205. DOI:10.1016/j.carbpol.2016.04.025 |
| [28] |
LIN S B, CHEN S H, PENG K C. Preparation of antibacterial chito-oligosaccharide by altering the degree of deacetylation of β-chitosan in a Trichoderma harzianum chitinase-hydrolysing process[J]. Journal of the Science of Food and Agriculture, 2009, 89(2): 238-244. DOI:10.1002/jsfa.3432 |
| [29] |
YANG J W, TIAN G, CHEN D W, et al. Involvement of PKA signalling in anti-inflammatory effects of chitosan oligosaccharides in IPEC-J2 porcine epithelial cells[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(1): 252-259. DOI:10.1111/jpn.12686 |
| [30] |
LI F Y, FU Y H, LIU B, et al. Stevioside suppressed inflammatory cytokine secretion by downregulation of NF-κB and MAPK signaling pathways in LPS-stimulated RAW264.7 cells[J]. Inflammation, 2012, 35(5): 1669-1675. DOI:10.1007/s10753-012-9483-0 |
| [31] |
BANNERMAN D D. Pathogen-dependent induction of cytokines and other soluble inflammatory mediators during intramammary infection of dairy cows[J]. Journal of Animal Science, 2009, 87(Suppl.13): 10-25. |
| [32] |
ZBINDEN C, STEPHAN R, JOHLER S, et al. The inflammatory response of primary bovine mammary epithelial cells to Staphylococcus aureus strains is linked to the bacterial phenotype[J]. PLoS One, 2014, 9(1): e87374. DOI:10.1371/journal.pone.0087374 |
| [33] |
YOON H J, MOON M E, PARK H S, et al. Chitosan oligosaccharide (COS) inhibits LPS-induced inflammatory effects in RAW 264.7 macrophage cells[J]. Biochemical and Biophysical Research Communications, 2007, 358(3): 954-959. DOI:10.1016/j.bbrc.2007.05.042 |
| [34] |
YANG W, ZERBE H, PETZL W, et al. Bovine TLR2 and TLR4 properly transduce signals from Staphylococcus aureus and E. coli, but S. aureus fails to both activate NF-κB in mammary epithelial cells and to quickly induce TNFα and interleukin-8(CXCL8) expression in the udder[J]. Molecular Immunology, 2008, 45(5): 1385-1397. DOI:10.1016/j.molimm.2007.09.004 |
| [35] |
OVIEDO-BOYSO J, VALDEZ-ALARCÓN J J, CAJERO-JUÁREZ M, et al. Innate immune response of bovine mammary gland to pathogenic bacteria responsible for mastitis[J]. Journal of Infection, 2007, 54(4): 399-409. DOI:10.1016/j.jinf.2006.06.010 |
| [36] |
VUNTA H, DAVIS F, PALEMPALLI U D, et al. The anti-inflammatory effects of selenium are mediated through 15-deoxy-Δ12, 14-prostaglandin J2 in macrophages[J]. The Journal of Biological Chemistry, 2007, 282(25): 17964-17973. DOI:10.1074/jbc.M703075200 |
| [37] |
GHOSH S, HAYDEN M S. New regulators of NF-κB in inflammation[J]. Nature Reviews Immunology, 2008, 8(11): 837-848. DOI:10.1038/nri2423 |
| [38] |
FANG L, WU H M, DING P S, et al. TLR2 mediates phagocytosis and autophagy through JNK signaling pathway in Staphylococcus aureus-stimulated RAW264.7 cells[J]. Cellular Signalling, 2014, 26(4): 806-814. DOI:10.1016/j.cellsig.2013.12.016 |
| [39] |
CELEC P. Nuclear factor kappa B-molecular biomedicine:the next generation[J]. Biomedicine & Pharmacotherapy, 2004, 58(6/7): 365-371. |
| [40] |
ZHANG W, ZHANG R X, WANG T C, et al. Selenium inhibits LPS-induced pro-inflammatory gene expression by modulating MAPK and NF-κB signaling pathways in mouse mammary epithelial cells in primary culture[J]. Inflammation, 2014, 37(2): 478-485. DOI:10.1007/s10753-013-9761-5 |
| [41] |
CROY C H, BERGQVIST S, HUXFORD T, et al. Biophysical characterization of the free IκBα ankyrin repeat domain in solution[J]. Protein Science, 2004, 13(7): 1767-1777. DOI:10.1110/ps.04731004 |
| [42] |
HOFFMANN A, LEVCHENKO A, SCOTT M L, et al. The IκB-NF-κB signaling module:temporal control and selective gene activation[J]. Science, 2002, 298(5596): 1241-1245. DOI:10.1126/science.1071914 |
| [43] |
CARIO E, ROSENBERG I M, BRANDWEIN S L, et al. Lipopolysaccharide activates distinct signaling pathways in intestinal epithelial cell lines expressing Toll-like receptors[J]. Journal of Immunology, 2000, 164(2): 966-972. DOI:10.4049/jimmunol.164.2.966 |
| [44] |
BEAUDOIN T, LAFAYETTE S, ROUSSEL L, et al. The level of P38α mitogen-activated protein kinase activation in airway epithelial cells determines the onset of innate immune responses to planktonic and biofilm Pseudomonas aeruginosa[J]. The Journal of Infectious Diseases, 2013, 207(10): 1544-1555. DOI:10.1093/infdis/jit059 |




