2. 贵州大学新农村发展研究院, 贵阳 550025;
3. 贵州省山地畜禽养殖污染控制与资源化技术工程实验室, 贵阳 550025
2. Institute of New Rural Development, Guizhou University, Guiyang 550025, China;
3. Engineering Key Laboratory of Plateau Mountain Livestock Pollution Control and Resource Reuse Technology of Guizhou Province, Guiyang 550025, China
我国蛋白质饲料资源较长时间处于短缺状态,进口依存度较高,制约了我国饲料工业和养殖业的持续发展。与此同时,作为养殖大国,我国肉、蛋、奶等畜产品产量连续多年位居全球首位,但相应产生的大量动物粪便严重污染了生态环境,不利于生态文明建设。从动物营养学专业的角度出发,降低饲粮蛋白质水平是减少氮排泄、减轻粪便污染环境的有效途径。但一般情况下,低蛋白质水平饲粮意味着缺乏必需氨基酸(essential amino acids,EAA),因此使用低蛋白质水平饲粮时需额外添加此类EAA。研究表明,对猪、鸡而言,低蛋白质水平饲粮下添加适当氨基酸可以满足动物生长需求,不会降低其生长性能和产品品质[1-3]。以此为基础,2018年10月26日,中国饲料工业协会批准发布《仔猪、生长育肥猪配合饲料》《蛋鸡、肉鸡配合饲料》2项团体标准,增设了粗蛋白质(crude protein,CP)、总磷上限值,有效减少了豆粕等蛋白质饲料原料用量。
蛋氨酸(methionine,Met)作为动物的前2位限制性氨基酸(limiting amino acids,LAA)之一,是动物机体内的重要含硫氨基酸,对动物维持、生长、繁殖和泌乳等生命活动十分重要,在低蛋白质水平饲粮中极易缺乏。对山羊来说,直接添加蛋氨酸会被瘤胃微生物降解而降低其生物功效,因此常以过瘤胃蛋氨酸(rumen-protected methionine,RPMet)的形式添加,但目前针对山羊低蛋白质水平饲粮补饲RPMet的研究报道较少。本课题组前期研究表明,在山羊常规蛋白质水平饲粮(CP含量12.1%)中添加RPMet(10 g/d)可提高饲粮CP表观消化率,且不影响生长性能、血浆生化指标及瘤胃发酵参数[4]。在此基础上,本试验拟在降低山羊饲粮蛋白质水平的同时添加RPMet,研究其对山羊饲粮养分消化率、血浆生化和抗氧化指标及瘤胃发酵参数的影响,为制订反刍动物低蛋白质水平饲粮标准及应用提供数据参考。
1 材料与方法 1.1 试验设计试验按单因素随机区组设计,选择体况良好,年龄、体重[(32.43±1.84) kg]相近的黔北麻羊(贵州地方品种)18只,随机分为3组(对照组、Ⅰ组、Ⅱ组),每组6个重复,每个重复1只羊。3组饲粮蛋白质水平分别设定为12%、10%、10%。参考《中国肉用山羊饲养标准(2004)》[5]配制对照组饲粮,且不添加RPMet;Ⅰ组、Ⅱ组的饲粮在对照组饲粮基础上蛋白质水平降低2个百分点,且分别添加0.2%、0.4%的RPMet。RPMet过瘤胃率为85%,饲粮精粗比为40 : 60,试验饲粮组成及营养水平见表 1。由于饲粮成分有所调整,饲粮CP含量实测值与设定值略有差异,稍高于预定水平。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验羊联排单笼全舍饲,自然通风,统一管理。每天定时饲喂2次(09:00和18:00),自由采食及饮水。RPMet按比例与精料逐级混匀后饲喂,且先饲喂精料后饲喂粗料,保证试验羊充分完全采食RPMet。试验共持续31 d,前10天用于观察试验羊健康状况及采食行为;之后进入试验期,包括预试期14 d和正试期7 d。
1.3 检测指标 1.3.1 生长性能每天晨饲前准确记录每只羊的饲粮饲喂量和剩余量,记录干物质采食量(dry matter intake,DMI),在预试期开始第1天和正试期最后1天试验羊空腹重,分别记为始重和末重,计算平均净增重(average net gain, ANG)、平均日增重(average daily gain, ADG)及料重比(feed to gain ratio, F/G),计算公式如下:

|
自预试期开始,每3 d采集1次饲粮样品。正试期最后5天连续收集新鲜粪样后及时加入10%盐酸固氮。将收集到的饲粮样及粪样按四分法取样,65 ℃烘干、回潮24 h,粉碎,制备成分析试样,参照《饲料分析及饲料质量检测技术》[6]测定概略养分含量。其中,总能(gross energy,GE)采用氧弹式测热仪测定,ME参照杜飞[7]估算,CP含量采用凯氏定氮法(K1100F,Hanon)测定,粗脂肪(ether extract, EE)含量采用乙醚浸提法测定,有机物(organic matter, OM)、酸不溶灰分(acid-insoluble ash, AIA)含量采用灼烧法测定,中性洗涤纤维(neutral detergent fiber, NDF)、酸性洗涤纤维(acid detergent fiber, ADF)含量采用Van Soest纤维素分析法测定。采用内源指示剂法(4 mol/L AIA法)计算养分消化率,计算公式为:
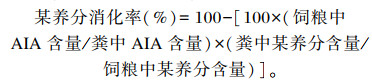
|
正试期第6天晨饲前用一次性肝素钠抗凝血真空采样管经颈静脉采血10 mL,805×g离心15 min,收集上层血浆,采用试剂盒法测定总蛋白(total protein, TP)、白蛋白(albumin, ALB)、总氨基酸(total amino acid, TAA)、尿素氮(urea nitrogen, UN)、尿酸(uric acid, UA)、肌酐(creatinine, Cr)、丙二醛(malondialdehyde, MDA)含量及碱性磷酸酶(alkaline phosphatase, AKP)、谷草转氨酶(aspartate transaminase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、过氧化氢酶(catalase, CAT)活性。检测试剂盒均购自南京建成生物工程研究所,采用全波段酶标仪(Synergy H4,美国BioTek公司)进行指标检测。
1.3.4 瘤胃发酵参数正试期最后1天用胃管式瘤胃液采样器(VP 30,北京莱伯泰科)经口腔插入瘤胃抽取瘤胃液,共采集3次,时间间隔为4 h(分别在09:00、13:00、17:00采集)。瘤胃液经4层纱布过滤后,用事先校准好的便携式pH计(PHS-3C,上海佑科)测定pH。剩余瘤胃液经4 000 r/min离心10 min后,采集上清液,测定氨态氮(NH3-N)浓度[8]、纤维素酶(微晶纤维素酶、羧甲基纤维素酶、纤维二糖酶与木聚糖酶)活性和挥发性脂肪酸(volatile fatty acid, VFA)浓度。
VFA浓度用气相色谱仪(GC-2010-plus,日本岛津)测定,测定条件为:色谱柱SH-Rtx-WAX(30.00 m×0.25 mm×0.25 μm);火焰氢离子检测器(FID)、气化室温度均分别为220、200 ℃;柱温初始温度为100 ℃,按照5 ℃/min,升至150 ℃;以巴豆酸作为内标物。
1.4 数据统计与分析应用SAS 9.2统计软件进行单因素方差分析,各组间平均值的多重比较采用Duncan氏法。试验数据以平均值±标准差(mean±SD)表示,P < 0.05为差异显著。
2 结果 2.1 低蛋白质水平饲粮添加RPMet对黔北麻羊生长性能的影响由表 2可知,各组试验羊的末重、DMI、ANG、ADG、F/G差异不显著(P>0.05)。
|
|
表 2 低蛋白质水平饲粮添加RPMet对黔北麻羊生长性能的影响 Table 2 Effects of RPMet supplementation in low protein level diet on growth performance of Qianbei brown goats |
由表 3可知,Ⅱ组CP、EE消化率显著高于对照组和Ⅰ组(P < 0.05),CP消化率分别提高了11.51%、11.02%,EE消化率分别提高了9.28%、7.71%。各组NDF、ADF、OM消化率差异不显著(P>0.05)。
|
|
表 3 低蛋白质水平饲粮添加RPMet对黔北麻羊饲粮养分消化率的影响 Table 3 Effects of RPMet supplementation in low protein level diet on nutrient digestibilities of Qianbei brown goats |
由表 4可知,各组血浆TP、ALB、TAA、UN、UA、Cr含量及AKP、AST、ALT活性差异不显著(P>0.05)。
|
|
表 4 低蛋白质水平饲粮添加RPMet对黔北麻羊血浆生化指标的影响 Table 4 Effects of RPMet supplementation in low protein level diet on plasma biochemical indexes of Qianbei brown goats |
由表 5可知,各组血浆SOD、GSH-Px、CAT活性及MDA含量差异不显著(P>0.05)。
|
|
表 5 低蛋白质水平饲粮添加RPMet对黔北麻羊血浆抗氧化指标的影响 Table 5 Effects of RPMet supplementation in low protein level diet on plasma antioxidant indexes of Qianbei brown goats |
由表 6可知,各组3个时间点的pH均处于正常范围(6.87~7.09),且各组间差异不显著(P>0.05)。各组NH3-N浓度及纤维素酶(微晶纤维素酶、木聚糖酶、纤维二糖酶、羧甲基纤维素酶)活性差异不显著(P>0.05)。
|
|
表 6 低蛋白质水平饲粮添加RPMet对黔北麻羊瘤胃液pH、NH3-N浓度及纤维素酶活性的影响 Table 6 Effects of RPMet supplementation in low protein level diet on pH, NH3-N concentration and cellulose activities in rumen of Qianbei brown goats |
由表 7可知,各组间3个时间点的乙酸/总挥发性脂肪酸、丙酸/总挥发性脂肪酸、丁酸/总挥发性脂肪酸和乙酸/丙酸差异不显著(P>0.05)。
|
|
表 7 低蛋白质水平饲粮添加RPMet对黔北麻羊瘤胃液挥发性脂肪酸比例的影响 Table 7 Effects of RPMet supplementation in low protein level diet on rumen volatile fatty acids proportion of Qianbei brown goats |
蛋氨酸作为山羊重要的限制性氨基酸,对山羊的生长起着至关重要的作用,可在动物体内能合成机体蛋白质,并能够很快转化为胱氨酸,满足动物营养需要,同时作为甲基供体之一,参与脂肪代谢、氨基酸的转移和再生。王萌等[9]研究表明,与对照组相比,舍饲滩羊基础饲粮中添加4 g/d RPMet可显著提高滩羊羔羊的全期总增重,ADG较对照组提高了43.25%,说明添加RPMet可促进滩羊生长。但也有研究报道与此不同。张艳梅等[10]用苜蓿与复合化学处理稻草以40 : 60组合作为粗饲料,在精粗比为30 : 70的饲粮中分别添加1.5、3.0、4.5和6.0 g/d的RPMet,结果发现,与对照组相比,试验组舍饲滩羊总增重和ADG均无显著影响,F/G均低于对照组。本试验中,与对照组相比,低蛋白质水平饲粮添加RPMet对山羊生长性能没有影响,各组末重、DMI、ANG、ADG和F/G均无显著差异。这可能是由于试验羊处于即将成年阶段,初始体重已接近成年体重,且试验期仅持续31 d,使体重增幅有限。
3.2 低蛋白质水平饲粮添加RPMet对黔北麻羊养分消化率的影响研究表明,饲粮中蛋白质水平降低会降低动物的生长性能、养分消化率和氨基酸消化率,同时还会改变动物氨基酸代谢平衡和氨基酸转换[11]。为了维持氨基酸平衡,常常在饲粮中添加一定水平限制性氨基酸。蛋氨酸作为反刍动物的高位限制性氨基酸,极大影响着氨基酸平衡。王杰等[12]研究指出,低蛋氨酸水平降低了湖羊对饲粮养分的消化率,但在提高蛋氨酸水平后,饲粮消化率随之提高。本试验中,与基础饲粮相比,低蛋白质水平饲粮添加0.4%的RPMet显著提高了CP消化率。这可能是因为添加RPMet提高了小肠可吸收氨基酸的含量,增加机体可利用氨基酸含量,使CP消化率随之提高。本试验还发现,低蛋白质水平饲粮添加0.4%的RPMet显著提高了EE消化率。刘保仓[13]认为,作为赖氨酸和蛋氨酸的代谢产物,肉毒碱是机体脂肪代谢的重要载体,RPMet的添加增加了肉毒碱的产量,参与了脂肪代谢,继而提高了EE消化率。黄健[11]研究发现,低蛋白质水平饲粮添加RPMet可显著提高梅花鹿幼鹿越冬后期CP、EE消化率。周玉香等[14]在舍饲滩羊中发现,饲粮添加4.5 g/d RPMet时氮利用率最高。El-Tahawy[15]研究发现,饲粮添加RPMet可提高羔羊CP、EE消化率。综上所述,饲粮添加RPMet可提高反刍动物饲粮CP、EE消化率。
3.3 低蛋白质水平饲粮添加RPMet对黔北麻羊血浆生化和抗氧化指标的影响 3.3.1 低蛋白质水平饲粮添加RPMet对黔北麻羊血浆生化指标的影响血浆生化指标是反映动物体内物质代谢和某些组织器官机能状态变化的重要指标。TAA、TP、ALB、UN、UA和Cr含量在一定程度上反映了动物机体内血浆蛋白质合成和分解及氨基酸代谢情况。当饲粮中蛋白质不足或氨基酸不平衡时,体内由于缺少合成蛋白质的原料,导致机体对养分的吸收利用被限制,血浆中TAA、TP、ALB、Cr含量会下降,而UN、UA含量则增加。杨维仁等[16]在研究瘤胃投饲不同形式的RPMet对肉牛血浆生化指标的影响时发现,以动物油包被的RPMet能显著提高血浆TAA含量,显著降低血浆UN含量,有效改善血液氮代谢。姜宁等[17]指出,饲粮中添加不同形式的蛋氨酸不会影响奶牛血浆TP、ALB及UN含量。张成喜等[18]报道,RPMet对奶牛血浆ALB、Cr含量及ALT活性没有显著影响。本试验中,与对照组相比,Ⅰ组、Ⅱ组血浆TAA、TP、ALB、Cr含量有所升高,血浆UN、UA含量有所下降,但差异不显著。这提示RPMet有改善血液氮代谢的潜力。
AKP、AST、ALT活性与动物的肝脏健康有关,参与机体氨基酸代谢,是其中重要的酶。AKP广泛存在于生物界和动物脏器中,在生物磷代谢过程中具有重要作用,有益于皮肤细胞的新陈代谢及再生[19]。正常情况下,AST和ALT活性相对稳定,若其活性升高幅度过大,表示心脏和肝脏可能受损[20]。本试验中,各组山羊血浆AST、ALT、AKP活性变化不大,差异不显著,说明RPMet对山羊心脏和肝脏没有造成损伤。郝薪云等[21]研究也表明,饲粮蛋氨酸水平对羊驼血清AKP、AST及ALT活性未产生显著影响。韩兆玉等[22]在夏季热应激奶牛上也发现类似结果。
3.3.2 低蛋白质水平饲粮添加RPMet对黔北麻羊血浆抗氧化指标的影响蛋氨酸在肝脏中通过转硫途径合成半胱氨酸,半胱氨酸在谷胱甘肽合成酶催化下合成谷胱甘肽(GSH),因此,饲粮添加蛋氨酸可通过调节机体内谷胱甘肽系统而提高抗氧化能力[23]。同时,蛋氨酸自身也是一种抗氧化剂,其化学结构中含有的二硫键可与活性氧作用生成蛋氨酸亚砜,蛋氨酸亚砜在蛋氨酸亚砜还原酶的作用下重新生成蛋氨酸,从而阻止活性氧对蛋白质造成氧化损伤,维持蛋白质结构和空间构象的完整性[24]。
SOD、CAT、GSH-Px活性及MDA含量是用来衡量动物机体抗氧化能力的重要指标。当机体的抗氧化能力增强时,血浆SOD、CAT、GSH-Px活性会随之升高,血浆MDA含量则降低。周国波[25]研究发现,给热应激奶牛补饲蛋氨酸羟基类似物异丙酯可提高其血浆GSH-Px、SOD活性,同时降低血浆MDA含量,表明给奶牛添加瘤胃保护性含硫氨基酸可提高抗氧化能力。韩兆玉等[22]研究表明,在热应激条件下补饲RPMet后,奶牛血浆SOD、GSH-Px活性升高,血浆MDA含量降低。本试验中,低蛋白质水平饲粮添加RPMet对山羊血浆抗氧化指标没有显著影响。
3.4 低蛋白质水平饲粮添加RPMet对黔北麻羊瘤胃发酵参数的影响 3.4.1 低蛋白质水平饲粮添加RPMet对黔北麻羊瘤胃pH、NH3-N浓度的影响相对稳定的瘤胃内环境是瘤胃微生物定殖与发挥功能的重要条件。瘤胃pH是食糜中的挥发性脂肪酸与唾液中缓冲盐相互作用,以及瘤胃上皮对挥发性脂肪酸吸收和随食糜外流等因素综合作用的结果,与饲粮类型、采食和反刍时间有关。瘤胃pH是反映瘤胃内环境是否正常的最重要指标,适宜的瘤胃pH是微生物正常活动的前提,pH过高或过低都会影响微生物发酵。瘤胃细菌、原虫和厌氧性真菌的适宜pH分别为6.0~7.0、5.8和7.5。韩占强等[26]在奶牛饲粮中添加用不同工艺制成的RPMet,结果发现,瘤胃pH不受RPMet的影响。本试验中,各组瘤胃pH在3个时间点均没有显著差异,在6.87~7.09变动,处于正常范围。
NH3-N是瘤胃内饲粮蛋白质、肽、氨基酸及非蛋白氮的消化代谢产物,也是合成微生物蛋白质的重要氮源。测定瘤胃液中NH3-N浓度可以间接反映瘤胃微生物分解饲粮蛋白质产生NH3-N和利用NH3-N合成微生物蛋白质的平衡情况。适宜的NH3-N浓度有利于瘤胃微生物发酵,浓度过低会影响微生物蛋白质的合成,过高则可能会造成氨中毒。李文华等[27]研究表明,瘤胃投饲不同水平DL-蛋氨酸(0、4、6、8 g/d)对NH3-N浓度没有显著影响。本试验条件下,与对照组相比,低蛋白质水平饲粮添加RPMet有降低瘤胃NH3-N浓度的趋势,说明RPMet可满足瘤胃微生物对蛋氨酸的需要,使瘤胃微生物蛋白质合成增加,提高了饲粮蛋白质利用率。王剑飞等[28]在体外发酵试验中也得到了相似的结论。
3.4.2 低蛋白质水平饲粮添加RPMet对黔北麻羊瘤胃纤维素酶活性的影响瘤胃内纤维素在多种酶的协同作用下完成水解。因此,通过测定瘤胃纤维素酶活性,可间接说明瘤胃微生物对特定饲粮纤维素的分解能力。羧甲基纤维素酶作用于羧甲基纤维素分子,能使羧甲基纤维素C链长度变短,其与纤维二糖酶活性均可间接反映瘤胃纤维降解菌降解水溶性纤维素衍生物的能力;木聚糖酶则反映瘤胃降解菌分解消化半纤维素的能力。王贞贞等[29]在研究不同氮源对绵羊瘤胃内纤维素酶活性的影响时发现,氮源对绵羊瘤胃固相纤维素酶活性影响显著,棉籽粕组的微晶纤维素酶、果胶酶、葡萄糖苷酶和木聚糖酶的活性都显著高于鱼粉组。本试验结果显示,低蛋白质水平饲粮添加RPMet对不同时间点瘤胃微晶纤维素酶、木聚糖酶、纤维二糖酶及羧甲基纤维素酶活性均没有显著影响,与上述试验结论有所差异,这可能与试验羊品种、蛋氨酸添加水平、饲养管理等因素有关。
3.4.3 低蛋白质水平饲粮添加RPMet对黔北麻羊瘤胃挥发性脂肪酸比例的影响瘤胃微生物可将饲粮碳水化合物降解成挥发性脂肪酸,提供反刍动物总能量需要的70%~80%[30]。未保护的蛋氨酸在瘤胃微生物的作用下降解产生氨和酮酸,酮酸在微生物的作用下进一步发酵生成挥发性脂肪酸。本试验中,各组乙酸、丙酸、丁酸占总挥发性脂肪酸的比例没有显著差异。这可能是因为蛋氨酸经过包被处理后,在瘤胃内保持相对稳定不会被降解,对挥发性脂肪酸的影响较小。韩占强等[31]在研究棕榈油脂肪粉包被的RPMet对瘤胃挥发性脂肪酸浓度的影响时也发现,RPMet虽然有提高乙酸和丙酸浓度和降低丁酸浓度的趋势,但差异不显著。毕晓华等[32]研究发现,在荷斯坦泌乳牛饲粮中添加60 g/d RPMet,饲喂2~6 d后,奶牛瘤胃pH、NH3-N浓度、挥发性脂肪酸浓度及其占总挥发性脂肪酸的比例没有显著差异。这与本试验研究结果一致。
4 结论低蛋白质水平饲粮添加RPMet对黔北麻羊生长性能、血浆生化和抗氧化指标及瘤胃发酵参数没有产生负面影响,且添加0.4%的RPMet还可提高饲粮粗蛋白质和粗脂肪消化率。
| [1] |
NUKREAW R, BUNCHASAK C. 低蛋白日粮补充合成氨基酸及随后再饲喂对肉鸡生长性能、血脂概况和化学组成的影响[J]. 饲料博览, 2015(7): 17. |
| [2] |
魏立民, 刘圈炜, 孙瑞萍, 等. 低蛋白质日粮添加蛋氨酸对海南猪生长性能和饲料养分消化率的影响[J]. 饲料研究, 2019(5): 30-33. |
| [3] |
李宁, 谢春元, 曾祥芳, 等. 饲粮粗蛋白质水平和氨基酸平衡性对肥育猪生长性能、胴体性状和肉品质的影响[J]. 动物营养学报, 2018, 30(2): 498-506. |
| [4] |
李海霞, 杨美英, 吴文海, 等. 过瘤胃蛋氨酸对黔北麻羊生长性能、养分表观消化率、血浆生化指标及瘤胃发酵的影响[J]. 动物营养学报, 2019, 31(6): 2933-2940. |
| [5] |
兰云贤. 动物饲养标准[M]. 重庆: 西南师大出版社, 2008.
|
| [6] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版.北京: 中国农业大学出版社, 2007.
|
| [7] |
杜飞.20~35 kg萨福克×阿勒泰杂交母羊能量需要量的研究[D].硕士学位论文.武汉: 华中农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10504-1012458252.htm
|
| [8] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010(6): 40-41. |
| [9] |
王萌, 周玉香, 张艳梅, 等. 过瘤胃蛋氨酸对舍饲滩羊生产性能的影响[J]. 家畜生态学报, 2017, 38(1): 36-38, 51. |
| [10] |
张艳梅, 周玉香, 李雨蔚. 复合化学处理稻草饲粮中添加过瘤胃蛋氨酸对舍饲滩羊生长性能、屠宰性能和肉品质的影响[J]. 动物营养学报, 2019, 31(2): 962-969. |
| [11] |
黄健.低蛋白质日粮添加蛋氨酸和赖氨酸对梅花鹿幼鹿生长性能、消化代谢和血清生化指标的影响[D].硕士学位论文.北京: 中国农业科学院, 2015. http://d.wanfangdata.com.cn/Thesis/Y2787351
|
| [12] |
王杰, 崔凯, 王世琴, 等. 饲粮蛋氨酸水平对湖羊公羔营养物质消化、胃肠道pH及血清指标的影响[J]. 动物营养学报, 2017, 29(8): 3004-3013. |
| [13] |
刘保仓.过瘤胃赖氨酸在育肥牛羊精补料中的添加效果研究[D].硕士学位论文.石河子: 石河子大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10759-1015511290.htm
|
| [14] |
周玉香, 王萌, 李作明, 等. 过瘤胃蛋氨酸对舍饲滩羊消化代谢的影响[J]. 饲料工业, 2019, 40(1): 50-53. |
| [15] |
EL-TAHAWY A. Methionine-supplemented diet increases the general performance and value of Rahmani lambs[J]. Iranian Journal of Applied Animal Science, 2013, 3(3): 513-520. |
| [16] |
杨维仁, 姜淑贞, 杨在宾, 等. 瘤胃投饲不同形式蛋氨酸对肉牛营养物质消化率和血液指标的影响[J]. 畜牧兽医学报, 2004, 35(2): 160-166. |
| [17] |
姜宁, 张爱忠, 苗树君, 等. 补充蛋氨酸和小肽及过瘤胃保护处理对奶牛血液生化指标和氨基酸浓度的影响[J]. 中国畜牧杂志, 2005, 41(5): 31-34. |
| [18] |
张成喜, 刘吉山, 孙国强. 过瘤胃蛋氨酸对奶牛血液生化指标和养分消化率的影响[J]. 中国饲料, 2017(16): 20-23. |
| [19] |
唐靓婷.牛肝碱性磷酸酶的分离纯化、部分性质和功能基团及固定化研究[D].硕士学位论文.重庆: 西南大学, 2010.
|
| [20] |
崔萌萌, 李福昌, 王雪鹏, 等. 饲粮赖氨酸水平对生长獭兔生长性能、氮代谢及血清免疫和生化指标的影响[J]. 动物营养学报, 2012, 24(3): 472-478. |
| [21] |
郝薪云, 林英庭, 刘迎春, 等. 饲粮蛋氨酸水平对羊驼生产性能、养分表观消化率和血清生化指标的影响[J]. 动物营养学报, 2018, 30(6): 2209-2214. |
| [22] |
韩兆玉, 周国波, 金志红, 等. 过瘤胃蛋氨酸对热应激下奶牛生产性能、淋巴细胞凋亡以及相关基因的影响[J]. 动物营养学报, 2009, 21(5): 665-672. |
| [23] |
唐漾波, 欧阳佩珍. 过量蛋氨酸对大鼠肝、脑组织脂质过氧化作用的研究[J]. 营养学报, 1994, 16(4): 362-366. |
| [24] |
陈跃平.孵化重和日粮蛋氨酸水平对肉鸡生长、免疫及抗氧化机能的影响[D].硕士学位论文.南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013286309.htm
|
| [25] |
周国波.蛋氨酸羟基类似物异丙酯对热应激奶牛生产性能和血液生化指标的影响[D].硕士学位论文.南京: 南京农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012490362.htm
|
| [26] |
韩占强, 林英庭, 黄世成. 保护性赖氨酸对荷斯坦奶牛瘤胃发酵参数的影响[J]. 饲料工业, 2009, 30(21): 35-37. |
| [27] |
李文华, 王安, 赵庆枫, 等. 瘤胃添加DL-蛋氨酸对槐山羊瘤胃消化代谢的影响研究[J]. 中国畜牧兽医, 2007, 34(7): 21-25. |
| [28] |
王剑飞, 王梦芝, 冯春燕, 等. 过瘤胃蛋氨酸对奶牛瘤胃体外发酵及泌乳奶牛生产性能的影响[J]. 动物营养学报, 2015, 27(7): 2248-2255. |
| [29] |
王贞贞, 侯先志, 王海荣, 等. 不同氮源对绵羊瘤胃内固液相纤维素酶活的影响[J]. 内蒙古农业大学学报(自然科学版), 2008, 29(1): 4-9. |
| [30] |
SAUVANT D, BAUMONT R, FAVERDIN P. Development of a mechanistic model of intake and chewing activities of sheep[J]. Journal of Animal Science, 1996, 74(11): 2785-2802. |
| [31] |
韩占强, 林英庭, 赵发盛, 等. 不同保护性蛋氨酸对奶牛挥发性脂肪酸和菌体蛋白的影响[J]. 饲料工业, 2008, 29(15): 34-36. |
| [32] |
毕晓华, 张晓明. 过瘤胃保护蛋氨酸对奶牛营养物质消化、瘤胃发酵和氮代谢的影响[J]. 饲料研究, 2014(19): 45-49. |




