2. 中国水产科学研究院黑龙江水产研究所, 哈尔滨 150070;
3. 湖州师范学院生命科学学院, 浙江省水生生物资源养护与开发技术研究重点实验室, 湖州 313000
2. Heilongjiang River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070, China;
3. Zhejiang Provincial Key Laboratory of Aquatic Bioresource Conservation and Development Technology, College of Life Sciences, Huzhou Normal University, Huzhou 313000, China
饲料氨基酸平衡是影响肌肉生长的关键因素[1-2],蛋氨酸(Met)作为鱼类生长的必需氨基酸,是蛋白质合成的重要组分[3],目前Met对鲤鱼肌肉生长机理的研究尚不深入,因此研究Met对鲤鱼肌肉品质及肌肉合成相关基因表达的影响具有重要意义。肌肉生长一般为肌纤维的增生和肥大的共同结果,在大多数脊椎动物中,肌肉的增生一般出生后很快就会结束[4],但在鱼类物种的大部分生命周期中一直维持着肌肉的增生和肥大,直到达到成年鱼类时的体积[5]。Met作为鱼类的必需氨基酸,对鱼体正常的生长及新陈代谢都具有重要作用[6]。研究表明,Met是参与蛋白质合成的重要组分,以S-腺苷甲硫氨酸的形式作为多种化合物甲基化的供体,在机体众多代谢过程中具有重要地位,同时Met也是合成胱氨酸、胆碱等物质的前体[3]。饲料Met缺乏会严重降低鱼类的摄食量及增重率,使鱼类生长受阻,而在饲料中补充Met可以显著改善鱼类生长性能,其中胰岛素样生长因子-Ⅰ(IGF-Ⅰ)作为鱼类的重要生长因子在一定程度上受饲料Met水平的影响。研究发现,外源性补充Met可提高虹鳟(Oncorhynchus mykiss)[7]、斑点叉尾(Ictalurus punctatus)[8]及建鲤(Cyprinus carpio var. Jian)[9]等鱼类IGF-Ⅰ的基因表达量,但Met对鲤鱼IGF-Ⅰ所主导的肌肉合成通路的研究并不够深入。因此,本试验旨在探究不同水平Met对松浦镜鲤肌肉成分与品质以及IGF-Ⅰ所主导的肌肉合成通路的影响,为进一步探索Met在鱼类肌肉合成中的作用、改善肌肉品质提供理论依据。
1 材料与方法 1.1 试验饲料Met添加形式为DL-Met(纯度≥99%),购自Evonik Industries AG公司。根据鲤鱼营养需要[10]以及NRC(2011)[11]要求,以进口蒸汽鱼粉、豆粕、菜籽粕和棉籽粕为蛋白质源,以豆油、鱼油、大豆磷脂为脂肪源,配制成低Met基础饲料,并于基础饲料中分别添加0.1%、0.2%、0.3%、0.4%和0.5%的Met。将饲料原料粉碎后过80目筛,称重后将各原料逐级混合均匀,加入一定量的水,充分混匀后经小型制粒机加工成粒径为3 mm的颗粒饲料,常温风干后于-20 ℃冰箱保存备用。试验饲料组成及营养水平见表 1,试验饲料氨基酸组成分析见表 2,其中实测饲料Met水平分别为0.56%、0.66%、0.75%、0.83%、0.92%和1.01%。粗蛋白质含量采用半自动微量凯氏定氮法(GB/T 6432—2018)测定;粗脂肪含量采用索氏抽提法(GB/T 6433—2006)测定;粗灰分含量采用马弗炉灼烧法(GB/T 6438—2007)测定;干物质含量通过饲料水分含量计算得出,水分含量采用直接干燥法(GB/T 6435—2014)测定。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
|
|
表 2 试验饲料氨基酸组成分析(干物质基础) Table 2 Analysis of amino acid composition of experimental diets (DM basis) |
试验采用循环水养殖系统,该系统桶容积为500 L,养殖试验前彻底清理鱼缸并消毒。试验鱼购自黑龙江水产研究所呼兰试验站,试验前用4%食盐水进行鱼体消毒,驯化2周后,挑取540尾初始体质量为(24.42±0.19) g、规格相近的镜鲤幼鱼,随机分为6组,每组3个重复,每个重复30尾鱼。各组分别饲喂Met水平为0.56%(对照)、0.66%、0.75%、0.83%、0.92%和1.01%的等氮等能饲料。试验期8周。
试验期间光照均匀,试验用水为曝气控温后的自来水,每天换水20%并定期清洗鱼缸,保持水质良好,水温(23±0.5) ℃,溶氧浓度>5.0 mg/L,氨氮浓度<1.0 mg/L。试验期间,按鱼体重的4%投喂相应饲料,每天09:00、13:00和17:00各投喂1次。
1.3 样品采集和测定 1.3.1 样品采集养殖试验结束后,清点每缸试验鱼的数量并称重。每缸随机取3尾鱼,用100 mg/L MS-222麻醉,称量体重和体长,置于冰盘上解剖,将鱼体沿鳃盖后缘至背鳍第1鳍条处的侧线以上部位去皮,取下肌肉。将慢肌与快肌分离,其中快肌呈乳白或浅黄色,慢肌呈深红色[12],分别取下一部分放于液氮中,采样后置于-80 ℃保存,用于RNA提取及分子检测。将另外部分快肌分割成数块0.5 cm宽的小块,分别用于检测肌肉pH、滴水损失、蒸煮损失及抗氧化酶活性,剩余肌肉用于检测水分、粗蛋白质、粗脂肪及粗灰分含量。
1.3.2 生长性能

|
肌肉pH测定:每缸分别取3尾鱼同侧新鲜背肌,立即用肌肉pH直测仪(德国麦特斯pH-Star)测定pH,记为pH0 min;测定后装入密封袋中,4 ℃保存24 h,再次测定pH,记为pH24 h。
肌肉滴水损失测定:每缸分别取3尾鱼同侧新鲜背肌,吸水纸吸干背肌上的水分和血渍,称重;放于离心管中(离心管底部垫有适量吸水纸),于4 ℃、4 000 r/min离心20 min,取出肉样,吸水纸吸干肌肉表面的水分,称重。
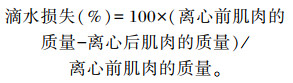
|
肌肉蒸煮损失测定:每缸分别取3尾鱼同侧新鲜背肌,吸水纸吸干背肌上的水分和血渍,称重,装入密封袋中;70 ℃隔水蒸煮15 min,取出肉样冷却,吸水纸吸干肌肉表面的水分,称重。
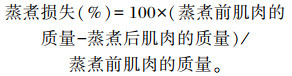
|
将待测的肌肉样品在4 ℃下解冻,称重后按1 : 9的质量体积比加入预冷的0.86%的生理盐水,然后采用FJ-200高速分散均质机(300~23 000 r/min)匀浆,匀浆液经4 000 r/min离心10 min,取上清,采用南京建成生物工程研究所生产的试剂盒检测超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)活性。
1.3.5 肌肉合成通路相关基因表达总RNA提取及反转录:取出备用的鲤鱼快肌及慢肌组织,用液氮研磨成粉末,按照Trizol试剂盒说明书的方法提取肌肉组织中的总RNA并溶解在焦碳酸二乙酯(DEPC)水中,采用Thermo ScientificTM NanoDrop 8000超微量紫外可见光分光光度计检测总RNA浓度及纯度,并使用1%琼脂糖凝胶电泳以确认样品28S和18S rRNA条带的完整性。将检测合格的RNA按照TaKaRa RR047A试剂盒说明书进行反转录为cDNA第1链。
引物的设计与合成。肌肉合成通路相关基因包括:IGF-Ⅰ、磷脂酰肌醇-3激酶调节亚基3(PIK3R3)、丝氨酸/苏氨酸蛋白激酶11(STK11)、雷帕霉素靶蛋白(mTOR)、肌球蛋白重链(MHC)及核因子E2相关因子2(Nrf2)。利用NCBI网址及Primier 5.0软件进行引物设计(表 3),以β-肌动蛋白(β-actin)为内参基因,通过这些基因的扩增用来显示在该基因鲤鱼快肌、慢肌之间的表达差异。
|
|
表 3 荧光定量引物序列 Table 3 Fluorescence quantitative primer sequences |
实时荧光定量PCR:运用Applied Biosystems公司7500实时荧光定量PCR操作系统,根据TaKaRa RR420A试剂盒说明书进行实时荧光定量PCR,检测鲤鱼快肌、慢肌中各待测基因的表达量。荧光定量结果采用2-ΔΔCt方法处理数据。
1.4 统计分析方法试验数据使用SPSS 19.0统计软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行多重比较,以P < 0.05为差异显著性标准,试验结果采用“平均值±标准差”表示。Met需要量以特定生长率、蛋白质效率为指标进行折线模型回归分析;Met与肌肉合成通路相关基因的相关性进行二次回归分析。
2 结果 2.1 饲料Met水平对松浦镜鲤生长性能的影响如表 4所示,0.83%、0.92%和1.01%组的增重率、特定生长率及蛋白质效率均显著高于其他各组(P < 0.05),0.75%组显著高于对照组和0.66%组(P < 0.05),0.83%、0.92%和1.01%组之间无显著差异(P>0.05);0.83%、0.92%和1.01%组的肥满度均显著高于对照组(P < 0.05),0.83%、0.92%和1.01%组之间无显著差异(P>0.05);0.83%、0.92%和1.01%组的饲料系数均显著低于其他各组(P < 0.05),0.92%和1.01%组显著低于0.83%组(P < 0.05)。
|
|
表 4 饲料Met水平对松浦镜鲤生长性能的影响 Table 4 Effects of dietary Met level on growth performance of Songpu mirror carp |
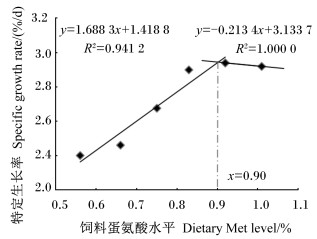
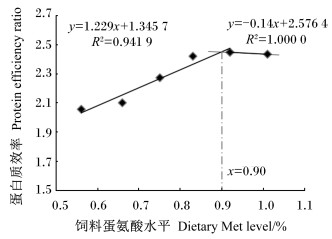
如图 1和图 2所示,当饲料Met水平低于0.90%时,松浦镜鲤特定生长率和蛋白质效率随饲料Met水平的增加均呈现升高趋势;当饲料Met水平高于0.90%时,特定生长率和蛋白质效率随饲料Met水平的增加均呈现降低趋势;当饲料Met水平为0.90%时,特定生长率和蛋白质效率均有最大值,分别为2.94%与2.45%。
|
图 1 松浦镜鲤特定生长率与饲料Met水平的折线关系 Fig. 1 Break-line relationship between specific growth rate and dietary Met level of Songpu mirror carp |
|
图 2 松浦镜鲤蛋白质效率与饲料Met水平的折线关系 Fig. 2 Break-line relationship between protein efficiency ratio and dietary Met level of Songpu mirror carp |
如表 5所示,0.83%、0.92%和1.01%组的肌肉水分含量显著低于对照组(P < 0.05),0.83%、0.92%和1.01%组的肌肉粗蛋白质含量显著高于对照组(P < 0.05),各组之间肌肉粗脂肪和粗灰分含量差异不显著(P>0.05)。
|
|
表 5 饲料Met水平对松浦镜鲤肌肉营养成分的影响 Table 5 Effects of dietary Met level on muscle nutritional composition of Songpu mirror carp |
如表 6所示,各组肌肉pH都为弱酸性,且对照组的肌肉pH最低,并且对照组的肌肉pH24 h < 6.00,0.83%和1.01%组的肌肉pH0 min显著高于对照组(P < 0.05),1.01%组的肌肉pH24 h显著高于对照组(P < 0.05),其他各组之间无显著差异(P> 0.05)。各组之间肌肉蒸煮损失及滴水损失均无显著差异(P>0.05)。
|
|
表 6 饲料Met水平对松浦镜鲤肌肉品质的影响 Table 6 Effects of dietary Met level on muscle quality of Songpu mirror carp |
如表 7所示,0.92%和1.01%组的肌肉SOD、CAT和GPx活性均显著低于对照组及0.66%、0.75%组(P < 0.05),0.92%和1.01%组之间无显著差异(P>0.05)。
|
|
表 7 饲料Met水平对松浦镜鲤肌肉抗氧化指标的影响 Table 7 Effects of dietary Met level on muscle antioxidant indices of Songpu mirror carp U/mg prot |
如图 3、图 4所示,随饲料Met水平的增加,快肌与慢肌IGF-Ⅰ基因表达量呈现先升高后降低趋势;0.83%、0.92%和1.01%组快肌IGF-Ⅰ基因表达量显著高于对照组(P < 0.05),0.75%、0.83%和0.92%组慢肌IGF-Ⅰ基因表达量显著高于对照组(P < 0.05)。随饲料Met水平的增加,快肌和慢肌mTOR和STK11基因表达量都呈现先升高后降低的趋势,其中快肌STK11和慢肌mTOR、STK11基因表达量均在0.83%组最高;0.75%、0.83%、0.92%和1.01%组快肌mTOR基因表达量以及0.83%、0.92%和1.01%组慢肌mTOR基因表达量均显著高于对照组(P < 0.05);各组之间快肌STK11基因表达量差异不显著(P>0.05),0.66%、0.75%、0.83%、0.92%和1.01%组慢肌STK11基因表达量均显著高于对照组(P < 0.05),且0.66%、0.75%、0.83%、0.92%和1.01%组之间无显著差异(P>0.05)。随饲料Met水平的增加,快肌和慢肌PIK3R3基因表达量呈现升高趋势,0.92%和1.01%组快肌PIK3R3基因表达量显著高于其他组(P < 0.05),各组之间慢肌PIK3R3基因表达量差异不显著(P>0.05)。快肌IGF-Ⅰ、mTOR、STK11和PIK3R3基因表达量与饲料Met水平相关性分别为:y=-3.262 4x2+7.253 2x-2.087 2 (R2=0.945 2),y=-24.72x2+46.261x-17.733 (R2=0.782 9);y=-3.851 1x2+6.422 6x-1.435 1 (R2=0.779 5);y=2.193 8x2-2.542 5x+1.731 7 (R2=0.935 5)。慢肌IGF-Ⅰ、mTOR、STK11和PIK3R3基因表达量与饲料Met水平相关性分别为:y=-4.416 3x2+7.359x-1.749 4 (R2=0.927 6);y=-19.822x2+35.971x-12.82 (R2=0.960 6);y=-5.345 2x2+9.046 8x-2.327 8 (R2=0.832 1);y=-0.055 4x2+0.810 9x+0.544 8 (R2=0.946 6)。
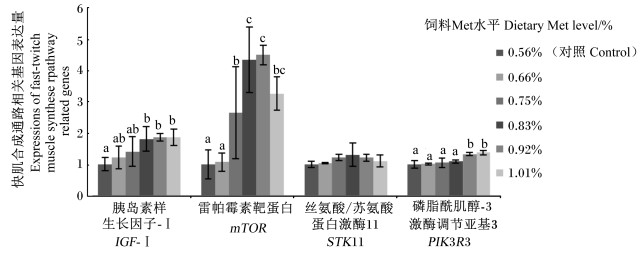
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 3 饲料Met水平对松浦镜鲤快肌合成通路相关基因表达量的影响 Fig. 3 Effects of dietary Met level on expressions of fast-twitch muscle synthesis pathway related genes of Songpu mirror carp |
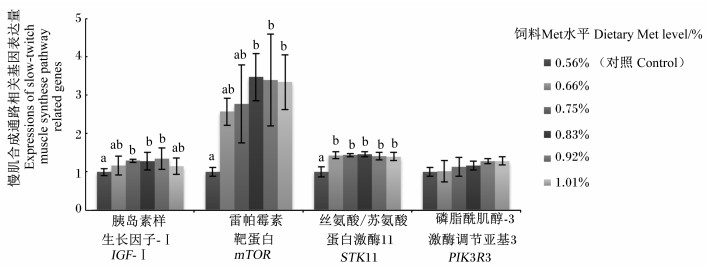
|
图 4 饲料Met水平对松浦镜鲤慢肌合成通路相关基因表达量的影响 Fig. 4 Effects of dietary Met level on expressions slow-twitch muscle synthesis pathway related genes of Songpu mirror carp |
如图 5所示,随饲料Met水平的增加,快肌和慢肌MHC基因表达量呈升高趋势;除0.75%与0.83%组间之外,其余各组之间快肌MHC基因表达量均差异显著(P < 0.05);0.66%、0.75%、0.83%、0.92%和1.01%组慢肌MHC基因表达量均显著高于对照组(P < 0.05),且0.66%、0.75%、0.83%、0.92%和1.01%组之间无显著差异(P>0.05)。快肌与慢肌MHC基因表达量与饲料Met水平相关性分别为:y=7.140 9x2+5.899 4x-4.581 8 (R2=0.974 7);y=-13.506x2+24.587x-8.471 8 (R2=0.976 8)。
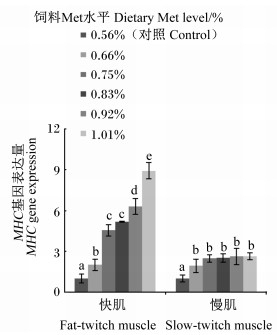
|
图 5 饲料Met水平对松浦镜鲤肌肉MHC基因表达量的影响 Fig. 5 Effects of dietary Met level on expression of muscle MHC gene of Songpu mirror carp |
如图 6所示,随饲料Met水平的增加,肌肉Nrf2基因表达量大致呈现逐渐增加的趋势;0.83%、0.92%和1.01%组快肌和慢肌Nrf2基因表达量均显著高于对照组(P < 0.05),0.92%和1.01%组慢肌Nrf2表达量显著高于其他各组(P < 0.05)。快肌与慢肌Nrf2基因表达量与饲料Met水平相关性分别为:y=-0.108 7x2+1.116 8x+0.409 2 (R2=0.906 0);y=0.712 2x2+1.300 9x+0.093 5 (R2=0.890 1)。
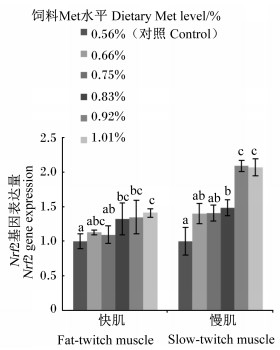
|
图 6 饲料Met水平对松浦镜鲤肌肉Nrf2基因表达量的影响 Fig. 6 Effects of dietary Met level on expression muscle Nrf2 gene of Songpu mirror carp |
蛋白质作为构成鱼体的主要有机物,也是水生动物饲料中重要的营养成分,鱼类对蛋白质的需求实际上是对必需氨基酸的需求,饲料中必需氨基酸的平衡性对鱼类的生长具有重要作用[3, 6]。Met是参与鱼类生长的必需氨基酸,研究发现在低鱼粉饲料中添加外源Met可显著提高鱼类的生长性能:Yang等[13]研究表明,低鱼粉饲料中添加外源Met可显著提高草鱼(Ctenopharyngodon idella)增重率和蛋白质保留率;Sardar等[14]在以豆粕为主要蛋白质源的南亚野鲮(Labeo rohita H.)饲料中添加DL-Met,结果表明添加0.7%的Met可显著改善饲料中豆粕的利用效率,使南亚野鲮体重增加显著,特定生长率及蛋白质效率显著提高,类似的结果在细鳞巨脂鲤(Piaractus mesopotamicus)[15]中也有发现。本试验结果中,饲料添加Met也可以提高松浦镜鲤增重率、特定生长率及蛋白质效率,进一步验证了外源Met对鱼类生长显著的促进作用。
在对鲤鱼饲料Met适宜添加量的研究中,Schwarz等[16]以终末体重为评价指标得出鲤鱼饲料含0.42%半胱氨酸条件下,其Met适宜需要量为0.86%。Tang等[17]采用二次回归分析对建鲤增重率进行分析,得出在饲料半胱氨酸水平为0.3%的条件下,幼年建鲤适宜Met水平为1.2%。本研究结果表明,在饲料半胱氨酸水平为0.64%条件下,松浦镜鲤适宜Met需要量为0.90%。此结果稍高于以往的研究结果,可能是由于试验鱼种类、生长阶段及投喂策略不同导致。
3.2 饲料Met水平对松浦镜鲤肌肉合成通路相关基因表达的影响肌肉的增加是鱼类生长的直接因素。研究发现,Met在鱼类肌肉合成过程中处于相当重要的地位[18]。饲料Met水平的增加可提高鱼类肌肉合成中对氨基酸的利用效率,减少氨基酸的氧化损失[2, 19],增加肌肉生长相关基因的表达,提高肌肉总横截面积[20]。本试验中,饲料添加Met可提高鲤鱼快肌及慢肌中IGF-Ⅰ基因表达量。IGF-Ⅰ作为鱼类生长的重要因子,其大量受体存在于鱼类肌肉中[21],IGF-Ⅰ在受营养活化后可进一步促进体外物质摄取,刺激鱼类肌细胞对氨基酸的摄取、合成及代谢[18],调节骨骼肌纤维功能,主要包括促进卫星细胞的活化、增殖和分化[22],其在提高肌肉合成效率等方面都具有相当重要的作用[5]。磷脂酰肌醇3激酶(PI3K)作为IGF-Ⅰ下游靶点,IGF-Ⅰ的活化可促进肌肉组织中PI3K合成基因的表达,进一步促进蛋白激酶B(AKT)的磷酸化过程[21]。本研究发现,PI3K及AKT相关基因PIK3R3及STK11在快肌与慢肌中的表达效应虽然总体都呈上升趋势,但个别组之间具有一定的差异,其中0.92%和1.01%组的快肌PIK3R3基因表达量与其余4组显著差异,而慢肌中各组之间均无差异显著;对照组慢肌STK11基因表达量与其余5组显著差异,而在快肌各组之间差异不显著。
雷帕霉素(TOR)及其效应子的mRNA表达能力主要受氨基酸的直接调节,mTOR作为营养敏感信号通路的重要靶点[23],具有整合来自营养素、能量状态和生长因子的信号,并且具有控制细胞周期、基因转录、细胞骨架组织和蛋白质合成等功能[24]。IGF-Ⅰ对mTOR信号通路的激活具有间接作用,一般需通过诱导PI3K/AKT信号通路的激活进而作用于mTOR[25]。但本试验中,mTOR在快肌及慢肌中的表达量都呈现高饲料Met水平抑制现象,其原因还需要进一步探索。此外,Shan等[9]提出肝脏中IGF-Ⅰ的水平可被认为是比肌肉中更好的指标,但是该假设需要进一步研究。MHC作为肌肉合成的标志基因,其表达量与饲料Met水平呈正相关,研究表明,MHC活性与IGF-Ⅰ在肌细胞中的含量有关,IGF-Ⅰ能够增加肌细胞生成素阳性细胞的存在,提高MHC表达[26]。此外,虽然大多数关于鱼类的研究表明IGF-Ⅰ基因表达量与其生长之间呈现正相关关系,但在澳洲肺鱼(Lates calcarifer)[27]和南部蓝鳍金枪鱼(Thunnus maccoyii)[28]等鱼类中未发现IGF-Ⅰ促进鱼类生长的这一特点。
3.3 饲料Met水平对松浦镜鲤肌肉品质的影响肌肉营养成分是评价肌肉价值和品质的重要指标。本试验中,饲料添加Met可提高肌肉中粗蛋白质含量,降低肌肉水分含量,进而提高肌肉营养成分。除营养成分外,肌肉pH及保水性等指标也是肌肉加工贮藏中影响肌肉品质的重要因素[29]。研究表明,动物经屠宰后会使得体内糖原迅速降解,产生乳酸,降低肌肉pH[30]。本试验结果显示,饲料添加Met可提高鲤鱼肌肉pH,但对肌肉滴水损失及蒸煮损失并无显著影响,此结果与蒋雪樱等[31]在肉鸡中的研究结果相同。
本试验结果表明,饲料添加Met对鲤鱼快肌及慢肌Nrf2基因表达量都具有提高作用。Nrf2作为抗氧化调节的关键因子,可诱导调节SOD、CAT和GPx等抗氧化酶基因编码[32]。大量研究表明,Nrf2表达受饲料多种氨基酸的影响;Luo等[33]研究发现,随饲料缬氨酸水平的增加,幼龄草鱼肌肉中的Nrf2表达上调,并且提高了肌肉SOD和CAT活性,相似的现象在草鱼饲料亮氨酸的研究中也有发现[34]。但本试验中,虽然Nrf2基因表达量与饲料Met水平呈正相关,但肌肉中SOD、CAT和GPx活性却呈降低趋势,此现象与Xiao等[35]研究的Met羟基类似物(MHA)对建鲤肌肉影响的结果相同,相似的结论在黄颡鱼(Pelteobagrus fulvidraco)中也有发现[36],其原因可能是Met对转录或翻译后的SOD和CAT活性具有一定的调节作用有关[35]。此外,饲料氨基酸的合理补充可增加鱼类肌肉中Nrf2基因表达量,但并无研究表明氨基酸可直接增加Nrf2基因表达量。一般认为Nrf2的调节机制包括胰岛素及mTOR调节2种方式:哺乳动物mTOR表达可调节肝癌细胞系HepG2细胞中的Nrf2水平,另外胰岛素可以增加Nrf2的核积累,从而上调小鼠肾细胞中Nrf2靶基因的表达。本试验结果中Met促进肌肉IGF-Ⅰ及mTOR的表达可能是介导Nrf2表达升高的原因,但是详细的机制还需要进一步探索。
4 结论饲料添加Met可促进鲤鱼生长,增加鲤鱼肌肉合成,提高肌肉品质,促进肌肉合成相关基因的表达。当饲料半胱氨酸含量为0.64%时,以特定生长率和蛋白质效率为评价指标,通过折线模型分析得到松浦镜鲤幼鱼Met需要量为0.90%。
| [1] |
MICHELATO M, ZAMINHAN M, BOSCOLO W R, et al. Dietary histidine requirement of Nile tilapia juveniles based on growth performance, expression of muscle-growth-related genes and haematological responses[J]. Aquaculture, 2016, 467: 63-70. |
| [2] |
OVERTURF K, BARROWS F T, HARDY R W, et al. Energy composition of diet affects muscle fiber recruitment, body composition, and growth trajectory in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2016, 457: 1-14. |
| [3] |
KASPER C S, WHITE M R, BROWN P B. Choline is required by tilapia when methionine is not in excess[J]. The Journal of Nutrition, 2000, 130(2): 238-242. |
| [4] |
GOLDSPINK G.5-postembryonic growth and differentiation of striated muscle[M]//BOURNE G H.The structure and function of muscle.New York: Elsevier, 1972, 179: 179-236.
|
| [5] |
ROWLERSON A, VEGGETTI A. 5-cellular mechanisms of post-embryonic muscle growth in aquaculture species[J]. Fish Physiology, 2001, 18: 103-140. |
| [6] |
LUO Z, LIU Y J, MAI K S, et al. Dietary L-methionine requirement of juvenile grouper Epinephelus coioides at a constant dietary cystine level[J]. Aquaculture, 2005, 249(1/2/3/4): 409-418. |
| [7] |
GAYLORD T G, BARROWS F T, TEAGUE A M, et al. Supplementation of taurine and methionine to all-plant protein diets for rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2007, 269(1/2/3/4): 514-524. |
| [8] |
CLAY L T A, WANG S Y, WOLTERS W R, et al. Molecular characterization of the insulin-like growth factor-Ⅰ (IGF-Ⅰ) gene in channel catfish (Ictalurus punctatus)[J]. Biochimica et Biophysica Acta:Gene Structure and Expression, 2005, 1731(3): 139-148. DOI:10.1016/j.bbaexp.2005.10.001 |
| [9] |
SHAN L L, LI X Q, ZHENG X M, et al. Effects of feed processing and forms of dietary methionine on growth and IGF-1 expression in Jian carp[J]. Aquaculture Research, 2017, 48(1): 56-67. |
| [10] |
徐奇友. 鲤鱼营养需要研究进展[J]. 饲料工业, 2019, 40(14): 1-10. |
| [11] |
RESOURCES N. Nutrient requirements of fish and shrimp[J]. Nutrient Requirements of Fish & Shrimp, 2011, 23(10): 2-8. DOI:10.17226/13039 |
| [12] |
BONE Q. 6-locomotor muscle[J]. Fish Physiology, 1979, 7: 361-424. |
| [13] |
YANG H J, LIU Y J, TIAN L X, et al. Effects of supplemental lysine and methionine on growth performance and body composition for grass carp (Ctenopharyngodon idella)[J]. American Journal of Agricultural and Biological Sciences, 2010, 5(2): 222-227. DOI:10.3844/ajabssp.2010.222.227 |
| [14] |
SARDAR P, ABID M, RANDHAWA H S, et al. Effect of dietary lysine and methionine supplementation on growth, nutrient utilization, carcass compositions and haemato-biochemical status in Indian major carp, Rohu (Labeo rohita H.) fed soy protein-based diet[J]. Aquaculture Nutrition, 2009, 15(4): 33-346. |
| [15] |
ABIMORAD E G, FAVERO G C, CASTELLANI D, et al. Dietary supplementation of lysine and/or methionine on performance, nitrogen retention and excretion in pacu Piaractus mesopotamicus reared in cages[J]. Aquaculture, 2009, 295(3/4): 266-270. |
| [16] |
SCHWARZ F J, KIRCHGESSNER M, DEURINGER U. Studies on the methionine requirement of carp (Cyprinus carpio L.)[J]. Aquaculture, 1998, 161(1/2/3/4): 121-129. |
| [17] |
TANG L, WANG G X, JIANG J, et al. Effect of methionine on intestinal enzymes activities, microflora and humoral immune of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. Aquaculture Nutrition, 2009, 15(5): 477-483. |
| [18] |
BELGHIT I, SKIBA-CASSY S, GEURDEN I, et al. Dietary methionine availability affects the main factors involved in muscle protein turnover in rainbow trout (Oncorhynchus mykiss)[J]. British Journal of Nutrition, 2014, 112(4): 493-503. |
| [19] |
CASTILLO J, CODINA M, MART?NEZ M L, et al. Metabolic and mitogenic effects of IGF-Ⅰ and insulin on muscle cells of rainbow trout[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2004, 286(5): R935-R941. |
| [20] |
ESPE M, VEISETH-KENT E, ZERRAHN J E, et al. Juvenile Atlantic salmon decrease white trunk muscle IGF-1 expression and reduce muscle and plasma free sulphur amino acids when methionine availability is low while liver sulphur metabolites mostly is unaffected by treatment[J]. Aquaculture Nutrition, 2016, 22(4): 801-812. |
| [21] |
CASTILLO J, AMMENDRUP-JOHNSEN I, CODINA M, et al. IGF-Ⅰ and insulin receptor signal transduction in trout muscle cells[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2006, 290(6): R1683-R1690. DOI:10.1152/ajpregu.00294.2005 |
| [22] |
SNIJDERS T, NEDERVEEN J P, MCKAY B R, et al. Satellite cells in human skeletal muscle plasticity[J]. Frontiers in Physiology, 2015, 6: 283. |
| [23] |
KIM E. Mechanisms of amino acid sensing in mTOR signaling pathway[J]. Nutrition Research and Practice, 2009, 3(1): 64-71. |
| [24] |
DESTEFANO M, JACINTO E. Regulation of insulin receptor substrate-1 by mTORC2 (mammalian target of rapamycin complex 2)[J]. Biochemical Society Transactions, 2013, 41(4): 896-901. |
| [25] |
GLASS D J.PI3 kinase regulation of skeletal muscle hypertrophy and atrophy[M]//ROMMEL C, VANHAESEBROECK B, VOGT P.Phosphoinositide 3-kinase in health and disease.Berlin, Heidelberg: Springer, 2010, 346: 267.
|
| [26] |
AZIZI S, ALI NEMATOLLAHI M, AMIRI B M, et al. IGF-Ⅰ and IGF-Ⅱ effects on local IGF system and signaling pathways in gilthead sea bream (Sparus aurata) cultured myocytes[J]. General and Comparative Endocrinology, 2016, 232: 7-16. DOI:10.1016/j.ygcen.2015.11.011 |
| [27] |
NANKERVIS L, MATTHEWS S J, APPLEFORD P. Effect of dietary non-protein energy source on growth, nutrient retention and circulating insulin-like growth factor Ⅰ and triiodothyronine levels in juvenile barramundi, Lates calcarifer[J]. Aquaculture, 2001, 191(4): 323-335. DOI:10.1016/S0044-8486(00)00436-1 |
| [28] |
DYER A R, BARLOW C G, BRANSDEN M P, et al. Correlation of plasma IGF-Ⅰ concentrations and growth rate in aquacultured finfish:a tool for assessing the potential of new diets[J]. Aquaculture, 2004, 236(1/2/3/4): 583-592. DOI:10.1016/j.aquaculture.2003.12.025 |
| [29] |
寇涛, 胡志萍, 董丽, 等. 二甲基甘氨酸钠对肉鸡屠宰性能、肉品质及肌肉抗氧化能力的影响[J]. 食品科学, 2015, 36(5): 179-184. |
| [30] |
周光宏. 肉品学[M]. 北京: 中国农业科技出版社, 1999: 221-262.
|
| [31] |
蒋雪樱, 张相伦, 陆鹏, 等. 蛋氨酸对肉鸡屠宰性能、肉品质及肌肉抗氧化的影响[J]. 食品科学, 2016, 37(21): 114-118. |
| [32] |
MA Q. Role of Nrf2 in oxidative stress and toxicity[J]. Annual Review of Pharmacology and Toxicology, 2013, 53: 401-426. |
| [33] |
LUO J B, FENG L, JIANG W D, et al. Physical and flavor characteristics, fatty acid profile, antioxidant status and Nrf2-dependent antioxidant enzyme gene expression changes in young grass carp (Ctenopharyngodon idella) fillets fed dietary valine[J]. PLoS One, 2017, 12(1): e0169270. |
| [34] |
DENG Y P, JIANG W D, LIU Y, et al. Dietary leucine improves flesh quality and alters mRNA expressions of Nrf2-mediated antioxidant enzymes in the muscle of grass carp (Ctenopharyngodon idella)[J]. Aquaculture, 2016, 452: 380-387. |
| [35] |
XIAO W W, FENG L, KUANG S Y, et al. Lipid peroxidation, protein oxidant and antioxidant status of muscle and serum for juvenile Jian carp (Cyprinus carpio var.Jian) fed grade levels of methionine hydroxy analogue[J]. Aquaculture Nutrition, 2012, 18(1): 90-97. |
| [36] |
ELMADA C Z, HUANG W, JIN M, et al. The effect of dietary methionine on growth, antioxidant capacity, innate immune response and disease resistance of juvenile yellow catfish (Pelteobagrus fulvidraco)[J]. Aquaculture Nutrition, 2016, 22(6): 1163-1173. |




