2. 农业部华南水产与畜禽饲料重点实验室, 湛江 524088;
3. 广东省水产动物精准营养高效饲料工程研究中心, 湛江 524088;
4. 南方海洋科学与工程广东省实验室(湛江), 湛江 524088
2. Key Laboratory of Aquatic, Livestock and Poultry Feed Science and Technology in South China, Ministry of Agriculture, Zhanjiang 524088, China;
3. Aquatic Animals Precision Nutrition and High Efficiency Feed Engineering Research Center of Guangdong Province, Zhanjiang 524088, China;
4. Southern Marine Science and Engineering Guangdong Laboratory(Zhanjiang), Zhanjiang 524088, China
鱼类在不同生长规格时对营养物质的需求量及利用能力存在差异。尼罗罗非鱼(Oreochromis niloticus)在初始体重分别为0.062[1]和5.620 g[2]的条件下,饲料蛋氨酸(Met)水平分别为饲料的1.00%和0.49%(占饲料蛋白质的1.75%)时可使其获得最佳生长性能。然而,异育银鲫(Carassius auratus gibelio)在初始体重分别为1.67[3]和51.00 g[4]的条件下,饲料Met最适需要量分别为饲料的0.69%(占饲料蛋白质的1.68%)和0.98%(占饲料蛋白质的2.30%)时可获得最佳生长性能。鱼类对Met需求量随着个体规格的增大而显示不同的变化趋势。
2018年中国渔业统计年鉴显示,海水养殖鱼类中,石斑鱼产量达13.15万t,位居第3[5],表明石斑鱼饲料的推广达到一定成效。但是,不同规格石斑鱼的营养需求量存在差异[6-8],开发不同规格石斑鱼精准高效配合饲料,提高饲料效率,有助于推动石斑鱼的养殖产量,提高优质蛋白质的高效供给。因此,本试验以斜带石斑鱼(Epinephelus coioides)为试验对象,探究养成期2个生长规格的斜带石斑鱼对饲料Met需求量的差异,以期有针对性地生产石斑鱼配合饲料,提高饲料氮的利用率,发展绿色养殖。
1 材料与方法 1.1 试验饲料以鱼粉、豆粕和玉米蛋白粉为主要蛋白质源,鱼油、豆油和大豆磷脂为脂肪源,在基础饲料中添加晶体DL-蛋氨酸(DL-Met)调节饲料Met水平,非必需氨基酸混合物(天冬氨酸:甘氨酸=1 : 1)调节至等氮,配制Met水平分别为0.70%(0.7M;基础饲料)、0.85%(0.85M)、1.00%(1.0M)、1.20%(1.2M)、1.40%(1.4M)、1.60%(1.6M)、1.90%(1.9M)和2.20%(2.2M)的8种等氮等脂的饲料。饲料原料经粉碎后过60目筛,按配方称取,经V型立式混合机(JS-14S型,浙江正泰电器股份有限公司)充分混匀,混入预先称取的鱼油、豆油、大豆磷脂和水,用双螺杆挤条机(F-75型,华南理工大学科技实业总厂)分别加工成直径为3.0(供给小规格斜带石斑鱼)和5.0 mm(供给大规格斜带石斑鱼)的颗粒状饲料,晾干后于-20 ℃冰箱中储存备用。基础饲料组成及营养水平见表 1,基础饲料氨基酸组成见表 2。
|
|
表 1 基础饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
|
|
表 2 基础饲料氨基酸组成(风干基础) Table 2 Amino acid composition of the basal diet (air-dry basis) |
斜带石斑鱼[初始体重:小规格为(9.75±0.05) g大规格为(102.60±0.14) g)],购自广东湛江雷州石斑鱼苗场,试验鱼在水泥池中暂养2周,期间投喂商业饲料(中山统一饲料有限公司,粗蛋白质含量为46%)。养殖试验在广东海洋大学东海岛生物研究基地室内海水鱼养殖系统进行。试验开始前,饥饿24 h,随机挑选健康、规格一致的斜带石斑鱼,分别分成6组,每组设3个重复,小规格斜带石斑鱼每个重复放养30尾鱼,分别投喂0.7M、1.0M、1.2M、1.6M、1.9M和2.2M饲料8周;大规格斜带石斑鱼每个重复放养20尾鱼,分别投喂0.7M、0.85M、1.0M、1.2M、1.4M和1.6M饲料10周。每天于08:00和17:00分别投喂试验饲料,初始投喂量为3%体重,并根据摄食情况适当调整。试验期间水温28.5~31.5 ℃,溶解氧≥7 mg/L,盐度26~32,氨氮浓度≤0.03 mg/L,pH 7.6~8.0。
1.3 样本采集养殖试验结束,饥饿24 h后称重、计数,计算成活率(SR)。每个重复随机取3尾鱼称重、测体长,计算增重率(WGR)、特定生长率(SGR)、饲料系数(FCR)、蛋白质效率(PER)和肥满度(CF),取肝脏并称重,用以计算肝体比(HSI),称重后的肝脏迅速置于液氮中,后置于-80 ℃冷冻保存,用于测定肝脏酶活性。另每个重复取3尾鱼测水分、粗蛋白质(CP)、粗脂肪(EE)和粗灰分(Ash)含量。鱼尾静脉取血,4 ℃静置12 h后离心,取上层清液用于检测血清生化指标。
1.4 测定方法 1.4.1 生长性能指标测定

|
参与AOAC(1990)[9]方法对饲料和全鱼样品进行常规营养成分分析,水分含量测定采用105 ℃烘干失重法,CP含量测定采用凯氏定氮法(KjeltecTM 8400,瑞典),EE含量测定采用索式抽提法(抽提剂为石油醚),Ash含量测定采用550 ℃马弗炉灼烧法。将试验饲料经由冷冻干燥处理后,按照GB/T 18246—2000进行酸水解和样本处理,采用日立L8900氨基酸自动分析仪测定氨基酸含量。
1.4.3 血清生化指标及肝脏酶活性测定血清葡萄糖(GLU)、总蛋白(TP)、总胆固醇(TC)和甘油三酯(TG)含量均使用全自动生化分析仪(日立7020HITACHI,日本)测定。
肝脏超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷草转氨酶(GOT)和谷丙转氨酶(GPT)活性测定均采用南京建成生物工程研究所试剂盒,肝脏磷酸烯醇式丙酮酸激酶(PEPCK)活性测定采用武汉华美生物公司试剂盒,测定方法按试剂盒说明书进行。
1.5 统计分析采用SPSS 19.0统计软件对同一规格斜带石斑鱼不同处理的数据进行单因素方差分析(one-way ANOVA),若存在显著性差异,则进行Duncan氏法多重比较,检验组间的差异显著性。对不同规格斜带石斑鱼同一处理的数据进行t检验。试验数据用“平均值±标准差”表示。P < 0.05表示差异显著。
2 结果 2.1 饲料Met水平对2种规格斜带石斑鱼生长性能的影响由图 1可见,小规格斜带石斑鱼1.2M组WGR、CF和HSI显著高于0.7M组(P < 0.05),PER和FCR各组间无显著差异(P>0.05)。大规格斜带石斑鱼1.0M组WGR和PER显著高于1.6M组(P < 0.05),1.6M组FCR显著高于其他组(P < 0.05)。小规格斜带石斑鱼各组WGR和PER显著高于大规格斜带石斑鱼(P < 0.05),0.7M和1.6M组FCR显著低于大规格斜带石斑鱼(P < 0.05),0.7M组CF显著低于大规格斜带石斑鱼(P < 0.05),1.6M组CF显著高于大规格斜带石斑鱼(P < 0.05),1.0M、1.2M和1.6M组HSI显著高于大规格斜带石斑鱼(P < 0.05)。
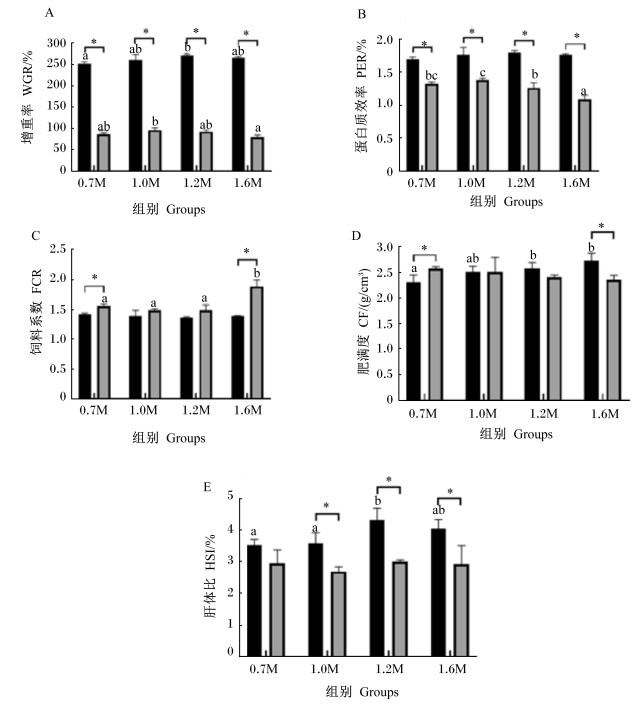
|
小规格: ;大规格: ;大规格: 。数据柱形标注无字母或相同字母表示同一规格组间差异不显著(P>0.05),不同小写字母表示同一规格组间差异显著(P < 0.05)。*表示同一Met水平2种规格间差异显著(P < 0.05)。下图同。 。数据柱形标注无字母或相同字母表示同一规格组间差异不显著(P>0.05),不同小写字母表示同一规格组间差异显著(P < 0.05)。*表示同一Met水平2种规格间差异显著(P < 0.05)。下图同。该图仅使用同一Met水平的2种规格的试验结果进行统计分析。图 3、图 4、图 5同。The experimental results of the two sizes only feeding the same Met level were used for statistical analysis in this figure. The same as Fig. 3, Fig. 4 and Fig. 5. Small size:  ; Large size: ; Large size: . Value columns with no letter or the same letter superscripts mean no significant difference among groups in the same size (P>0.05), while with different small letter superscripts mean significant difference among groups in the same size (P < 0.05). * indicated a significant difference between two sizes in the same Met level (P < 0.05). The same as below.
图 1 饲料Met水平对2种规格斜带石斑鱼生长性能的影响
Fig. 1
Effects of dietary methionine level on growth performance of Epinephelus coioides in two sizes . Value columns with no letter or the same letter superscripts mean no significant difference among groups in the same size (P>0.05), while with different small letter superscripts mean significant difference among groups in the same size (P < 0.05). * indicated a significant difference between two sizes in the same Met level (P < 0.05). The same as below.
图 1 饲料Met水平对2种规格斜带石斑鱼生长性能的影响
Fig. 1
Effects of dietary methionine level on growth performance of Epinephelus coioides in two sizes
|
由图 2可知,以SGR为判据,经二次曲线模型拟合可得出,小规格和大规格斜带石斑鱼对Met的最适需要量分别为饲料的1.40%(占饲料蛋白质的3.16%)和1.07%(占饲料蛋白质的2.38%)。
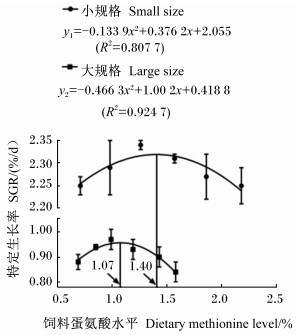
|
图 2 饲料Met水平与2种规格斜带石斑鱼特定生长率的二次曲线关系 Fig. 2 Second-order polynomial relationship between dietary methionine level and special growth rate of Epinephelus coioides in two sizes |
由图 3可知,饲料Met水平对2种规格斜带石斑鱼全鱼水分、CP、EE和Ash含量的影响不显著(P>0.05)。
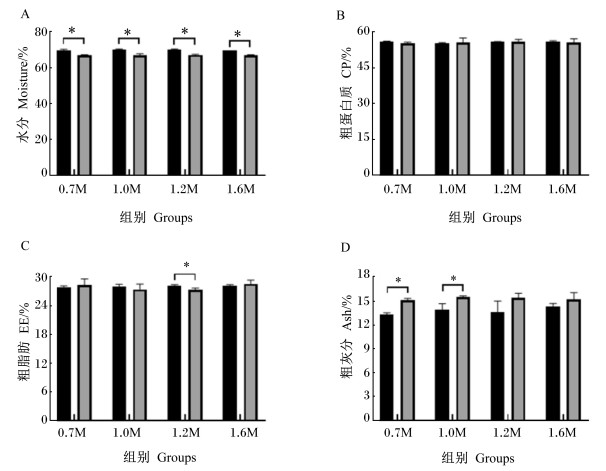
|
图 3 饲料Met水平对2种规格斜带石斑鱼体营养成分的影响 Fig. 3 Effects of dietary methionine level on body nutrient compositions of Epinephelus coioides in two sizes |
由图 4可知,小规格斜带石斑鱼1.2M和1.6M组血清GLU含量显著低于0.7M组(P < 0.05),血清TC和TG含量与0.7M组无显著差异(P>0.05),1.2M组血清TP含量显著高于0.7M组(P < 0.05)。大规格斜带石斑鱼1.2M组血清GLU含量显著高于其他组(P < 0.05),1.0M和1.2M组血清TG含量显著低于其他组(P < 0.05),各组间血清TP和TC含量无显著差异(P>0.05)。小规格斜带石斑鱼0.7M和1.0M组血清GLU含量显著高于大规格斜带石斑鱼(P < 0.05),血清TP和TG含量显著低于大规格斜带石斑鱼(P < 0.05),1.2M组血清GLU、TC和TG含量显著低于大规格斜带石斑鱼(P < 0.05)。
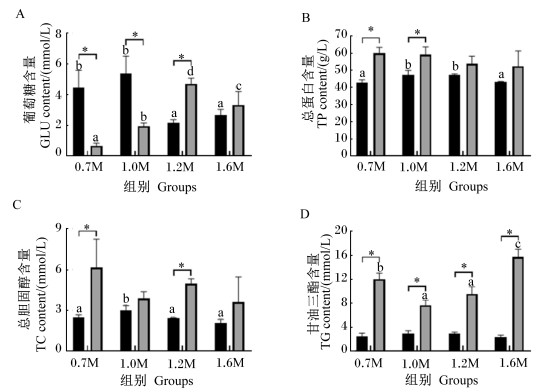
|
图 4 饲料Met水平对2种规格斜带石斑鱼血清生化指标的影响 Fig. 4 Effects of dietary methionine level on serum biochemical indices of Epinephelus coioides in two sizes |
由图 5可知,小规格斜带石斑鱼1.2M组肝脏SOD和CAT活性显著高于其他组(P < 0.05),0.7M组肝脏PEPCK活性显著高于其他组(P < 0.05)。大规格斜带石斑鱼1.0M组肝脏SOD和CAT活性显著高于0.7M组(P < 0.05),肝脏PEPCK活性最低。2个规格斜带石斑鱼0.7M组肝脏GOT和GPT活性均最低。小规格斜带石斑鱼1.2M和1.6M组肝脏SOD活性显著高于大规格斜带石斑鱼(P < 0.05),各组肝脏CAT活性显著高于大规格斜带石斑鱼(P < 0.05),1.0M和1.2M组肝脏GOT活性显著低于大规格斜带石斑鱼(P < 0.05),0.7M、1.2M和1.6M组肝脏GPT活性显著高于大规格斜带石斑鱼(P < 0.05),肝脏PEPCK活性显著低于大规格斜带石斑鱼(P < 0.05)。
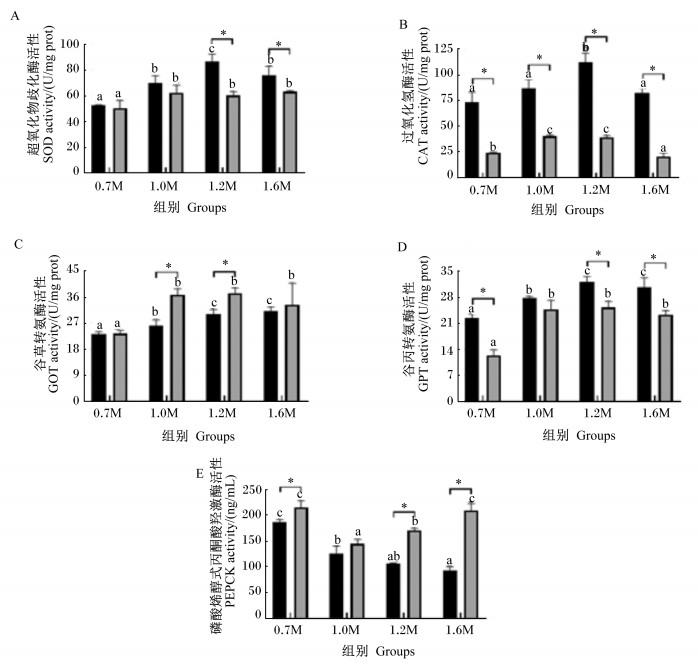
|
图 5 饲料Met水平对2种规格斜带石斑鱼肝脏酶活性的影响 Fig. 5 Effects of dietary methionine level on liver enzyme activity of Epinephelus coioides in two sizes |
2个规格斜带石斑鱼SGR均随着饲料Met水平升高呈现先升后降的变化趋势,这与红鳍东方鲀(Takifugu rubripes)幼鱼[10]、军曹鱼(Rachycentron canadum)幼鱼[11]、大黄鱼(Larimichthys crocea)稚鱼[12]、黑鲈(Micropterus salmoides)(37.88 g)[13]和草鱼(Ctenopharyngodon idellus)(451.30 g)[14]等研究结果一致。添加适量Met能够有效促进鱼类的生长发育,Met缺乏或者过量会抑制鱼类的生长发育。但是有研究表明,虹鳟(Oncorhynchus mykiss)(15.40 g)[15]和斜带石斑鱼(13.25 g)[16]摄食高含量Met并没有对生长产生负面影响,可能是饲料氨基酸组成模式不同产生了不同的生长效果。本试验中,小规格和大规格斜带石斑鱼对Met的最适需要量分别为饲料的1.40%和1.07%。小规格石斑鱼Met最适需求量、SGR、WGR和PER显著高于大规格斜带石斑鱼,这与569.00[17]和9.90 g[18]鲤鱼(Cyprinus carpio)、0.062[1]和5.620 g[2]尼罗罗非鱼研究结果一致,表明鱼体在规格较小时生长速度较快,对蛋白质等营养物质需求量较大且消化吸收利用能力较强。
小规格斜带石斑鱼各组间FCR和PER无显著变化。大规格斜带石斑鱼在Met水平最适时,PER最高,在高Met水平时,PER变低。这可能是大规格斜带石斑鱼对蛋白质等营养物质的吸收利用能力受Met水平影响较敏感。在虹鳟(116.80 g)[19]和草鱼(259.00 g)[20]等研究中发现,饲料Met水平适宜时,PER最高,超过这个水平时PER无显著变化,可能是该规格虹鳟和草鱼对Met水平的耐受程度较强。随着饲料Met水平升高,小规格斜带石斑鱼CF和HSI均呈现升高趋势,但卵形鲳鲹(Trachinotus ovatus)幼鱼[21]和军曹鱼幼鱼[22]的HSI和CF受饲料Met水平的影响不显著,可能是不同鱼类对营养物质的利用与沉积能力也存在差异。大规格斜带石斑鱼CF和HSI受Met水平的影响不显著,这与军曹鱼(150.90 g)[23]、异育银鲫(51.00 g)[4]和草鱼(259.00 g)[20]等的研究结果一致。在Met水平适宜的条件下,小规格斜带石斑鱼对蛋白质和脂肪等吸收利用能力较强,蛋白质体内沉积较高,使小规格斜带石斑鱼长得更肥满。
3.2 饲料Met水平对2个规格斜带石斑鱼血清生化指标的影响小规格斜带石斑鱼血清GLU含量随着饲料Met水平升高,显著下降,这与卵形鲳鲹幼鱼[21]和红鳍东方鲀幼鱼[10]等研究结果一致。而大规格斜带石斑鱼摄食Met缺乏饲料时,血清GLU含量较低,在Met水平适量时,血清GLU含量较高,与军曹鱼(150.90 g)[23]的结果相同。在Met缺乏时,小规格斜带石斑鱼对糖类的利用能力较大规格斜带石斑鱼弱。随着Met水平升高,可改善小规格斜带石斑鱼对糖类的利用。
Met在脂代谢调解中发挥重要作用,缺乏导致军曹鱼(150.90 g)[23]体内参与脂质分解的过氧化物酶体增殖物激活受体α(PPARα)、肉毒碱棕榈酰转移酶-1(CPT-1)和脂蛋白脂酶(LPL)等基因高度表达,Met水平适宜时则促进脂质合成的固醇调节元件结合蛋白-1(SREBP-1)、过氧化物酶体增殖物激活受体γ(PPARγ)、脂肪酸合成酶(FAS)和硬脂酰辅酶A去饱和酶-1(SCD-1)基因表达上调。本试验中,小规格斜带石斑鱼血清TG含量受Met水平影响不显著,而大规格斜带石斑鱼在Met缺乏和过高条件下,血清TG含量较高,Met水平适宜时血清TG含量较低,这与军曹鱼(150.90 g)[23]研究结果一致,提示大规格石斑鱼在Met缺乏或过高时,对脂类的利用能力较弱,在添加适宜Met水平条件下,对脂类的利用能力得到改善。在低Met水平条件下,小规格斜带石斑鱼血清TP、TC和TG含量显著低于大规格斜带石斑鱼,表明Met缺乏时,小规格斜带石斑鱼对蛋白质和脂类的利用能力较大规格斜带石斑鱼强。
3.3 饲料Met水平对2个规格斜带石斑鱼肝脏酶活性的影响Met可刺激线粒体,通过残基中的二硫键可保护蛋白质等生物分子免受氧化损伤[24-25],从而提高机体抗氧化能力。本试验中,随着Met水平升高,2个规格斜带石斑鱼肝脏SOD和CAT活性均显著升高,在摄食适宜Met水平获得最大SGR时,SOD与CAT活性最高,能够有效改善鱼体的氧化损伤。这与团头鲂(Megalobrama amblycephala)幼鱼[26]、欧洲鲈鱼(Dicentrarchus labrax)幼鱼[27]和草鱼(259.00 g)[20]等的研究结果一致。小规格斜带石斑鱼肝脏SOD和CAT活性高于大规格斜带石斑鱼,表明小规格斜带石斑鱼抗氧化损伤能力相对较强。
Met缺乏会导致氨基酸不平衡[28],影响动物体内氨基酸代谢酶GOT和GPT活性[29]。随着饲料Met水平升高,瓦氏黄颡鱼(Pelteobagrus vachelli)幼鱼[30]和草鱼(451.30 g)[14]肝脏中GPT活性显著升高。本试验中Met水平对2个规格斜带石斑鱼肝脏GOT和GPT活性有显著的提升作用。但在红鳍东方鲀幼鱼[10]与卵形鲳鲹幼鱼[21]中,随着Met水平升高,肝脏GOT活性呈现一定波动,而肝脏GPT活性无显著变化,这与本试验结果不一致,可能是饲料配方氨基酸组成比例差异过大导致。
Met可以转化为三羧酸循环的中间产物琥珀酰辅酶A,进入糖异生环节,而PEPCK是糖异生作用的关键限速酶。高水平Met会促使虹鳟(40.00 g)[31]肝脏PEPCK表达,本试验发现,在最适Met水平时,2个规格斜带石斑鱼肝脏PEPCK活性均显著最低,随着Met水平进一步升高,大规格斜带石斑鱼肝脏PEPCK活性显著升高。相比于大规格斜带石斑鱼,小规格斜带石斑鱼肝脏PEPCK活性较低,可以减弱糖异生作用,使Met更好地参与蛋白质代谢,尽管鱼体CP含量无显著差异,但是,适宜Met水平组的血清TP含量优于其他组,有利于机体健康。
4 结论① 以SGR为判据,经二次曲线模型拟合可得出,小规格和大规格斜带石斑鱼对Met的最适需要量分别为饲料的1.40%(占饲料蛋白质的3.16%)和1.07%(占饲料蛋白质的2.38%)。
② 与大规格斜带石斑鱼相比,在饲料Met水平低时,小规格斜带石斑鱼对GLU的调节能力较弱,随着Met水平升高,小规格斜带石斑鱼对糖和蛋白质的利用均得到改善。
| [1] |
SANTIAGO C B, LOVELL R T. Amino acid requirements for growth of Nile tilapia[J]. The Journal of Nutrition, 1988, 118(12): 1540-1546. |
| [2] |
NGUYEN T N, DAVIS D A. Methionine requirement in practical diets of juvenile Nile tilapia, Oreochromis niloticus[J]. Journal of the World Aquaculture Society, 2009, 40(3): 410-416. |
| [3] |
周贤君.异育银鲫对晶体赖氨酸和蛋氨酸的利用及需求量研究[D].硕士学位论文.武汉: 华中农业大学, 2005.
|
| [4] |
WANG X, XUE M, FIGUEIREDO-SILVA C, et al. Dietary methionine requirement of the pre-adult gibel carp (Carassius auratus gibeilo) at a constant dietary cystine level[J]. Aquaculture Nutrition, 2016, 22(3): 509-516. |
| [5] |
农业部渔业渔政管理局. 2018中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2018: 26.
|
| [6] |
杨俊江.三个生长阶段斜带石斑鱼蛋白质、脂肪和碳水化合物需要量研究[D].硕士学位论文.湛江: 广东海洋大学, 2013.
|
| [7] |
王学武.两个生长阶段斜带石斑鱼对赖氨酸和蛋氨酸最适需要量的研究[D].硕士学位论文.湛江: 广东海洋大学, 2014.
|
| [8] |
丁明岩.VA、VD对两种规格斜带石斑鱼生长、饲料利用、脂肪代谢及FAS、HL mRNA表达量的影响研究[D].硕士学位论文.湛江: 广东海洋大学, 2015.
|
| [9] |
AOAC.Official methods of analysis of AOAC[S].15th ed.Washington, D.C.: Association of Official Analytical Chemists, 1990: 70-80.
|
| [10] |
张庆功, 梁萌青, 徐后国, 等. 红鳍东方鲀幼鱼对饲料中蛋氨酸需求的研究[J]. 渔业科学进展, 2019, 40(4): 1-10. |
| [11] |
何远法, 郭勇, 迟淑艳, 等. 低鱼粉饲料中补充蛋氨酸对军曹鱼生长性能、体成分及肌肉氨基酸组成的影响[J]. 动物营养学报, 2018, 30(2): 624-634. |
| [12] |
于海瑞, 艾庆辉, 麦康森, 等. 大黄鱼稚鱼L-蛋氨酸需要量的研究[J]. 水生生物学报, 2013, 37(6): 1094-1102. |
| [13] |
陈乃松, 马建忠, 周恒永, 等. 大口黑鲈对饲料中蛋氨酸需求量的评定[J]. 水产学报, 2010, 34(8): 1244-1253. |
| [14] |
WU P, TANG L, JIANG W D, et al. The relationship between dietary methionine and growth, digestion, absorption, and antioxidant status in intestinal and hepatopancreatic tissues of sub-adult grass carp (Ctenopharyngodon idella)[J]. Journal of Animal Science and Biotechnology, 2017, 8: 63. |
| [15] |
KIM K I, KAYES T B, AMUNDSON C H. Requirements for sulfur amino acids and utilization of D-methionine by rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1992, 101(1/2): 95-103. DOI:10.1016/0044-8486(92)90235-d |
| [16] |
LUO Z, LIU Y J, MAI K S, et al. Dietary L-methionine requirement of juvenile grouper Epinephelus coioides at a constant dietary cystine level[J]. Aquaculture, 2005, 249(3/4): 409-418. |
| [17] |
SCHWARZ F J, KIRCHGESSNER M, DEURINGER U. Studies on the methionine requirement of carp (Cyprinus carpio L.)[J]. Aquaculture, 1998, 161(1/2/3/4): 121-129. |
| [18] |
TANG L, WANG G X, JIANG J, et al. Effect of methionine on intestinal enzymes activities, microflora and humoral immune of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. Aquaculture Nutrition, 2009, 15(5): 477-483. |
| [19] |
ROLLAND M, DALSGAARD J, HOLM J, et al. Dietary methionine level affects growth performance and hepatic gene expression of GH-IGF system and protein turnover regulators in rainbow trout (Oncorhynchus mykiss) fed plant protein-based diets[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2015, 181: 33-41. |
| [20] |
唐炳荣.蛋氨酸对生长中期草鱼消化吸收能力和抗氧化能力影响的研究[D].硕士学位论文.雅安: 四川农业大学, 2012.
|
| [21] |
马学坤.卵形鲳鲹幼鱼对饲料中蛋白能量比和几种必需氨基酸需求的研究[D].博士学位论文.青岛: 中国海洋大学, 2013.
|
| [22] |
CHI S Y, TAN B P, DONG X H, et al. Effects of supplemental coated or crystalline methionine in low-fishmeal diet on the growth performance and body composition of juvenile cobia Rachycentron canadum (Linnaeus)[J]. Chinese Journal of Oceanology and Limnology, 2014, 32(6): 1297-1306. |
| [23] |
WANG Z, MAI K S, XU W, et al. Dietary methionine level influences growth and lipid metabolism via GCN2 pathway in cobia (Rachycentron canadum)[J]. Aquaculture, 2016, 454: 148-156. |
| [24] |
TRIPODI F, CASTOLDI A, NICASTRO R, et al. Methionine supplementation stimulates mitochondrial respiration[J]. Biochimica et Biophysica Acta:Molecular Cell Research, 2018, 1865(12): 1901-1913. |
| [25] |
LEVINE R L, BERLETT B S, MOSKOVITZ J, et al. Methionine residues may protect proteins from critical oxidative damage[J]. Mechanisms of Ageing and Development, 1999, 107(3): 323-332. |
| [26] |
廖英杰.团头鲂幼鱼对蛋氨酸、赖氨酸和精氨酸需要量的研究[D].硕士学位论文.南京: 南京农业大学, 2014.
|
| [27] |
COUTINHO F, SIMÕES R, MONGE-ORTIZ R, et al. Effects of dietary methionine and taurine supplementation to low-fish meal diets on growth performance and oxidative status of European sea bass (Dicentrarchus labrax) juveniles[J]. Aquaculture, 2017, 479: 447-454. |
| [28] |
向枭, 周兴华, 曾本和, 等. 蛋氨酸水平对罗非鱼蛋白质代谢及血清生化指标的影响[J]. 中国粮油学报, 2016, 31(11): 92-98, 105. |
| [29] |
SEGNER H, VERRETH J. Metabolic enzyme activities in larvae of the African catfish, Clarias gariepinus:changes in relation to age and nutrition[J]. Fish Physiology and Biochemistry, 1994, 14(5): 385-398. |
| [30] |
王香丽.蛋氨酸对瓦氏黄颡鱼幼鱼生长和代谢的影响[D].硕士学位论文.青岛: 中国海洋大学, 2014.
|
| [31] |
SKIBA-CASSY S, GEURDEN I, PANSERAT S, et al. Dietary methionine imbalance alters the transcriptional regulation of genes involved in glucose, lipid and amino acid metabolism in the liver of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2016, 454: 56-65. |




