2. 国家水禽产业技术体系营养与饲料功能研究室, 青岛 266109
2. National Waterfowl Industry Technical System Nutrition and Feed Function Laboratory, Qingdao 266109, China
肠道微生物既影响着营养物质的消化、吸收和能量供应,又调控着宿主正常生理功能及疾病的发生与发展,对机体正常功能的运行有着至关重要的影响[1]。溃疡性结肠炎是一种病因尚不十分清楚的结肠和直肠慢性非特异性炎症性疾病,人类和动物发病率均较高,尤其是畜禽饲粮中霉菌污染造成的溃疡性结肠炎现象更为严重。因此,深入研究溃疡性结肠炎状态下肠道菌群结构的修复新方法以提高肠道健康水平具有重要意义。Song等[2]研究发现,甘油二酯激酶参与氧化应激肠细胞损伤的调节。甘油二酯对胆汁酸的分泌有抑制作用,可用来防治腹泻及其他疾病引起的刺激腹泻症状。甘油二酯能够抑制脂质体的形成从而控制治疗炎症[3]。甘油二酯的糖苷,例如经活性导引分离法由玫瑰果提取物中分离得到的3-β-D-吡喃半乳糖基氧基-2-(十八碳-9Z, 12Z, 15Z-三烯酰氧基)丙基十八碳-9Z,12Z, 15Z-三烯酸酯,可作为治疗炎症疾病例如关节炎的口服抗炎药物。维生素D3除参与钙、磷代谢外,还可通过调节机体免疫细胞因子、诱导表达抗菌肽以及维持肠黏膜屏障的完整性,调节肠道菌群,增加肠道中有益菌的相对丰度,缓解炎症性肠病的疾病程度[4]。
目前,对于维生素D3促进畜禽生长发育技术的研究和产品开发较多,而维生素D3与乳化添加剂鸭油甘油二酯(goose oil diglyceride,DDG)的联合使用对结肠炎大鼠肠道菌群结构、脾脏过氧化物酶体增殖物激活受体γ(PPARγ)mRNA表达量及肠道组织发育影响的研究尚未见报道。因此,本试验利用16S rRNA技术对不同水平的鸭油甘油二酯和维生素D3对结肠炎大鼠结肠菌群进行检测,并利用定量PCR(Q-PCR)技术对脾脏PPARγ mRNA表达量进行分析[5],旨在从分子和代谢组学机制分析鸭油甘油二酯和维生素D3与结肠炎大鼠结肠菌群和脾脏PPARγ mRNA表达量及其与肠道组织发育的相关性,开发出一种新型结肠炎辅助治疗修复制剂。
1 材料与方法 1.1 试验材料及饲粮鸭油甘油二酯为本实验室自制(甘油二酯含量>85%),维生素D3购自上海源叶生物有限公司(含量≥10万IU/g),葡聚糖硫酸钠(dextran sulfate sodium,DSS)购自合肥博美生物科技有限公司,6周龄雄性SD大鼠购自青岛大任富城有限公司。
基础饲粮购自德州诺唯实生物技术有限公司,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验分为葡聚糖硫酸钠诱导结肠炎模型建立和不同水平的鸭油甘油二酯和维生素D3对结肠炎大鼠干预试验2个阶段。本试验符合《实验动物福利伦理审查指南》(GB/T 35892—2018)。
第1阶段:结肠炎模型建立[6]。选择100只大鼠,随机分为模型组和对照组,对照组每组4个重复;模型组每组16个重复,每个重复均5只大鼠。对照组大鼠自由饮用蒸馏水,模型组大鼠自由饮用5%葡聚糖硫酸钠水溶液,连续7 d。造模结束后,对照组和模型组各抽取10只大鼠,禁食12 h,取血清和结肠,并检测终末体重、结肠长度和血清致炎因子含量,验证模型建立是否成功。
第2阶段:大鼠干预试验。选取10只正常大鼠作为对照组(Ⅰ组),另选择第1阶段建模成功的大鼠70只,随机分成7个组,分别为模型组(Ⅱ组)和试验组(Ⅲ~Ⅷ组);每组均2个重复,每个重复5只。试验期3周。具体的试验设计见表 2。
|
|
表 2 试验设计 Table 2 Experimental design |
结肠样品的采集:试验的第3周龄末,各组随机选择3只大鼠,眼球放血脱颈致死后迅速剖开腹腔,无菌操作取出结肠,截取2 cm于-80 ℃冰箱保存待测。
结肠微生物总DNA的提取:使用MN NucleoSpin 96 Soil DNA提取试剂盒进行提取。
PCR扩增及细菌16S rDNA测序分析:按照细菌16S rRNA(V3+V4)区域合成引物,上游引物,5′-ACTCCTACGGGAGGCAGCA-3′;下游引物,5′-GGACTACHVGGGTWTCTAAT-3′。样品检测时PCR预试验的程序如下:95 ℃预变性5 min,95 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1 min,共15个循环,然后在72 ℃延伸7 min。微生物多样性建库:目标区域PCR及纯化,Solexa PCR,定量,混样,切胶回收。将优化序列进行聚类,划分操作分类单位(OTUs),基于OTUs分析结果,对样品在各个分类水平上进行分类学分析,获得各样品在门、纲、属分类学水平上的菌群结构等[7-8]。
1.3.2 结肠肠道组织学检测每个样品分别取2 cm长的组织样品去内容物后,蒸馏水清洗后固定在10%的福尔马林溶液用于组织切片的制作。组织样品经冲洗组织、脱水、透明、浸蜡、包埋、切片、展片、苏木精-伊红(HE)染色、封片的石蜡切片制作程序。在OLYMPUS系统显微镜4×10倍镜下观察,LY-WN-HP SUPPER CCD软件测量结肠的绒毛高度(villus height,VH)、隐窝深度(crypt depth,CD)及绒毛高度/隐窝深度(V/C)。绒毛高度以绒毛顶端至绒毛基部为准,隐窝深度为量绒毛之间基部开口处至肠腺底部的距离。
1.3.3 脾脏PPARγ mRNA表达量的测定选取各脾脏样品50 mg,加入1 mL的TRNzol(Roche)试剂粉碎匀浆后抽提RNA。使用Bio-Photometer型核酸蛋白测定仪测定其浓度和纯度,将检验合格的RNA用反转录试剂盒逆转录成cDNA用于mRNA表达量测定试验。cDNA合成条件37 ℃,15 min;85 ℃,5 s。按照日本TaKaRa公司SYBR Premix Ex Taq Ⅱ试剂盒的说明,采用SYBR Green Ⅰ嵌合荧光法进行靶基因mRNA表达量的检测。以3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)为内参基因,引物由生工生物(上海)有限公司合成。使用2-ΔΔCt法计算目的基因mRNA相对于内参基因GAPDH的表达量。基因引物序列见表 3。
|
|
表 3 基因引物序列 Table 3 Gene primer sequence |
利用SPSS 17.0软件中GLM分析主效应和互作效应,再利用ANOVA程序和LSD法对数据进行差异显著性分析,建模阶段的模型组和对照组之间差异采用Student-t检验分析,P<0.05为差异显著。
2 结果与分析 2.1 葡聚糖硫酸钠诱导结肠炎模型的建立由表 4可知,对照组和模型组的初始体重无显著差异(P>0.05)。饲喂葡聚糖硫酸钠后,与对照组相比,模型组的终末体重和结肠长度均显著降低(P<0.05),血清白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)含量及二胺氧化酶(DAO)活性均显著升高(P<0.05)。以上结果表明,葡聚糖硫酸钠诱导结肠炎模型建立成功[6]。
|
|
表 4 葡聚糖硫酸钠对大鼠造模的影响 Table 4 Effects of DSS on modeling of rats |
由表 5可知,与Ⅰ组相比,Ⅱ~Ⅷ组的OTUs数量、Ace指数、Chao1指数均显著降低(P<0.05);与Ⅱ组相比,Ⅲ~Ⅷ组的OTUs数量、Ace指数、Chao1指数均显著升高(P<0.05);鸭油甘油二酯和维生素D3交互作用对Ace指数、Chao1指数影响显著(P<0.05),Ⅳ组的Ace指数、Chao1指数最高。鸭油甘油二酯和维生素D3交互作用对OTUs数量影响不显著(P>0.05),鸭油甘油二酯对OTUs数量影响显著(P<0.05),维生素D3对OTUs数量影响不显著(P>0.05)。各组样本覆盖率(coverage)值均大于0.998,表明样品中物种被测出的概率很高。
|
|
表 5 鸭油甘油二酯和维生素D3对结肠炎大鼠结肠菌群α多样性的影响 Table 5 Effects of duck oil diacylglycerol and vitamin D3 on colon microbial α diversity of colitis rats |
以上结果表明,不同水平的鸭油甘油二酯和维生素D3能够使结肠炎大鼠结肠微生物α多样性增加,其中Ⅳ组的结肠微生物的物种丰度高于其他5个试验组。
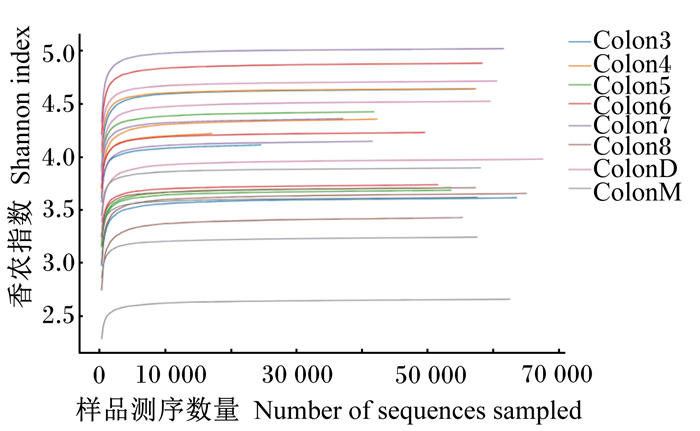
香农曲线用来反映各样品在不同测序数量时的微生物多样性。由图 1可知,起初曲线直线上升,随后数值升高直至平滑,8个组样品均表现出先骤增后趋于某一个定值的趋势,由此表明,8个组样品的测序条数都足以覆盖样品中绝大部分微生物。
|
ColonD:Ⅰ组group Ⅰ;colonM:Ⅱ组group Ⅱ;colon3:Ⅲ组group Ⅲ;colon4:Ⅳ组group Ⅳ;colon5:Ⅴ组group Ⅴ;colon6:Ⅵ组group Ⅵ;colon7:Ⅶ组group Ⅶ;colon8:Ⅷ组group Ⅷ。图 3同The same as Fig. 3。 图 1 样品香农曲线 Fig. 1 Shannon curve of sample |
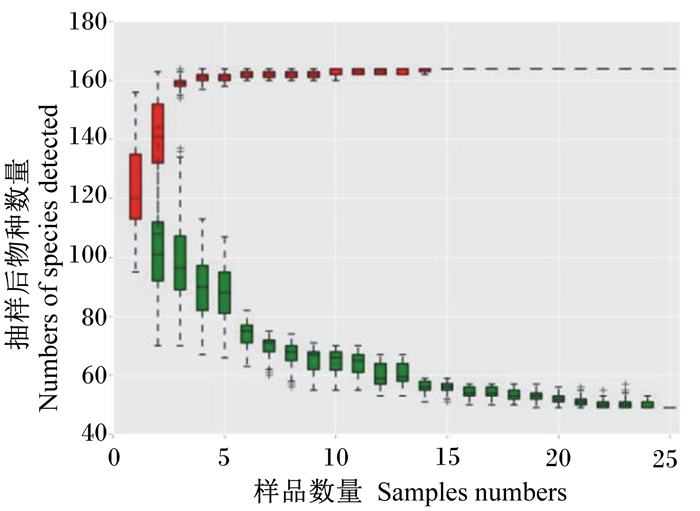
由图 2可知,本试验样品组成的红色箱式曲线先升高后趋于平缓,表明物种不随样品数量的增加而显著增多;绿色箱式曲线先下降后趋于平缓,表明所取样品中的共有物种趋于饱和。红色和绿色箱式曲线结果均说明本试验所取样品数量足以反映当前所有微生物物种。
|
图 2 属水平物种累积曲线图 Fig. 2 Species cumulative curve in genus level |
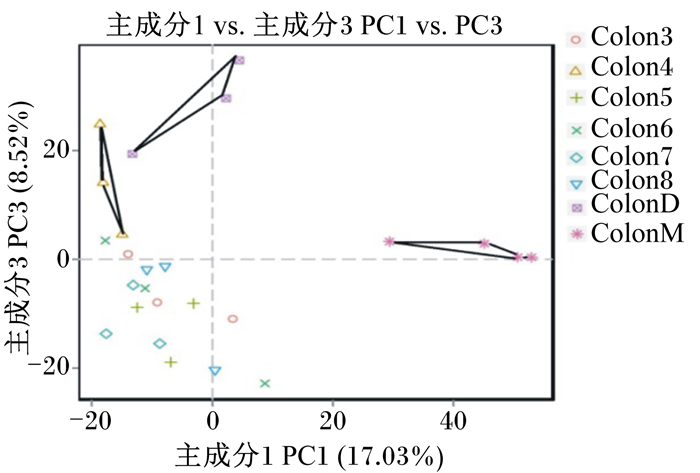
如图 3所示,主成分分析(PCoA)图显示Ⅰ组和Ⅱ组小鼠有明显差异,鸭油甘油二酯和维生素D3处理后主成分向Ⅰ组靠近,且Ⅳ组主成分与Ⅰ组相似。以上结果表明,鸭油甘油二酯和维生素D3能使结肠炎大鼠的肠道菌群逐渐恢复正常健康,调节了肠道菌群的失衡。
|
图 3 PCoA图 Fig. 3 PCoA figure |
由表 6可知,与Ⅰ组相比,Ⅱ~Ⅷ组厚壁菌门(Firmicutes)比例显著增加(P<0.05);与Ⅱ组相比,Ⅲ~Ⅷ组Firmicutes比例均显著降低(P<0.05);鸭油甘油二酯和维生素D3交互作用对Firmicutes比例影响显著(P<0.05),Ⅳ组Firmicutes比例显著低于其他5个试验组(P<0.05)。
|
|
表 6 鸭油甘油二酯和维生素D3对结肠炎大鼠结肠门水平优势菌群的影响 Table 6 Effects of duck oil diacylglycerol and vitamin D3 on colonic dominant microbial in phylum level of colitis rats |
与Ⅰ组相比,Ⅱ~Ⅶ组拟杆菌门(Bacteroidetes)比例显著降低(P<0.05),Ⅷ组与Ⅰ组差异不显著(P>0.05);与Ⅱ组相比,Ⅲ~Ⅷ组Bacteroidetes比例显著升高(P<0.05);鸭油甘油二酯和维生素D3交互作用对Bacteroidetes比例影响显著(P<0.05),Ⅷ组Bacteroidetes比例显著高于其他5个试验组(P<0.05)。
与Ⅰ组相比,Ⅱ~Ⅷ组变形菌门(Proteobacteria)比例显著增加(P<0.05);与Ⅱ组相比,Ⅲ~Ⅷ组Proteobacteria比例均显著降低(P<0.05);鸭油甘油二酯和维生素D3交互作用对Proteobacteria比例影响显著(P<0.05),Ⅴ组Proteobacteria比例与Ⅳ组差异不显著(P>0.05),但显著低于其他4个试验组(P<0.05)。
以上结果表明,不同水平的鸭油甘油二酯和维生素D3可使结肠炎大鼠结肠Firmicutes、Proteobacteria比例显著降低,Bacteroidetes比例显著增加。
2.2.4 鸭油甘油二酯和维生素D3对结肠炎大鼠结肠纲水平优势菌群的影响由表 7可知,与Ⅰ组相比,Ⅱ~Ⅷ组梭状芽孢杆菌纲(Clostridia)比例无显著差异(P>0.05);与Ⅱ组相比,Ⅱ~Ⅷ组Clostridia比例无显著差异(P>0.05);维生素D3、鸭油甘油二酯及鸭油甘油二酯和维生素D3交互作用对Clostridia比例影响不显著(P>0.05)。
|
|
表 7 鸭油甘油二酯和维生素D3联合对结肠炎大鼠结肠纲水平优势菌群的影响 Table 7 Effects of duck oil diacylglycerol and vitamin D3 on colonic dominant microbial in class level of colitis rats |
与Ⅰ组相比,Ⅱ~Ⅷ组拟杆菌纲(Bacteroidia)比例显著降低(P<0.05);与Ⅱ组相比,Ⅲ~Ⅷ组Bacteroidia比例显著升高(P<0.05);鸭油甘油二酯和维生素D3交互作用对Bacteroidia比例影响显著(P<0.05),Ⅷ组Bacteroidia比例显著高于Ⅲ、Ⅴ、Ⅵ、Ⅶ组(P<0.05)。
与Ⅰ组相比,Ⅱ~Ⅷ组丹毒丝菌纲(Erysipelotrichia)比例显著增加(P<0.05);与Ⅱ组相比,Ⅲ、Ⅳ、Ⅴ、Ⅶ、Ⅷ组Erysipelotrichia比例均显著降低(P<0.05);鸭油甘油二酯和维生素D3交互作用对Erysipelotrichia比例影响显著(P<0.05),Ⅳ组Erysipelotrichia比例显著低于Ⅲ、Ⅴ、Ⅵ组(P<0.05),但与Ⅶ、Ⅷ组无显著差异(P>0.05)。
与Ⅰ组相比,Ⅱ~Ⅷ组γ-变形菌纲(Gammaproteobacteria)比例显著增加(P<0.05);与Ⅱ组相比,Ⅲ~Ⅷ组Gammaproteobacteria比例显著降低(P<0.05);鸭油甘油二酯和维生素D3交互作用对Gammaproteobacteria比例影响显著(P<0.05),Ⅳ组Gammaproteobacteria比例显著低于其他5个试验组(P<0.05)。
以上结果表明,不同水平的鸭油甘油二酯和维生素D3使结肠炎大鼠肠道Erysipelotrichia、Gammaproteobacteria比例显著降低,Bacteroidia比例显著增加。
2.2.5 鸭油甘油二酯和维生素D3对结肠炎大鼠结肠属水平优势菌群的影响由表 8可知,与Ⅰ组相比,Ⅱ、Ⅲ、Ⅵ、Ⅶ、Ⅷ组志贺氏菌属(Shigella)比例显著增加(P<0.05),Ⅳ、Ⅴ组Shigella比例无显著差异(P>0.05);与Ⅱ组相比,Ⅲ~Ⅷ组Shigella比例显著降低(P<0.05);鸭油甘油二酯和维生素D3交互作用对Shigella比例影响显著(P<0.05),Ⅳ组Shigella比例与Ⅴ组无显著差异(P>0.05),但显著低于其他4个试验组(P<0.05)。
|
|
表 8 鸭油甘油二酯和维生素D3联合对结肠炎大鼠结肠属水平优势菌群的影响 Table 8 Effects of duck oil diacylglycerol and vitamin D3 on colonic dominant microbial in genus level of colitis rats |
与Ⅰ组相比,Ⅱ~Ⅷ组拟杆菌属(Bacteroides)比例显著降低(P<0.05);与Ⅱ组相比,Ⅲ~Ⅷ组Bacteroides比例显著升高(P<0.05);鸭油甘油二酯和维生素D3交互作用对Bacteroides比例影响显著(P<0.05),Ⅳ组Bacteroides比例显著高于其他5个试验组(P<0.05)。
与Ⅰ组相比,Ⅱ~Ⅷ组普拉氏菌属(Prevotella)比例显著增加(P<0.05);与Ⅱ组相比,Ⅲ~Ⅷ组Prevotella比例显著降低(P<0.05);鸭油甘油二酯和维生素D3交互作用对Prevotella比例影响显著(P<0.05),Ⅷ组Prevotella比例显著低于其他5个试验组(P<0.05)。
与Ⅰ组相比,Ⅱ、Ⅵ组支原体菌属(Allobaculum)比例显著增加(P<0.05),Ⅳ、Ⅷ组Allobaculum比例显著降低(P<0.05),Ⅲ、Ⅴ、Ⅶ组Allobaculum比例无显著差异(P>0.05);与Ⅱ组相比,Ⅲ~Ⅷ组Allobaculum比例显著降低(P<0.05);鸭油甘油二酯和维生素D3交互作用对Allobaculum比例影响显著(P<0.05),Ⅷ组Allobaculum比例显著低于其他5个试验组(P<0.05)。
以上结果表明,不同水平的鸭油甘油二酯和维生素D3可使结肠炎大鼠肠道病原菌Shigella、Prevotella、Allobaculum比例显著降低,有益菌Bacteroides比例显著增加。
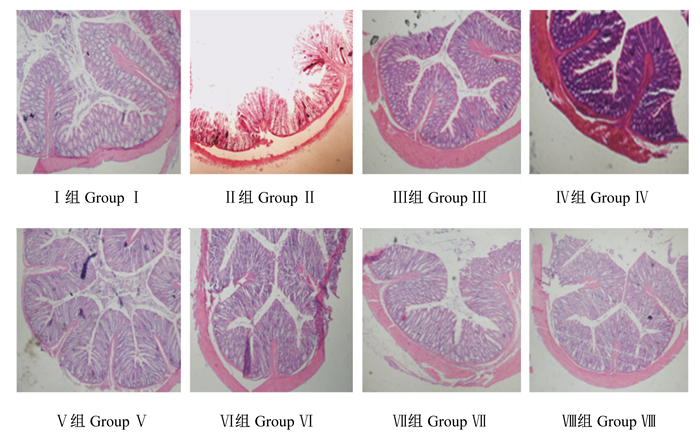
2.3 鸭油甘油二酯和维生素D3对结肠炎大鼠结肠组织发育的影响由图 4可知,与Ⅰ组相比,Ⅱ组绒毛长度明显缩短;经过鸭油甘油二酯和维生素D3处理后,Ⅲ~Ⅷ组绒毛长度明显增加。
|
图 4 大鼠结肠组织学切片 Fig. 4 Colonic histology section of rats (400×) |
由表 9可知,与Ⅰ组相比,Ⅱ~Ⅷ组绒毛高度显著降低(P<0.05);与Ⅱ组相比,Ⅲ~Ⅷ组绒毛高度显著升高(P<0.05);鸭油甘油二酯和维生素D3交互作用对绒毛高度影响显著(P<0.05),Ⅳ组绒毛高度显著高于其他5个试验组(P<0.05)。
|
|
表 9 鸭油甘油二酯与维生素D3对结肠炎大鼠结肠发育的影响 Table 9 Effects of synergistic action of duck oil diacylglycerol and vitamin D3 on colon development of colitis rats |
与Ⅰ组相比,Ⅱ~Ⅷ组隐窝深度显著变深(P<0.05);与Ⅱ组相比,Ⅲ~Ⅷ组隐窝深度显著变浅(P<0.05);鸭油甘油二酯和维生素D3交互作用对隐窝深度影响显著(P<0.05),Ⅳ组隐窝深度显著低于其他5个试验组(P<0.05)。
与Ⅰ组相比,Ⅱ~Ⅷ组绒毛高度/隐窝深度显著降低(P<0.05);与Ⅱ组相比,Ⅲ~Ⅷ组绒毛高度/隐窝深度显著升高(P<0.05);鸭油甘油二酯和维生素D3交互作用对绒毛高度/隐窝深度影响不显著(P>0.05),鸭油甘油二酯对绒毛高度/隐窝深度影响显著(P<0.05),维生素D3对绒毛高度/隐窝深度影响不显著(P>0.05)。
以上结果表明,不同水平的鸭油甘油二酯和维生素D3可使绒毛高度、绒毛高度/隐窝深度变大,隐窝深度变浅,促进结肠炎大鼠结肠发育,其中Ⅳ组效果最好。
2.4 鸭油甘油二酯和维生素D3对结肠炎大鼠脾脏PPARγ mRNA表达量的影响与Ⅰ组相比,Ⅱ~Ⅷ组脾脏PPARγ mRNA表达量显著降低(P<0.05);与Ⅱ组相比,Ⅲ~Ⅶ组脾脏PPARγ mRNA表达量显著升高(P<0.05);鸭油甘油二酯和维生素D3交互作用对脾脏PPARγ mRNA表达量影响显著(P<0.05),Ⅳ组脾脏PPARγ mRNA表达量显著高于其他5个试验组(P<0.05)。
|
|
表 10 鸭油甘油二酯和维生素D3对结肠炎大鼠脾脏PPARγ mRNA表达量的影响 Table 10 Effects of synergistic action of duck oil diacylglycerol and vitamin D3 on spleen PPARγ mRNA expression of colitis rats |
由表 11可知,脾脏PPARγ mRNA表达量与绒毛高度、绒毛高度/隐窝深度呈极显著正相关(P<0.01),与隐窝深度呈极显著负相关(P<0.01)。
|
|
表 11 脾脏PPARγ mRNA表达量与结肠炎大鼠结肠发育的相关性 Table 11 Correlation between spleen PPARγ mRNA expression and colon development of colitis rats |
以上结果表明,脾脏PPARγ mRNA表达量对结肠炎大鼠的肠道发育具有显著的调控作用。
3 讨论 3.1 鸭油甘油二酯和维生素D3的功能及相互关系甘油二酯是一类甘油三酯(triacylglycerol,TG)中1个脂肪酸被羟基取代的结构脂质[9],具有脂溶性。初步研究表明,甘油二酯通过改变细胞膜的通透性,起到抑菌的作用[10]。研究人员发现,甘油二酯激酶参与氧化应激肠细胞损伤的调节。甘油二酯对胆汁酸的分泌有抑制作用,可用来防治腹泻及其他疾病引起的刺激腹泻症状[11]。维生素D主要功能在调节钙、磷代谢方面,直至20世纪80年代,维生素D受体在外周血单核细胞上发现,人们才逐渐开始认识其对免疫调节的作用。维生素D可通过抗菌、抗炎及修复肠黏膜屏障减轻炎症性肠病的病情[12-13]。维生素D在炎症性肠病中通过多种方式发挥其生物学作用[14],而且已证实,在炎症性肠病患者中普遍存在维生素D缺乏,而且维生素D的缺乏与炎症性肠病的疾病程度呈相关性[4]。肠道微生物与动物营养代谢、肥胖、脂肪沉积和糖尿病等有密切的关系,肠道微生物在营养代谢方面主要作用于碳水化合物代谢、蛋白质和氨基酸代谢、脂质代谢、维生素代谢及矿物质代谢等[5]。维生素D3是医学常用的一种治疗结肠炎的有效物质,在营养学上也经常见报道,但是与鸭油甘油二酯联合使用的研究基本处于空白。本试验将维生素D3与同样具有调节肠道细胞损伤的溶剂鸭油甘油二酯联合使用,利用高通量测序分析不同水平的鸭油甘油二酯和维生素D3对结肠炎大鼠结肠微生物多样性的影响,并采用Q-PCR技术对脾脏PPARγ mRNA表达量进行测定及分析PPARγ mRNA表达量与结肠发育的相关性,从分子机制探讨了不同水平鸭油甘油二酯和维生素D3对结肠菌群和基因表达的干预效果。
3.2 鸭油甘油二酯与维生素D3对结肠炎大鼠结肠菌群多样性的影响肠道菌群α多样性分析揭示了样品物种丰度及多样性[15]。OTUs数量、Chao1指数和Ace指数表示的是物种数量多样性的大小,指数越大说明物种多样性越高。肠道菌群β多样性比较的是样品之间的相似程度[16-17],通过PCoA计算样品之间的距离可以比较样品相似性,物种距离越近反映物种类型越相似。本试验发现,Ⅱ组多样性与其他组相比显著降低,Ⅱ组PCoA与Ⅰ组有明显的分离且距离最远,说明葡聚糖硫酸钠诱导大鼠肠道多样性发生极大变化,不同水平的鸭油甘油二酯和维生素D3处理后,物种丰度显著增加,逐渐恢复至正常水平。本试验结果表明,鸭油甘油二酯和维生素D3具有改善肠道菌群多样性、调节肠道菌群失衡的功能。
3.3 鸭油甘油二酯和维生素D3对结肠炎大鼠结肠优势菌群的影响本试验发现,在门水平上,与Ⅱ组相比,Ⅲ~Ⅷ组Firmicutes、Proteobacteria比例显著降低,Bacteroidetes比例显著增加。其中,Ⅳ组Firmicutes比例与其他5个试验组相比最低;Ⅴ组Proteobacteria比例与Ⅳ组差异不显著,但显著低于其他4个试验组;Ⅷ组Bacteroidetes比例与其他5个试验组相比最高。在纲水平上,与Ⅱ组相比,Ⅲ~Ⅷ组Erysipelotrichia和Gammaproteobacteria比例显著降低,Bacteroides比例显著增加。其中Ⅳ组效果相比于其他5个试验组较好。在属水平上,与Ⅱ组相比,Ⅲ~Ⅷ组Shigella、Prevotella、Allobaculum比例显著降低,Bacteroides比例显著增加。其中,Ⅳ组Shigella比例显著低于其他5个试验组,Bacteroides比例显著高于其他5个试验组;Ⅷ组Prevotella、Allobaculum比例显著低于其他5个试验组。先前研究报道过炎症性肠病患者Firmicutes比例增加,并且Firmicutes与很多疾病有着密切的关系[18]。Firmicutes在肥胖人体内相对丰度较高,容易对高脂饮食人群造成肠道炎症。Kim等[19]研究发现,Bacteroidetes是有益菌,对于维持胃肠道稳态有重要作用,炎症性肠病患者Bacteroidetes比例减少。Shigella可引起痢疾等各种肠道疾病,肠炎患者体内Shigella比例增多。栾子健[20]研究发现,肠癌组Prevotella比例增加,炎症性肠病患者普遍存在维生素D3缺乏,服用维生素D3可调节肠道菌群,增加Bacteroides的比例,降低Prevotella等病原菌的比例,减少肠炎的疾病发生度。上述研究与本试验的研究结果基本一致。
3.4 鸭油甘油二酯和维生素D3对结肠炎大鼠结肠组织发育的影响肠黏膜是肠道机械屏障的重要组成成分,绒毛长度、隐窝深度及绒毛长度/隐窝深度是衡量肠黏膜完整的重要指标,当肠道黏膜收到侵害或者发生疾病时,绒毛长度会缩短,隐窝深度加深,导致肠道成熟细胞分泌减少,吸收营养面积变小,肠道吸收营养物质效率降低。本试验发现,Ⅱ组大鼠绒毛长度及绒毛长度/隐窝深度变小,隐窝深度加深,经过鸭油甘油二酯和维生素D3处理后结肠炎大鼠绒毛长度及绒毛长度/隐窝深度变大,隐窝深度变浅。张丽霞等[22]研究表明,结肠炎大鼠绒毛萎缩或者脱落。石宝石等[23]研究表明,维生素D3可以通过Wnt信号通路调控肠道发育。雷荣苹[24]研究表明,饲粮中添加维生素D3显著升高四川山地乌骨鸡绒毛长度和绒毛长度/隐窝深度。本试验发现,不同水平的鸭油甘油二酯和维生素D3显著升高结肠炎大鼠的绒毛长度,降低隐窝深度,与上述试验结果一致。这表明鸭油甘油二酯和维生素D3可促进大鼠结肠组织发育。
3.5 鸭油甘油二酯和维生素D3对结肠炎大鼠脾脏PPARγ mRNA表达量的影响过氧化物酶体增殖物激活受体(peroxisome proliferators activated receptor,PPAR)是核激素受体家族中的配体激活受体,PPARγ属于其中一种亚型,主要分布在脂肪组织、肠道、脾脏等处[25]。邹婉婧[26]研究发现,PPARγ mRNA表达量的增加可以减少促炎细胞因子核因子-κB(NF-κB)的表达从而缓解结肠炎症反应。韩涵[27]研究发现,维生素D3可上调2型糖尿病大鼠脾脏PPARγ mRNA表达量,减轻大鼠脂肪组织炎症浸润现象。本试验结果发现,不同水平的鸭油甘油二酯与维生素D3对肠炎大鼠脾脏PPARγ mRNA表达量具有显著上调作用,表明鸭油甘油二酯和维生素D3可以促进配体激活受体的表达,下调炎症因子的表达。
3.6 脾脏PPARγ mRNA表达量与结肠炎大鼠肠道发育的相关性分析耿丽[25]研究表明,PPARγ可以调节炎性因子的表达,促进组织修复,肠道内PPARγ的表达降低可能导致炎症的发生。宋柯[28]研究发现,激活PPARγ调控相关炎症通路可以修复肝损伤,减轻肝脏坏死性炎症。姜莉莉等[29]研究发现,通过下调肾小球NF-κB表达和上调PPARγ表达可改善糖尿病肾病大鼠肾脏肾小球和毛细血管结构,缓解肾脏病变。目前,关于PPARγ mRNA表达量对炎症通路相关基因的表达和生化指标影响研究比较多,但是对于PPARγ mRNA表达量与炎症大鼠的肠道发育的相关性的分析并未见到报道。本试验结果表明,脾脏PPARγ mRNA表达量与绒毛长度、绒毛长度/隐窝深度呈极显著正相关,与隐窝深度呈极显著负相关。这表明鸭油甘油二酯与维生素D3可影响脾脏PPARγ mRNA表达,进一步影响结肠炎大鼠的肠道发育。
4 结论不同水平的鸭油甘油二酯和维生素D3能够改善结肠炎大鼠的结肠区系微生物结构,增加有益微生物比例,促进结肠肠道发育,上调脾脏PPARγ mRNA表达量,并且对肠道发育具有调控作用,以5.0 mL/kg鸭油甘油二酯和12.5 μg/kg维生素D3组合为最优。
| [1] |
YANG G Q, YIN Y, LIU H Y, et al. Effects of dietary oligosaccharide supplementation on growth performance, concentrations of the major odor-causing compounds in excreta, and the cecal microflora of broilers[J]. Poultry Science, 2016, 95(10): 2342-2351. DOI:10.3382/ps/pew124 |
| [2] |
SONG J, LI J, MOUROT J M, et al. Diacylglycerol kinase regulation of protein kinase D during oxidative stress-induced intestinal cell injury[J]. Biochemical and Biophysical Research Communications, 2008, 375(2): 200-204. DOI:10.1016/j.bbrc.2008.07.155 |
| [3] |
MURASE T, AOKI M, WAKISAKA T, et al. Anti-obesity effect of dietary diacylglycerol in C57BL/6J mice:dietary diacylglycerol stimulates intestinal lipid metabolism[J]. Journal of Lipid Research, 2002, 43(8): 1312-1319. DOI:10.1194/jlr.M200094-JLR200 |
| [4] |
王宽, 黄任佳, 吴焕淦, 等. 维生素D在炎症性肠病中的作用机制[J]. 世界华人消化杂志, 2015, 23(35): 5655-5661. |
| [5] |
金多晨, 曹海龙, 董文逍, 等. 肠道微生态失衡与结肠炎相关肠癌发生发展的研究进展[J]. 肿瘤药学, 2016, 6(5): 321-325. |
| [6] |
赵闪闪, 黄雪, 覃蒙斌, 等. 葡聚糖硫酸钠诱导慢性溃疡性结肠炎小鼠模型的建立及评价[J]. 广西医科大学学报, 2019, 36(4): 559-562. |
| [7] |
袁榴娣. 高级生物化学与分子生物学实验教程[M]. 南京: 东南大学出版社, 2006.
|
| [8] |
程漫漫, 张廷荣, 王宝维, 等. 饲粮中添加叶酸和维生素B12对雏鹅盲肠菌群结构的影响[J]. 动物营养学报, 2018, 30(8): 2987-2996. |
| [9] |
陈琼, 杨雪, 赵金利, 等. 酶法制备甘油二酯与甘油三酯的结晶特性研究[J]. 中国油脂, 2015, 40(11): 48-53. |
| [10] |
郭夏丽, 张虹, 杜雨芊, 等. 樟树籽油甘油二酯的分离及抑菌活性[J]. 南昌大学学报(理科版), 2015, 39(5): 485-491, 497. |
| [11] |
孟祥河, 毛忠贵, 高保军, 等. 甘油二酯的应用现状[J]. 中国食品添加剂, 2002(4): 58-61. |
| [12] |
杨亭亭.维生素D与维生素D相关性疾病[D].硕士学位论文.石家庄: 河北医科大学, 2016. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_D844922
|
| [13] |
姚志伟, 周永宁. 维生素D治疗炎症性肠病的研究进展[J]. 胃肠病学和肝病学杂志, 2017, 26(7): 827-831. |
| [14] |
孙乐科, 吴俭. 维生素D与危重症的关系[J]. 江西医药, 2016, 51(4): 379-381. |
| [15] |
许燕.养殖斑石鲷黑身病的病原病理学及药物干预下肠道菌群结构分析[D].硕士学位论文.上海: 上海海洋大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10264-1017854301.htm
|
| [16] |
熊慧芳.TIM信号通路干预对小鼠实验性结肠炎的作用及机制研究[D].博士学位论文.南昌: 南昌大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10403-1017224075.htm
|
| [17] |
JIANG T T, GAO J, WU C, et al. Apple-derived pectin modulates gut microbiota, improves gut barrier function, and attenuates metabolic endotoxemia in rats with diet-induced obesity[J]. Nutrients, 2016, 8(3): 126. DOI:10.3390/nu8030126 |
| [18] |
KIM Y S, HO S B. Intestinal goblet cells and mucins in health and disease:recent insights and progress[J]. Current Gastroenterology Reports, 2010, 12(5): 319-330. DOI:10.1007/s11894-010-0131-2 |
| [19] |
KIM Y S, MILNER J A. Dietary modulation of colon cancer risk[J]. The Journal of Nutrition, 2007, 137(11): 2576S-2579S. DOI:10.1093/jn/137.11.2576S |
| [20] |
栾子健.维生素D3对炎症相关结直肠癌小鼠模型肠道菌群的影响及机制探究[D].博士学位论文.北京: 北京协和医学院, 2016. http://d.wanfangdata.com.cn/Thesis/Y3075007
|
| [21] |
PEI L Y, KE Y S, ZHAO H H, et al. Role of colonic microbiota in the pathogenesis of ulcerative colitis[J]. BMC Gastroenterology, 2019, 19: 10. DOI:10.1186/s12876-019-0930-3 |
| [22] |
张丽霞, 丁玉林, 毕艳楠, 等. 牛源致病性大肠埃希菌K99对小鼠肠绒毛生长和肠三叶因子mRNA表达的影响[J]. 动物医学进展, 2019, 40(2): 91-99. |
| [23] |
石宝石, 徐玲, 张小龙, 等. 维生素D通过Wnt信号通路对肠道发育调控机制的研究进展[J]. 动物营养学报, 2015, 27(3): 698-702. |
| [24] |
雷荣苹.饲粮中添加VD3对四川山地乌骨鸡生长性能和免疫功能的影响[D].硕士学位论文.雅安: 四川农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10626-2009258694.htm
|
| [25] |
耿丽.PPARγ激动剂在DSS诱导结肠炎小鼠中的作用机制[D].硕士学位论文.郑州: 郑州大学, 2019.
|
| [26] |
邹婉婧.罗格列酮对大鼠溃疡性结肠炎PPARγ、NF-κB和TNF-α表达的影响[D].硕士学位论文.大连: 大连医科大学, 2011. http://d.wanfangdata.com.cn/Thesis/Y2028566
|
| [27] |
韩涵.维生素D3通过NF-κB/PPARγ通路对2型糖尿病大鼠脂肪组织炎症的影响[D].硕士学位论文.郑州: 郑州大学, 2019.
|
| [28] |
宋珂.四妙勇安汤通过激活PPARγ调控相关炎症通路对ApoE-/-小鼠AS肝损伤的影响[D].北京: 北京中医药大学, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10026-1019153503.htm
|
| [29] |
姜莉莉, 毛利民, 胡思佳, 等. 肾衰宁颗粒对糖尿病肾病大鼠肾组织NF-κB及PPARγ表达的影响[J]. 中国临床药理学与治疗学, 2018, 23(2): 132-137. |




