2. 山西省右玉县畜牧局, 右玉 037200;
3. 山西祥和岭上农牧开发有限公司, 右玉 037200
2. Animal Husbandry Bureau of Youyu County, Youyu 037200, China;
3. Shanxi Xianghe Lingshang Farm Animal Husbandry Development Co., Ltd., Youyu 037200, China
随着“2020禁抗令”进入倒计时,养殖业和饲料业正在努力开发各种天然、健康、安全的饲料添加剂,各种酸化剂、酶制剂、益生菌、植物提取物等在畜禽生产中的应用效果研究甚多,其中植物提取物以其天然、无抗药性、多功能等优点,成为新型饲料添加剂开发和利用中的研究热点。沙棘属于胡颓子科沙棘属植物,在我国种植广泛,资源丰富,其叶子、果肉、籽实中含有大量的活性成分。沙棘黄酮是沙棘的主要活性成分,主要包括槲皮素、山奈酚、异鼠李素等苷元及其苷类化合物。研究表明,沙棘黄酮具有抗氧化、清除自由基、抗应激、促生长、免疫调节等生物学作用[1]。沙棘黄酮在单胃动物饲养中的添加试验在国内外均有报道,而其对肉羊生长性能、瘤胃发酵、微生物菌群的影响方面的报道较少,有必要深入此方面的研究。
研究表明,沙棘黄酮可以提高生长育肥猪的生长性能,并在转录水平调控猪脂肪代谢相关基因的表达,改善猪肉品质[2];可以提高肉鸡胴体品质,改善肉品质,改善蛋鸡产蛋性能;可以缓解氧化应激,提高畜禽机体免疫力[3]。在反刍动物方面,孙守琢[4]报道妊娠母牛饲粮中补饲沙棘果渣,可以提高血清中总蛋白含量,同时提高产后犊牛平均日增重和抗病力。Hao等[5]研究发现,育肥羔羊饲粮中添加16%沙棘果渣可以提高羔羊干物质采食量、平均日增重、蛋白质表观消化率和能量沉积,并促进瘤胃微生物蛋白质(MCP)合成,提高代谢蛋白质的供应量。刁小高等[6]研究也表明,沙棘果渣可以提高育肥羔羊肉品质,改善肠道内环境。Bodas等[7]研究表明,黄酮类化合物对瘤胃中产甲烷(CH4)菌具有直接作用,可以抑制甲烷产生,提高能量利用率。然而,目前关于沙棘黄酮对反刍动物甲烷产量和瘤胃微生物区系影响的报道较少。
因此,本试验采用体外产气法研究沙棘黄酮对绵羊瘤胃体外发酵参数、甲烷产量、营养物质降解率和微生物区系的影响,旨在为沙棘黄酮在反刍动物生产中的应用研究提供理论依据。
1 材料与方法 1.1 试验材料发酵底物:精粗比为60:40的育肥羊全混合日粮(TMR),粗蛋白质(CP)含量为13.14%,中性洗涤纤维(NDF)含量为49.63%。TMR经烘干制成风干样品,粉碎过40目筛备用,其组成及营养水平见表 1。
|
|
表 1 全混合日粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the TMR (DM basis) |
沙棘黄酮:购自西安昊轩生物科技有限公司,纯度≥30%。
发酵液:由瘤胃液与缓冲液以1:2的比例混合制成。缓冲液按照刁小高等[8]报道的方法配制,持续通入饱和二氧化碳(CO2)至颜色变成无色透明,并于39 ℃水浴中预热备用。瘤胃液采自4只12月龄体重(60.0±1.2) kg、健康且装有永久瘤胃瘘管的杜×寒F1代杂交成年公羊,其饲粮与发酵底物相同。晨饲前取瘤胃液,混合后经4层纱布过滤,装入39 ℃预热(装满40 ℃温水)的保温瓶中,迅速带回实验室。
1.2 试验设计试验采用单因子多水平试验设计,准确称取200 mg底物装入尼龙袋中,放入对应编号的100 mL培养管(注射器)中,各组底物中分别添加0(对照组)、0.1%、0.2%、0.3%、0.4%和0.5%的沙棘黄酮,每组6个重复。迅速加入30 mL混合好的人工瘤胃发酵液,于39 ℃恒温水浴中连续培养24 h。
1.3 体外发酵参数测定在体外培养24 h后,将培养管取出,迅速放入冰水浴中中止发酵,采集气体测定甲烷产量;将发酵液排出,立即测定发酵液pH;然后将培养管的发酵液分装,待测挥发性脂肪酸(VFA)、氨态氮(NH3-N)和MCP浓度。其中,测定VFA的发酵液中按比例加入25%偏磷酸溶液(5:1,体积比),-20 ℃保存。取出测定袋,用冷水冲至无色无味,105 ℃烘干恒重,用于底物和发酵残渣营养成分的测定。
1.4 测定指标及方法 1.4.1 底物和发酵残渣营养成分的测定参考AOAC(2012)[8]方法测定发酵底物和发酵24 h后残渣的干物质(DM)、粗灰分(Ash)、CP、粗脂肪(EE)含量,利用ANKOM A200i型半自动分析仪并参考Van Soest等[9]的方法测定酸性洗涤纤维(ADF)和NDF含量。
1.4.2 产气量和甲烷产量的测定体外培养过程中分别读取0、2、4、6、8、10、12、16、20和24 h的培养管刻度值,计算不同时间点的体外产气量,并计算24 h的累积净产气量。当度数超过80 mL时,及时将气体排入气体采样袋中。体外培养24 h后,收集气体,立即利用气相色谱仪(Aglient 7890B,美国)检测气体中的甲烷产量,色谱条件参照Wu等[10]的报道。
1.4.3 发酵参数的测定发酵液pH采用酸度计测定。发酵液VFA浓度采用气相色谱仪(Aglient 7890B,美国)测定,色谱条件参照杨德莲等[11];NH3-N浓度采用苯酚-次氯酸钠比色法[12]测定;MCP浓度采用考马斯亮蓝法[13]测定。MCP浓度的测定:将10 mL收集的培养液12 000 r/min冷冻离心20 min,弃上清;用0.9%的生理盐水冲洗沉淀,12 000 r/min冷冻离心20 min,重复2次;加10 mL蒸馏水与沉淀混匀后,取0.5 mL与0.5 mL、2 mol/mL的氢氧化钠(NaOH)溶液混合,90 ℃预热10 min,10 000 r/min离心5 min;取上清0.5 mL与0.75 mL、0.833 mol/mL的盐酸(HCl)混合,成为待测样品;配制0.05、0.10、0.15和0.20 mg/mL的牛血清白蛋白溶液(BSA),各取1 mL于试管中,每管分别加入5 mL、0.01%的考马斯亮蓝溶液,混匀,静置20 min,在595 nm处用分光光度计测定吸光度,以BSA浓度为横坐标,以吸光度为横坐标,绘制标准曲线;取1 mL待测样,加入5 mL、0.01%的考马斯亮蓝溶液,混匀,静置20 min,在595 nm处用分光光度计测定吸光度;根据标准曲线计算MCP浓度。
1.5 发酵液微生物菌群的定量分析 1.5.1 发酵液微生物菌群和内参基因引物基因引物序列见表 2[14],是由北京六合华大基因科技股份有限公司合成的正向引物。
|
|
表 2 基因引物序列 Table 2 Primer sequences of genes |
采用珠磨-十六烷基三甲基溴化铵(CTAB)法提取总DNA[15]。
1.5.3 荧光定量PCR利用Light Cycler 480 Ⅱ型荧光定量基因扩增仪,采用荧光定量PCR(qPCR)比较阈值法测定微生物数量。PCR反应体系及反应步骤参照Roche试剂盒(No.06402712001)说明书进行。目的微生物的数量以每毫升样品中16S rRNA或18S rRNA基因拷贝数(拷贝数/mL)表示。
1.6 体外营养物质降解率以及代谢能(ME)的计算底物样品干物质降解率(DMD)、酸性洗涤纤维降解率(ADFD)和中性洗涤纤维降解率(NDFD)的计算公式如下:

|
底物样品有机物降解率(OMD)以及ME的计算公式[15]:
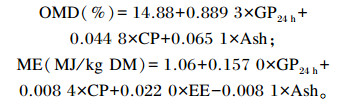
|
式中:GP24 h为24 h时0.200 0 g底物的累计产气量(mL);CP为饲粮粗蛋白质含量(g/kg DM);Ash为饲粮粗灰分含量(g/kg DM);EE为饲粮粗脂肪含量(g/kg DM)。
1.7 数据统计与分析试验数据采用Excel 2010进行初步整理,并采用SPSS 22.0进行单因素方差分析,当差异显著时用Duncan氏法进行多重比较,以P < 0.05表示差异显著。
2 结果 2.1 饲粮中添加不同水平沙棘黄酮对体外产气动态变化的影响由表 3可知,随着沙棘黄酮添加水平的增加,各时间点产气量均呈增加趋势,其中,对照组、0.1%组和0.2%组之间产气量差异不显著(P>0.05),0.3%组产气量较对照组、0.1%组和0.2%组显著增加(P < 0.05)。0.5%组的2、4、6、8 h的产气量较0.3%组、0.4%组显著增加(P < 0.05);0.3%组和0.4%之间的12、16、20、24 h的产气量差异不显著(P>0.05),但均显著高于对照组、0.1%组和0.2%组(P < 0.05),0.5%组显著高于0.3%组(P < 0.05),与0.4%组差异不显著(P>0.05)。
|
|
表 3 饲粮中添加不同水平沙棘黄酮对体外产气动态变化的影响 Table 3 Effects of dietary different supplement levels of sea buckthorn flavone on dynamic changes of gas production in vitro |
由表 4可知,随着沙棘黄酮添加水平的增加,DMD先升高后降低,其中,0.3%组的DMD最高,显著高于其他各组(P < 0.05);随着沙棘黄酮添加水平的增加,NDFD和ADFD有所升高,但各组之间均差异不显著(P>0.05)。0.3%组、0.4%组的OMD显著高于对照组(P < 0.05)。0.2%组、0.3%组、0.4%组的ME显著高于对照组和0.1%组(P < 0.05)。
|
|
表 4 饲粮中添加不同水平沙棘黄酮对体外营养物质降解率以及代谢能的影响 Table 4 Effects of dietary different supplement levels of sea buckthorn flavone on nutrient degradation rates and metabolisable energy in vitro |
由表 5可知,饲粮中添加不同水平沙棘黄酮对发酵液pH和NH3-N浓度无显著影响(P> 0.05);发酵液MCP浓度随着沙棘黄酮添加水平的增加逐渐升高,0.4%组和0.5%组显著高于其他各组(P < 0.05);发酵液甲烷产量随着沙棘黄酮添加水平的增加先降低后升高,0.3%组最低,显著低于对照组、0.1%组、0.2%组和0.5%组(P < 0.05)。
|
|
表 5 饲粮中添加不同水平沙棘黄酮对体外瘤胃发酵参数的影响 Table 5 Effects of dietary different supplement levels of sea buckthorn flavone on rumen fermentation parameters in vitro |
由表 6可知,发酵液乙酸和丙酸浓度都在0.3%组达到最高,0.3%组发酵液乙酸浓度显著高于对照组、0.1%组(P < 0.05),0.3%组发酵液丙酸浓度显著高于其他各组(P < 0.05);0.3%组发酵液丁酸浓度显著低于除0.2%组外的其他各组(P < 0.05),其他组之间差异不显著(P>0.05);0.3%组发酵液总挥发性脂肪酸(TVFA)浓度最高,显著高于对照组、0.1%组(P < 0.05)。0.4%组、0.5%组发酵液乙酸/丙酸显著高于对照组、0.1%组、0.3%组(P < 0.05)。
|
|
表 6 饲粮中添加不同水平沙棘黄酮对发酵液VFA浓度的影响 Table 6 Effects of dietary different supplement levels of sea buckthorn flavone on VFA concentration in fermentation liquor |
由表 7可知,0.4%组和0.5%组发酵液白色瘤胃球菌、黄色瘤胃球菌、原虫、产甲烷菌和总菌的数量显著低于其他各组(P < 0.05),0.5%组最低。饲粮中添加不同水平沙棘黄酮对发酵液溶纤维丁酸弧菌、栖瘤胃普雷沃氏菌、产琥珀酸丝状杆菌及总厌氧真菌的数量没有显著影响(P>0.05)。
|
|
表 7 饲粮中添加不同水平沙棘黄酮对发酵液微生物菌群的影响 Table 7 Effects of dietary different supplement levels of sea buckthorn flavone on microflora population in fementation liquor |
饲粮被瘤胃微生物发酵主要产生VFA、NH3-N、氨基酸、小肽、甲烷和CO2等发酵产物。其中,发酵产气量主要与饲粮成分和营养水平有关,可发酵营养物质越多,微生物的活性越强,则发酵产气量越高[16]。因此,发酵产气量在一定程度上能反映出瘤胃内微生物的发酵状况及底物被瘤胃内微生物的利用程度[17]。前人研究表明,黄酮类化合物可以提高微生物氮代谢和糖代谢水平,促进瘤胃发酵[18-19]。本试验中,产气量随着沙棘黄酮添加水平的增加而提高,可能是由于沙棘黄酮促进了微生物代谢,提高了消化酶活性,促进了有机物的降解。包玲玲等[20]研究发现,沙葱黄酮可以显著提高瘤胃产气量,与本试验研究结果一致。
反刍动物能够利用纤维素、半纤维素等难降解的结构性碳水化合物,有机物和纤维素瘤胃降解率反映了反刍动物对饲粮的消化利用程度[21]。反刍动物消化过程中的能量损失较大,目前衡量饲料利用能是从ME、消化能和净能3方面进行的,但ME比消化能更能确定饲料对动物的潜在价值[22]。本试验中,饲粮中添加0.3%和0.4%沙棘黄酮显著提高了DMD、OMD和ME,且均在沙棘黄酮添加水平为0.3%时达到大值。这说明饲粮中添加0.3%沙棘黄酮促进了微生物对底物的利用,但添加水平达到0.4%和0.5%时,发酵液中黄色瘤胃球菌和白色瘤胃球菌数量显著降低,一定程度上影响纤维类物质的降解。
pH是评价瘤胃发酵功能的一个重要指标,受到诸多因素的影响,如饲粮结构、营养水平和缓冲物质等[23]。包玲玲等[20]研究发现,沙葱黄酮对瘤胃pH没有显著影响,但可以提高瘤胃VFA和MCP浓度。本试验结果发现,各组间pH均差异不显著,且均大于6.5,表明在本试验沙棘黄酮的添加水平没有对绵羊瘤胃酸碱内环境未造成不良影响。Oskoueian等[24]在研究黄酮对瘤胃发酵功能、甲烷产量和微生物菌群时也表明,即便是高达4.5%添加水平的黄酮也不会对瘤胃pH产生显著影响,与本试验结果一致。VFA是碳水化合物在瘤胃发酵后的产物,是反刍动物的主要能量物质。本试验中,饲粮中添加0.3%沙棘黄酮显著提高了发酵液乙酸、丙酸和TVFA浓度,进一步说明饲粮中添加0.3%沙棘黄酮促进了微生物发酵底物。充足的发酵底物为微生物的生长和繁殖提供营养物质,促进MCP的合成。
瘤胃液中的NH3-N是饲粮中可降解蛋白和非蛋白氮的降解终产物,也是合成MCP的重要原料,瘤胃中适宜的NH3-N浓度有利于微生物利用无机氮合成MCP,浓度过高或过低都会对瘤胃微生物的生长繁殖产生不利影响,是瘤胃氮代谢中重要的指标之一[17]。本试验中,饲粮中添加不同水平的沙棘黄酮对发酵液NH3-N浓度没有显著影响,但王永梅[18]和王梦竹等[23]研究表明大豆黄酮可以显著提高瘤胃NH3-N浓度,而包玲玲等[20]发现沙葱黄酮可以显著降低瘤胃NH3-N浓度。因此,关于黄酮类化合物对瘤胃NH3-N浓度的影响结果尚不一致,可能是不同类型黄酮对CP瘤胃降解率及蛋白质分解菌、蛋白酶活性的调控作用不尽一致。
甲烷的合成不仅造成反刍动物的能量损失,而且会造成严重的温室效应。本试验表明,饲粮添加不同水平的沙棘黄酮可降低甲烷产量,且0.3%组的发酵液甲烷产量最低。韩继福等[25]研究表明,丙酸浓度与甲烷产生量呈较高的负相关,乙酸浓度和乙酸/丙酸与甲烷产生量呈较高的正相关,本试验中,0.3%组发酵液丙酸浓度最高,同时甲烷产量最低,与其相符。槲皮素是沙棘黄酮的主要成分之一,Oskoueian等[24]研究表明,在体外发酵底物中添加4.5%的槲皮素显著降低了总原虫数量,进而导致甲烷产量降低。原虫与产甲烷菌是互利共生关系,附着在原虫表面的甲烷菌随原虫数量的降低而降低,因此甲烷产量降低。
反刍动物采食的饲粮中70%~85%的可消化物和50%的粗纤维在瘤胃内消化,其消化能力依赖于瘤胃内复杂的微生物区系的作用[26]。一些研究认为槲皮素对除原虫、甲烷菌之外的其他瘤胃微生物无显著抑制作用[27]。王帅等[28]研究发现,饲粮中添加50 mg/kg小花棘豆黄酮对瘤胃纤维降解菌有抑制作用。Oskoueian等[24]研究表明,饲粮中添加黄酮可降低瘤胃微生物的数量。但陈丹丹[29]研究结果表明,桑叶黄酮可以提高瘤胃液中纤维分解菌的拷贝数。本试验中,饲粮中沙棘黄酮添加水平达到0.4%和0.5%时,发酵液中白色瘤胃球菌、黄色瘤胃球菌、原虫、产甲烷菌和总菌的数量显著下降,对其他微生物数量没有显著影响,造成这些研究结果差异的原因可能是黄酮类物质的来源及添加水平不同。
4 结论沙棘黄酮可以提高体外发酵产气量和养物质降解率,提高发酵液中乙酸、丙酸、TVFA和MCP浓度,降低甲烷的产量,但添加水平达到0.4%和0.5%时对纤维降解菌有一定的抑制作用。综上所述,沙棘黄酮可以改善绵羊体外发酵,本试验条件下,沙棘黄酮的适宜添加水平为0.3%。
| [1] |
曹群华, 瞿伟菁, 黄晓青, 等. 沙棘籽渣和果渣中黄酮抗脂质过氧化、清除自由基作用[J]. 中成药, 2003, 25(8): 670-673. DOI:10.3969/j.issn.1001-1528.2003.08.027 |
| [2] |
张志宏, 夏蕾, 陈鑫, 等. 早期饲喂沙棘提取物对猪生长性能、肉品质和血清Leptin水平及脂肪Leptin mRNA表达的影响[J]. 动物营养学报, 2009, 21(5): 734-740. DOI:10.3969/j.issn.1006-267x.2009.05.019 |
| [3] |
丁保安, 陈福军, 秦迎新. 日粮中添加沙棘果渣对肉鸡生产性能和免疫机能的影响[J]. 中国饲料, 2010(13): 32-34. DOI:10.3969/j.issn.1004-3314.2010.13.010 |
| [4] |
孙守琢. 沙棘果渣在畜牧业上的应用[J]. 新农业, 1998(7): 43-44. |
| [5] |
HAO X Y, DIAO X G, YU S C, et al. Nutrient digestibility, rumen microbial protein synthesis, and growth performance in sheep consuming rations containing sea buckthorn pomace[J]. Journal of Animal Science, 2018, 96(8): 3412-3419. DOI:10.1093/jas/sky201 |
| [6] |
刁小高, 郝小燕, 赵俊星, 等. 饲粮中添加沙棘果渣对育肥羊生长性能、屠宰性能、肉品质及消化道内容物pH的影响[J]. 动物营养学报, 2018, 30(8): 3258-3266. DOI:10.3969/j.issn.1006-267x.2018.08.045 |
| [7] |
BODAS R, PRIETO N, GARCÍA-GONZÁLEZ R, et al. Manipulation of rumen fermentation and methane production with plant secondary metabolites[J]. Animal Feed Science and Technology, 2012, 176(1/2/3/4): 78-93. |
| [8] |
刁小高, 郝小燕, 赵俊星, 等. 饲粮中添加沙棘果渣对体外瘤胃发酵参数和营养物质有效降解率的影响[J]. 动物营养学报, 2019, 31(5): 2423-2430. |
| [9] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [10] |
WU H, MENG Q X, YU Z T, et al. Evaluation of ferric oxide and ferric citrate for their effects on fermentation, production of sulfide and methane, and abundance of select microbial populations using in vitro rumen cultures[J]. Bioresource Technology, 2016, 211: 603-609. DOI:10.1016/j.biortech.2016.03.126 |
| [11] |
杨德莲, 童津津, 张婕, 等. 葡萄籽原花青素对奶牛瘤胃体外发酵参数及微生物区系的影响[J]. 动物营养学报, 2018, 30(2): 717-725. DOI:10.3969/j.issn.1006-267x.2018.02.037 |
| [12] |
金亚倩, 赵俊星, 刘文忠, 等. 酿酒葡萄皮渣对绵羊瘤胃代谢及发育的影响[J]. 畜牧兽医学报, 2017, 48(9): 1683-1693. |
| [13] |
王金洛, 韩正康, 陈杰. 山羊瘤胃微生物蛋白(MCP)与十二指肠食糜MCP浓度的比较研究[J]. 动物营养学报, 1991, 3(2): 61. |
| [14] |
谢明欣.苦豆子对蒙古羔羊体外发酵参数、微生物种群及血液中生理生化指标的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10129-1018881874.htm
|
| [15] |
BÜRGMANN H, PESARO M, WIDMER F, et al. A strategy for optimizing quality and quantity of DNA extracted from soil[J]. Journal of Microbiological Methods, 2001, 45(1): 7-20. DOI:10.1016/S0167-7012(01)00213-5 |
| [16] |
QIAO F Q, WANG F, REN L P, Ren Liping, et al. Effect of steam-flaking on chemical compositions, starch gelatinization, in vitro fermentability, and energetic values of maize, wheat and rice[J]. Journal of Integrative Agriculture, 2015, 14(5): 949-955. DOI:10.1016/S2095-3119(14)60913-8 |
| [17] |
孙国强, 吕永艳, 张杰杰. 利用体外瘤胃发酵法研究全株玉米青贮与花生蔓和羊草间的组合效应[J]. 草业学报, 2014, 23(3): 224-231. |
| [18] |
王永梅.大豆异黄酮对山羊瘤胃代谢影响的研究[D].硕士学位论文.南京: 南京农业大学, 2007. http://d.wanfangdata.com.cn/Thesis/Y1215504
|
| [19] |
刘艳丰, 王晶, 王文奇, 等. 沙棘叶黄酮对绵羊瘤胃代谢和血清指标的影响[J]. 中国牧杂志, 2016, 52(7): 66-70. |
| [20] |
包玲玲, 敖长金, 萨茹丽, 等. 沙葱黄酮类化合物对绵羊瘤胃内环境(体外)的影响[J]. 饲料工业, 2015, 36(14): 6-10. |
| [21] |
许贵善, 刁其玉, 纪守坤, 等. 不同饲喂水平对肉用绵羊能量与蛋白质消化代谢的影响[J]. 中国畜牧杂志, 2012, 48(17): 40-44. DOI:10.3969/j.issn.0258-7033.2012.17.011 |
| [22] |
刘洁, 刁其玉, 邓凯东. 肉用羊营养需要及研究方法研究进展[J]. 中国草食动物, 2010, 30(3): 67-70. DOI:10.3969/j.issn.2095-3887.2010.03.022 |
| [23] |
王梦竹, 刘艳丰, 王文奇, 等. 苜蓿黄酮对杂交绵羊瘤胃发酵功能和纤维降解酶活性的影响[J]. 中国畜牧兽医, 2015, 42(11): 2969-2976. |
| [24] |
OSKOUEIAN E, ABDULLAH N, OSKOUEIAN A, et al. Effects of flavonoids on rumen fermentation activity, methane production, and microbial population[J]. BioMed Research International, 2013, 2013: 349129. |
| [25] |
韩继福, 冯仰廉, 张晓明, 等. 阉牛不同日粮的纤维消化、瘤胃内VFA对甲烷产生量的影响[J]. 中国兽医学报, 1997, 17(3): 278-280. |
| [26] |
裴彩霞. 反刍动物瘤胃微生物及其利用[M]. 北京: 中国农业科学技术出版社, 2012.
|
| [27] |
LEIBER F, KUNZ C, KREUZER M. Influence of different morphological parts of buckwheat (Fagopyrum esculentum) and its major secondary metabolite rutin on rumen fermentation in vitro[J]. Czech Journal of Animal Science, 2012, 57(1): 10-18. DOI:10.17221/5479-CJAS |
| [28] |
王帅, 贾琦珍, 陈根元, 等. 小花棘豆黄酮对绵羊瘤胃微生物数量的影响[J]. 华北农学报, 2014, 29. |
| [29] |
陈丹丹.四种植物提取物对肉羊甲烷排放、物质代谢及瘤胃微生物区系的影响[D].硕士学位论文.乌鲁木齐: 新疆农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10758-1015548182.htm
|




