2. 天津市静海区畜牧水产业发展服务中心, 天津 301600;
3. 天津市水产研究所, 天津 300202;
4. 天津现代晨辉科技集团有限公司, 天津市水族动物功能性饲料企业重点实验室, 天津 301800
2. Development Services Center of Animal Husbandry and Fisheries, Jinghai District of Tianjin, Tianjin 301600, China;
3. Tianjin Fisheries Research Institute, Tianjin 300202, China;
4. Tianjin Enterprise Key Lab of the Functional Feed of Aquatic Animals, Tianjin Chenhui Modern Technology Group Co., Ltd., Tianjin 301800, China
红草金鱼(Garassius auratus red var.)是由鲫鱼进化而来的一种“土著”观赏鱼类,在我国已有上千年的养殖历史,其形态优美、颜色靓丽、易于饲养,为大多数中国人所喜爱。目前体色、体形与健康状况是评价红草金鱼质量的几项重要指标。根据《2017中国渔业统计年鉴》统计,2016年我国观赏鱼的养殖总量已经达到400 145万尾。在如此巨大的养殖总量下,如何针对红草金鱼的体色与营养健康需求,研制开发高效、环保、健康的配合饲料,已经成为促进红草金鱼养殖可持续发展的当务之急。
螺旋藻(Sprinulian)隶属于蓝藻门,颤藻目,颤藻科,含有丰富的蛋白质、氨基酸、多糖、维生素、类胡萝卜素、无机元素以及微量元素等,不仅可以提高动物的免疫力,还能改善动物的体色[1]。裂壶藻(Schizochytrium)属于真菌门,卵菌纲,水霉目,破囊壶菌科[2]。裂壶藻中二十二碳六烯酸(DHA)含量非常高,达到35%~40%,可促进水产动物的生长与发育[3]。近年来,螺旋藻与裂壶藻等藻类作为增色、促生长物质在饲料中的应用已有报道[4-5]。当前,开发利用替代鱼粉的新型蛋白质饲料资源已成为营养研究的热点和难点问题,大型溞(Daphnia magna)属于节肢动物门,甲壳纲,枝角类,溞属,作为常见的小型浮游甲壳动物,是一种优质的动物蛋白质源[6]。大型溞粉蛋白质和脂肪含量与鱼粉相接近,与其他动物性蛋白质源相比生长周期短,容易采集;与植物性蛋白质源相比,其蛋白质含量相对较高[7]。但目前关于使用大型溞粉替代鱼粉的报道尚不多见。
基于此,本试验以红草金鱼为研究对象,通过在饲料中添加不同水平的螺旋藻、裂壶藻和大型溞粉3种饲料原料,来研究其对红草金鱼生长、体色和生理生化指标的影响,旨在开发提高红草金鱼生长性能、体表色度及非特异性免疫力的功能性饲料配方,从而为红草金鱼的健康养殖提供参考。
1 材料与方法 1.1 饲料设计螺旋藻购买于西安天广源生物科技有限公司,裂壶藻购买于西安明朗生物科技有限公司,其余原料购于天津市晨辉饲料有限公司。按照试验设计配制5种试验饲料,其中C组(对照组)饲料中不含螺旋藻、裂壶藻和大型溞粉;C1组饲料中含4.0%螺旋藻、1.0%裂壶藻、4.0%大型溞粉;C2组饲料中含6.0%螺旋藻、1.5%裂壶藻、6.0%大型溞粉;C3组饲料中含8.0%螺旋藻、2.0%裂壶藻、8.0%大型溞粉;C4组饲料中含10.0%螺旋藻、2.5%裂壶藻、10.0%大型溞粉。试验饲料组成及营养水平见表 1。根据表 1配方称取各原料,将各原料混合后,制成直径为2.5 mm的颗粒饲料,风干后保存备用。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
试验用红草金鱼购自天津市金水族水产养殖有限公司。选取300尾体格健壮的试验鱼,初始体重(21.77±1.38) g、初始体长(8.79±0.55) cm,随机分成5组,每组3个重复,每个重复20条鱼。每天投喂2次(09:00、16:00),投饲率为体重的3%左右,并根据具体情况进行调整。定期检测水质指标,及时换水,试验期间水温保持在(24±2) ℃,溶解氧浓度>6 mg/L,氨氮浓度 < 0.3 mg/L,亚硝酸浓度 < 0.02 mg/L。饲喂期为60 d。
1.3 样品采集分别在养殖第30天和第60天取样,每次取样时每个重复取10尾鱼(每组30尾鱼),先测量每尾试验鱼的体重、体长,再自尾静脉取血,然后4 ℃条件下4 000 r/min离心10 min,将制备的血清于4 ℃保存,待测。在冰块上解剖鱼体,采集内脏、鳞片、鳍条、皮肤、肌肉与鳃组织,于-20 ℃保存。
1.4 指标测定 1.4.1 生长指标生长指标计算公式如下:
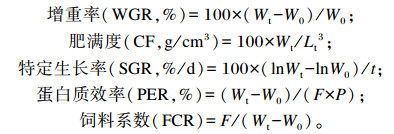
|
式中:Wt为终末体重(g);W0为初始体重(g);Lt为终末体长(cm);t为试验天数(d);F为饲料干物质摄入量(g);P为饲料粗蛋白质含量(%)。
1.4.2 体色指标体表色度的测定:用色差仪(CR-400,美能达)测定鱼体亮度(L*)、红度(a*)和黄度(b*)值并记录。测定前先将色差仪调零,用纱布吸干鱼体表面水分,为确保试验准确性,将色差仪的照射孔对准每尾鱼同侧胸鳍旁位置进行测定。
类胡萝卜素含量的测定:皮肤、鳞片及鳍条中类胡萝卜素含量的测定参照陈晓明等[8]的方法,并稍加改动。分别取鱼体侧线上方的皮肤、鳞片和鳍条,将其剪碎,用电子天平准确称取鲜样0.1 g,用丙酮定容至5 mL,放入超声波清洗机低温超声波振荡40 min后取出,4 000 r/min离心10 min后放入4 ℃冰箱里静置24 h。将所得色素萃取液置于1 cm比色皿中,以丙酮为空白对照管,用紫外-可见分光光度计(UV-1750,日本岛津)在500 nm波长处测定各组色素萃取液吸光度值,按如下公式计算类胡萝卜素含量:
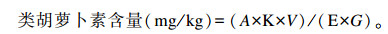
|
式中:A为吸光度值;K为常数(104);V为提取液体积(mL);E为摩尔消光系数(2 500);G为样品重量(g)。
1.4.3 生理生化指标超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性与丙二醛(MDA)、一氧化氮(NO)、甘油三酯(TG)、总胆固醇(T-CHO)含量测定所用试剂盒均购自南京建成生物工程研究所,具体测定方法参照说明书。
1.5 数据分析所有试验数据采用Excel 2017软件整理后,采用SPSS 18.0软件进行相关性检验,单因素极差与方差分析检验组间差异显著性,P < 0.05表示差异显著,用Duncan氏法进行多重比较分析。试验结果用平均值±标准差(mean±SD)表示。
2 结果与分析 2.1 螺旋藻、裂壶藻、大型溞粉组合饲料对红草金鱼生长的影响由表 2可知,投喂添加不同水平的螺旋藻、裂壶藻和大型溞粉组合饲料30 d后,红草金鱼的蛋白质效率、特定生长率、肥满度及增重率均随着组合饲料添加水平的增加呈现先升后降的变化趋势,其中C1与C2组的蛋白质效率、特定生长率与增重率较之其他组均有显著提高(P < 0.05);C1~C4组的肥满度均显著高于C组(P < 0.05);饲料系数则随着组合饲料添加水平的增加呈现先降后升的变化趋势,C1与C2组较之其他组显著下降(P < 0.05)。
|
|
表 2 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼生长的影响 Table 2 Effects of combined feed of Spirulina, Schizochytrium and Daphnia magna powder on growth of Garassius auratus red var. |
由表 2可知,投喂添加不同水平的螺旋藻、裂壶藻和大型溞粉组合饲料60 d后,红草金鱼的增重率与肥满度均随着组合饲料添加水平的增加呈现先升后降的变化趋势,C2组的肥满度显著高于其他各组(P < 0.05),C2、C3组的增重率显著高于其他各组(P < 0.05)。特定生长率、蛋白质效率与饲料系数则随着组合饲料添加水平的增加呈现不规则的变化趋势。其中,C3组的特定生长率显著高于其他各组(P < 0.05);C3、C4组的蛋白质效率显著高于C组(P < 0.05),C1组的蛋白质效率较之C组有所提高但差异并未达到显著水平(P>0.05),而C2组的蛋白质效率则显著低于C组(P < 0.05);C1、C3组的饲料系数较之其他组有显著降低(P < 0.05),C2组的饲料系数高于C组,但差异并未达到显著水平(P>0.05)。
2.2 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼体色的影响 2.2.1 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼各组织中类胡萝卜素含量的影响由表 3可知,投喂添加不同水平的螺旋藻、裂壶藻和大型溞粉组合饲料30或60 d后,经检测,皮肤、鳞片、鳍条中类胡萝卜素含量均随着组合饲料添加水平的增加呈现先升后降的变化趋势。皮肤中类胡萝卜素含量在投喂30与60 d时均在C2组达到最大值,分别比C组提高32.0%(P < 0.05)与14.8%(P < 0.05);鳞片中类胡萝卜素含量在投喂30与60 d时的最大值分别出现在C2与C1组,较之C组分别提高14.4%(P < 0.05)与10.2%(P>0.05);鳍条中类胡萝卜素含量在投喂30 d时的最大值出现在C1组,且该组显著高于C2、C3与C4组(P < 0.05),投喂60 d时的最大值出现在C2组,且该组显著高于其他各组(P < 0.05)。
|
|
表 3 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼各组织中类胡萝卜素含量的影响 Table 3 Effects of combined feed of Spirulina, Schizochytrium and Daphnia magna powder on tissue carotenoid content of Garassius auratus red var. |
由表 4可知,投喂添加不同水平的螺旋藻、裂壶藻和大型溞粉组合饲料30或60 d后,红草金鱼体表L*与a*值均随着组合饲料添加水平的增加呈现先升后降的变化趋势,且在投喂30与60 d时C2与C3组体表L*值均显著高于其他各组(P < 0.05)。投喂30与60 d时体表a*值的峰值均出现在C3组,较之C组分别提高了18.3%(P < 0.05)与36.7%(P < 0.05)。投喂30 d时,C1、C2、C3与C4组体表b*值较之C组均有所提高,但差异并未达到显著水平(P>0.05);投喂60 d时,C1、C2、C3与C4组体表b*值均显著高于C组(P < 0.05)。
|
|
表 4 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼体表色度的影响 Table 4 Effects of combined feed of Spirulina, Schizochytrium and Daphnia magna powder on body color of Garassius auratus red var. |
综合比较投喂30与60 d时红草金鱼各组织中类胡萝卜素含量与体表色度指标判定,C3组添加的组合饲料对改善试验鱼体色效果较好。
2.3 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼生理生化指标的影响 2.3.1 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼血清和各组织中SOD活性的影响由表 5可知,投喂添加不同水平的螺旋藻、裂壶藻和大型溞粉组合饲料30或60 d后,红草金鱼血清和各组织中SOD活性均随着组合饲料添加水平的增加呈现先增后减的变化趋势。投喂30与60 d时,C2、C3组血清和各组织中SOD活性均显著高于C组(P < 0.05),且最大值均出现在C3组;C1、C4组血清和各组织中SOD活性虽高于C组,但差异并未达到显著水平(P>0.05)。
|
|
表 5 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼血清和各组织中SOD活性的影响 Table 5 Effects of combined feed of Spirulina, Schizochytrium and Daphnia magna powder on SOD activity in serum and tissues of Garassius auratus red var. |
由表 6可知,投喂添加不同水平的螺旋藻、裂壶藻和大型溞粉组合饲料30或60 d后,红草金鱼血清和各组织中CAT活性均随着组合饲料添加水平的增加呈现先增后减的变化趋势,但投喂60 d时血清和各组织中CAT活性均高于投喂30 d时。C2、C3组血清和各组织中CAT活性在投喂30与60 d时均显著高于C组(P < 0.05),且CAT活性最大值均出现在C3组。
|
|
表 6 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼血清和各组织中CAT活性的影响 Table 6 Effects of combined feed of Spirulina, Schizochytrium and Daphnia magna powder on CAT activity in serum and tissues of Garassius auratus red var. |
由表 7可知,投喂添加不同水平的螺旋藻、裂壶藻和大型溞粉组合饲料30或60 d后,红草金鱼血清和各组织中MDA含量随着组合饲料添加水平的增加呈现先减后增的变化趋势。投喂30与60 d时,C2和C3组血清和各组织中MDA含量显著低于其他各组(P < 0.05),且最小值均出现在C3组。
|
|
表 7 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼血清和各组织中MDA含量的影响 Table 7 Effects of combined feed of Spirulina, Schizochytrium and Daphnia magna powder on MDA content in serum and tissues of Garassius auratus red var. |
由表 8可知,投喂添加不同水平的螺旋藻、裂壶藻和大型溞粉组合饲料30或60 d后,红草金鱼血清和各组织中NO含量均随着组合饲料添加水平的增加呈现先增后减的变化趋势。投喂30与60 d时,C2、C3组血清和各组织中NO含量显著高于其他各组(P < 0.05),且最大值均出现的C3组;C4组血清和各组织中NO含量呈现急剧下降的趋势,显著低于其他各组(P < 0.05)。
|
|
表 8 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼血清和各组织中NO含量的影响 Table 8 Effects of combined feed of Spirulina, Schizochytrium and Daphnia magna powder on NO content in serum and tissues of Garassius auratus red var. |
由表 9可知,投喂添加不同水平的螺旋藻、裂壶藻和大型溞粉组合饲料30或60 d后,C1、C2、C3和C4组红草金鱼血清中TG和T-CHO含量较之C组均有显著下降(P < 0.05),2项指标的最低值均出现在C3组。投喂30 d时,C3组血清TG和T-CHO含量相对于C组分别降低了24.9%和21.6%;投喂60 d时,C3组血清TG和T-CHO含量相对于C组分别降低了19.5%和11.2%。
|
|
表 9 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼血清中TG和T-CHO含量的影响 Table 9 Effects of combined feed of Spirulina, Schizochytrium and Daphnia magna powder on serum TG and T-CHO contents of Garassius auratus red var. |
综合评定螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼生理生化指标的影响得出,C3组效果最佳。
3 讨论 3.1 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼生长的影响螺旋藻主要含有蛋白质、脂肪、碳水化合物以及多种维生素和矿物质等营养元素,被誉为“最理想的高蛋白质源”“生命营养库”[9]。裂壶藻中富含油脂、色素、角鳖烯等大量的有益活性物质,其中,油脂占细胞干重的70%以上,总脂中DHA含量高达35%~40%[3]。DHA是许多鱼类幼体、对虾幼体、双壳类幼虫的必需脂肪酸,它直接关系到幼虫和幼体的生长发育和存活[10]。大型溞等枝角类的粗蛋白质含量高,种类不同的枝角类其粗蛋白质含量在30%~70%,所包含的氨基酸的种类也较多[11]。
本试验发现,投喂30与60 d时,C3组(螺旋藻8.0%、裂壶藻2.0%、大型溞粉8.0%)促生长效果明显,可以有效提高红草金鱼的增重率、肥满度、特定生长率与蛋白质效率,降低了饲料系数。吕子君[12]得出,饲料中添加1%的钝顶螺旋藻(Spirulina platensis)可显著提高海南长臀鮠(Cranoglanis multiradiatus)的终末体重、增重率和特定生长率,并能显著降低其饲料系数;刘华忠等[13]研究发现,投喂添加量为2%、4%螺旋藻的饲粮可显著提高彭泽鲫(Carassius auratus var. Pengze)的生长性能;罗萍[14]证实,在建鲤(Cyprinus carpio var. Jian)的基础饲料中添加2%、4%的螺旋藻粉均能显著提高建鲤的生长性能,且成活率也有不同程度提高;刘宏超等[15]发现,饲料中添加0.80%~1.20%的裂壶藻可有效促进津新鲤(Cyprinus carpio var. Jian)的生长;张红霞等[16]发现,使用大型溞粉替代40%~60%的鱼粉可显著提高黄颡鱼(Pelteobagrus fulvidraco)的生长性能和饲料利用率,其中替代水平为60%时效果最佳。这些结论与本试验结果可以相互印证,至于添加水平有别,可能与试验动物种类、养殖条件、养殖目的、养殖成本等因素有关。
3.2 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼体色的影响类胡萝卜素、嘌呤、黑色素以及养殖环境等多种因素决定了鱼体所呈现的颜色,其中类胡萝卜素有很关键的作用,但鱼体自身是不能够合成相关类胡萝卜素的[17],只能通过外界摄取。在饲料中添加增色剂,能较好地促进鱼体的增色,是一种安全可靠的方法。何志刚[18]测得,饲料中添加7.5%的螺旋藻时锦鲤(Cyprinus carpio var. Koi)体表类胡罗卜含量较对照组提高了42.19%。孙金辉等[19]报道,饲料中添加1%的裂壶藻对血艳红慈鲷(Copadichromis trimaculatus)体表a*值的增加有着显著的促进作用。关献涛[20]研究得出,饲料中添加12%的螺旋藻可显著提高东星斑(Plectropomus leopardus)体表a*与b*值。方春林等[21]曾报道,在饲料中添加0.5%、2.0%以及8.0%的螺旋藻可有效地增加锦鲤的体色,并可使体色由黄色逐渐变为金黄色、橙黄色、橙红色或红色,且以8.0%的螺旋藻添加量效果最佳。Harpaz等[22]研究发现,在饲料中添加类胡萝卜素可增加拉氏彩蝶鲷(Papiliochromis ramirezi)的体色。上述这些研究结果均可与本试验得出的在饲料中添加不同水平裂壶藻、螺旋藻及大型溞粉组合饲料可有效提高红草金鱼体色的试验结果相吻合。
但随着饲料中色素添加量的增加,鱼类的体色并非一直呈现加深的趋势,当色素添加量超过一个临界值,鱼体中沉积的色素量会随色素添加量的增加而呈现下降趋势[23]。这一理论解释了本试验中C4组试验鱼体色较C3组下降的问题。目前,关于使用大型溞粉增加鱼类体色的研究还未见报道,本试验在一定程度上填补了此方面研究的空白。
3.3 螺旋藻、裂壶藻和大型溞粉组合饲料对红草金鱼生理生化指标的影响正常生理条件下,活性氧类高活性分子的生成和清除维持在稳定平衡的状态,氧化应激的发生会对大分子造成损伤,导致疾病发生。SOD是抗氧化系统中首先被激活的酶类,具有清除自由基的功能[24]。CAT是一种末端氧化酶,它广泛存在于动物、植物和微生物体内,有保护细胞、防止过氧化的作用[25]。油脂氧化产生的自由基能通过攻击生物膜中的不饱和脂肪酸进而引发脂质过氧化,形成脂质过氧化产物并降解为MDA,MDA含量的高低可间接反映组织细胞受损伤程度[26]。刘宏超等[15]研究得出,饲料中添加0.80%~1.20%的裂壶藻可显著降低津新鲤血清中MDA含量,显著提高血清中总超氧化物歧化酶(T-SOD)及CAT活性。吕子君[12]研究得出,使用0.5%~2.0%的钝顶螺旋藻投喂高海南长臀鮠,各添加组的血清SOD、CAT活性比对照组均有所提高,血清MDA、TC和TG含量则随螺旋藻添加量的增加呈下降趋势。张红霞等[16]报道,大型溞粉替代鱼粉水平为60%时黄颡鱼血清和肝胰脏中SOD和CAT活性最高,血清和肝胰脏中MDA含量显著下降。本试验中,在投喂30与60 d时,C3组红草金鱼血清和各组织中SOD及CAT活性均显著增加,血清和各组织中MDA含量均显著降低,三者基本成同步升高或降低的趋势,与上述研究结果相一致。
NO作为一种新型生物信使分子、效应分子和免疫调节分子,广泛分布于生物体的各个器官和组织中,参与机体多种重要的生理病理活动,可以通过非特异性的杀伤细菌、真菌、寄生虫及病毒等,增强机体的非特异性免疫[27]。大菱鲆(Scophthalmus maximus L.)头肾巨噬细胞产生的NO能显著抑制病毒性出血败血症病毒(VHSV)在细胞中的复制[28]。殷国俊等[29]在研究鲤鱼头肾巨噬细胞NO产生时发现,黄芪和脂多糖(LPS)联合使用能显著提高LPS刺激所产生的NO的量,从而对鲤鱼机体的非特异性免疫功能起到调节作用。Ottaviani等[30]在采用大肠杆菌感染紫贻贝(Mytilus galloprovincialis)和田螺(Busycon canaliculatu)时发现,大肠杆菌能诱导这2种动物血细胞一氧化氮合酶(NOS)的表达并产生大量的NO,而产生的NO有利于细菌聚集在血细胞的周围,以增强杀菌的效率。本试验中C1~C3组较C组均能显著提高红草金鱼血清和各组织中NO的含量,这说明饲料中添加适量的由裂壶藻、螺旋藻与大型溞粉组成的组合饲料可在一定程度上增强鱼类的非特异性免疫能力。
4 结论含8.0%螺旋藻、2.0%裂壶藻以及8.0%大型溞粉的C3组饲料可提高红草金鱼的生长性能和饲料利用率,具有较好的增红提亮效果,同时具有较好的降脂和提高机体抗氧化与非特异性免疫能力的作用。基于此,建议红草金鱼饲料中添加8.0%螺旋藻、2.0%裂壶藻和8.0%大型溞粉。
| [1] |
余颉, 董秋燕. 螺旋藻在饲料中的应用研究进展[J]. 绿色科技, 2018(23): 51-53. |
| [2] |
NAKAHAR T, YOKOCHI T, HIGASHIHARA T, et al. Production of docosahexaenoic and docosapentaenoic acids by Schizochytrium sp. isolated from Yap islands[J]. Journal of the American Oil Chemists' Society, 1996, 73(11): 1421-1426. |
| [3] |
李美玉, 李健, 陈萍, 等. 维生素E和裂壶藻对中国对虾生长及TLR/NF-κB表达水平的影响[J]. 中国渔业质量与标准, 2012, 2(2): 37-44. |
| [4] |
周俊宇, 杨志刚. 富含HUFA海洋微藻在水产饲料中的应用[J]. 饲料研究, 2012(7): 40-44. |
| [5] |
黄亮华, 李浩洋, 李彬, 等. 裂壶藻对刺参生长、免疫及消化酶的影响[J]. 渔业科学进展, 2014, 35(3): 91-97. |
| [6] |
冯悦, 黄仲园, 华雪铭, 等. 大型溞的营养成分分析及其作为渔用饲料原料的潜在利用价值[J]. 水产学报, 2018, 42(4): 565-574. |
| [7] |
孟琼, 邓道贵, 杜浩, 等. 温度和培养体积对大型溞种群动态和两性生殖影响的研究[J]. 水生生物学报, 2009, 33(6): 1160-1167. |
| [8] |
陈晓明, 徐学明, 金征宇. 富含虾青素的法夫酵母对金鱼体色的影响[J]. 中国水产科学, 2004, 11(1): 70-73. |
| [9] |
卢隆杰, 岳森, 苏浓. 神奇螺旋藻超级营养库[J]. 中国食物与营养, 2004, 10(3): 17-19. |
| [10] |
梁英, 麦康森. 微藻EPA和DHA的研究现状及前景[J]. 水产学报, 2000, 24(3): 289-296. |
| [11] |
冯悦.大型溞对水体中氮元素的转移利用及其在罗氏沼虾饲料中的应用[D].硕士学位论文.上海: 上海海洋大学, 2018: 16. http://cdmd.cnki.com.cn/Article/CDMD-10264-1018848999.htm
|
| [12] |
吕子君.钝顶螺旋藻对海南长臀鮠生长、营养、消化和免疫的影响[D].硕士学位论文.广州: 华南农业大学, 2016: 18-26. http://cdmd.cnki.com.cn/Article/CDMD-10564-1016923435.htm
|
| [13] |
刘华忠, 刘定忠, 姚茂忠, 等. 螺旋藻对彭泽鲫生长性能的影响[J]. 江西水产科技, 2004(3): 15-16, 25. |
| [14] |
罗萍. 螺旋藻对建鲤生长发育的影响[J]. 水利渔业, 2006, 26(4): 41-42. |
| [15] |
刘宏超, 程镇燕, 翟胜利, 等. 裂壶藻对津新鲤(Cyprmus carpio var.Jian)生长、血液非特异性免疫指标及抗病力的影响[J]. 渔业科学进展, 2016, 37(6): 42-48. |
| [16] |
张红霞, 王洋, 吴旋, 等. 大型溞粉替代鱼粉对黄颡鱼生长、部分生化指标及水质指标的影响[J]. 饲料工业, 2019, 40(2): 47-53. |
| [17] |
GOODWIN T W. The biochemistry of the carotenoids[M]. London: Chapman & Hall, 1984.
|
| [18] |
何志刚, 王冬武, 曾国清, 等. 不同饲料对红白锦鲤生长、体色和血液生化指标的影响[J]. 广东农业科学, 2015, 42(20): 107-111. |
| [19] |
孙金辉, 李家鑫, 崔培, 等. 不同藻源对血艳红慈鲷体色及部分免疫指标的影响[J]. 湖北农业科学, 2019, 58(2): 100-103, 114. |
| [20] |
关献涛.饲料中添加虾青素、叶黄素等4种物质对东星斑的生长、体色和抗氧化性的影响[D].硕士学位论文.上海: 上海海洋大学, 2017: 30-36. http://cdmd.cnki.com.cn/Article/CDMD-10264-1017854228.htm
|
| [21] |
方春林, 贺刚, 余智杰, 等. 饲料中3种增色剂对锦鲤体色的影响[J]. 江苏农业科学, 2013, 41(5): 226-228. |
| [22] |
HARPAZ S, PADOWICZ D. Color enhancement in the ornamental dwarf cichlid Microgeophagus ramirezi by addition of plant carotenoids to the fish diet[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2007, 59(4): 195-200. |
| [23] |
贺国龙, 刘立鹤. 鱼类体色成因及其调控技术研究进展(下)[J]. 水产科技情报, 2010, 37(3): 115-120. |
| [24] |
何娇娇, 王萍, 冯建, 等. 玉米蛋白粉替代鱼粉对大黄鱼生长、血清生化指标及肝脏组织学的影响[J]. 水生生物学报, 2017, 41(3): 506-515. |
| [25] |
张坤生, 田荟琳. 过氧化氢酶的功能及研究[J]. 食品科技, 2007, 32(1): 8-11. |
| [26] |
LIN C C, LIANG J H. Effect of antioxidants on the oxidative stability of chicken breast meat in a dispersion system[J]. Journal of Food Science, 2002, 67(2): 530-533. |
| [27] |
王广军, 谢骏, 余德光, 等. 一氧化氮及一氧化氮合酶在水生动物免疫系统中的研究进展[J]. 水产科技, 2009(3): 1-6. |
| [28] |
TAFALLA C, FIGUERAS A, NOVOA B. Role of nitric oxide on the replication of viral haemorrhagic septicemia virus (VHSV), a fish rhabdovirus[J]. Veterinary Immunology and Immunopathology, 1999, 72(3/4): 249-256. |
| [29] |
殷国俊, WIEGERTJES G, LI Y M, 等. 黄芪对鲤头肾中巨噬细胞的增殖和一氧化氮产量的影响:离体研究[J]. 水产学报, 2004, 28(6): 628-632. |
| [30] |
OTTAVIANI E, PAEMAN L R, CADET P, et al. Evidence for nitric oxide production and utilization as a bacteriocidal agent by invertebrate immunocytes[J]. European Journal of Pharmacology:Environmental Toxicology and Pharmacology, 1993, 248(4): 319-324. |




