2. 动物疫病与人类健康四川省重点实验室, 雅安 625014
2. Key Laboratory of Animal Disease and Human Health of Sichuan Province, Ya'an 625014, China
随着动物微生态学的理论发展与技术革新,更多关于肠道菌群与宿主机能间的关系被揭示。依据目前的研究,机体的多种生理状态以及病理性的改变都与肠道菌群有着直接或间接的联系[1],这促使人们开始着眼于通过调整肠道菌群结构或组成来探索甚至是解决一些重大生物学及医学难题。益生菌(probiotics)可通过调节肠道微生态、改善肠道形态结构、增强免疫功能等多个途径对宿主健康起到保护和促进作用,与此同时还具有绿色无公害、无抗药性和无残留等优点[2-4]。因此,益生菌日益受到人们的关注和青睐。
肠黏膜屏障主要包括物理屏障、化学屏障、免疫屏障和微生物屏障,肠黏膜屏障的完整性与肠道健康息息相关[5]。紧密连接(tight junction)是维持肠道黏膜上皮细胞间物理屏障的基础结构,同时也是机体抵抗有害物质侵入的重要防线。紧密连接主要由闭锁蛋白(occludin,OCLN)、闭合蛋白(claudin,CLDN)和连接黏附分子(junction adhesion molecules,JAMs)3种完整膜蛋白和闭合小环蛋白(zonula occludens)等外周胞浆蛋白组成[6]。OCLN作为其中最重要的蛋白之一,帮助上皮细胞封闭细胞间隙,从而提高肠道物理屏障的稳定性。炎症性肠病(inflammatory bowel diseases,IBD)等肠道疾病的发生发展被认为与肠上皮细胞屏障受损有关。研究提示,紧密连接蛋白OCLN、ZO-1可能会成为评估溃疡性结肠炎(ulcerative colitis,UC)患者肠道炎症程度及黏膜愈合度的指标[7]。给予患者或疾病模型动物益生菌治疗能帮助缓解肠道症状、促进健康恢复,具体机制可能与益生菌治疗能保护或恢复肠黏膜屏障功能有关。王婷婷等[8]研究了嗜酸乳杆菌KLDS AD1和瑞士乳杆菌KLDS 1.8701对大肠杆菌感染小鼠肠黏膜免疫的影响,结果显示,补充益生菌可显著提高肠道组织中分泌型免疫球蛋白A(sIgA)、白细胞介素-2(IL-2)、γ-干扰素(IFN-γ)、白细胞介素-4(IL-4)和白细胞介素-6(IL-6)的含量,增强肠道黏膜免疫功能。王旭霞等[9]探究了双歧杆菌对葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的UC大鼠肠黏膜屏障功能的影响,结果发现,双歧杆菌治疗后大鼠的结肠损伤组织学评分(CMDI)显著下降,血清中髓过氧化物酶(MPO)活性及IL-6、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)含量显著降低。进一步地,张文远等[10]的试验证明了双歧杆菌三联活苗对UC大鼠肠黏膜上皮细胞紧密连接蛋白OCLN具有保护作用。可见,益生菌能够调节细胞因子,调控紧密连接相关蛋白表达,改善肠道屏障功能,降低肠道通透性,进而阻止有害物质侵入引起的炎症反应。本文就益生菌对紧密连接蛋白OCLN蛋白表达调控的相关研究进行整理,以期阐述其调控机制,并为益生菌在预防和治疗肠道疾病的临床应用提供理论支撑。
1 OCLN的结构与功能 1.1 OCLN的结构OCLN是第1个被发现的定位于紧密连接的完整跨膜蛋白,它最早由Furuse等[11]于1993年在鸡的肝脏中发现,其分子质量约为65 ku。OCLN在进化上属于非常保守的一类基因,对其cDNA和氨基酸序列的分析发现小鼠、人和犬的OCLN基因具有90%的同源性[12]。人的OCLN基因定位于染色体5q13.1上,转录可得到全长为2 379 bp的mRNA[13]。
肠道OCLN是形成肠上皮细胞间紧密连接的结构基础,其含有的4个疏水跨膜域将OCLN分为5个部分:1个细胞内环、2个细胞外环以及游离在细胞质中的氨基末端和羧基末端[14]。细胞内环由10个氨基酸残基构成,其作用尚不清楚。2个细胞外环含有大量的丝氨酸、苏氨酸和酪氨酸残基。相邻细胞之间的第1个细胞外环交错形成封闭区域,该结构对细胞间的黏合具有重要的作用[15];第2个细胞外环对紧密连接具有特异性的调节功能,研究发现,缺少第2个细胞外环的OCLN在紧密连接中不存在,表明第2个细胞外环对OCLN稳定地组装进紧密连接是必不可少的[16]。氨基末端和羧基末端在维持紧密连接的屏障功能中起着重要作用,羧基末端通过与ZO-1等蛋白结合以维持紧密连接的完整性,增加细胞间连接的稳定性[17]。OCLN的磷酸化是其发挥功能所必需的。以往的研究显示,在肠上皮细胞中,磷酸化的OCLN常定位在紧密连接结构中,而非磷酸化的OCLN定位在细胞基侧膜和细胞质的囊泡内[18]。
1.2 OCLN的功能OCLN蛋白通常表达于细胞基侧膜的顶端,它是构成紧密连接的重要结构和功能组成部分。OCLN具有和CLDN类似的生物学功能:栅栏功能和屏障调节功能。栅栏功能是指OCLN能将肠上皮细胞质膜分成顶端侧的脂质部分和基底侧的蛋白部分,阻止2个功能区之间的相互弥散,帮助建立和维持细胞极性,进而保障细胞的正常生理功能[19-20]。因此,当OCLN蛋白的表达水平提高时,单层细胞膜的跨膜电阻(transepithelial electrical resistance,TEER)值增加。
屏障调节功能则对分子大小、离子类型、细胞渗透性等表现出选择性,调节细胞间小分子的运输,维持组织稳态[21]。OCLN有助于提高肠道物理屏障的稳定性,这对维持肠黏膜通透性和防止病原体等有害物质入侵具有重要意义[22]。此外,Van Itallie等[15]发现在纤维原细胞中OCLN与非钙离子(Ca2+)依赖的黏附作用相关,暗示OCLN可能具有调节细胞黏附的作用。
2 与OCLN相关的肠道疾病 2.1 肠易激综合征(irritable bowel syndrome,IBS)OCLN是紧密连接中的重要蛋白之一,它与肠黏膜的选择性屏障功能密切相关,一旦发生减少、缺失或变异将引起肠上皮细胞通透性增加,细菌、脂多糖和其他大分子等有害物质即可穿过屏障进入体循环,影响机体的正常生理活动,危害健康。
IBS在过去被认为是由内脏超敏、肠道黏膜免疫反应以及精神等因素诱导的肠道功能性疾病[23]。然而,近年来的临床研究结果提示,肠道通透性改变参与了IBS的发生发展,具体机制可能与OCLN被蛋白酶体降解有关[24]。Coëffier等[25]的研究初步揭示了蛋白酶体在IBS发病机制中的作用,利用荧光分析方法对比IBS患者、克罗恩病(Crohn’s disease,CD)患者和健康志愿者的结肠黏膜样本中蛋白酶体的活性,他们发现克罗恩病患者和健康志愿者的胰蛋白酶样蛋白酶活性均显著低于IBS患者;蛋白质印迹结果显示,IBS患者结肠黏膜样本中OCLN蛋白的表达水平较健康志愿者显著降低,但在OCLN mRNA表达水平上两者间无显著差异。他们进一步通过体外试验为蛋白酶体介导OCLN的降解改变肠黏膜通透性进而参与IBS的发生发展提供了直接证据:一方面,IBS患者样本中的蛋白质能够降解被硫35(35S)标记的OCLN,而从健康志愿者样本中提取的蛋白质则无此效应;另一方面,蛋白酶体抑制剂预处理阻止了IBS患者样本中蛋白质对重组OCLN的降解作用。
2.2 IBDIBD主要包括UC和CD,该病具有起病隐匿和易反复发作等特点。近年来,随着理论知识地逐渐完善和科学技术地不断发展,人们对IBD的发病及治疗有了新的认识,认为不论是肠道的原发性病变还是继发性损害,均与肠上皮屏障结构的破坏和功能的受损有关。
紧密连接结构受损可能是导致IBD患者肠道通透性增加的重要原因。在健康人的肠道黏膜中,OCLN连续分布于黏膜上皮细胞边缘,主要定位于细胞膜和细胞质,而在结肠炎中OCLN蛋白的表达和定位均发生明显变化。已有的研究提示,胞外信号调节激酶(external-signal regulated kinase,ERK)通路对OCLN蛋白的表达具有重要调节作用,ERK的自身磷酸化作用会影响到OCLN蛋白的翻译过程,同时还会干扰OCLN与其他紧密连接分子形成复合体的过程[26-27]。另外,各种炎症细胞因子和细菌内毒素也可改变OCLN蛋白的表达与分布,破坏紧密连接复合体结构,进而引起肠黏膜屏障功能障碍。例如,Al-Sadi等[28]报道白细胞介素-1β(IL-1β)通过调节核转录因子-κB(NF-κB)通路抑制OCLN蛋白的表达,使得紧密连接的结构受损;Sappington等[29]在Caco-2细胞单层膜中加入TNF-α引起OCLN分布异常,最终导致单层细胞膜的通透性显著升高。
3 应用益生菌改善肠道健康传统且常用的肠道疾病防治方法是使用抗生素。抗生素主要通过清除肠道微生物、重建肠道菌群达到改善肠道功能、防治肠道疾病的目的。然而,近年来,使用抗生素防治肠道疾病的有效性和安全性不断受到质疑。Ledder等[30]指出,包括阿奇霉素、环丙沙星和利福昔明在内的多种抗生素类药物在治疗轻、中度CD时发挥的作用不大。另外,抗生素类药物的副作用也是不容忽视的。研究发现,使用利福昔明容易出现上呼吸道感染、恶心和腹痛等症状[31];一项应用新霉素改善IBS症状的双盲试验发现受试者出现尿潴留的现象[32];抗生素相关腹泻更是成为抗生素使用时常见的症状[30]。而抗生素对肠道微生物的影响是限制抗生素使用的一个重要因素。事实上,已经有研究证明了在IBD患者中某些细菌的耐药性比普通人群的高,如黏附侵袭性大肠杆菌和禽分枝杆菌副结核亚种[33-34]。因此,相关指南中不建议使用抗生素治疗CD和UC[35]。益生菌被认为是抗生素的重要替代物,它不仅能产生多种有益作用,还具有绿色无害、无抗药性等诸多优点,有望成为肠道相关疾病治疗的有效新方法。
目前,应用益生菌防治与屏障功能受损相关的肠道疾病取得了不错的效果。Szajewska等[36]发现鼠李糖乳杆菌GG治疗能有效减少抗生素相关的腹泻,降低抗生素副作用,保护肠黏膜功能。Majeed等[37]报道了凝结芽孢杆菌MTCC 5856对IBS伴有抑郁症的患者的治疗效果,结果显示患者的血清MPO活性在益生菌干预后显著降低,肠黏膜中紧密连接相关蛋白表达水平显著提高,多种量表评分和问卷结果显示,益生菌干预显著改善了患者的抑郁和胃肠道症状。Sun等[38]研究发现,丁酸梭菌治疗IBS具有较高的应答率,丁酸梭菌通过下调患者的脂肪酸代谢、β-丙氨酸代谢和色氨酸代谢,降低粪便中狭义梭菌属的丰度,有效改善了IBS患者的症状。Srutkova等[39]报道了长双歧杆菌CCM 7952可通过增强DSS诱导的UC小鼠肠上皮细胞中紧密连接蛋白OCLN和ZO-1等蛋白的表达,降低肠道对细菌的通透性,增强肠黏膜屏障功能,进而有效阻止DSS诱导UC症状继续发展。多项给予IBS患者提供益生菌胶囊的研究也表明,持续提供益生菌胶囊可明显增加肠道菌群中乳酸杆菌属的丰度,降低嗜胆菌属的丰度,减少患者体内炎症标志物[40],促进肠道黏膜功能恢复,降低腹痛严重度和IBS症状严重程度评分(IBS-SSS),使排便频率及粪便硬度得到显著改善[41-42]。除此之外,Ng等[43]的研究发现商业性益生菌产品VSL#3(主要成分为乳酸杆菌、双歧杆菌)在治疗急性UC后可显著改善患者的肠道树突状细胞功能,上调肠黏膜中抗炎性细胞因子的表达水平,降低促炎性细胞因子的表达水平,使患者症状得到显著改善。
4 益生菌调控OCLN蛋白表达的机制 4.1 细胞因子文献报道的参与OCLN调节的细胞因子主要包括TNF-α、白细胞介素-1(IL-1)和IFN-γ。TNF-α是一种具有诱发炎症反应和免疫调节作用的细胞因子。研究发现,在CD患者肠组织中TNF-α含量异常增高。体外试验显示,在Caco-2单层细胞中加入TNF-α后可引起OCLN分布异常,使其不能准确地定位到紧密连接中,影响紧密连接的结构完整性[29]。早期的研究提示,这可能与TNF-α降低OCLN转录启动子的活性有关[44]。另外,Nwariaku等[45]报道了TNF-α可通过激活Rho家族蛋白(Rac1和Cdc42)使Rho相关的蛋白激酶(ROCK)磷酸化,进而激活p38丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK),激活的p38 MAPK不仅可以通过正反馈作用再促进TNF-α的合成与分泌,进一步抑制OCLN蛋白的表达[46-47],还能通过半胱天冬酶(cysteinyl aspartate specific proteinases,Caspases)级联反应启动细胞凋亡,诱导肠黏膜细胞程序性凋亡,影响OCLN的合成[47-48]。益生菌干预可能是通过调节关键基因[如丝裂原活化蛋白激酶磷酸酶-1(MKP-1)]的表达,磷酸化的MKP-1使p38 MAPK失活,进而降低TNF-α的转录,恢复OCLN等紧密连接相关基因的表达[49]。
NF-κB作为重要的核转录因子,参与了炎症、免疫、细胞增殖和凋亡等多种生理和病理过程相关基因的调控。研究发现,细菌脂多糖刺激引起NF-κB抑制蛋白(IκB)的磷酸化和解离,随后p65亚基被释放并转移至核内,加速下游基因的表达[50-51]。TNF-α即为受其调控的下游基因之一。已有的研究中,植物乳杆菌(Lactobacillus plantarum)L2被报道可以阻止IκB的解离,抑制NF-κB进入细胞核[52];詹氏乳杆菌(Lactobacillus jensenii)、植物乳杆菌和鼠李糖乳杆菌(Lactobacillus rhamnosus)GG通过下调NF-κB和MAPK信号通路[49, 53-55],降低TNF-α引起的损伤,保护肠上皮屏障功能。
IL-1在感染、炎症、免疫调节、细胞分化和凋亡等多个过程中起着关键作用。IL-1β与炎症反应的启动和放大有关。对IBD患者肠组织中细胞因子的检测显示,IL-1β含量与炎症的严重程度呈正相关。IL-1β可以促进肌球蛋白轻链激酶(myosin light chain kinases,MLCKs)合成,MLCKs破坏紧密连接蛋白复合体,进而引起细胞旁通透性增加[56-61]。此外,研究发现,IL-1β也可以降解IκB促进p65亚基核转位,影响OCLN基因表达,造成单层细胞分子TEER值降低和旁细胞途径通透性增加[28, 58]。霍丽娟等[62]研究了混合益生菌(含双歧杆菌、乳酸杆菌、肠球菌)对UC大鼠结肠黏膜中IL-1β和TNF-α基因表达的影响,通过原位杂交技术检测结肠黏膜中IL-1β和TNF-α的mRNA表达水平,发现益生菌可通过抑制黏膜中促炎性细胞因子的转录,解除它们对OCLN基因表达的抑制作用,最终发挥修复和改善UC大鼠受损黏膜的作用。此外,源自离心后婴儿双歧杆菌培养基和嗜酸乳杆菌培养基的上清液也被证明可改善IL-1β诱导的肠上皮屏障功能障碍,使OCLN基因的表达恢复正常,具体机制与抑制NF-κB活化和阻止p65亚基转位入核有关[58]。
IFN-γ是一种具有免疫调节和抗病毒作用的多效性细胞因子,它能激活巨噬细胞和自然杀伤细胞,也可促进炎症发生。在UC患者的肠组织中常发现高水平的IFN-γ。体外试验结果表明,IFN-γ可通过介导OCLN蛋白表达下调增加细胞间的渗透性[63]。进一步的研究提示,这可能与IFN-γ激活磷脂酰肌醇-3-激酶/NF-κB串联通路有关,最后使OCLN蛋白的表达量降低[64]。叶胜青等[65]报道了植物乳杆菌可降低IL-10基因敲除小鼠结肠黏膜中TNF-α和IFN-γ含量,混合益生菌制剂VSL#3也能减少IL-10基因敲除小鼠黏膜IFN-γ和TNF-α的合成与分泌,修复肠上皮细胞旁通透性损伤。刘伟等[66]的研究发现,结肠炎模型组大鼠黏膜中的促炎性和抗炎性细胞因子间的平衡失调,促炎性细胞因子TNF-α和IFN-γ含量显著升高,而抗炎性细胞因子IL-10的含量显著降低,益生菌治疗能帮助重建这2类细胞因子之间的平衡,增加紧密连接蛋白OCLN蛋白的表达量,促进肠黏膜功能恢复。我们早期的试验探究了不同益生菌对獭兔肠道屏障功能的影响[67-69],研究结果支持益生菌通过调节促炎性细胞因子和抗炎性细胞因子之间的平衡进而改善肠道屏障功能这一观点。
4.2 MAPK信号通路MAPK信号通路是生物体内重要的信号转导系统之一,参与了细胞生长、发育、分裂和分化等多种生理及病理过程。在哺乳动物细胞中,MAPK包括细胞外信号调节激酶1/2(ERK1/2,也称为p44和p42 MAPK)、c-Jun氨基末端激酶1/2/3(JNK1/2/3)、p38α/β/γ/δ、细胞外信号调节激酶3/4(ERK3/4)、细胞外信号调节激酶5(ERK5)和细胞外信号调节激酶7/8(ERK7/8)。
MAPK信号通路参与了对紧密连接相关蛋白表达的调控。Yu等[70]研究发现,产肠毒素大肠杆菌或鼠伤寒沙门氏杆菌SL1344感染可引起细胞内磷酸化的ERK和JNK表达水平显著升高,破坏紧密连接的结构和功能,而添加益生菌嗜淀粉乳杆菌D14可以缓解病原菌对肠上皮细胞完整性的破坏,作用机制是通过降低细胞内磷酸化的ERK和JNK的表达水平,增加紧密连接蛋白OCLN蛋白的表达并改善其分布,从而保护细胞间的紧密连接结构。Wu等[71]报道了p38 MAPK磷酸化与OCLN蛋白表达降低有关,而加入let-7b或SB203580(p38 MAPK特异性抑制剂)下调p38 MAPK磷酸化水平可使OCLN蛋白表达恢复正常[72];另外,如前文所述,激活的p38 MAPK还能通过TNF-α影响OCLN的转录过程。乳酸杆菌可通过下调p38 MAPK表达水平或降低其磷酸化水平,抑制肠毒素性大肠杆菌触发的促炎性细胞因子的表达,改善紧密连接蛋白OCLN蛋白的表达[49, 53]。进一步地研究发现,乳酸杆菌表面蛋白可能与MAPK信号通路有关。刘志华[73]结合生物信息学和分子生物学技术对植物乳酸杆菌CGMCC 1258表面蛋白进行纯化鉴定,得到具有黏附活性的微小整合膜蛋白片段(micro IMP,MIMP),利用蛋白质免疫印记技术检测MIMP对细胞内OCLN蛋白、p38蛋白和磷酸化p38蛋白表达的影响,采用免疫荧光法检测p38 MAPK信号通路对OCLN蛋白表达和分布的变化,其结果显示MIMP能抑制单层细胞跨膜电阻下降,减轻致病菌对OCLN的损伤,而加入p38 MAPK信号分子激活剂则抑制了MIMP对OCLN的保护作用,降低了细胞连接处OCLN蛋白的荧光强度,证明p38 MAPK是植物乳酸杆菌CGMCC 1258 MIMP调控OCLN蛋白表达的通路之一。
综上所述,肠道疾病状态下,黏膜中TNF-α、IL-1β、IFN-γ的含量明显增加,促炎性细胞因子含量的异常升高会激活细胞内NF-κB和MAPK信号通路,进而抑制OCLN基因的转录和翻译过程;此外,肠道疾病状态下,细胞内ERK、JNK和p38的磷酸化水平也明显增加,这些激酶的磷酸化水平升高会干扰OCLN基因的翻译及蛋白质修饰过程。以上2种不利因素导致最终的OCLN蛋白表达量降低和/或不能正确地组装到紧密连接中。益生菌治疗通过干预NF-κB和MAPK信号通路,帮助重建促炎性细胞因子和抗炎性细胞因子间的平衡,降低细胞内ERK、JNK和p38的磷酸化水平,进而缓解异常因子对OCLN基因转录、翻译及蛋白质修饰过程的不利影响,最终使得OCLN蛋白的表达恢复正常,改善肠黏膜屏障功能。益生菌调控OCLN蛋白表达的机制如图 1所示。
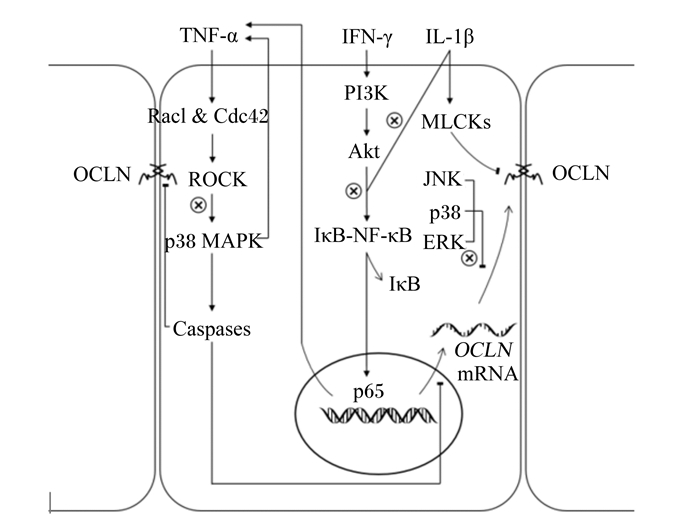
|
IL-1β:白细胞介素-1β interleukin-1β;IFN-γ:γ-干扰素interferon-γ;PI3K:磷酸肌醇3激酶phosphotylinosital 3 kinase;Akt:蛋白激酶B protein kinase B;MLCKs:肌球蛋白轻链激酶myosin light chain kinases;NF-κB:核转录因子-κB nuclear transcription factor-κB;IκB:核转录因子-κB抑制蛋白nuclear transcription factor-κB inhibitor;JNK:c-Jun氨基末端激酶c-Jun N-terminal kinase;ERK:胞外信号调节激酶external-signal regulated kinase;OCLN:闭锁蛋白occludin;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α;ROCK:Rho相关的蛋白激酶Rho-associated protein kinase;MAPK:丝裂原活化蛋白激酶mitogen-activated protein kinases;Caspases:半胱天冬酶cysteinyl aspartate specific proteinase。 线段端头为箭头,表示激活或促进作用;线段端头为短线,表示干扰或抑制作用;表示前人文献中报道的益生菌调控OCLN蛋白表达的潜在位点。The arrows at the end of the lines represent activation or promotion, and short lines at the end represent inhibition or interference, while indicates the potential site for probiotics to regulate OCLN protein expression in previous researches. 图 1 益生菌调控OCLN蛋白表达的机制 Fig. 1 Regulatory mechanisms of OCLN protein expression by probiotics |
肠上皮屏障是肠黏膜的重要防线之一,屏障功能受损将严重影响肠道健康,诱发多种肠道疾病。益生菌能够保护肠黏膜屏障的结构和功能,以往的研究侧重于其宏观保护效果的探究,因而对具体的微观调控机制尚未完全理解清楚,需要继续深入地探索和研究。在未来的相关研究中,我们可通过以下2个途径探究益生菌对肠道OCLN蛋白表达的微观调控机制:第一,益生菌自身结构与上皮细胞接触后激活的细胞信号通路,即以益生菌自身的有效结构元件为出发点,寻找细胞上益生菌的特定作用受体,利用大数据分析挖掘并验证其下游调控因子,进而绘制该益生菌调控OCLN蛋白表达的完整的胞内信号通路。第二,益生菌的代谢产物可能间接地发挥调控作用。伴有“肠漏”或免疫功能不全的患者可能不适合摄入大量的细菌,新的方法可以通过分离益生菌来源的生物活性因子。许多益生菌源的生物活性因子已被证明也能对肠上皮屏障功能发挥有益作用,如短乳杆菌(Lactobacillus brevis)SBC8803源的聚磷酸盐能帮助维持肠道内稳态[74],植物乳杆菌表面黏附蛋白可保护肠上皮细胞免受肠致病性大肠杆菌引起的紧密连接损伤[75],饮用副干酪乳杆菌(Lactobacillus paracasei)CBA L74发酵后的牛奶能上调OCLN和ZO-1蛋白的表达[76]。然而,其中发挥作用的成分不清楚,且益生菌的代谢受培养基成分和培养条件的影响。因此,未来的研究可结合转录组学、蛋白质组学和代谢组学分离并解析益生菌代谢产物对OCLN蛋白表达的影响,并深入探究某一代谢产物成分对OCLN蛋白表达的调控通路。在以上2个途径中找到的益生菌的有效成分和受体结构的调控元件,将为临床上肠道屏障相关疾病防治药物的设计和研发提供参考依据。
| [1] |
WATSON R R, PREEDY V R. Probiotics, prebiotics, and synbiotics[M]. Pittsburgh: Academic Press, 2016: 75-85.
|
| [2] |
XUE L, HE J T, GAO N, et al. Probiotics may delay the progression of nonalcoholic fatty liver disease by restoring the gut microbiota structure and improving intestinal endotoxemia[J]. Scientific Reports, 2017, 7: 45176. DOI:10.1038/srep45176 |
| [3] |
VALERIANO V D V, BALOLONG M P, KANG D K. Probiotic roles of Lactobacillus sp. in swine:insights from gut microbiota[J]. Journal of Applied Microbiology, 2017, 122(3): 554-567. DOI:10.1111/jam.13364 |
| [4] |
GAO J S, WU H W, LIU J F. Importance of gut microbiota in health and diseases of new born infants[J]. Experimental and Therapeutic Medicine, 2016, 12(1): 28-32. DOI:10.3892/etm.2016.3253 |
| [5] |
TURNER J R. Intestinal mucosal barrier function in health and disease[J]. Nature Reviews Immunology, 2009, 9(11): 799-809. DOI:10.1038/nri2653 |
| [6] |
SHIN K, FOGG V C, MARGOLIS B. Tight junctions and cell polarity[J]. Annual Review of Cell and Developmental Biology, 2006, 22: 207-235. DOI:10.1146/annurev.cellbio.22.010305.104219 |
| [7] |
谭悦, 郑长清. 紧密连接蛋白occludin、ZO-1在溃疡性结肠炎中的表达及其临床意义[J]. 现代药物与临床, 2018, 33(7): 1803-1808. |
| [8] |
王婷婷, 王雪芹, 霍贵成. 乳酸杆菌对感染大肠杆菌O157:H7小鼠肠道黏膜免疫的影响[J]. 微生物学通报, 2014, 41(10): 2082-2089. |
| [9] |
王旭霞, 赵曙光, 刘震雄, 等. 双歧杆菌对溃疡性结肠炎大鼠肠黏膜屏障功能及细胞因子的影响[J]. 山西医科大学学报, 2011, 42(8): 621-623, 694. DOI:10.3969/J.ISSN.1007-6611.2011.08.003 |
| [10] |
张文远, 姜伟炜. 肠道微生态对三硝基苯磺酸诱导大鼠结肠炎肠黏膜上皮细胞紧密连接蛋白occludin保护作用的研究[J]. 临床消化病杂志, 2010, 22(1): 21-24. DOI:10.3870/lcxh.j.issn.1005-541X.2010.01.007 |
| [11] |
FURUSE M, HIRASE T, ITOH M, et al. Occludin:a novel integral membrane protein localizing at tight junctions[J]. The Journal of Cell Biology, 1993, 123(6): 1777-1788. DOI:10.1083/jcb.123.6.1777 |
| [12] |
ANDO-AKATSUKA Y, SAITOU M, HIRASE T, et al. Interspecies diversity of the occludin sequence:cDNA cloning of human, mouse, dog, and rat-kangaroo homologues[J]. The Journal of Cell Biology, 1996, 133(1): 43-47. DOI:10.1083/jcb.133.1.43 |
| [13] |
SAITOU M, ANDO-AKATSUKA Y, ITOH M, et al. Mammalian occludin in epithelial cells:its expression and subcellular distribution[J]. European Journal of Cell Biology, 1997, 73(3): 222-231. |
| [14] |
CUMMINS P M. Occludin:one protein, many forms[J]. Molecular and Cellular Biology, 2012, 32(2): 242-250. DOI:10.1128/MCB.06029-11 |
| [15] |
VAN ITALLIE C M, ANDERSON J M. Occludin confers adhesiveness when expressed in fibroblasts[J]. Journal of Cell Biology, 1997, 110(9): 1113-1121. |
| [16] |
MEDINA R, RAHNER C, MITIC L L, et al. Occludin localization at the tight junction requires the second extracellular loop[J]. The Journal of Membrane Biology, 2000, 178(3): 235-247. DOI:10.1007/s002320010031 |
| [17] |
MANDELL K J, PARKOS C A. The JAM family of proteins[J]. Advanced Drug Delivery Reviews, 2005, 57(6): 857-867. DOI:10.1016/j.addr.2005.01.005 |
| [18] |
BOLINGER M T.Phosphorylation of the tight junction protein occludin regulates epithelial monolayer proliferation and maturation[D].Ph.D.Thesis.Ann Arbor: University of Michigan, 2016. https://ui.adsabs.harvard.edu/abs/2016PhDT.......216B/abstract
|
| [19] |
TOKUNAGA Y, KOJIMA T, OSANAI M, et al. A novel monoclonal antibody against the second extracellular loop of occludin disrupts epithelial cell polarity[J]. Journal of Histochemistry & Cytochemistry, 2007, 55(7): 735-744. |
| [20] |
ODENWALD M A, CHOI W, BUCKLEY A, et al. ZO-1 interactions with F-actin and occludin direct epithelial polarization and single lumen specification in 3D culture[J]. Journal of Cell Science, 2017, 130(1): 243-259. DOI:10.1242/jcs.188185 |
| [21] |
BALDA M S, FLORES-MALDONADO C, CEREIJIDO M, et al. Multiple domains of occludin are involved in the regulation of paracellular permeability[J]. Journal of Cellular Biochemistry, 2000, 78(1): 85-96. DOI:10.1002/(SICI)1097-4644(20000701)78:1<85::AID-JCB8>3.0.CO;2-F |
| [22] |
MIR H, MEENA A S, CHAUDHRY K K, et al. Occludin deficiency promotes ethanol-induced disruption of colonic epithelial junctions, gut barrier dysfunction and liver damage in mice[J]. Biochimica et Biophysica Acta:General Subjects, 2016, 1860(4): 765-774. DOI:10.1016/j.bbagen.2015.12.013 |
| [23] |
杨建锋, 戴宁. 肠道黏膜免疫在肠易激综合征发病中的作用[J]. 中华消化杂志, 2010, 30(4): 282-285. DOI:10.3760/cma.j.issn.0254-1432.2010.04.021 |
| [24] |
PICHE T, BARBARA G, AUBERT P, et al. Impaired intestinal barrier integrity in the colon of patients with irritable bowel syndrome:involvement of soluble mediators[J]. Gut, 2009, 58(2): 196-201. DOI:10.1136/gut.2007.140806 |
| [25] |
COËFFIER M, GLORO R, BOUKHETTALA N, et al. Increased proteasome-mediated degradation of occludin in irritable bowel syndrome[J]. The American Journal of Gastroenterology, 2010, 105(5): 1181-1188. DOI:10.1038/ajg.2009.700 |
| [26] |
BASUROY S, SETH A, ELIAS B, et al. MAPK interacts with occludin and mediates EGF-induced prevention of tight junction disruption by hydrogen peroxide[J]. Biochemical Journal, 2006, 393(1): 69-77. DOI:10.1042/BJ20050959 |
| [27] |
高欣, 张振玉, 吴海露, 等. 雷贝拉唑对NSAIDs相关小肠损伤大鼠紧密连接蛋白Occludin表达的影响及其机制[J]. 胃肠病学和肝病学杂志, 2012, 21(8): 771-774. |
| [28] |
AL-SADI R M, MA T Y. IL-1β causes an increase in intestinal epithelial tight junction permeability[J]. The Journal of Immunology, 2007, 178(7): 4641-4649. DOI:10.4049/jimmunol.178.7.4641 |
| [29] |
SAPPINGTON P L, HAN X N, YANG R K, et al. Ethyl pyruvate ameliorates intestinal epithelial barrier dysfunction in endotoxemic mice and immunostimulated Caco-2 enterocytic monolayers[J]. Journal of Pharmacology and Experimental Therapeutics, 2003, 304(1): 464-476. DOI:10.1124/jpet.102.043182 |
| [30] |
LEDDER O, TURNER D. Antibiotics in IBD:still a role in the biological era?[J]. Inflammatory Bowel Diseases, 2018, 24(8): 1676-1688. DOI:10.1093/ibd/izy067 |
| [31] |
SCHOENFELD P, PIMENTEL M, CHANG L, et al. Safety and tolerability of rifaximin for the treatment of irritable bowel syndrome without constipation:a pooled analysis of randomised, double-blind, placebo-controlled trials[J]. Alimentary Pharmacology and Therapeutics, 2014, 39(10): 1161-1168. DOI:10.1111/apt.12735 |
| [32] |
PIMENTEL M, CHOW E J, LIN H C. Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome:a double-blind, randomized, placebo-controlled study[J]. The American Journal of Gastroenterology, 2003, 98(2): 412-419. |
| [33] |
DOGAN B, SCHERL E, BOSWORTH B, et al. Multidrug resistance is common in Escherichia coli associated with ileal Crohn's disease[J]. Inflammatory Bowel Diseases, 2013, 19(1): 141-150. |
| [34] |
BECKLER D R, ELWASILA S, GHOBRIAL G, et al. Correlation between rpoB gene mutation in Mycobacterium avium subspecies paratuberculosis and clinical rifabutin and rifampicin resistance for treatment of Crohn's disease[J]. World Journal of Gastroenterology, 2008, 14(17): 2723-2730. DOI:10.3748/wjg.14.2723 |
| [35] |
GOMOLLÓN F, DIGNASS A, ANNESE V, et al. 3rd European evidence-based consensus on the diagnosis and management of Crohn's disease 2016.Part 1:diagnosis and medical management[J]. Journal of Crohn's and Colitis, 2017, 11(1): 3-25. DOI:10.1093/ecco-jcc/jjw168 |
| [36] |
SZAJEWSKA H, CANANI RB, GUARINO A, et al. Probiotics for the prevention of antibiotic-associated diarrhea in children[J]. Journal of Pediatric Gastroenterology Nutrition, 2015, 62(3): 495-506. |
| [37] |
MAJEED M, NAGABHUSHANAM K, ARUMUGAM S, et al. Bacillus coagulans MTCC 5856 for the management of major depression with irritable bowel syndrome:a randomised, double-blind, placebo controlled, multi-centre, pilot clinical study[J]. Food & Nutrition Research, 2018, 62. DOI:10.29219/fnr.v62.1218 |
| [38] |
SUN Y Y, LI M, LI Y Y, et al. The effect of Clostridium butyricum on symptoms and fecal microbiota in diarrhea-dominant irritable bowel syndrome:a randomized, double-blind, placebo-controlled trial[J]. Scientific Reports, 2018, 8: 2964. DOI:10.1038/s41598-018-21241-z |
| [39] |
SRUTKOVA D, SCHWARZER M, HUDCOVIC T, et al. Bifidobacterium longum CCM 7952 promotes epithelial barrier function and prevents acute DSS-induced colitis in strictly strain-specific manner[J]. PLoS One, 2015, 10(7): e0134050. DOI:10.1371/journal.pone.0134050 |
| [40] |
HOD K, DEKEL R, COHEN N A, et al. The effect of a multispecies probiotic on microbiota composition in a clinical trial of patients with diarrhea-predominant irritable bowel syndrome[J]. Neurogastroenterology & Motility, 2018, 30(12): e13456. |
| [41] |
ISHAQUE S M, KHOSRUZZAMAN S M, AHMED D S, et al. A randomized placebo-controlled clinical trial of a multi-strain probiotic formulation (Bio-Kult) in the management of diarrhea-predominant irritable bowel syndrome[J]. BMC Gastroenterology, 2018, 18: 71. DOI:10.1186/s12876-018-0788-9 |
| [42] |
PRESTON K, KRUMIAN R, HATTNER J, et al. Lactobacillus acidophilus CL1285, Lactobacillus casei LBC80R and Lactobacillus rhamnosus CLR2 improve quality-of-life and IBS symptoms:a double-blind, randomised, placebo-controlled study[J]. Beneficial Microbes, 2018, 9(5): 697-706. DOI:10.3920/BM2017.0105 |
| [43] |
NG S C, PLAMONDON S, KAMM M A, et al. Immunosuppressive effects via human intestinal dendritic cells of probiotic bacteria and steroids in the treatment of acute ulcerative colitis[J]. Inflammatory Bowel Diseases, 2010, 16(8): 1286-1298. DOI:10.1002/ibd.21222 |
| [44] |
MANKERTZ J, TAVALALI S, SCHMITZ H, et al. Expression from the human occludin promoter is affected by tumor necrosis factor alpha and interferon gamma[J]. Journal of Cell Science, 2000, 113(11): 2085-2090. |
| [45] |
NWARIAKU F E, ROTHENBACH P, LIU Z J, et al. Rho inhibition decreases TNF-induced endothelial MAPK activation and monolayer permeability[J]. Journal of Applied Physiology, 2003, 95(5): 1889-1895. DOI:10.1152/japplphysiol.00225.2003 |
| [46] |
WANG X W, MAGOMED K, DING Z F, et al. Cross-talk between inflammation and angiotensin Ⅱ:studies based on direct transfection of cardiomyocytes with AT1R and AT2R cDNA[J]. Experimental Biology and Medicine, 2012, 237(12): 1394-1401. DOI:10.1258/ebm.2012.012212 |
| [47] |
王建峰, 程丽红, 席红卫. p38MAPK对小儿急性肠梗阻肠坏死Occludin表达的影响及临床意义[J]. 中华小儿外科杂志, 2017, 38(2): 95-98. DOI:10.3760/cma.j.issn.0253-3006.2017.02.004 |
| [48] |
JIN S, RAY R M, JOHNSON L R. TNF-α/cycloheximide-induced apoptosis in intestinal epithelial cells requires Rac1-regulated reactive oxygen species[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2008, 294(4): G928-G937. DOI:10.1152/ajpgi.00219.2007 |
| [49] |
WU Y P, ZHU C, CHEN Z, et al. Protective effects of Lactobacillus plantarum on epithelial barrier disruption caused by enterotoxigenic Escherichia coli in intestinal porcine epithelial cells[J]. Veterinary Immunology and Immunopathology, 2016, 172: 55-63. DOI:10.1016/j.vetimm.2016.03.005 |
| [50] |
TU J, XU Y L, XU J Q, et al. Chitosan nanoparticles reduce LPS-induced inflammatory reaction via inhibition of NF-κB pathway in Caco-2 cells[J]. International Journal of Biological Macromolecules, 2016, 86: 848-856. DOI:10.1016/j.ijbiomac.2016.02.015 |
| [51] |
CIANCIULLI A, CALVELLO R, CAVALLO P, et al. Modulation of NF-κB activation by resveratrol in LPS treated human intestinal cells results in downregulation of PGE2 production and COX-2 expression[J]. Toxicology in Vitro, 2012, 26(7): 1122-1128. DOI:10.1016/j.tiv.2012.06.015 |
| [52] |
WANG B, LI J J, CHEN J, et al. Effect of live Lactobacillus plantarum L2 on TNF-α-induced MCP-1 production in Caco-2 cells[J]. International Journal of Food Microbiology, 2010, 142(1/2): 237-241. |
| [53] |
SHIMAZU T, VILLENA J, TOHNO M, et al. Immunobiotic Lactobacillus jensenii elicits anti-inflammatory activity in porcine intestinal epithelial cells by modulating negative regulators of the Toll-like receptor signaling pathway[J]. Infection and Immunity, 2012, 80(1): 276-288. DOI:10.1128/IAI.05729-11 |
| [54] |
ZHANG L Y, LI N, CAICEDO R, et al. Alive and dead Lactobacillus rhamnosus GG decrease tumor necrosis factor-α-induced interleukin-8 production in Caco-2 cells[J]. The Journal of Nutrition, 2005, 135(7): 1752-1756. DOI:10.1093/jn/135.7.1752 |
| [55] |
GHADIMI D, DE VRESE M, HELLER K J, et al. Effect of natural commensal-origin DNA on Toll-like receptor 9(TLR9) signaling cascade, chemokine IL-8 expression, and barrier integritiy of polarized intestinal epithelial cells[J]. Inflammatory Bowel Diseases, 2010, 16(3): 410-427. DOI:10.1002/ibd.21057 |
| [56] |
CHATURVEDI L S, MARSH H M, BASSON M D. Role of RhoA and its effectors ROCK and mDia1 in the modulation of deformation-induced FAK, ERK, p38, and MLC motogenic signals in human Caco-2 intestinal epithelial cells[J]. American Journal of Physiology-Cell Physiology, 2011, 301(5): C1224-C1238. DOI:10.1152/ajpcell.00518.2010 |
| [57] |
YE D M, MA I, MA T Y. Molecular mechanism of tumor necrosis factor-α modulation of intestinal epithelial tight junction barrier[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2006, 290(3): G496-G504. DOI:10.1152/ajpgi.00318.2005 |
| [58] |
GUO S S, GILLINGHAM T, GUO Y M, et al. Secretions of Bifidobacterium infantis and Lactobacillus acidophilus protect intestinal epithelial barrier function[J]. Journal of Pediatric Gastroenterology and Nutrition, 2017, 64(3): 404-412. DOI:10.1097/MPG.0000000000001310 |
| [59] |
AL-SADI R, GUO S H, YE D M, et al. Mechanism of IL-1β modulation of intestinal epithelial barrier involves p38 kinase and activating transcription factor-2 activation[J]. The Journal of Immunology, 2013, 190(12): 6596-6606. DOI:10.4049/jimmunol.1201876 |
| [60] |
AL-SADI R, YE D M, DOKLADNY K, et al. Mechanism of IL-1β-induced increase in intestinal epithelial tight junction permeability[J]. The Journal of Immunology, 2008, 180(8): 5653-5661. DOI:10.4049/jimmunol.180.8.5653 |
| [61] |
AL-SADI R, YE D M, SAID H M, et al. Cellular and molecular mechanism of interleukin-1β modulation of Caco-2 intestinal epithelial tight junction barrier[J]. Journal of Cellular and Molecular Medicine, 2011, 15(4): 970-982. DOI:10.1111/j.1582-4934.2010.01065.x |
| [62] |
霍丽娟, 赵和平. 益生菌对溃疡性结肠炎大鼠结肠黏膜中IL-1和TNF-α表达的影响[J]. 山西医科大学学报, 2004, 35(4): 341-343, 349. |
| [63] |
WATSON C J, HOARE C J, GARROD D R, et al. Interferon-γ selectively increases epithelial permeability to large molecules by activating different populations of paracellular pores[J]. Journal of Cell Science, 2005, 118(22): 5221-5230. DOI:10.1242/jcs.02630 |
| [64] |
BOIVIN M A, ROY P K, BRADLEY A, et al. Mechanism of interferon-γ-induced increase in T84 intestinal epithelial tight junction[J]. Journal of Interferon & Cytokine Research, 2009, 29(1): 45-54. |
| [65] |
叶胜青, 丁在咸, 张旻, 等. 植物乳杆菌对白细胞介素-10基因敲除小鼠结肠炎的治疗作用[J]. 中华消化杂志, 2011, 31(9): 619-624. DOI:10.3760/cma.j.issn.0254-1432.2011.09.010 |
| [66] |
刘伟, 戎兰, 丁伟群, 等. 益生菌对结肠炎大鼠黏膜和系统水平细胞因子的影响[J]. 复旦学报(医学版), 2008, 35(2): 278-281. DOI:10.3969/j.issn.1672-8467.2008.02.028 |
| [67] |
LIU L, ZENG D, YANG M Y, et al. Probiotic Clostridium butyricum improves the growth performance, immune function, and gut microbiota of weaning Rex rabbits[J]. Probiotics and Antimicrobial Proteins, 2019, 11(4): 1278-1292. DOI:10.1007/s12602-018-9476-x |
| [68] |
ZHOU Y, NI X Q, WEN B, et al. Appropriate dose of Lactobacillus buchneri supplement improves intestinal microbiota and prevents diarrhoea in weaning Rex rabbits[J]. Beneficial Microbes, 2018, 9(3): 401-416. DOI:10.3920/BM2017.0055 |
| [69] |
SUN H, NI X Q, SONG X, et al. Fermented Yupingfeng polysaccharides enhance immunity by improving the foregut microflora and intestinal barrier in weaning Rex rabbits[J]. Applied Microbiology and Biotechnology, 2016, 100(18): 8105-8120. DOI:10.1007/s00253-016-7619-0 |
| [70] |
YU Q, WANG Z, YANG Q. Lactobacillus amylophilus D14 protects tight junction from enteropathogenic bacteria damage in Caco-2 cells[J]. Journal of Dairy Science, 2012, 95(10): 5580-5587. DOI:10.3168/jds.2012-5540 |
| [71] |
WU H L, GAO X, JIANG Z D, et al. Attenuated expression of the tight junction proteins is involved in clopidogrel-induced gastric injury through p38 MAPK activation[J]. Toxicology, 2013, 304: 41-48. DOI:10.1016/j.tox.2012.11.020 |
| [72] |
LIU Z H, TIAN Y H, JIANG Y Q, et al. Protective effects of Let-7b on the expression of occludin by targeting p38 MAPK in preventing intestinal barrier dysfunction[J]. Cellular Physiology and Biochemistry, 2018, 45(1): 343-355. DOI:10.1159/000486815 |
| [73] |
刘志华.乳酸杆菌表面蛋白活性片段MIMP诱导肠上皮细胞MAPK信号通路调控occludin表达的机制研究[D].博士学位论文.上海: 上海交通大学, 2011. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2031274
|
| [74] |
SEGAWA S, FUJIYA M, KONISHI H, et al. Probiotic-derived polyphosphate enhances the epithelial barrier function and maintains intestinal homeostasis through integrin-p38 MAPK pathway[J]. PLoS One, 2011, 6(8): e23278. DOI:10.1371/journal.pone.0023278 |
| [75] |
LIU Z H, SHEN T Y, ZHANG P, et al. Lactobacillus plantarum surface layer adhesive protein protects intestinal epithelial cells against tight junction injury induced by enteropathogenic Escherichia coli[J]. Molecular Biology Reports, 2011, 38(5): 3471-3480. DOI:10.1007/s11033-010-0457-8 |
| [76] |
PAPARO L, AITORO R, NOCERINO R, et al. Direct effects of fermented cow's milk product with Lactobacillus paracasei CBA L74 on human enterocytes[J]. Beneficial Microbes, 2018, 9(1): 165-172. DOI:10.3920/BM2017.0038 |




