牛链球菌(Streptococcus bovis,S. bovis)是瘤胃中主要的微生物之一,特别是在饲喂高淀粉饲粮时,其主要发酵产物为乳酸[1]。在实际生产中常喂以淀粉为主的高精料饲粮,导致瘤胃中S. bovis快速增殖生长,并利用碳水化合物发酵产生乳酸,从而引起瘤胃酸中毒的发生[2]。因此,揭示S. bovis利用碳水化合物的代谢规律,从而控制S. bovis代谢生长水平,可以一定程度上抑制瘤胃乳酸中毒[3]。大量研究表明,分解代谢物控制蛋白A(catabolite control protein A,CcpA)是低GC含量的革兰氏阳性菌基因转录的抑制或激活因子,S. bovis中的CcpA与磷酸转移酶系统(phosphotransferase system,PTS)有着密切关系,可调控碳源次序代谢利用[4-5]。有研究表明,在S. bovis中的CcpA可调控乳酸脱氢酶(LDH)、丙酮酸甲酸裂解酶(PFL)、磷酸果糖激酶(PFK)、丙酮酸激酶(PYK)和甘油醛-3-磷酸脱氢酶(GAPDH)等碳水化合物代谢过程中的重要酶[6-8]。为此,本文将重点综述CcpA对瘤胃S. bovis碳水化合物代谢的调控,旨在为进一步研究S. bovis代谢产酸机制、防控反刍动物瘤胃酸中毒提供思路和参考。
1 CcpA与PTS目前研究认为,PTS和易化扩散是S. bovis内葡萄糖跨膜摄取转运的主要途径[9]。S. bovis可利用易化扩散中的葡萄糖转运蛋白将葡萄糖顺浓度梯度转运至胞内,而PTS则可以特异性地将葡萄糖逆浓度梯度主动转运到胞质中[10]。PTS由3类酶构成,它们分别是磷酸烯醇式丙酮酸依赖性蛋白激酶Ⅰ(phosphoenolpyruvate-dependent protein kinase enzyme Ⅰ,EⅠ)、热稳定性组氨酸磷酸化蛋白(heat-stable, histidine-phosphoryl protein,HPr)以及磷酸烯醇式丙酮酸依赖性蛋白激酶酶Ⅱ(PEP-dependent protein kinase enzyme Ⅱ,EⅡ)[11]。EⅠ和HPr是非特异性的,而EⅡ具有糖类特异性,一般包含3个结构域(包括EⅡA、EⅡB和EⅡC),3个结构域或组织在1个蛋白质上,由连接序列融合,当相互结合时具转运活性[12]。当细胞外有大量葡萄糖时,首先EⅠ的组氨酸位点被磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)磷酸化,随后EⅠ将磷酸基团转移到HPr的组氨酸的位点,HPr被磷酸化并形成组氨酰磷酸化HPr(HPr-[His-P]);磷酸基团从HPr-[His-P]被转移到EⅡA,再次转移到EⅡB,最后EⅡB激活EⅡC。葡萄糖被EⅡC特异性识别,并磷酸化为葡萄糖-6-磷酸(glucose 6-phosphate,G-6-P),然后被转运至胞内(图 1)[13]。
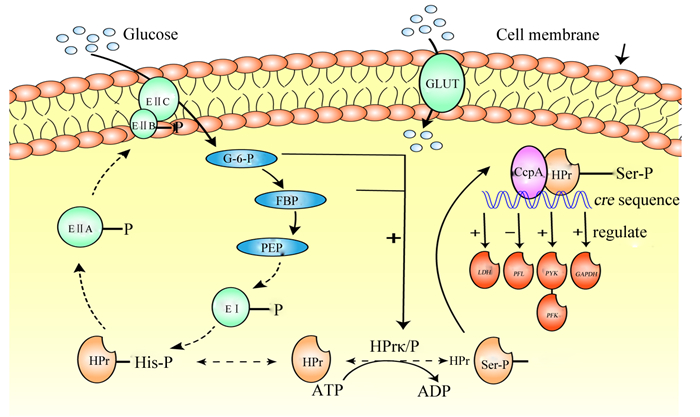
|
Glucose:葡萄糖;Cell membrane:细胞膜;GLUT:葡萄糖转运蛋白glucose transporter;EⅠ:磷酸烯醇式丙酮酸依赖性蛋白激酶Ⅰ phosphoenolpyruvate-dependent protein kinase enzyme Ⅰ;EⅡA、EⅡB和EⅡC:phosphoenolpyruvate-dependent protein kinase enzyme ⅡA, ⅡB and ⅡC;HPr:热稳定性组氨酸磷酸化蛋白heat-stable, histidine-phosphoryl protein;G-6-P:葡萄糖-6-磷酸glucose 6-phosphate;FBP:果糖1,6-二磷酸fructose-1,6-diphosphate;PEP:磷酸烯醇式丙酮酸phosphoenolpyruvate;CcpA:分解代谢物控制蛋白A catabolite control protein A; LDH:乳酸脱氢酶基因lactic dehydrogenase gene;PFL:丙酮酸甲酸裂解酶基因pyruvate formate-lyase gene;PFK:磷酸果糖激酶基因phosphofructokinase gene;PYK:丙酮酸激酶基因pyruvate kinase gene;GAPDH:甘油醛-3-磷酸脱氢酶基因glyceraldehyde 3-phosphatedehydrogenase gene;cre sequence:cre序列,本文指LDH、PFL、PFK、PYK、GAPDH基因的cre序列in this paper, it was the cre sequence of LDH, PFL, PFK, PYK and GAPDH genes。 图 1 S. bovis中CcpA与PTS的作用机制 Fig. 1 Mechanism of action between CcpA and PTS in S. bovis[5-15] |
有学者发现,PTS不仅具有运输功能,同时还可以调控代谢。HPr有2个磷酸化位点——组氨酸残基和丝氨酸残基。在PTS中,在HPr激酶等催化下,EⅡ也可将磷酸基团传递到该蛋白的46号丝氨酸残基,形成丝氨酰磷酸化HPr(HPr-[Ser-P])[12]。CcpA一般与HPr-[Ser-P]复合体结合,然后与相关基因的特定序列(cre序列)结合并参与基因转录调控(图 1)[6]。另外,胞内的HPr激酶与磷酸酯酶的比例(HPr kinase/phosphoesterase,HPrK/P)受胞内ATP/Pi以及糖酵解中的果糖1, 6-二磷酸(fructose-1,6-diphosphate, FBP)、G-6-P等水平的影响(图 1)[14-15]。
2 CcpA参与的碳分解代谢物阻遏(carbon catabolite repression,CCR)/碳分解代谢激活(carbon catabolite activation,CCA)效应CCR是在1942年由Jacques Monod等发现的,他们观察到用葡萄糖和半乳糖混合培养的大肠杆菌会优先利用葡萄糖,葡萄糖耗尽后再利用半乳糖,出现二次生长的现象[16]。这种现象的产生就是CCR效应的作用——被不同碳源培养的微生物会优先利用速效碳源,同时其代谢物会抑制与其他碳源代谢相关联的基因的表达以及蛋白质的活性,从而阻碍微生物对非速效碳源的利用[16]。日本学者Asanuma等[6]同样发现在S. bovis中也存在这种效应,他们利用葡萄糖和乳糖共同培养细菌,也观察到二次生长的现象。
研究表明,不同的微生物,其介导CCR效应的调控蛋白也有差异,在GC含量较低的革兰氏阳性细菌中,效应关键调控因子为CcpA。CcpA属于Lacl/GalR家族的转录调控蛋白,是一种反式作用因子和DNA捆绑式调节蛋白[17-18]。CcpA通过与非速效碳源代谢相关基因的cre序列结合,抑制其他相关基因的表达,即产生CCR效应[19]。
除此之外,CcpA还可以促进基因的表达。一般情况下,CcpA是激发CCR效应还是CCA效应,取决于cre序列在基因上的不同位置。若cre序列在基因的启动子区内或在编码框内时,一般抑制该基因的表达,造成CCR效应;而在启动子上游时,一般引发CCA效应[5]。
3 CcpA对S. bovis碳水化合物代谢中关键酶的调控作用S. bovis中的碳水化合物代谢为葡萄糖后,一般首先进行糖酵解过程,其酵解产物为丙酮酸。而S. bovis摄取的丙酮酸可被不同的代谢酶作用生成不同的产物。丙酮酸的代谢通路有以下几条:1)丙酮酸在LDH的作用下生成乳酸;2)丙酮酸可被PFL代谢为甲酸;3)在丙酮酸脱羧酶及乙醇脱氢酶作用下,丙酮酸生成乙醇;4)丙酮酸也可转化为乙酰辅酶A(CoA)后生成乙醇,与草酰乙酸生成柠檬酸进入生物合成,糖酵解途径中的PEP可被磷酸烯醇式丙酮酸羧化酶(PCK)代谢生成草酰乙酸[20]。
3.1 对LDH的调控LDH是S. bovis中乳酸产生途径中的主要代谢酶[21]。Bogaard等[22]和Luesink等[23]均发现在与S. bovis同样是革兰氏阳性菌的嗜热链球菌(Streptococcus thermophilus)和乳酸乳球菌(Lactococcus lactis)中,其编码基因LDH的转录受CcpA的调控。
Asanuma等[6]接着证实了S. bovis的LDH上部区域同样存在cre序列(图 2-a),同时发现生长在葡萄糖培养基中的突变菌的LDH mRNA水平和LDH活性是同样环境培养的野生菌的1/2,而恢复突变后的细菌又出现了和野生菌一致的mRNA水平与活性,结果证明了在S. bovis中CcpA能够正向调节LDH的转录;但是生长在乳糖培养基中的CcpA缺失菌LDH mRNA水平和LDH活性与野生菌都没有显著差异,说明在乳糖上生长时CcpA并不会增强LDH的转录,可能与碳源类型的利用有关。
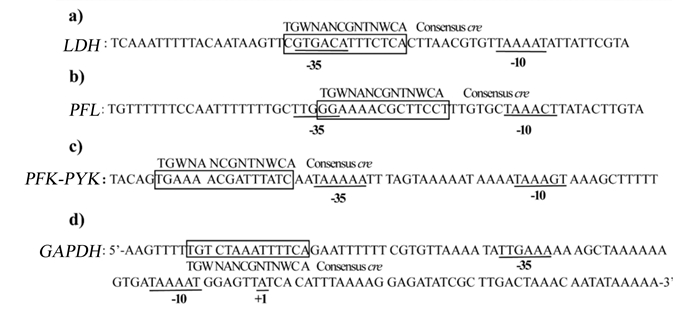
|
LDH:乳酸脱氢酶基因lactic dehydrogenase gene;PFL:丙酮酸甲酸裂解酶基因pyruvate formate-lyase gene;PFK:磷酸果糖激酶基因phosphofructokinase gene;PYK:丙酮酸激酶基因pyruvate kinase gene;GAPDH:甘油醛-3-磷酸脱氢酶基因glyceraldehyde 3-phosphatedehydrogenase gene;Consensus cre:基因共有的cre序列;A:腺嘌呤adenine;G:鸟嘌呤guanine;T:胸腺嘧啶thymine;C:胞嘧啶cytosine;W:腺嘌呤或者胸腺嘧啶adenine or thymine;N:任何碱基any nucleobase;文字框内序列表示cre序列the sequence in the text box represents the cre sequence;横线和数字表示基因序列上的相对位置the horizontal lines and numbers represent the relative positions in the gene sequence。 图 2 cre序列在不同编码酶基因中的位置 Fig. 2 Position of cre sequence in different coding enzyme genes[6-8] |
有研究分离出了PFL和PFL激活酶(PFL-AE),并研究S. bovis中PFL的酶系统,发现S. bovis中PFL和PFL-AE与大肠杆菌中的相似,表明其激活机制相似[24]。不同生长条件下发酵产物中乳酸盐的含量不同,乳酸盐的含量取决于LDH和PFL的相对活性[25]。因此,PFL对S. bovis碳水化合物代谢具有重要作用。
有学者发现,基因PFL的上部区域同样存在cre序列(图 2-b)[8]。由CcpA和HPr-[Ser-P]组成的复合物可能与PFL上区cre序列结合,抑制了PFL的转录。研究人员发现用乳糖培养S. bovis野生菌的PFL mRNA水平比葡萄糖培养的高3.6倍,并且发现在葡糖糖和乳糖培养基中,敲除CCPA的突变菌PFL mRNA水平均有不同程度地提高,尤其是在葡萄糖中培养的突变菌,其mRNA水平和活性分别是同环境下野生菌的9.4和7.6倍,说明S. bovis中PFL的转录被CcpA抑制[6]。
3.3 对PFK和PYK的调控PYK可将PEP和二磷酸腺苷(ADP)转化为丙酮酸和三磷酸腺苷(ATP),被认为可以控制某些菌的糖酵解通量。也有报道称,PFK是某些菌糖酵解通量的一个更为重要的控制点[26-27]。
相关研究发现在S. bovis中分别编码PFK、PYK 2个基因共转录。PYK和PFK的合成是通过CcpA在转录水平上对碳水化合物进行调节完成的。在PFK起始密码子上游97 bp发现与CcpA结合的cre结合位点(图 2-c),并且CcpA可增强PFK-PYK的转录。研究发现,在葡萄糖培养基中培养的S. bovis突变菌的PYK mRNA水平是野生菌的60%。但是在乳糖培养基中培养的CCPA突变菌的PYK mRNA水平比野生菌高1.4倍,说明除CcpA外可能还有其他转录因子参与PYK和PFK转录[7]。
然而,尽管PFK和PYK是共转录的,但PFK和PYK在葡萄糖和乳糖培养细胞中的活性存在显著差异。这种差异可能是翻译效率或者酶的稳定性不同等原因导致的。另外,在同样是低GC革兰氏阳性菌干酪乳杆菌(Lactobacillus casei)中,PFK和PYK活性与PFK-PYK转录也不成比例,这种现象的产生可能是由于翻译或翻译后的调节机制不同造成的[28]。
3.4 对GAPDH的调控在S. bovis中GAPDH需要烟酰胺腺嘌呤二核苷磷酸(NADP+)才能发挥作用,但没有其他还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)生成的途径(如己糖磷酸途径),因此GAPDH在NADPH产生中起着重要作用。研究发现大肠杆菌产生的重组S. bovis的GAPDH可以减少NADP+的产生。然而,当NADP+被烟酰胺腺嘌呤二核苷酸(NAD+)取代时,没有NAD+减少,这表明GAPDH特别需要NADP+,且GAPDH的活性不受磷酸盐的影响。S. bovis中GAPDH的这些性质与变形链球菌(Streptococcus mutans)中GAPDH相似[29]。
为了揭示GAPDH在S. bovis中的作用,Asanuma等[8]检测了编码GAPDH基因的分子特性和转录调控,验证了GAPDH基因以单顺反子方式转录,GAPDH的合成在转录水平上受到调节,以响应生长条件的变化;研究证明了cre结合位点的存在,他们在GAPDH转录起始位点上游56 bp处发现了1个cre的序列(图 2-d)。
研究结果显示,葡萄糖培养的CcpA突变菌的GAPDH mRNA水平为野生菌的1/2,说明S. bovis的CcpA可促进GAPDH基因的转录[8]。Crow等[29]研究发现在葡萄糖过剩的情况下,GAPDH活性似乎不会改变糖酵解途径中的通量。GAPDH活性可能高到足以满足对NADPH的需求,GAPDH活性不太可能影响糖酵解途径中的代谢流动。
4 小结S. bovis与瘤胃乳酸中毒关系密切,对该菌的碳水化合物代谢路径及调控的研究,一定程度上可揭示瘤胃中S. bovis的代谢规律,对解析瘤胃乳酸中毒具有重要意义。当前研究已初步表明了CcpA与PTS的作用关系以及对LDH、PFL、PYK、PFK、GAPDH等重要代谢酶的调控,但是在转录水平对S. bovis的碳水化合物调控研究仍处于浅层次、初阶段,多数研究只是针对单一编码酶的基因转录变化,缺乏对代谢通路的系统性研究、验证。在以后的研究中,一方面,可以借助代谢组学、转录组学、微生物组学等技术手段,系统地揭示CcpA对S. bovis碳水化合物的代谢规律;另一方面,在瘤胃酸中毒环境条件下,通过改造与重建CcpA,进一步研究其对S. bovis代谢产酸模式的调控,为防控瘤胃乳酸中毒提供新思路和新方法。
| [1] |
RUSSELL J B, HINO T. Regulation of lactate production in Streptococcus bovis:a spiraling effect that contributes to rumen acidosis[J]. Journal of Dairy Science, 1985, 68(7): 1712-1721. DOI:10.3168/jds.S0022-0302(85)81017-1 |
| [2] |
WANG H R, PAN X H, WANG C, et al. Effects of different dietary concentrate to forage ratio and thiamine supplementation on the rumen fermentation and ruminal bacterial community in dairy cows[J]. Animal Production Science, 2014, 55(2): 189-193. |
| [3] |
LETTAT A, NOZIÈRE P, SILBERBERG M, et al. Rumen microbial and fermentation characteristics are affected differently by bacterial probiotic supplementation during induced lactic and subacute acidosis in sheep[J]. BMC Microbiology, 2012, 12: 142. DOI:10.1186/1471-2180-12-142 |
| [4] |
CHAUVAUX S. CcpA and HPr(Ser-P):mediators of catabolite repression in Bacillus subtilis[J]. Research in Microbiology, 1996, 147(6/7): 518-522. |
| [5] |
吴艳, 顾阳, 任聪, 等. 微生物分解代谢物控制蛋白CcpA的研究进展[J]. 生命科学, 2011, 23(9): 882-890. |
| [6] |
ASANUMA N, YOSHⅡ T, HINO T. Molecular characterization of CcpA and involvement of this protein in transcriptional regulation of lactate dehydrogenase and pyruvate formate-lyase in the ruminal bacterium Streptococcus bovis[J]. Applied and Environmental Microbiology, 2004, 70(9): 5244-5251. DOI:10.1128/AEM.70.9.5244-5251.2004 |
| [7] |
ASANUMA N, KANADA K, HINO T. Molecular properties and transcriptional control of the phosphofructokinase and pyruvate kinase genes in a ruminal bacterium, Streptococcus bovis[J]. Anaerobe, 2008, 14(4): 237-241. DOI:10.1016/j.anaerobe.2008.05.004 |
| [8] |
ASANUMA N, HINO T. Presence of NADP+-specific glyceraldehyde-3-phosphate dehydrogenase and CcpA-dependent transcription of its gene in the ruminal bacterium Streptococcus bovis[J]. FEMS Microbiology Letters, 2006, 257(1): 17-23. DOI:10.1111/j.1574-6968.2006.00111.x |
| [9] |
RUSSELL J B. Low-affinity, high-capacity system of glucose transport in the ruminal bacterium Streptococcus bovis:evidence for a mechanism of facilitated diffusion[J]. Applied and Environmental Microbiology, 1990, 56(11): 3304-3307. DOI:10.1128/AEM.56.11.3304-3307.1990 |
| [10] |
VADEBONCOEUR C, PELLETIER M. The phosphoenolpyruvate:sugar phosphotransferase system of oral Streptococci and its role in the control of sugar metabolism[J]. FEMS Microbiology Reviews, 1997, 19(3): 187-207. DOI:10.1111/j.1574-6976.1997.tb00297.x |
| [11] |
KOTRBA P, INUI M, YUKAWA H. Bacterial phosphotransferase system (PTS) in carbohydrate uptake and control of carbon metabolism[J]. Journal of Bioscience and Bioengineering, 2001, 92(6): 502-517. DOI:10.1016/S1389-1723(01)80308-X |
| [12] |
DEUTSCHER J, KVSTER E, BERGSTEDT U, et al. Protein kinase-dependent HPr/CcpA interaction links glycolytic activity to carbon catabolite repression in gram-positive bacteria[J]. Molecular Microbiology, 1995, 15(6): 1049-1053. DOI:10.1111/j.1365-2958.1995.tb02280.x |
| [13] |
POSTMA P W, LENGELER J W, JACOBSON G R. Phosphoenolpyruvate:carbohydrate phosphotransferase systems of bacteria[J]. Microbiology Reviews, 1993, 57(3): 543-594. DOI:10.1128/MMBR.57.3.543-594.1993 |
| [14] |
ASANUMA N, HINO T. Molecular characterization of HPr and related enzymes, and regulation of HPr phosphorylation in the ruminal bacterium Streptococcus bovis[J]. Archives of Microbiology, 2003, 179(3): 205-213. DOI:10.1007/s00203-003-0516-9 |
| [15] |
SCHUMACHER M A, SEIDEL G, HILLEN W, et al. Structural mechanism for the fine-tuning of CcpA function by the small molecule effectors glucose 6-phosphate and fructose 1, 6-bisphosphate[J]. Journal of Molecular Biology, 2007, 368(4): 1042-1050. |
| [16] |
BORIS M. Catabolite repression[J]. Cold Spring Harbor Symposia on Quantitaive Biology, 1961, 26: 249-256. DOI:10.1101/SQB.1961.026.01.031 |
| [17] |
HENKIN T M, GRUNDY F J, NICHOLSON W L, et al. Catabolite repression of alpha-amylase gene expression in Bacillus subtilis involves a trans-acting gene product homologous to the Escherichia coli lacl and galR repressors[J]. Molecular Microbiology, 1991, 5(3): 575-584. DOI:10.1111/j.1365-2958.1991.tb00728.x |
| [18] |
HUECK C J, HILLEN W. Catabolite repression in Bacillus subtilis:a global regulatory mechanism for the gram-positive bacteria?[J]. Molecular Microbiology, 1995, 15(3): 395-401. DOI:10.1111/j.1365-2958.1995.tb02252.x |
| [19] |
JONES B E, DOSSONNET V, KVSTER E, et al. Binding of the catabolite repressor protein CcpA to its DNA target is regulated by phosphorylation of its corepressor HPr[J]. Journal of Biological Chemistry, 1997, 272(42): 26530-26535. DOI:10.1074/jbc.272.42.26530 |
| [20] |
陈连民, 沈宜钊, 王洪荣. 牛链球菌在瘤胃中产酸的代谢机制及调控[J]. 动物营养学报, 2016, 28(3): 665-673. DOI:10.3969/j.issn.1006-267x.2016.03.005 |
| [21] |
WYCKOFF H A, CHOW J, WHITEHEAD T R, et al. Cloning, sequence, and expression of the L-(+) lactate dehydrogenase of Streptococcus bovis[J]. Current Microbiology, 1997, 34(6): 367-373. DOI:10.1007/s002849900197 |
| [22] |
VAN DEN BOGAARD P T C, KLEEREBEZEM M, KUIPERS O P, et al. Control of lactose transport, β-galactosidase activity, and glycolysis by CcpA in Streptococcus thermophilus:evidence for carbon catabolite repression by a non-phosphoenolpyruvate-dependent phosphotransferase system sugar[J]. Journal of Bacteriology, 2000, 182(21): 5982-5989. DOI:10.1128/JB.182.21.5982-5989.2000 |
| [23] |
LUESINK E J, VAN HERPEN R E M A, GROSSIORD B P, et al. Transcriptional activation of the glycolytic las operon and catabolite repression of the gal operon in Lactococcus lactis are mediated by the catabolite control protein CcpA[J]. Molecular Microbiology, 1998, 30(4): 789-798. DOI:10.1046/j.1365-2958.1998.01111.x |
| [24] |
ASANUMA N, HINO T. Effects of pH and energy supply on activity and amount of pyruvate formate-lyase in Streptococcus bovis[J]. Applied and Environmental Microbiology, 2000, 66(9): 3773-3777. DOI:10.1128/AEM.66.9.3773-3777.2000 |
| [25] |
ASANUMA N, IWAMOTO M, HINO T. Structure and transcriptional regulation of the gene encoding pyruvate formate-lyase of a ruminal bacterium, Streptococcus bovis[J]. Microbiology, 1999, 145(1): 151-157. |
| [26] |
KANDLER O. Carbohydrate metabolism in lactic acid bacteria[J]. Antonie van Leeuwenhoek, 1983, 49(3): 209-224. DOI:10.1007/BF00399499 |
| [27] |
FRAENKEL D G. Genetics and intermediary metabolism[J]. Annual Review of Genetics, 1992, 26: 159-177. DOI:10.1146/annurev.ge.26.120192.001111 |
| [28] |
VIANA R, PÉREZ-MARTÍNEZ G, DEUTSCHER J, et al. The glycolytic genes pfk and pyk from Lactobacillus casei are induced by sugars transported by the phosphoenolpyruvate:sugar phosphotransferase system and repressed by CcpA[J]. Archives of Microbiology, 2005, 183(6): 385-393. DOI:10.1007/s00203-005-0003-6 |
| [29] |
CROW V L, WITTENBERGER C L. Separation and properties of NAD+-and NADP+-dependent glyceraldehyde-3-phosphate dehydrogenases from Streptococcus mutans[J]. The Journal of Biological Chemistry, 1979, 254(4): 1134-1142. |




