现代化的集约饲养过程中,常常给予反刍动物大量的高淀粉谷物饲料,以期在短期内获得最大的经济效益。但这种饲喂方式在提高动物生产水平的同时,也增加了代谢性疾病的发生风险。瘤胃酸中毒作为一种常见的反刍动物营养代谢性疾病,已经制约了当前反刍动物生产的发展。关于瘤胃酸中毒发生机制的探讨目前仍存在争议,其中乳酸中毒学说目前得到大多数学者的认同,该学说认为瘤胃中乳酸代谢菌群失衡,致使乳酸在瘤胃中大量蓄积,引起瘤胃的酸度降低,从而破坏上皮结构完整性以及抑制微生物生长,并影响宿主代谢机能的正常进行,是造成瘤胃酸中毒的根本原因[1]。瘤胃中的乳酸主要由以饲粮中淀粉为底物的乳酸利用菌代谢产生,正常的生理条件下,这些乳酸并不会在瘤胃中大量蓄积,其中的大部分会被瘤胃内的乳酸利用菌代谢分解,从而维持瘤胃内环境的相对稳定;还有部分乳酸会经由食糜进入后消化道吸收;此外,乳酸还能经由瘤胃上皮吸收进入血液再经肝脏氧化或肾脏排出体外。当血液中的乳酸浓度超过机体的排除能力,动物就可能发生酸中毒。因此,了解瘤胃中乳酸的代谢过程对于调控瘤胃酸中毒的发生发展具有重要的意义。
1 瘤胃上皮对乳酸的吸收目前对于发生瘤胃酸中毒时,瘤胃内的乳酸浓度并没有准确的定义,但Owens等[2]指出当瘤胃内乳酸浓度高于40 mmol/L时,机体表现出严重的酸中毒现象。Møller等[3]使用尤斯灌流室研究2~20 mmol/L乳酸浓度下瘤胃上皮的吸收速率,发现吸收速速率与乳酸浓度呈正相关,表明瘤胃吸收乳酸可能是以被动转运的形式进行的。有研究表明,瘤胃中的低pH会降低乳酸在瘤胃上皮的吸收速率,这可能与瘤胃中短链脂肪酸(short chain fatty acid,SCFA)和乳酸同时存在时,SCFA导致瘤胃乳酸吸收速率下降有关[4]。此外,瘤胃中的乳酸存在D、L 2种不同的构型,正常生理条件下L-乳酸的浓度较高,但当饲喂反刍动物大量精料时,D-乳酸浓度逐渐增加,直至与L-乳酸浓度相似[5-6]。D-乳酸可以在瘤胃中被上皮细胞吸收,且当添加5 mmol/L时对于上皮细胞的角化无影响[7-8]。而反刍动物瘤胃上皮细胞角化不全通常是由采食大量的精料造成的,瘤胃内较低浓度的D-乳酸(< 5 mmol/L)并不会对机体造成影响,但随着D-乳酸的不断蓄积,由于动物体内缺乏D-乳酸脱氢酶,D-乳酸的代谢速度较L-乳酸低,且体内L-乳酸的代谢产物可造成D-乳酸的代谢抑制,因此D-乳酸较L-乳酸更易造成瘤胃中乳酸的蓄积[5]。
2 乳酸转运相关蛋白 2.1 单羧酸转运蛋白(monocarboxylate transporters,MCTs)在瘤胃中,单羧酸的存在方式为质子形式和酸根形式,而前者具有亲脂性,可以直接渗透细胞膜完成转运过程。在早期的研究中认为单羧酸在上皮细胞的转运是通过自由扩散实现的,但Halestrap等[9]在人类红细胞上的研究显示L-乳酸及丙酮酸的转运可以被α-氰基-4-羟基肉桂酸酯特异性的抑制,提示存在一种特殊的转运体来介导二者的转运。后经不断的研究,证明了这种转运蛋白的存在,并在多种细胞中得到了广泛的表征。此外,根据Henderson-Hasselbalch方程可以得知乳酸在瘤胃内大多是以解离形式存在的,因此必须依靠蛋白介导才能完成乳酸的跨膜转运。MCTs在哺乳动物体内具有14个亚型,已经证明的负责乳酸转运的蛋白包括MCT1、MCT2、MCT3、MCT4,其在组织内的分布与转运底物如表 1所示[10]。其中MCT3在瘤胃内的基因表达水平较低,因此瘤胃内的乳酸转运主要依靠MCT1、MCT2与MCT4进行的。
|
|
表 1 乳酸转运蛋白 Table 1 Protein-linked lactate acid transporter |
MCT1在红细胞与非洲爪蟾卵母细胞中最先被表征出来,主要负责体内单羧酸盐的转运。MCT1对乳酸的转运具有选择性,其中L-乳酸更易于蛋白结合进行跨膜转运。Ritzhaupt等[17]在研究猪和人的大肠中MCT1时发现,其参与丁酸盐及L-乳酸在结肠肠腔的转运。Müller等[18]在研究MCT1转运功能时发现,利用L-乳酸诱导绵羊瘤胃上皮细胞酸化后,添加抑制剂可以降低细胞酸化速度和恢复速度,可知MCT1在瘤胃上皮顶端及基底膜上都进行表达,但对于清除细胞内堆积的乳酸过程中似乎发挥着更为重要的作用,研究同样暗示了乳酸在细胞膜两侧的跨膜转运是双向进行的,但这一过程取决于细胞内外进出乳酸和质子的细胞内外浓度。瘤胃上皮细胞由内腔向外依次为角质层、颗粒层、棘突层、基底层,Kirat等[19]发现MCT1广泛的存在于瘤胃上皮基底层中,且MCT1促进单羧酸及酮体通过上皮向血液侧转运。MCT1正常功能的发挥必须依靠辅助蛋白basigin(CD147)的帮助才能实现,而在瘤胃上皮细胞中MCT1与CD147都集中在基底层中,且CD147主要参与MCT1与细胞膜的连接[20]。这进一步表明了相较于吸收乳酸进入细胞而言,MCT1在缓解细胞内乳酸堆积中发挥着更为重要的作用。
2.1.2 MCT2MCT2也需要辅助蛋白的存在才能发挥正常的功能,但不同于MCT1,MCT2完全依赖于embigin的存在,因此MCT1的抑制剂——对氯汞苯磺酸并不会对MCT2产生影响[21]。Graham等[22]通过研究MCTs在瘤胃上皮的定位与表达时,发现与MCT1相比,MCT2免疫染色在除角质层外的上皮细胞层中都很弱并且弥散。与此同时,Kirat等[10]发现瘤胃中MCT2主要定位于基底层和棘层,并且在颗粒层的一些细胞上也发现了微弱的MCT2阳性染色,但角质层中未见MCT2反应。但Koho等[23]利用Western Blot技术并未发现同样作为反刍动物的驯鹿的瘤胃内存在MCT2蛋白表达。刘军花等[24]发现,在高谷物饲粮饲养条件下,瘤胃内MCT2的基因表达并无显著差异。这似乎表明MCT2在作为瘤胃上皮的单羧酸转运中并不起主导作用。但Ma等[25]发现,当饲粮中中性洗涤纤维/淀粉(NDF/starch)升高时,瘤胃内MCT2的基因表达量会相应的增加,这可能与饲粮中NDF的比例升高使瘤胃上皮细胞的棘层与基底层的厚度增加有关。虽然MCT2在瘤胃中呈弱分布,但研究表明MCT2与MCT1具有相似的转运底物类型,且对于大部分底物而言,MCT2的亲和力要高于MCT1,因此,MCT2在瘤胃的乳酸转运中也具有重要的意义,但关于MCT2在瘤胃中的报道并不多见,有待进一步的探索。
2.1.3 MCT4大量研究表明,MCT4可以在组织中被广泛的表征出来,特别是一些与糖酵解和高效输出乳酸有关的细胞。当这些细胞进行高效的酵解活动时,经常产生大量的乳酸,此时MCT4起到最为主要的乳酸转运功能,以避免细胞遭受酸化的风险。Kirat等[16]首次对反刍动物胃肠道中的MCT4进行了精准定位,指出前胃中的MCT4蛋白表达量最高,同时免疫组织化学和免疫荧光共聚焦激光显微镜显示,前胃中的MCT4主要存在于颗粒层中,而在棘层和基底层中弥散可见。另一项研究也指出,MCT4在层状鳞状上皮细胞颗粒层细胞膜上表达,在棘层和基底层细胞胞浆中弥散,且角质层未见染色[10]。上述的研究表明,MCT4可能在上皮顶膜和基底外侧膜的乳酸转运中发挥着作用。Yan等[26]发现饲粮中精料水平的增加将促进山羊瘤胃内MCT4的表达增加,这与刘军花等[24]的结果不一致,可能是由于试验中的精料供给水平不同造成的,当饲喂大量精料时会致使瘤胃内颗粒层数量的下降由此影响MCT4的表达。作为瘤胃内另一个重要的乳酸转运蛋白,MCT4与MCT1一样需要辅助蛋白CD147的介导才能发挥作用。Kirk等[27]利用免疫共沉淀技术证明了MCT4与CD147特异性的结合在一起,而这种结合对于促进MCT4在细胞表面的正确表达方面起重要作用。上述研究表明,MCT4在介导瘤胃内的乳酸进入上皮细胞的过程中发挥着重要的作用。
2.2 钠离子偶联单羧酸转运蛋白(sodium-coupled monocarboxylate transporter,SMCTs)研究表明,SMCTs也参与体内乳酸的转运。SMCTs与MCTs具有相似的底物特异性,但两者底物的转运过程却截然不同。前者通过氢离子偶联的方式完成跨膜转运过程,其中氢离子与单羧酸根的化学计量数之比为1 : 1,整个转运过程呈电中性;而SMCTs的转运必须依靠Na+的介导[28]。SMCTs具有2个亚型,分别为SMCT1与SMCT2,前者是生电性的转运蛋白,而后者呈电中性,二者Na+与乳酸根的化学计量数之比分别为2 : 1和1 : 1。研究发现,SMCT2的底物亲和力远低于SMCT1,且SMCT1转运乳酸时具有选择性,L-乳酸的亲和力显著高于D-乳酸[29]。不同于MCTs的广泛分布,SMCTs在反刍动物瘤胃内大量存在且主要集中于顶膜侧,主要负责吸收瘤胃中的乳酸进入细胞,当发生亚急性瘤胃酸中毒时,SMCT1的表达受到抑制,转运能力降低,从而加剧了瘤胃的单羧酸的蓄积[30]。
3 小结瘤胃内乳酸代谢研究对于反刍动物的健康具有重要的意义。一方面,乳酸的低电离常数(pKa,为3.85)对于瘤胃pH的影响要大于挥发性脂肪酸(pKa为4.8),因此乳酸是造成酸中毒的主要原因;另一方面,乳酸又是维持与判断瘤胃内乳酸代谢菌群稳定的重要参考指标。已有的研究表明,通过调控瘤胃内的细菌来控制乳酸的丰度是一个切实有效的手段,此外瘤胃上皮是否也能对乳酸进行代谢调控一直是我们所关注的重点。早期的研究发现瘤胃上皮可以对乳酸进行吸收,并且这一过程与瘤胃内环境密切相关,随着研究的深入,单羧酸转运蛋白在反刍动物体内得到表征,为探讨乳酸转运机制的研究提供了方向。现有的结果显示乳酸在瘤胃内的转运主要涉及4种转运蛋白:MCT1、MCT2、MCT4以及SMCT1。值得注意的是在过往的反刍动物单羧酸盐转运过程研究中前3种转运体经常被提及,而作为钠离子偶联的单羧酸转运体在近期的研究才得到重视,并在反刍动物瘤胃内得到表征。因此,我们推测瘤胃内乳酸转运的过程如图 1所示,这为进一步研究瘤胃上皮细胞是否具有代谢乳酸能力提供了重要的理论依据。
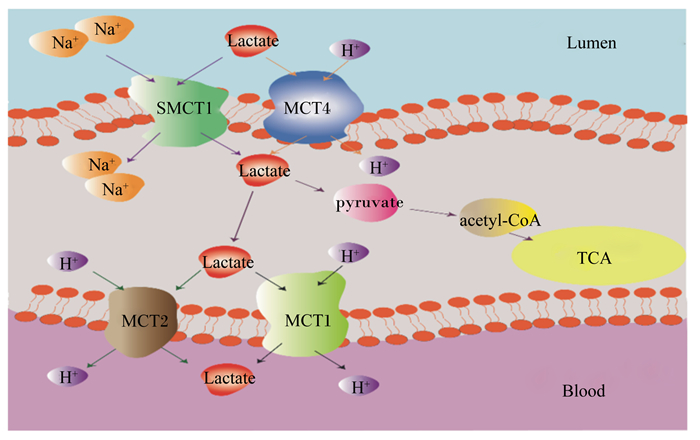
|
Na+:钠离子;H+:氢离子;Lactate:乳酸;pyruvate:丙酮酸;acetyl-CoA:乙酰辅酶A;lumen:肠腔;blood:血液;SMCT1:钠离子偶联单羧酸转运蛋白1 sodium-coupled monocarboxylate transporter 1;MCT4:单羧酸转运蛋白4 monocarboxylate transporters 4;MCT1:单羧酸转运蛋白1 monocarboxylate transporters 1;MCT2:单羧酸转运蛋白2 monocarboxylate transporters 2;TCA:三羧酸循环tricarboxylic acid cycle。 图 1 瘤胃内的乳酸转运过程 Fig. 1 Lactic acid transport in rumen[10-11, 16, 30] |
| [1] |
ENEMARK J M D, JORGENSEN R J, ST ENEMARK P. Rumen acidosis with special emphasis on diagnostic aspects of subclinical rumen acidosis:a review[J]. Veterinarija ir Zootechnika, 2002, 20(42): 16-29. |
| [2] |
OWENS F N, SECRIST D S, HILL W J, et al. Acidosis in cattle:a review[J]. Journal of Animal Science, 1998, 76(1): 275-286. DOI:10.2527/1998.761275x |
| [3] |
M∅LLER P D, DIERNAES L, SEHESTED J, et al. Absorption and fate of L- and D-lactic acid in ruminants[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1997, 118(2): 387-388. DOI:10.1016/S0300-9629(96)00325-8 |
| [4] |
WILLIAMS V J, MACKENZIE D D S. The absorption of lactic acid from the reticulo-rumen of the sheep[J]. Australian Journal of Biological Sciences, 1965, 18(4): 917-934. DOI:10.1071/BI9650917 |
| [5] |
DUNLOP R H, HAMMOND P B. D-lactic acidosis of ruminants[J]. Annals of the New York Academy of Science, 1965, 119(3): 1109-1132. |
| [6] |
HUNTINGTON G B, BRITTON R A. Effect of dietary lactic acid on rumen lactate metabolism and blood acid-base status of lambs switched from low to high concentrate diets[J]. Journal of Animal Science, 1979, 49(6): 1569-1576. DOI:10.2527/jas1979.4961569x |
| [7] |
PRESTON A M, NOLLER C H. Metabolism of D-lactate by tissues of the ruminant digestive tract[J]. Journal of Animal Science, 1973, 37(6): 1403-1407. DOI:10.2527/jas1973.3761403x |
| [8] |
GÁLFI P, NEOGRÁDY S, KUTAS F, et al. Keratinization of cultured ruminal epithelial cells treated with butyrate and lactate[J]. Zentralblatt für Veterinärmedizin Reihe A, 1983, 30(10): 775-781. |
| [9] |
HALESTRAP A P, DENTON R M. Specific inhibition of pyruvate transport in rat liver mitochondria and human erythrocytes by α-cyano-4-hydroxycinnamate (short communication)[J]. Biochemical Journal, 1974, 138(2): 313-316. |
| [10] |
KIRAT D, SALLAM K I, KATO S. Expression and cellular localization of monocarboxylate transporters (MCT2, MCT7, and MCT8) along the cattle gastrointestinal tract[J]. Cell and Tissue Research, 2013, 352(3): 585-598. DOI:10.1007/s00441-013-1570-5 |
| [11] |
HALESTRAP A P. Monocarboxylic acid transport[J]. Comperhensive Physiology, 2011, 3(4): 1611-1643. |
| [12] |
POOLE R C, HALESTRAP A P. Transport of lactate and other monocarboxylates across mammalian plasma membranes[J]. American Journal of Physiology, 1993, 264(1): 761-782. |
| [13] |
GRAHAM C, GATHERAR I, HASLAM I, et al. Expression and localization of monocarboxylate transporters and sodium/proton exchangers in bovine rumen epithelium[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2007, 292(2): R997-R1007. DOI:10.1152/ajpregu.00343.2006 |
| [14] |
GARCIA C K, BROWN M S, PATHAK R K, et al. cDNA cloning of MCT2, a second monocarboxylate transporter expressed in different cells than MCT1[J]. Journal of Biological Chemistry, 1995, 270(4): 1843-1849. DOI:10.1074/jbc.270.4.1843 |
| [15] |
YOON H, FANELLI A, GROLLMAN E F, et al. Identification of a unique monocarboxylate transporter (MCT3) in retinal pigment epithelium[J]. Biochemical and Biophysical Research Communications, 1997, 234(1): 90-94. DOI:10.1006/bbrc.1997.6588 |
| [16] |
KIRAT D, MATSUDA Y, YAMASHIKI N, et al. Expression, cellular localization, and functional role of monocarboxylate transporter 4 (MCT4) in the gastrointestinal tract of ruminants[J]. Gene, 2007, 391(1/2): 140-149. |
| [17] |
RITZHAUPT A, WOOD I S, ELLIS A, et al. Identification and characterization of a monocarboxylate transporter (MCT1) in pig and human colon:its potential to transport L-lactate as well as butyrate[J]. The Journal of Physiology, 1998, 513(3): 719-732. DOI:10.1111/j.1469-7793.1998.719ba.x |
| [18] |
MVLLER F, HUBER K, PFANNKUCHE H, et al. Transport of ketone bodies and lactate in the sheep ruminal epithelium by monocarboxylate transporter[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2002, 283(5): G1139-G1146. DOI:10.1152/ajpgi.00268.2001 |
| [19] |
KIRAT D, MASUOKA J, HAYASHI H, et al. Monocarboxylate transporter 1 (MCT1) plays a direct role in short-chain fatty acids absorption in caprine rumen[J]. Journal of Physiology, 2006, 576(2): 635-647. DOI:10.1113/jphysiol.2006.115931 |
| [20] |
MURAMATSU T, MIYAUCHI T. Basigin(CD147):a multifunctional transmembrane protein involved in reproduction, neural function, inflammation and tumor invasion[J]. Histology & Histopathology, 2003, 18(3): 981-987. |
| [21] |
OVENS M J, MANOHARAN C, WILSON M C, et al. The inhibition of monocarboxylate transporter 2 (MCT2) by AR-C155858 is modulated by the associated ancillary protein[J]. Biochemical Journal, 2010, 431(2): 217-225. DOI:10.1042/BJ20100890 |
| [22] |
GRAHAM C, GATHERAR I, HASLAM I, et al. Expression and localization of monocarboxylate transporters and sodium/proton exchangers in bovine rumen epithelium[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2007, 292(2): R997-R1007. DOI:10.1152/ajpregu.00343.2006 |
| [23] |
KOHO N, MAIJALA V, NORBERG H, et al. Expression of MCT1, MCT2 and MCT4 in the rumen, small intestine and liver of reindeer (Rangifer tarandus tarandus L.)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2005, 141(1): 29-34. |
| [24] |
刘军花, 朱伟云, 毛胜勇. 高谷物日粮促进山羊瘤胃上皮单羧酸转运蛋白1及钠钾ATP酶mRNA的表达[J]. 草业学报, 2017, 26(2): 95-101. |
| [25] |
MA L, ZHAO M, ZHAO L S, et al. Effects of dietary neutral detergent fiber and starch ratio on rumen epithelial cell morphological structure and gene expression in dairy cows[J]. Journal of Dairy Science, 2017, 100(5): 3705-3712. DOI:10.3168/jds.2016-11772 |
| [26] |
YAN L, ZHANG B, SHEN Z M. Dietary modulation of the expression of genes involved in short-chain fatty acid absorption in the rumen epithelium is related to short-chain fatty acid concentration and pH in the rumen of goats[J]. Journal of Dairy Science, 2014, 97(9): 5668-5675. DOI:10.3168/jds.2013-7807 |
| [27] |
KIRK P, WILSON M C, HEDDLE C, et al. CD147 is tightly associated with lactate transporters MCT1 and MCT4 and facilitates their cell surface expression[J]. The EMBO Journal, 2014, 19(15): 3896-3904. |
| [28] |
MIYAUCHI S, GOPAL E, FEI Y J, et al. Functional identification of SLC5A8, a tumor suppressor down-regulated in colon cancer, as a Na+-coupled transporter for short-chain fatty acids[J]. Journal of Biological Chemistry, 2004, 279(14): 13293-13296. DOI:10.1074/jbc.C400059200 |
| [29] |
SRINIVAS S R, GOPAL E L, ZHUANG L N, et al. Cloning and functional identification of slc5a12 as a sodium-coupled low-affinity transporter for monocarboxylates (SMCT2)[J]. Biochemical Journal, 2005, 392(3): 655-664. DOI:10.1042/BJ20050927 |
| [30] |
王亚洲.短链脂肪酸蓄积抑制SLC5A8和MCT1表达并加重亚急性瘤胃酸中毒[D].硕士学位论文.长春: 吉林大学, 2017.
|




