2. 北京黑六牧业科技有限公司, 北京 102211
2. Beijing Hei Liu Animal Husbandry Science and Technology Co., Ltd., Beijing 102211, China
动物肠道中栖息着数量庞大而复杂的微生物菌群,菌群变化会影响饲粮消化、营养物质吸收和能量供应,还会影响肠道内乳酸、短链脂肪酸等代谢产物的分泌与吸收,进而影响宿主健康和生长性能的发挥[1-3]。因此,研究动物肠道内菌群、乳酸和脂肪酸组成规律具有重要意义。饲粮中添加乳酸菌能促进肠道发育、调节肠道菌群结构、维持机体健康、提高生长性能[4-8]。李雪莉等[9]给断奶仔猪饲喂植物乳杆菌,提高了肠道中短链脂肪酸和乳酸含量,促进了肠道中乳酸杆菌的增殖,减少了大肠杆菌数量。张董燕等[10]在饲粮中添加卷曲乳杆菌,影响了生长猪粪便中菌群组成,增加了粪便中丁酸含量,改善了血清中不饱和脂肪酸组成。王四新等[11-12]在保育猪和育肥猪饲粮中添加干酪乳杆菌(Lactobacillus casei),显著提高了猪的生长速度和饲料转化率,育肥猪背最长肌中的肌内脂肪和不饱和脂肪酸含量有所提高,饱和脂肪酸含量有所下降。育肥阶段猪生长快,是形成肌肉和脂肪的重要阶段,而有关研究育肥猪肠道内菌群组成和脂肪酸含量的报道较少。在干酪乳杆菌可以提高育肥猪日增重和饲料转化率的情况下[12],本试验进一步分析了干酪乳杆菌对肠道消化物中菌群组成及乳酸、短链脂肪酸和长链脂肪酸含量的影响,旨在为乳酸菌在养殖生产中应用提供科学依据。
1 材料与方法 1.1 试验材料干酪乳杆菌ZLC018菌株为北京市农林科学院畜牧兽医研究所从健康猪肠道中分离得到的,经过体外试验证明其有益生特性,该菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.9041。干酪乳杆菌冻干制剂活菌数为2.0×1010 CFU/g。
1.2 试验设计和试验饲粮选用北京黑猪育肥猪120头,初始体重为(62.77±0.59) kg,随机分成2组,分别为对照组和干酪乳杆菌组,每组5个重复,每个重复12头(阉公猪与母猪各占1/2)。对照组饲喂基础饲粮(不添加抗生素和干酪乳杆菌),干酪乳杆菌组饲喂在基础饲粮中添加干酪乳杆菌有效活菌数为2.0×109 CFU/kg的试验饲粮。基础饲粮参照《猪饲养标准》(NY/T 65—2004)配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验在冬季进行,圈舍内温度12~18 ℃,相对湿度60%~70%,对照组和干酪乳杆菌组育肥猪饲养在同一猪舍,猪群自由采食,自由饮水,饲养管理按场内统一技术规程进行,试验期为42 d。
1.3 样品采集饲养试验结束时,对照组和干酪乳杆菌组各选取10头猪(每个重复2头,阉公猪和母猪各1头,平均体重为92 kg),禁食24 h后屠宰,分离空肠和结肠,采集空肠和结肠消化物于无菌冻存管中,-80 ℃保存,用于菌群组成及乳酸和脂肪酸含量的分析。
1.4 肠道微生物菌群分析采用E.Z.N.A. Stool DNA提取试剂盒(Omega Bio-tek, Norcross,美国)提取肠道消化物样品中细菌总DNA,具体提取步骤参照试剂盒说明书进行。对提取的总DNA进行纯化,用琼脂糖凝胶电泳检验总DNA浓度和纯度,-20 ℃冰箱保存备用。以提取的DNA为模板,PCR扩增细菌16S rRNA基因的V3~V4区。扩增体系:4 μL的5×FastPfu Buffer,2 μL的2.5 mmol/L dNTPs,各0.8 μL的上、下游引物(5 μmol/L),0.4 μL的FastPfu DNA Polymerase,10 ng的DNA模板,最终体积20 μL。采用细菌通用引物:338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR反应条件为:95 ℃变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,进行27个循环;72 ℃,延伸10 min。将纯化后的PCR产物在Illumina MiSeq PE300平台进行测序。
1.5 乳酸和脂肪酸含量测定乳酸含量测定:将肠道消化物样品解冻后取1 g,加入硫酸铜溶液(0.5 g/L)稀释定容至25 mL,用0.45 μm微孔滤膜过滤,为样品待测液。使用LC-1220安捷伦液相色谱仪对乳酸含量进行分析。色谱柱长15 cm,内径4.6 mm,流动相为0.5 g/L硫酸铜溶液,检测波长254 nm,柱温35 ℃,流速0.5 mL/min,进样量20 μL。
短链脂肪酸含量测定:将肠道消化物样品解冻后取1 g,加入3 mL硫酸溶液(50 mmol/L),4 ℃静置30 min,20 000×g离心10 min,取上清液为样品待测液。将上清液过滤到进样瓶中,使用GC-6890安捷伦气相色谱仪对短链脂肪酸含量进行分析。色谱柱长30 m,内径0.32 mm,膜厚度0.5 μm,进样器和探测器温度分别为260和280 ℃,载气为氦气,流速2.5 mL/min。
长链脂肪酸含量测定:参照《食品中脂肪酸的测定》(GB 5009.168—2016)中的水解-提取法,在肠道消化物样品中加入内标物十一碳酸甘油三酯内标溶液,试样经盐酸水解,乙醚溶液提取其中的脂肪后,在碱性条件下皂化和甲酯化,生成脂肪酸甲酯,使用GC-6890安捷伦气相色谱仪分析脂肪酸甲酯含量,依据各种脂肪酸甲酯含量和转换系数计算出长链脂肪酸含量。
1.6 数据统计分析对测序数据进行去杂、拼接,得到优化序列。对优化序列提取非重复序列,按照97%相似性对非重复序列(不含单序列)进行操作分类单元(OTU)聚类,在聚类过程中去除嵌合体,得到OTU的代表序列,将所有优化序列map至OTU代表序列,选出与OTU代表序列相似性在97%以上的序列,生成OTU表格。采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并分别在各个分类水平统计各样本的群落组成。比对数据库为细菌16S rRNA数据库。上述数据分析在美吉I-Sanger云平台上完成。
数据结果用平均值表示,数据处理与分析采用SPSS 19.0统计软件进行t检验,P<0.05为差异显著。
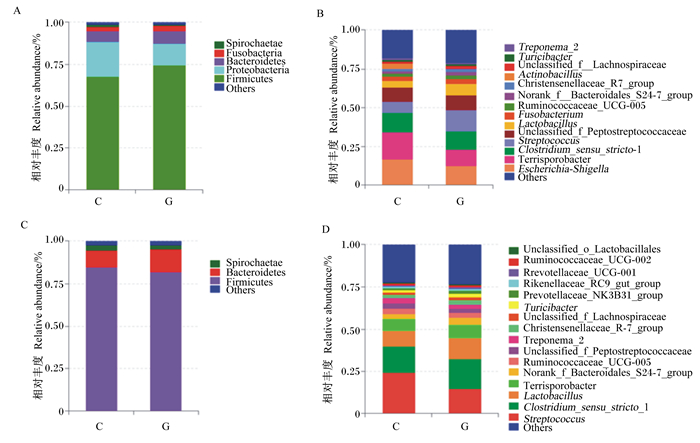
2 结果与分析 2.1 肠道消化物中菌群组成由图 1可知,育肥猪空肠消化物中的优势菌群为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)及Terrisporobacter、埃希氏菌属-志贺氏菌属(Escherichia-Shigella)和梭菌属_狭义_1(Clostridium_sensu_stricto_1)等;结肠消化物中的优势菌群为厚壁菌门、拟杆菌门及链球菌属(Streptococcus)、梭菌属_狭义_1和乳杆菌属(Lactobacillus)等。
|
Firmicutes:厚壁菌门;Proteobacteria:变形菌门;Bacteroidetes:拟杆菌门;Fusobacteria:梭杆菌门;Spirochaetae:螺旋菌门;Others:其他;Escherichia-Shigella:埃希氏菌属-志贺氏菌属;Clostridium_sensu_stricto_1:梭菌属_狭义_1;Streptococcus:链球菌属;Unclassified_f__Peptostreptococcaceae:未分类消化链球菌科;Lactobacillus:乳杆菌属;Fusobacterium:梭杆菌属;Ruminococcaceae_UCG-005:瘤胃菌科_UCG-005;Norank_f__Bacteroidales_S24-7_group:未标记拟杆菌目_S24-7_群;Actinobacillus:放线杆菌属;Unclassified_f_Lachnospiraceae:未分类毛螺旋菌科;Treponema_2:密螺旋体属_2;Turicibacter:苏黎世杆菌属;Prevotellaceae_NK3B31_group:普雷沃氏菌科_NK3B31_群;Rikenellaceae_RC9_gut_group:理研菌科_RC9_群;Prevotellaceae_UCG-001:普雷沃氏菌科_UCG-001;Ruminococcaceae_UCG-002:瘤胃菌科_UCG-002;Unclassified_o_Lactobacillales:未分类乳杆菌目;Others:其他。 图A、图B为空肠消化物中门和属水平;图C、图D为结肠消化物中门和属水平。4个图中,C为对照组,G为干酪乳杆菌组。 The figures A and B indicated the phylum and genus levels in jejunum digesta; figures C and D indicated the phylum and genus levels in colon digesta. In the 4 figures, C was control group, and G was Lactobacillus casei group. The same as below. 图 1 肠道消化物中优势菌群分布 Fig. 1 Distribution of dominant microbiota in intestinal digesta |
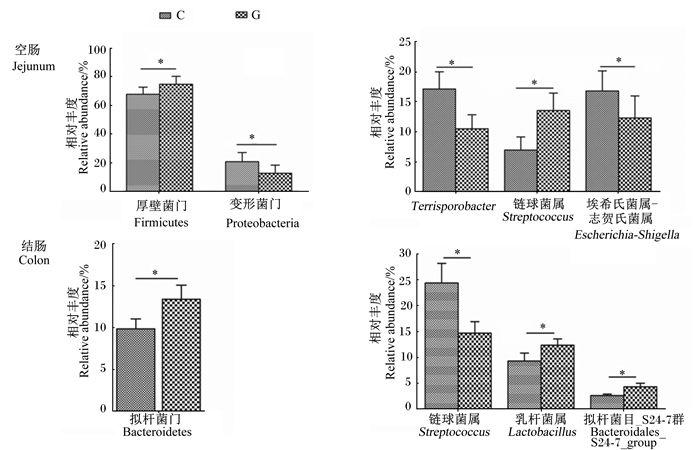
由图 2可知,饲粮中添加干酪乳杆菌后,育肥猪肠道菌群的相对丰度发生了变化。与对照组相比,空肠消化物中,干酪乳杆菌组厚壁菌门的相对丰度(67.71% vs. 74.65%)显著升高(P<0.05),变形菌门的相对丰度(20.75% vs. 12.75%)显著下降(P<0.05);链球菌属的相对丰度(6.94% vs. 13.53%)显著升高(P<0.05),埃希氏菌属-志贺氏菌属的相对丰度(16.80% vs. 12.31%)和Terrisporobacter的相对丰度(17.14% vs. 10.48%)显著下降(P<0.05)。结肠消化物中,干酪乳杆菌组拟杆菌门的相对丰度(9.87% vs. 13.39%)显著升高(P<0.05);乳杆菌属的相对丰度(9.29% vs. 12.34%)和未标记拟杆菌目_S24-7_群的相对丰度(2.62% vs. 4.31%)显著升高(P<0.05),链球菌属的相对丰度(24.34% vs. 14.69%)显著下降(P<0.05)。
|
*表示组间差异显著(P<0.05)。 * indicated significant difference between groups (P < 0.05). 图 2 肠道消化物中菌群变化 Fig. 2 Changes of microbiota in intestinal digesta |
由表 2可知,与对照组相比,干酪乳杆菌对空肠消化物中乳酸、甲酸、乙酸、丙酸和丁酸含量影响不显著(P>0.05);而在结肠消化物中,干酪乳杆菌组的乳酸含量显著降低(P<0.05),丁酸含量显著增加(P<0.05),其他短链脂肪酸含量差异不显著(P>0.05)。
|
|
表 2 育肥猪肠道消化物中乳酸和短链脂肪酸含量 Table 2 Contents of lactic acid and SCFAs in intestinal digesta of finishing pigs |
由表 3可知,饲粮中添加干酪乳杆菌,显著降低了育肥猪空肠消化物中山嵛酸和顺-15-二十四碳一烯酸含量(P<0.05),显著提高了二十二碳六烯酸和ω-3多不饱和脂肪酸含量(P<0.05);对其他脂肪酸含量影响不显著(P>0.05)。
|
|
表 3 育肥猪空肠消化物中长链脂肪酸含量(干物质基础) Table 3 Contents of LCFAs in jejunum digesta of finishing pigs (DM basis) |
由表 4可知,饲粮中添加干酪乳杆菌,显著降低了育肥猪结肠消化物中不饱和脂肪酸棕榈油酸和花生四烯酸含量(P<0.05),对其他脂肪酸含量影响不显著(P>0.05)。
|
|
表 4 育肥猪结肠消化物中长链脂肪酸含量(干物质基础) Table 4 Contents of LCFAs in colon digesta of finishing pigs (DM basis) |
猪肠道中的微生物主要是厚壁菌门、拟杆菌门、变形菌门和放线菌门,其中以厚壁菌门和拟杆菌门为主[13]。本研究显示,北京黑猪育肥阶段空肠消化物中厚壁菌门和变形菌门为优势菌群,结肠消化物中以厚壁菌门和拟杆菌门为优势菌群,这与Zhao等[14]测定的6月龄大白猪肠道中菌群组成结果类似。
研究表明,乳酸菌通过竞争肠道黏附位点及分泌抗菌物质等方式抑制病原菌的定植和生长繁殖,维持肠道健康[15]。Liu等[8]和李雪莉等[9]分别给断奶仔猪饲喂短乳杆菌和植物乳杆菌,均降低了仔猪粪便或盲肠中的大肠杆菌数量,增加了乳酸菌数量。张董燕等[10]给生长猪饲喂卷曲乳杆菌,发现提高了粪便菌群物种丰富度,增加了粪便中厚壁菌门、乳杆菌属和光岗菌属的比例。本研究中,在北京黑猪育肥阶段饲粮中添加干酪乳杆菌,增加了猪空肠消化物中厚壁菌门的相对丰度,降低了变形菌门及埃希氏菌属-志贺氏菌属的相对丰度。厚壁菌门是肠道中与碳水化合物代谢相关的菌群,其相对丰度增加对碳水化合物的消化吸收有积极作用。变形菌门被认为是不稳定的微生物群,其大量繁殖会导致菌群失调,引起肠炎反应[16]。埃希氏菌属-志贺氏菌属隶属变形菌门,是条件性致病菌,其相对丰度降低,会减少肠道疾病的发生几率。本研究还发现,结肠消化物中拟杆菌门、乳杆菌属和未标记拟杆菌目_S24-7_群的相对丰度显著增加,链球菌属的相对丰度显著降低。有研究报道,肠道拟杆菌门细菌的基因组中,含有较多的糖苷水解酶和多糖裂解酶编码基因,能促进多糖降解[17]。结肠是消化低聚糖、非淀粉多糖及抗性淀粉而产生短链脂肪酸的主要部位,结肠中拟杆菌门相对丰度增加,会促进多糖的降解,为机体提供更多的能量,有利于猪群生长性能提高;乳杆菌属是肠道中的有益菌群,对于维持肠道菌群平衡、竞争性排斥致病菌、促进营养物质消化吸收、产生防御肽、提高机体免疫力具有重要作用[18-19]。
3.2 干酪乳杆菌对育肥猪肠道消化物中乳酸和短链脂肪酸含量的影响乳酸和短链脂肪酸是肠道微生物与宿主、食物间互作的主要代谢产物,在维持动物肠上皮屏障、营养物质消化吸收、抵御病原菌、增强免疫力和机体能量代谢方面发挥着重要作用[20-21]。肠道内大部分短链脂肪酸在结肠被吸收,丁酸被G蛋白偶联受体41(GPR41)识别后,优先为结肠上皮细胞提供能量,还可通过丝裂原活化蛋白激酶(MAPK)介导,促进机体对炎症反应的应答;乙酸是合成胆固醇和脂肪酸的前体物质;丙酸是肝脏糖异生的底物[22]。李雪莉等[9]在饲粮中添加植物乳杆菌,发现仔猪结肠中乳酸和丁酸含量显著增加,并认为是植物乳杆菌促进了肠道中乳酸菌的增殖,导致结肠中乳酸含量显著增加,且为丁酸产生菌提供了底物来源。本研究显示,饲粮中添加干酪乳杆菌对育肥猪空肠消化物中乳酸和短链脂肪酸的含量没有产生显著影响;而结肠消化物中乳酸含量显著降低,丁酸含量显著增加。造成结果差异的原因可能与猪的生理阶段和菌株不同有关。有研究报道,肠道内乳酸与短链脂肪酸可以通过不同途径进行相互转化,乳酸或乙酸可以作为前体物质或发酵基质合成丙酸或丁酸,结肠中乳酸生成菌和丁酸生成菌的平衡,对于防止乳酸积累以及稳定结肠代谢有重要意义[22-23]。可以推测,从空肠到结肠的消化过程中,干酪乳杆菌引起了肠道消化物中菌群变化,可能激活了一系列转化酶的活性,促进了结肠中乳酸向丁酸转化,维持了乳酸生成菌和丁酸生成菌的动态平衡,有利于肠道健康和机体健康。
3.3 干酪乳杆菌对育肥猪肠道消化物中长链脂肪酸含量的影响长链脂肪酸是指含有14个及以上碳原子的脂肪酸,按双键情况可分为饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸(PUFA)。PUFAs又分为ω-3和ω-6系列。亚油酸和α-亚麻酸是多不饱和脂肪酸,是动物营养中的必需脂肪酸。亚油酸可以衍生成花生四烯酸,α-亚麻酸可以转化成二十碳五烯酸和二十二碳六烯酸[24],对人和动物有重要保健作用。
张董燕等[10]的研究发现,生长猪饲粮中添加卷曲乳杆菌,影响血清中长链脂肪酸组成,显著增加了单不饱和脂肪酸中油酸、多不饱和脂肪酸中亚油酸和花生四烯酸的含量。孙建广[25]在饲粮中添加发酵乳杆菌,猪肉中亚油酸、顺二十碳二烯酸和花生四烯酸等多不饱和脂肪酸含量显著升高。王四新等[12]在饲粮中添加干酪乳杆菌,育肥猪背最长肌中不饱和脂肪酸含量显著高于对照组。本研究显示,在育肥猪饲粮中添加干酪乳杆菌,猪空肠消化物中山嵛酸和顺-15-二十四碳一烯酸含量显著下降,二十二碳六烯酸和ω-3多不饱和脂肪酸含量显著增高;而结肠消化物中饱和脂肪酸含量升高,单不饱和脂肪酸和多不饱和脂肪酸含量下降。这说明干酪乳杆菌影响了肠道中脂肪酸代谢,促进了不饱和脂肪酸的转化和吸收,对不同肠段的长链脂肪酸组成有调节作用。已有研究表明,肠道微生物双歧杆菌属、乳杆菌属和乳球菌属等具有合成ω-3、ω-6多不饱和脂肪酸的功能,且能将多不饱和脂肪酸转化成具有独特分子结构和特殊功能的脂肪酸,如羟基脂肪酸和共轭脂肪酸等[26]。因此,调控好饱和脂肪酸与不饱和脂肪酸的含量与比例,有利于机体健康和生长性能提高。
4 结论在北京黑猪育肥阶段饲粮中添加干酪乳杆菌,减少了空肠中埃希氏菌属-志贺氏菌属相对丰度,增加了结肠中乳杆菌属相对丰度;降低了结肠中乳酸含量,提高了丁酸含量;提高了空肠中二十二碳六烯酸含量,降低了结肠中花生四烯酸含量。肠道内的这些变化有利于猪群健康和生长性能提高。
| [1] |
O'HARA A M, SHANAHAN F. The gut flora as a forgotten organ[J]. EMBO Reports, 2006, 7(7): 688-693. |
| [2] |
刘虹, 王琪, 刘作华, 等. 猪肠道微生物区系的形成及营养调控[J]. 动物营养学报, 2018, 30(7): 2480-2487. DOI:10.3969/j.issn.1006-267x.2018.07.007 |
| [3] |
ISAACSON R, KIM H B. The intestinal microbiome of the pig[J]. Animal Health Research Reviews, 2012, 13(1): 100-109. DOI:10.1017/S1466252312000084 |
| [4] |
张魏伟, 王安如, 滕可导, 等. 干酪乳杆菌对断奶仔猪十二指肠发育的组织学影响[J]. 中国农业大学学报, 2015, 20(3): 114-120. |
| [5] |
王齐桓, 王安如, 周宁聪, 等. 干酪乳杆菌对断奶仔猪回肠黏膜结构及上皮内淋巴细胞数量的影响[J]. 中国兽医杂志, 2016, 52(2): 34-37. DOI:10.3969/j.issn.0529-6005.2016.02.011 |
| [6] |
ZHANG D Y, JI H F, LIU H, et al. Changes in the diversity and composition of gut microbiota of weaned piglets after oral administration of Lactobacillus or an antibiotic[J]. Applied Microbiology and Biotechnology, 2016, 100(23): 10081-10093. DOI:10.1007/s00253-016-7845-5 |
| [7] |
LIU C Q, ZHU Q, CHANG J, et al. Effects of Lactobacillus casei and Enterococcus faecalis on growth performance, immune function and gut microbiota of suckling piglets[J]. Archives of Animal Nutrition, 2017, 71(2): 120-133. DOI:10.1080/1745039X.2017.1283824 |
| [8] |
LIU H, JI H F, ZHANG D Y, et al. Effects of Lactobacillus brevis preparation on growth performance, fecal microflora and serum profile in weaned pigs[J]. Livestock Science, 2015, 178: 251-254. DOI:10.1016/j.livsci.2015.06.002 |
| [9] |
李雪莉, 虞德夫, 王超, 等. 植物乳杆菌制剂对断奶仔猪肠道黏膜功能和微生物菌群及短链脂肪酸的影响[J]. 南京农业大学学报, 2018, 41(3): 504-510. |
| [10] |
张董燕, 季海峰, 刘辉, 等. 卷曲乳杆菌对生长猪生长性能、粪便菌群和短链脂肪酸组成以及血清长链脂肪酸组成的影响[J]. 动物营养学报, 2019, 31(4): 1564-1573. |
| [11] |
王四新, 季海峰, 石国华, 等. 干酪乳杆菌对北京黑猪保育阶段生长性能及肠道菌群的影响[J]. 动物营养学报, 2018, 30(1): 326-335. DOI:10.3969/j.issn.1006-267x.2018.01.039 |
| [12] |
王四新, 季海峰, 王红卫, 等. 干酪乳杆菌对北京黑猪育肥阶段生长性能和肌肉营养成分含量的影响[J]. 动物营养学报, 2019, 31(1): 469-476. DOI:10.3969/j.issn.1006-267x.2019.01.055 |
| [13] |
WANG X F, TSAI T, DENG F L, et al. Longitudinal investigation of the swine gut microbiome from birth to market reveals stage and growth performance associated bacteria[J]. Microbiome, 2019, 7: 109. DOI:10.1186/s40168-019-0721-7 |
| [14] |
ZHAO W J, WANG Y P, LIU S Y, et al. The dynamic distribution of porcine microbiota across different ages and gastrointestinal tract segments[J]. PLoS One, 2015, 10(2): e0117441. DOI:10.1371/journal.pone.0117441 |
| [15] |
CHO J H, ZHAO P Y, KIM I H. Probiotics as a dietary additive for pigs:a review[J]. Journal of Animal and Veterinary Advances, 2011, 10(16): 2127-2134. DOI:10.3923/javaa.2011.2127.2134 |
| [16] |
SHIN N R, WHON T W, BAE J W. Proteobacteria:microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 2015, 33(9): 496-503. DOI:10.1016/j.tibtech.2015.06.011 |
| [17] |
EI KAOUTARI A, ARMOUGOM F, GORDON J I, et al. The abundance and variety of carbohydrate-active enzymes in the human gut microbiota[J]. Nature Reviews Microbiology, 2013, 11(7): 497-504. DOI:10.1038/nrmicro3050 |
| [18] |
张日俊. 动物微生态制剂(益生菌)的标准、评价规程、功能和发展趋势[J]. 饲料工业, 2015, 36(4): 1-7. |
| [19] |
付连军, 郝景峰, 宋永利, 等. 益生菌对肠道黏膜免疫影响的研究进展[J]. 中国畜牧兽医, 2013, 40(2): 113-116. DOI:10.3969/j.issn.1671-7236.2013.02.027 |
| [20] |
LYNCH J B, HSIAO E Y. Microbiome as sources of emergent host phenotypes[J]. Science, 2019, 365(6460): 1405-1408. DOI:10.1126/science.aay0240 |
| [21] |
SANDERS M E, MERENSTEIN D J, REID G, et al. Probiotics and prebiotics in intestinal health and disease:from biology to the clinic[J]. Nature Reviews Gastroenterology & Hepatology, 2019, 16(10): 605-616. |
| [22] |
KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology:short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |
| [23] |
于卓腾, 杭苏琴, 姚文, 等. 肠道产丁酸细菌及其丁酸产生机制的研究进展[J]. 世界华人消化杂志, 2006, 14(25): 2531-2534. DOI:10.3969/j.issn.1009-3079.2006.25.012 |
| [24] |
毕重朋, 侯晓亮, 苏洋, 等. 脂肪对动物免疫功能作用的研究[J]. 饲料工业, 2017, 38(12): 32-35. |
| [25] |
孙建广.发酵乳酸杆菌对生长肥育猪生长性能和肉品质的影响[D].硕士学位论文.长沙: 湖南农业大学, 2009.
|
| [26] |
左正三, 郭东升, 纪晓俊, 等. 肠道中多不饱和脂肪酸及其衍生物研究进展[J]. 中国生物工程杂志, 2018, 38(11): 66-75. |




