育雏期是蛋鸡肠道发育的关键时期。肠道的早期发育和成熟可为蛋鸡育成期的生长、产蛋期的健康和生产性能提供保障。育雏期因肠道发育问题而引发的雏鸡腹泻、营养吸收不良等,可能会对后期生长造成不可逆的损伤。若能在胚期进行早期营养调控,不仅可改善雏鸡的生长发育,可能还会影响到整个生命周期机体的生长和健康[1]。目前,家禽孵化后期常采用胚蛋注射技术供给外源营养物质,改善雏鸡出壳前后生理代谢转变和禁食造成的发育不良等问题,以促进雏鸡早期发育[2]。精氨酸(Arg)是禽类的必需氨基酸[3],而禽类体内缺乏合成Arg所必需的氨甲酰磷酸合成酶和二氢吡咯-5-羧酸合成酶。胚期给养L-Arg能够促进肉仔鸡早期消化器官发育,提高生长性能、肠道消化酶活性和免疫功能[4-6]。但目前胚蛋注射L-Arg对蛋鸡早期肠道发育及机体代谢影响的研究较少。雏鸡出壳后即可获得充足的氧气,氧化利用卵黄囊中丰富的脂质,为机体发育提供能量。同时,卵黄囊还是十分重要的外源糖原储存器官[7]。因此,猜测胚蛋注射L-Arg可能通过调控雏鸡脂质代谢和糖代谢功能,促进卵黄囊中营养物质的吸收,为促进肠道早期发育提供更多能量。本研究以蛋雏鸡为动物模型,研究胚期给养L-Arg对机体早期肠道发育和能量代谢的影响,为胚蛋注射L-Arg在蛋雏鸡中的应用提供理论基础。
1 材料与方法 1.1 试验设计 1.1.1 孵化试验和胚蛋注射选取产自47周龄京红1号蛋鸡的种蛋1 080枚,随机分为3组,分别为未注射对照(non-injected control,NC)组、生理盐水注射对照(saline-injected control,SC)组和L-Arg注射(L-Arg-injected,Arg)组,每组8个重复,每个重复45枚种蛋,各组种蛋重量无显著差异(P>0.05)。孵化开始前,对孵化室进行紫外灯照射,并用新洁尔灭喷洒消毒。孵化期间,保持孵化室内温度为25 ℃,孵化箱内温度为(37.8±0.1) ℃,相对湿度为60%。在孵化第7天和第17天进行照蛋,剔除死胚和未受精种蛋,并记录。
在孵化第17.5天开始胚蛋羊膜腔注射L-Arg,NC组不注射,Arg组每枚蛋注射10 mg L-Arg(用0.85%的生理盐水做溶剂配制浓度为10%的L-Arg注射液,注射剂量为0.1 mL/枚蛋),SC组注射相同剂量的0.85%生理盐水。本课题组研究结果表明,每枚胚蛋注射10 mg L-Arg不会降低蛋雏鸡的孵化率,可显著改善生长性能、肠道形态结构和微生物区系(数据未发表)。所有注射试剂当天配制,并对试验所需的烧杯等物品进行高温高压(121.3 ℃,103.4 kPa)蒸气消毒灭菌15 min。在超净工作台完成注射剂配制后,用0.22 μm细菌过滤器过滤注射剂,使用1 mL一次性灭菌注射器抽取相应注射剂放在孵化箱内1 h,确保注射前注射剂温度为37.8 ℃。为防止周围环境中的微生物污染,需再次对注射区域进行新洁尔灭喷雾消毒。通过照蛋确定羊膜腔的位置,并用铅笔画圈标记,然后用75%酒精棉球擦拭气室端,接着用钻孔器在标记位置打孔,最后将注射器内注射剂通过小孔打入羊水中。为避免环境对胚蛋的影响,注射过程需在1 h内完成,然后将胚蛋放回孵化器中继续孵化。
1.1.2 饲养试验出雏当天,通过羽色鉴定雏鸡性别,淘汰公雏,从每组选取体重无显著差异(P>0.05)的健康母雏120只,随机分配到8个笼子(100 cm×90 cm×65 cm)中,每笼15只鸡。饲粮参照NRC(1994)配制,基础饲粮组成及营养水平见表 1。饲养管理按照《京红蛋鸡饲养手册》进行,自由采食和饮水,试验期14 d,并按蛋雏鸡正常免疫程序免疫接种。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
L-Arg购自北京博奥拓达科技有限公司,纯度≥99%。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体和生物素标记的羊抗鼠免疫球蛋白G(IgG)复合物均购自英国Abcam公司。
1.3 检测指标及方法 1.3.1 孵化性能于孵化第19天和出雏当天,每个重复挑选1枚接近平均重量的胚蛋或1只接近平均体重的雏鸡,记录胚蛋、胚胎、雏鸡和卵黄囊重量,并计算绝对体质量,计算公式如下:

|
于1、3和14日龄时,每重复选取1只接近平均体重的雏鸡,称重并屠宰,取十二指肠、空肠和回肠,量取各肠段的长度。
1.3.3 消化酶活性于3和14日龄时,屠宰雏鸡,采集空肠内容物于冻存管中,迅速放入液氮中冻存,然后保存到-80 ℃冰箱中待测。检测空肠内容物的淀粉酶、胰蛋白酶和脂肪酶活性,所需试剂盒购买于南京建成生物工程研究所,并按照说明书要求进行检测。
1.3.4 PCNA免疫组织化学染色和观察采集14日龄时空肠肠段1.5 cm,经预冷的生理盐水冲洗后,浸泡在4%多聚甲醛溶液中,用于制作石蜡切片。然后进行PCNA免疫组织化学染色,石蜡切片经脱蜡入水,用磷酸盐缓冲液(PBS)(pH=7.4)冲洗3次,每次5 min;将组织放入抗原修复液中,于微波炉中热修复10 min,随后冷却至室温;PBS冲洗3次,每次5 min;除去PBS,在组化笔圈定的区域内加100 μL 3%的双氧水(H2O2),室温孵育10 min;PBS冲洗3次,每次5 min;除去PBS,加100 μL封闭液,室温孵育1 h;除去封闭液,按照1 : 1 000的比例滴加PCNA抗体,4 ℃过夜;PBS冲洗3次,每次5 min;滴加1 : 100比例配制的生物素标记的羊抗鼠IgG复合物,室温孵育1 h;PBS冲洗3次,每次5 min,滴加100 μL链霉菌抗生物素蛋白-过氧化物酶,室温孵育30 min;加100 μL新鲜配制的二氨基联苯胺显色液,室温孵育5 min,反应到变棕黄色为止;苏木素复染30 s,然后用树脂封片;最后在放大400倍的光镜下随机观察5个视野,每个视野选定小肠绒毛顶端至隐窝部位约300个细胞统计PCNA阳性细胞数量,计算细胞增殖指数(cell proliferation index),公式如下:
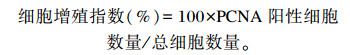
|
于3和14日龄时,每个重复随机选取1只雏鸡空腹翅静脉采血,室温静置3 h,然后用高速冷冻离心机3 500 r/min离心10 min,分离血清于1.5 mL Eppendof管中,保存于-80 ℃冰箱待测。血清甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、葡萄糖(GLU)含量采用CHEM-5型半自动生化分析仪测定,试剂盒购买于上海科华生物工程股份有限公司。
1.4 数据统计分析试验数据采用SPSS 19.0软件的one-way ANOVA程序对均值进行方差分析,采用Duncan氏多重比较法检验组间差异显著性,以P < 0.05为差异显著标准。孵化率数据在方差分析前进行反正弦转换。表格中数据用平均值和标准误(SEM)表示,图片中数据用平均值和标准差(SD)表示。
2 结果 2.1 胚蛋注射L-Arg对蛋雏鸡孵化性能的影响由表 2可知,各组种蛋的开始孵化重量在60.74~60.79 g,且无显著差异(P>0.05);与NC和SC组相比,胚蛋注射L-Arg对19胚龄时的胚蛋重、胚胎重、绝对体质量和卵黄囊重均无显著影响(P>0.05),其中,Arg组的卵黄囊重最低;胚蛋注射L-Arg对1日龄蛋雏鸡的孵化率、出孵重和绝对体质量也无显著影响(P>0.05),但显著降低卵黄囊重(P < 0.05)。
|
|
表 2 胚蛋注射L-Arg对蛋雏鸡孵化性能的影响 Table 2 Effects of in ovo feeding of L-Arg on hatchability of layer chicks |
由表 3可知,与NC和SC组相比,胚蛋注射L-Arg显著提高1日龄蛋雏鸡的空肠长度和3日龄时的十二指肠长度(P < 0.05),但对3日龄时的空肠和回肠长度无显著影响(P>0.05);胚蛋注射L-Arg显著提高14日龄蛋雏鸡的空肠和回肠长度(P < 0.05),但对14日龄时的十二指肠长度无显著影响(P>0.05)。
|
|
表 3 胚蛋注射L-Arg对1、3和14日龄蛋雏鸡肠道器官发育的影响 Table 3 Effects of in ovo feeding of L-Arg on intestinal organ development of layer chicks at 1, 3 and 14 days of age |
由表 4可知,与NC和SC组相比,胚蛋注射L-Arg对3和14日龄蛋雏鸡的空肠内容物淀粉酶和胰蛋白酶活性无显著影响(P>0.05);Arg组3日龄蛋雏鸡的空肠内容物脂肪酶活性有增加趋势(P=0.084),比NC和SC组分别提高14.78%和19.09%。
|
|
表 4 胚蛋注射L-Arg对3和14日龄蛋雏鸡空肠内容物消化酶活性的影响 Table 4 Effects of in ovo feeding of L-Arg on jejunal contents digestive enzyme activities of layer chicks at 3 and 14 days of age |
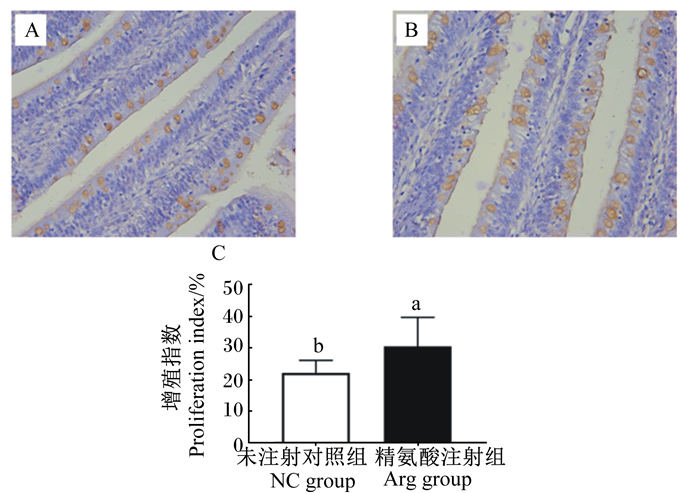
图 1-A、图 1-B中箭头所指的棕黄色颗粒即为PCNA免疫组织化学阳性反应产物,主要分布在细胞核中,而非增殖细胞的细胞核呈蓝色。由图 1-C可知,与NC组相比,胚蛋注射L-Arg显著提高14日龄蛋雏鸡的空肠上皮细胞增殖指数(P < 0.05)。
|
图 1-A为NC组PCNA免疫组织化学染色结果;图 1-B为Arg组PCNA免疫组织化学染色结果。数据柱标注不同小写字母表示差异显著(P < 0.05)。 Fig. 1-A indicated PCNA immunohistochemistry staining results of NC group; Fig. 1-B indicated PCNA immunohistochemistry staining results of Arg group. Value columns with different small letter superscripts mean significant difference (P < 0.05). 图 1 胚蛋注射L-Arg对14日龄蛋雏鸡空肠上皮细胞增殖指数的影响 Fig. 1 Effects of in ovo feeding of L-Arg on proliferation indexes of jejunal epithelial cells of layer chicks at 14 days of age |
由表 5可知,与NC组相比,胚蛋注射L-Arg显著降低3和14日龄蛋雏鸡的血清TG含量(P < 0.05),显著增加3和14日龄时的血清TC和LDL含量(P < 0.05);与SC组相比,Arg组14日龄蛋雏鸡的血清HDL和GLU含量显著增加(P < 0.05)。
|
|
表 5 胚蛋注射L-Arg对3和14日龄蛋雏鸡血清生化指标的影响 Table 5 Effects of in ovo feeding of L-Arg on serum biochemical indexes of layer chicks at 3 and 14 days of age |
胚蛋注射作为早期营养补给技术应用的前提是不对孵化性能产生不良影响。研究表明,胚蛋注射适宜剂量的L-Arg不会造成种蛋孵化率的降低[8-9]。本试验研究结果显示,胚蛋注射10 mg L-Arg不会对孵化率造成不良影响。但研究发现,注射高剂量的L-Arg会显著降低种蛋的孵化率[10],原因可能是高剂量L-Arg和赖氨酸发生拮抗作用,从而引发机体内氨基酸代谢紊乱[11-12],影响胚胎的正常生长发育。卵黄囊是家禽胚胎生长发育所需的能量和营养物质的主要来源,出壳后,雏鸡主要吸收利用卵黄囊中大量的脂质,为肠道发育提供能量[13-14]。此外,卵黄囊还是十分重要的外源糖原存储器官,和肝脏一样具有糖原合成的功能[7]。Dal Pont等[15]还将剩余卵黄囊的重量作为营养物质利用的指标,从而区分雏鸡肠道发育的差异。本研究结果表明,胚蛋注射L-Arg促进1日龄蛋雏鸡卵黄囊的吸收,可能与机体脂质代谢功能增强有关,进而为促进早期肠道发育提供更多的能量。此外,雏鸡卵黄囊的吸收加快还可防止孵化后期死胚和出壳后弱雏现象的发生[16]。
3.2 胚蛋注射L-Arg对蛋雏鸡肠道器官发育和消化功能的影响小肠作为家禽营养物质消化吸收的主要场所,对机体生长发育极其重要,但早期肠道的各项生理功能尚未发育成熟。研究表明,出壳前后1周是雏鸡肠道发育的关键时期[2, 17]。因此,有关胚期营养供给以促进家禽肠道早期发育的研究越来越多。研究发现,胚蛋注射L-Arg可促进肉鸡的消化器官发育,并提高生长性能、肠道消化酶活性和免疫功能[4-6]。L-Arg可通过在动物体内代谢产生一氧化氮(NO)和多胺,进而发挥改善肠道生理结构和功能的作用[18]。Gao等[19]研究发现,胚蛋注射L-Arg可抑制诱导型一氧化氮合酶(iNOS)基因甲基化,并激活Arg-NO途径,从而改善肉鸡的肠道发育和免疫屏障功能。此外,体外细胞培养试验发现,L-Arg可上调雏鸡胚期肠上皮细胞哺乳动物雷帕霉素靶蛋白(mTOR)信号通路中雷帕霉素靶蛋白(TOR)、真核细胞翻译起始因子4E结合蛋白1(4E-BP1)和核糖体S6蛋白激酶(S6K1)基因的表达水平,促进上皮细胞蛋白质的合成,进而加快胚期肠道的发育成熟[20]。肠道的早期发育可提高肠道营养物质消化吸收能力,进而改善肉仔鸡的早期生长性能[21]。目前为止,有关胚蛋注射L-Arg对蛋雏鸡肠道发育影响的研究较少。本试验结果表明,胚期给养L-Arg可促进蛋雏鸡的肠道发育,增加肠道长度;此外,脂肪酶活性增加与卵黄囊重减少相对应,可更加高效地吸收来自卵黄囊和饲粮中的脂质;但脂肪酶活性仅有增加的趋势,可能是由于个体差异较大造成。PCNA免疫组化法进一步证实Arg组的空肠上皮细胞增殖指数显著高于NC组;但本研究发现胚蛋注射L-Arg未显著改善蛋雏鸡出壳后2周内的生长性能(数据未发表)。报道认为,雏鸡出壳后第1周,消化系统发育的速度比体重增加的速度快约5倍[17, 22],卵黄囊中营养物质的吸收利用主要用于雏鸡消化器官的发育,而不是体重的增加[23],再次解释了本试验中Arg组蛋雏鸡卵黄囊重显著降低的原因。
3.3 胚蛋注射L-Arg对蛋雏鸡血清生化指标的影响TG、TC、HDL和LDL含量是反映机体脂质代谢水平的指标。TG作为体内含量最多的脂类可被水解为脂肪酸,为组织提供能量。TC是动物机体必需的营养成分,不仅是构成细胞膜的重要组成成分,还可在体内转化合成维生素D3和胆汁酸,有利于促进机体骨骼发育和血管壁修复,并提高体液免疫和脂肪消化能力[24]。血液中HDL和LDL则作为TC在血液中结合的主要转运体,对调节机体TG平衡起到重要作用。GLU在家禽体内主要发挥氧化供能作用,还是肝糖原、脂肪酸、氨基酸和维生素C等营养物质合成的前体[25]。氨基酸作为合成蛋白质的前体物质,可被动物感应其在机体内含量的变化,并产生信号调节脂质和碳水化合物代谢[26]。Arg经一氧化氮合酶(NOS)代谢产生的NO可作为一种信号分子,不仅广泛影响信息传导和DNA合成等过程,在调节能量和营养物质代谢中也发挥着重要作用[27]。作为Arg参与调控肠道发育的主要途径,mTOR信号通路也参与调控机体能量代谢过程[28]。本试验结果表明,胚蛋注射10 mg L-Arg提高蛋雏鸡的血清TC、胆固醇转运体和GLU含量,并降低血清TG含量,说明早期外源补给L-Arg可促进蛋雏鸡的脂质代谢和糖代谢,加快血液中TG的分解利用,为机体早期肠道发育提供更多能量。
4 结论① 胚蛋注射10 mg L-Arg对蛋雏鸡的孵化率和出孵重等孵化性能均无不良影响。
② 胚蛋注射10 mg L-Arg可促进蛋雏鸡的脂质代谢和糖代谢,为促进早期肠道发育提供更多能量。
| [1] |
WU G Y, BAZER F W, CUDD T A, et al. Maternal nutrition and fetal development[J]. The Journal of Nutrition, 2004, 134(9): 2169-2172. DOI:10.1093/jn/134.9.2169 |
| [2] |
FERKET P R.Embryo epigenomic response to breeder management and nutrition[C]//Proceedings of the 24th World's Poultry Congress.Salvador: [s.n.], 2012.
|
| [3] |
TAMIR H, RATNER S. Enzymes of arginine metabolism in chicks[J]. Archives of Biochemistry and Biophysics, 1963, 102(2): 249-258. DOI:10.1016/0003-9861(63)90178-4 |
| [4] |
TAHMASEBI S, TOGHYANI M. Effect of arginine and threonine administered in ovo on digestive organ developments and subsequent growth performance of broiler chickens[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(5): 947-956. DOI:10.1111/jpn.12400 |
| [5] |
FOYE O T, FERKET P R, UNI Z. The effects of in ovo feeding arginine, β-hydroxy-β-methyl-butyrate, and protein on jejunal digestive and absorptive activity in embryonic and neonatal turkey poults[J]. Poultry Science, 2007, 86(11): 2343-2349. DOI:10.3382/ps.2007-00110 |
| [6] |
SUBRAMANIYAN S A, KANG D R, PARK J R, et al. Effect of in ovo injection of L-arginine in different chicken embryonic development stages on post-hatchability, immune response, and myo-D and myogenin proteins[J]. Animals, 2019, 9(6): 357. DOI:10.3390/ani9060357 |
| [7] |
YADGARY L, UNI Z. Yolk sac carbohydrate levels and gene expression of key gluconeogenic and glycogenic enzymes during chick embryonic development[J]. Poultry Science, 2012, 91(2): 444-453. DOI:10.3382/ps.2011-01669 |
| [8] |
GAO T, ZHAO M, ZHANG L, et al. Effect of in ovo feeding of L-arginine on the hatchability, growth performance, gastrointestinal hormones, and jejunal digestive and absorptive capacity of posthatch broilers[J]. Journal of Animal Science, 2017, 95(7): 3079-3092. |
| [9] |
LI Y, WANG Y, WILLEMS E, et al. In ovo L-arginine supplementation stimulates myoblast differentiation but negatively affects muscle development of broiler chicken after hatching[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(1): 167-177. DOI:10.1111/jpn.12299 |
| [10] |
TOGHYANI M, TAHMASEBI S, MODARESI M, et al. Effect of arginine and threonine in ovo supplementation on immune responses and some serum biochemical attributes in broiler chickens[J]. Italian Journal of Animal Science, 2019, 18(1): 342-349. DOI:10.1080/1828051X.2018.1529545 |
| [11] |
JAHANIAN R. Immunological responses as affected by dietary protein and arginine concentrations in starting broiler chicks[J]. Poultry Science, 2009, 88(9): 1818-1824. DOI:10.3382/ps.2008-00386 |
| [12] |
KHAJALI F, BASOO H, FARAJI M. Estimation of arginine requirements for male broilers grown at high altitude from one to twenty-one days of age[J]. Journal of Agricultural Science and Technology, 2013, 15(5): 911-917. |
| [13] |
LILBURN M S. Practical aspects of early nutrition for poultry[J]. The Journal of Applied Poultry Research, 1998, 7(4): 420-424. DOI:10.1093/japr/7.4.420 |
| [14] |
NOY Y, SKLAN D. Yolk and exogenous feed utilization in the posthatch chick[J]. Poultry Science, 2001, 80(10): 1490-1495. DOI:10.1093/ps/80.10.1490 |
| [15] |
DAL PONT G C, GOES E C, DA SILVA K F, et al. Glycerol in ovo feeding as an energy substrate improves performance of broilers from young breeders[J]. Journal of Animal Physiology and Animal Nutrition, 2019, 103(5): 1453-1461. DOI:10.1111/jpn.13153 |
| [16] |
张媛媛, 李绪卫, 李高武. 孵化后期鸡胚死亡原因的观察报告[J]. 家禽科学, 2010(2): 37-38. DOI:10.3969/j.issn.1673-1085.2010.02.017 |
| [17] |
IJI P A, SAKI A, TIVEY D R. Body and intestinal growth of broiler chicks on a commercial starter diet.1.Intestinal weight and mucosal development[J]. British Poultry Science, 2001, 42(4): 505-513. DOI:10.1080/00071660120073151 |
| [18] |
WU G Y, BAZER F W, DAVIS T A, et al. Arginine metabolism and nutrition in growth, health and disease[J]. Amino Acids, 2009, 37(1): 153-168. DOI:10.1007/s00726-008-0210-y |
| [19] |
GAO T, ZHAO M M, ZHANG L, et al. Effects of in ovo feeding of L-arginine on the development of lymphoid organs and small intestinal immune barrier function in posthatch broilers[J]. Animal Feed Science and Technology, 2017, 225: 8-19. DOI:10.1016/j.anifeedsci.2017.01.004 |
| [20] |
YUAN C, DING Y, HE Q, et al. L-arginine upregulates the gene expression of target of rapamycin signaling pathway and stimulates protein synthesis in chicken intestinal epithelial cells[J]. Poultry Science, 2015, 94(5): 1043-1051. DOI:10.3382/ps/pev051 |
| [21] |
LI C L, WANG J, ZHANG H J, et al. Intestinal morphologic and microbiota responses to dietary Bacillus spp. in a broiler chicken model[J]. Frontiers in Physiology, 2018, 9: 1968. |
| [22] |
NITSAN Z, DUNNINGTON E A, SIEGEL P B. Organ growth and digestive enzyme levels to fifteen days of age in lines of chickens differing in body weight[J]. Poultry Science, 1991, 70(10): 2040-2048. DOI:10.3382/ps.0702040 |
| [23] |
NOY Y, GEYRA A, SKLAN D. The effect of early feeding on growth and small intestinal development in the posthatch poult[J]. Poultry Science, 2001, 80(7): 912-919. DOI:10.1093/ps/80.7.912 |
| [24] |
郭翔.降胆固醇益生乳酸菌筛选及其功能机理的研究[D].博士学位论文.无锡: 江南大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10295-2010075495.htm
|
| [25] |
BRAUN E J, SWEAZEA K L. Glucose regulation in birds[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2008, 151(1): 1-9. DOI:10.1016/j.cbpb.2008.05.007 |
| [26] |
GOSBY A K, CONIGRAVE A D, LAU N S, et al. Testing protein leverage in lean humans:a randomised controlled experimental study[J]. PLoS One, 2011, 6(10): e25929. DOI:10.1371/journal.pone.0025929 |
| [27] |
ZHENG L, DU Y, MILLER C, et al. Critical role of inducible nitric oxide synthase in degeneration of retinal capillaries in mice with streptozotocin-induced diabetes[J]. Diabetologia, 2007, 50(9): 1987-1996. DOI:10.1007/s00125-007-0734-9 |
| [28] |
POLAK P, HALL M N. mTOR and the control of whole body metabolism[J]. Current Opinion in Cell Biology, 2009, 21(2): 209-218. DOI:10.1016/j.ceb.2009.01.024 |




