2. 青藏高原动物遗传资源保护与 利用重点实验室, 成都 610041
2. Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization, Ministry of Education, Chengdu 610041, China
反刍动物瘤胃中栖息着复杂、多样的原虫、细菌、古细菌及真菌等多种微生物,它们之间的相互作用对维持瘤胃内环境稳定和动物健康至关重要[1]。动物的年龄、饲粮结构、健康状况等均会影响瘤胃发酵参数和微生物区系多样性,其中饲粮结构是最主要的因素[2]。酵母培养物(YC)是酵母菌在特定工艺条件下发酵培养后产生的一种微生态制剂,富含糖类、蛋白质、维生素、矿物质、免疫多糖、消化酶等成分,可为微生物的生长提供丰富的营养物质[3]。有研究表明,YC可维持瘤胃健康及肠道菌群平衡, 提高免疫力及营养物质消化率, 促进动物的生长, 提高动物的生长性能[4-6]。向洋[7]研究发现,荷斯坦奶牛饲粮中添加15 g/d的YC可提高纤维消化率及微生物蛋白(MCP)的产量,进而改善泌乳性能。Williams等[8]研究表明,在奶牛饲粮中添加酿酒YC可有效地维持瘤胃内环境的稳定。Price等[9]研究报道,在被沙门氏菌感染的断奶仔猪饲粮中添加0.2% YC可增加胃肠道中乳酸菌和拟杆菌的数量,改善微生物区系。Liu等[3]研究发现,YC能影响瘤胃微生物门水平和属水平的相对丰度,进而改变瘤胃微生物区系组成。
牦牛(Bos grunniens)作为青藏高原地区特有的家畜,与当地居民的生活息息相关,被称之为“高原之舟”,但长期以来“靠天养畜”的养殖模式极大地限制了牦牛的生产效率。为了改善牦牛生产现状、促进牦牛产业化发展,近年来研究者们通过借鉴肉牛养殖经验开展牦牛的舍饲育肥工作,但主要集中在提高生长性能、消化率和改善肉品质等方面的研究,关于舍饲牦牛瘤胃微生物区系的研究鲜有报道。另外,YC在反刍动物中的应用已经趋于成熟,但未见YC在舍饲牦牛瘤胃发酵参数和微生物区系研究的报道。鉴于此,本试验在舍饲牦牛饲粮中添加不同水平的YC,对舍饲牦牛瘤胃发酵参数和微生物区系多样性进行研究,以期为YC在牦牛饲粮中的应用和牦牛饲粮的合理配制提供理论基础。
1 材料与方法 1.1 试验时间和地点本试验于2017年11月至2018年3月在四川省阿坝藏族羌族自治州茂县南新镇(东经103°73′,北纬31°57′)进行。该地区平均海拔约1 500 m,属于高原性季风气候,干燥、多风。试验期间,用高低温温度计(河北省衡水市顺发仪器仪表厂)测得牦牛圈舍内温度在4~25 ℃。
1.2 试验设计本试验采用单因素随机试验设计,选取36头4岁左右、体重相近[(180.31±29.73) kg]、健康的麦洼公牦牛随机分为4组,每组9个重复,每个重复1头牦牛,Ⅰ、Ⅱ、Ⅲ和Ⅳ组饲喂YC添加水平分别为0、0.5%、1.0%和1.5%的全混合日粮(TMR)。试验期90 d,其中预试期10 d,正试期80 d。
1.3 试验饲粮试验饲粮参照本课题组前期研究[10]设计,由精料和粗料(青贮玉米、发酵酒糟)按50 : 50混合配制成TMR,其组成及营养水平见表 1。YC由美国国际生物营养科技有限公司(Bio-Nutrition International,Inc)提供,为黄色流动性良好的细小颗粒,其营养成分含量如下:粗蛋白质≥18.0%、粗脂肪≥1.5%、粗纤维≤12.0%、水分≤12.0%、粗灰分≤6.0%。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验开始前,做好圈舍清洁和消毒等准备工作。牦牛进场后,待其精神状况良好后皮下注射伊维菌素注射液进行驱虫,2周后进行再次驱虫,驱虫完成后进入预试期。试验牦牛采用舍饲分栏栓系饲养,占地面积约3 m2。每天按预估采食量供给TMR,分别在07:00和16:00各饲喂1次。自由采食,自由饮水。每天记录投料量和剩料量,计算每日采食量。
1.5 样品采集及测定 1.5.1 瘤胃液的采集试验结束当天晨饲前,每组随机选取5头牦牛采用口腔导管采集瘤胃液,弃去最初的50 mL(避免唾液的影响),然后分装于15 mL离心管和5 mL冻存管中,15 mL离心管-20 ℃保存,用于氨态氮(NH3-N)、MCP、挥发性脂肪酸(VFA)含量的测定;5 mL冻存管立即投入液氮中保存,用于细菌菌群多样性的测定。
1.5.2 样品的测定饲粮中干物质、粗蛋白质、粗脂肪、粗灰分、钙和磷含量参照国家相关标准[12-17]进行测定,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量参照Van Soest等[18]方法进行测定。
pH:采用PHS-10型便携式pH计测定。
NH3-N含量:参照冯宗慈等[19]的比色法测定。
MCP含量:参照Bradford[20]提出的考马斯亮蓝法测定。将瘤胃液涡旋振荡1 min,使微生物与食糜分离,在4 ℃下309×g离心5 min,取上清液1.5 mL于2 mL EP管中,4 ℃下15 640×g离心30 min,弃上清液,底物中加入1.5 mL 0.5 mol/L的NaOH溶液混匀,100 ℃水浴15 min,再4 ℃下15 640×g离心30 min,取上清液加入3 mL考马斯亮蓝染液(现配现用),振荡混匀后静置10 min,用721型分光光度计在波长595 nm处比色。
VFA含量:用Agilent 6890N气相色谱仪测定。以2-乙基丁酸(2EB)作为内标物,采用内标校正定量方法进行计算。载气为氮气(N2),分流比40 : 1,流量2.0 mL/min,平均线速度38 cm/s,柱压11.3 psi,采用程序升温,初始温度为120 ℃(3 min),以10 ℃/min升温至180 ℃(1 min),氢焰检测器温度为250 ℃,氢气(H2)流量40 mL/min,空气流量450 mL/min,柱流量+尾吹气流量45 mL/min,进样口温度为210 ℃,进样量为0.6 μL。
1.5.3 瘤胃细菌多样性根据OMEGA-soil DNA试剂盒(Omega Bio-tek,美国)说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳提取得到的DNA进行质量检测;然后用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对V3~V4可变区进行PCR扩增,扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min(PCR仪:ABI GeneAmp® 9700型)。扩增体系为20 μL:4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶,10 ng DNA模板。
使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, 美国)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST (Promega,美国)进行定量检测。然后用纯化后的扩增片段构建Miseq PE 2×300的文库,采用Illumina MiSeq平台(Illumina, 美国)进行测序(上海美吉生物医药科技有限公司)。
原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接,使用的UPARSE软件(version 7.1 http://drive5.com/uparse/)根据97%的相似度对序列进行操作分类单元(OTU)聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU128),设置比对阈值为70%。
1.6 数据分析数据通过Excel 2010整理后,再使用SPSS 24.0进行单因素方差分析,采用Duncan氏法进行多重比较,随后对YC添加水平进行线性(linear)和二次曲线(quadratic)的回归分析。结果以平均值±标准差表示,P≤0.05表示差异显著,P>0.05表示差异不显著,0.05 < P < 0.10表示有趋势。
2 结果与分析 2.1 饲粮中添加YC对牦牛瘤胃发酵参数的影响由表 2可知,Ⅲ组MCP含量显著高于Ⅰ、Ⅱ组(P < 0.05),与Ⅳ组差异不显著(P>0.05),Ⅱ组显著高于Ⅰ组(P < 0.05);随着饲粮中YC添加水平的升高,牦牛瘤胃液pH有呈线性降低的趋势(P=0.058),NH3-N含量有呈二次曲线变化的趋势(P=0.055),乙酸比例及乙酸/丙酸呈显著线性降低(P < 0.05),丙酸和丁酸比例呈显著线性增加(P < 0.05),总挥发性脂肪酸(TVFA)含量无显著变化(P>0.05)。
|
|
表 2 饲粮中添加YC对舍饲牦牛瘤胃发酵参数的影响 Table 2 Effects of yeast culture supplementation in diets on ruminal fermentation parameters of house-feeding yak |
通过MiSeq测序,20个样本中共获得917 770条优质细菌16S rRNA基因序列,每个样本平均产生45 889条,序列平均长度为440 bp。由表 3可知,4个组的覆盖度均大于0.99,能准确地反映牦牛瘤胃中细菌的组成。Ⅱ组Chao指数显著高于Ⅰ组(P < 0.05),与Ⅲ、Ⅳ组差异不显著(P>0.05),其余各指标组间均无显著差异(P>0.05)。
|
|
表 3 饲粮中添加YC对舍饲牦牛瘤胃细菌群落alpha多样性的影响 Table 3 Effects of yeast culture supplementation in diets on alpha diversity of rumen microflora of house-feeding yak |
在相似度为97%的水平下,4个组共聚类得到1 463个OUT,Ⅰ、Ⅱ、Ⅲ和Ⅳ组OUT数分别为1 273、1 346、1 315和1 334个,共用1 109个OUT,占OUT总数的75.8%,独有的OUT数分别为9、20、11和31个,占OUT总数的比例分别为0.71%、1.46%、0.84%和2.32%,表明各组OUT组成相似度较高,差异较小。
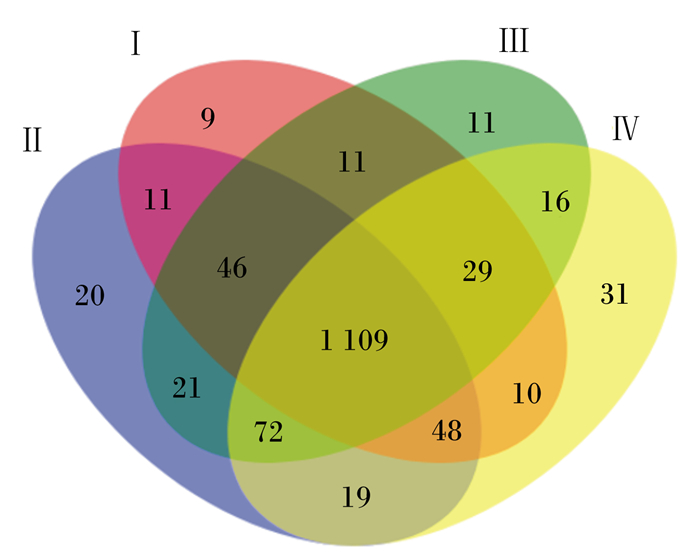
|
Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表Ⅰ、Ⅱ、Ⅲ、Ⅳ组。图 2同。Ⅰ, Ⅱ, Ⅲ and Ⅳ mean groups Ⅰ, Ⅱ, Ⅲ and Ⅳ, respectively. The same as Fig. 2. 图 1 舍饲牦牛瘤胃微生物Venn图 Fig. 1 Venn graph of rumen microorganism of house-feeding yak |
瘤胃细菌OUT水平上基于bray-curtis距离计算的主坐标分析结果见图 2,2个样本间的距离代表这2个样本组成的相似性与差异性,其距离越近,2个样本的相似性越高。如图 2所示,主成分1和主成分2的贡献值分别为10.96%和8.94%。与Ⅰ组相比,Ⅱ、Ⅲ组细菌组成差异较小,而Ⅳ组差异较大,表明在舍饲牦牛饲粮中添加1.5%的YC可以改变瘤胃细菌区系的组成。
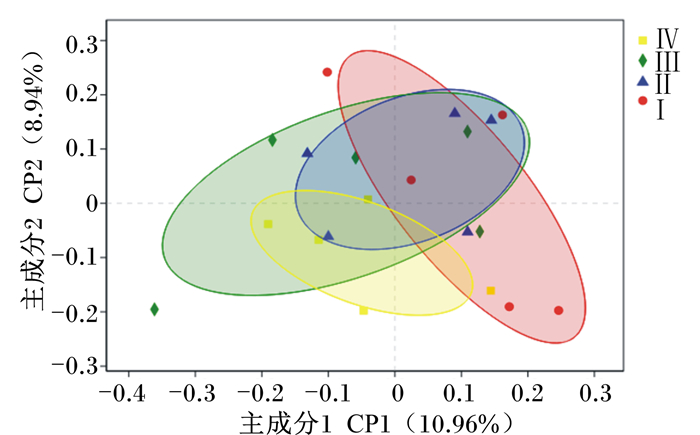
|
图 2 舍饲牦牛瘤胃细菌主坐标分析 Fig. 2 PCoA analysis of rumen microorganism of housing-feed yak |
本次测序经过序列比对和注释,20个样本共得到17个门、30个纲、49个目、81个科、210个属。由表 4可知,4个组在门水平上的优势菌群均为拟杆菌门、厚壁菌门和变形菌门,其相对丰度均在1%以上。随着饲粮中YC添加水平的升高,疣微菌门的相对丰度呈显著线性升高(P < 0.05),Saccharibacteria的相对丰度呈显著线性降低(P < 0.05),互养菌门的相对丰度呈显著二次曲线变化(P < 0.05),变形菌门和纤维杆菌门的相对丰度有呈二次曲线变化的趋势(P=0.065,P=0.064)。
|
|
表 4 饲粮中添加YC对舍饲牦牛瘤胃细菌组成的影响 Table 4 Effects of yeast culture supplementation in diets on rumen bacteria community of house-feeding yak |
在属水平上,4个组的优势菌属均为普雷沃氏菌属1、拟杆菌目BS11和理研菌科RC9,其相对丰度均在5%以上。同时,随着饲粮中YC添加水平的升高,克里斯藤菌科R7、奎因氏菌属、瘤胃球菌科UCG-001和瘤胃球菌科UCG-014的相对丰度呈显著线性降低(P < 0.05),瘤胃球菌科UCG-011和瘤胃球菌属2的相对丰度呈显著二次曲线变化(P < 0.05)。
2.2.5 属水平细菌相对丰度与瘤胃发酵参数的相关性分析图 3展示了舍饲牦牛瘤胃细菌属水平相对丰度(排名前20的菌属)与发酵参数的相关关系。其中,pH与克里斯滕森菌科R7(r=0.520,P=0.019)、瘤胃球菌科UCG-001(r=0.557,P=0.011)和瘤胃球菌科UCG-014(r=0.522,P=0.018)的相对丰度呈显著正相关,NH3-N含量与克里斯滕森菌科R7(r=0.664,P=0.001)和瘤胃球菌科UCG-011(r=0.521,P=0.018)的相对丰度呈显著正相关,MCP含量与瘤胃球菌科UCG-014的相对丰度呈显著负相关(r=-0.466,P=0.038),TVFA含量与奎因氏菌属的相对丰度呈显著正相关(r=0.460,P=0.041),乙酸与瘤胃球菌科NK4A214的相对丰度呈显著正相关(r=0.546,P=0.013),丙酸比例与普雷沃氏菌科UCG-001的相对丰度呈显著正相关(r=0.469,P=0.037)。
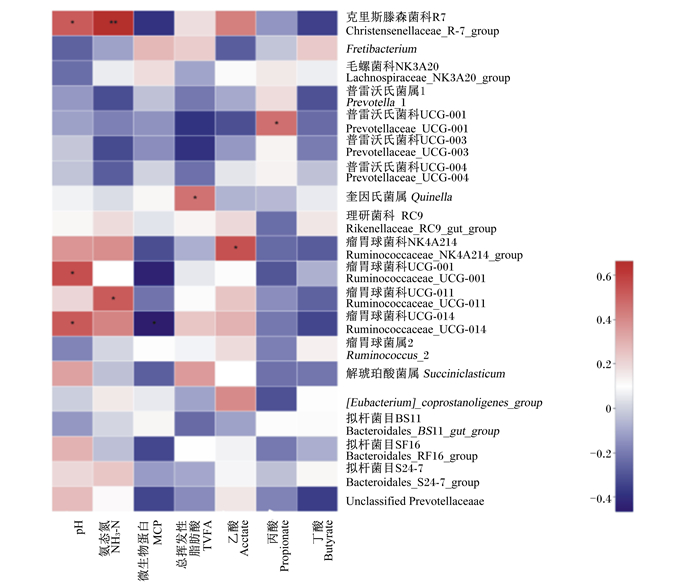
|
每一对变量之间的相关强度用颜色和*表示,*表示P≤0.05,* *表示P≤0.01,深蓝色表示正相关且相关系数接近1,砖红色表示负相关且相关系数接近1。 The correlation strength between each pair of variables was represented by color and *. The * indicated P≤0.05, and * * indicated P≤0.01. Dark blue indicated a positive correlation coefficient close to 1, and brick red indicated a negative correlation coefficient close to 1. 图 3 属水平细菌相对丰度与瘤胃发酵参数的相关关系 Fig. 3 Correlation between relative abundances of bacteria and rumen fermentation parameters |
瘤胃pH是瘤胃生理状况的最直接表现[21],与饲粮组成和营养成分密切相关[5],可综合反映瘤胃微生物代谢和有机酸产生、吸收、排除及中和的状况。Yoon等[22]研究表明,反刍动物瘤胃pH为6.2~6.8时,瘤胃中发酵纤维物质的微生物活性最高,pH为5.5~6.0时,瘤胃中发酵淀粉的微生物活性最强,当瘤胃pH降低到5.5以下时,动物容易出现酸中毒。本试验中,各组pH均处于正常生理范围内,随着YC添加水平的升高呈线性降低的趋势,与Erasmus等[23]在奶牛中的研究结果一致,可能是由于YC促进了饲粮中营养物质的快速降解,加速有机酸的积累,导致瘤胃pH下降。
NH3-N的含量可直接反映瘤胃中微生物生长状况,也是MCP合成主要原料。研究表明最适宜瘤胃微生物生长的NH3-N含量为10~50 mg/dL[24]。本试验中,随着YC添加水平的升高,NH3-N含量逐渐降低,与Erasmus等[23]的结果一致,在奶牛饲粮中添加YC能降低瘤胃NH3-N含量。而Hristov等[25]在奶牛中的研究发现,YC对瘤胃NH3-N含量无显著影响,Liu等[3]在绵羊的饲粮中添加YC能够增加瘤胃NH3-N含量。不同的结果可能与动物品种、饲粮组成、YC的来源、添加形式等有关。瘤胃内NH3-N和MCP的含量密切相关,MCP的含量可以反映微生物摄取和利用NH3-N的能力[26]。本试验中,随着YC添加水平的升高,MCP的含量线性升高,与Dias等[27]的研究结果一致,在泌乳奶牛饲粮中添加YC降低了瘤胃NH3-N含量,增加了MCP的合成。Yoon等[22]研究表明,YC能提高瘤胃微生物的活性和生长繁殖,刺激蛋白分解菌的生长,加快NH3-N的生成和MCP的合成。
VFA是瘤胃内碳水化合物发酵的主要产物,是反刍动物主要的能量来源,包括乙酸、丙酸、丁酸及少数短链脂肪酸和支链脂肪酸[28]。乙酸、丙酸和丁酸含量较高,其含量约占TVFA的95%左右,其中丙酸的转化效率最高,乙酸最低。丙酸在糖异生作用下合成葡萄糖,乙酸是乳脂合成的主要前体,在动物生产中丙酸比例越高,可为机体提供的能量越高[29]。研究表明,在反刍动物饲粮中添加YC可增加VFA的含量[30],也有研究表明,瘤胃中VFA的含量与YC的添加水平无显著关系[8, 31]。本试验中,随着YC添加水平的升高,瘤胃内乙酸比例和乙酸/丙酸显著降低,丙酸比例显著增加。与Harrison等[32]在泌乳奶牛饲粮中添加YC增加瘤胃丙酸比例和降低乙酸比例的结果一致。这说明在舍饲牦牛饲粮中添加YC可以使牦牛瘤胃发酵类型由乙酸型向丙酸型转变,在采食量相同的情况下,促进舍饲牦牛的增重。
3.2 饲粮中添加YC对舍饲牦牛瘤胃微生物区系的影响16S rRNA高通量测序技术可以很好地揭示反刍动物瘤胃微生物多样性。本试验中,20个样品通过Illumina MiSeq平台测序后共获得917 770条优化序列,平均长度为440 bp,共聚类得到1 463个OTU。略高于杨琦玥等[33]在牦牛中的研究结果。Mao等[34]研究发现,覆盖度高于97%说明测序样品取样充分。本试验中各组覆盖度均高于0.99,说明本次测序结果能真实地反映舍饲牦牛瘤胃细菌群落种类和结构多样性。Shannon指数和Simpson指数可反映瘤胃菌群的多样性,Shannon指数越大,群落多样性越高;Simpson指数越小,群落多样性越高。Ace指数和Chao指数可反映瘤胃菌群的丰富度,其数值越大,群落丰富度越高。本试验中,在舍饲牦牛中添加YC不会影响瘤胃细菌多样性,但会增加瘤胃细菌的丰富度。
研究表明,拟杆菌门和厚壁菌门是反刍动物瘤胃中的优势菌门[1, 35]。牦牛瘤胃中的优势菌门为拟杆菌门、厚壁菌门、变形菌门和螺旋菌门[33, 35],本试验中,舍饲牦牛瘤胃优势菌门为拟杆菌门、厚壁菌门和变形菌门,与前人研究基本一致。Evans等[36]研究发现,拟杆菌门在非纤维物质的降解中发挥重要作用,而厚壁菌门主要参与纤维物质的分解。非纤维物质经瘤胃发酵后产生丙酸,而纤维物质被降解后主要产生乙酸[37]。本试验中,随着YC添加水平的升高,拟杆菌门相对丰度逐渐增加,厚壁菌门的相对丰度逐渐降低,但差异不显著,同时,丙酸比例线性升高,乙酸比例线性降低。这可能与本试验在舍饲条件下进行,牦牛采食了大量的精料,使得分解淀粉、可溶性碳水化合物的拟杆菌门的相对丰度升高有关。这说明YC可促进拟杆菌门微生物的生长、增殖,降解饲粮中非纤维类物质产生更多的丙酸。螺旋菌门能够降解纤维素、半纤维素、果胶等,对植物类纤维物质转化为VFA产生重要影响[38]。本试验中,螺旋菌门的相对丰度先升高后降低,呈二次曲线变化。这表明在牦牛饲粮中添加1%的YC可促进瘤胃微生物对纤维类物质的降解,同时与纤维降解密切相关的纤维杆菌门也呈现相似的变化趋势,其在Ⅲ组(1%)纤维杆菌门相对丰度最高。这说明VFA含量与组成的变化可能与不同微生物对纤维物质和非纤维物质降解程度有关。疣微菌门在哺乳动物胃肠道免疫耐受中起主要作用,其物种丰度的减少或缺失与宿主免疫力的下降密切相关[37, 39]。本研究中,随着YC添加水平的升高,疣微菌门的相对丰度线性升高。这表明在饲粮中添加YC可能与增强机体免疫力相关。
张红涛[38]研究荷斯坦后备牛瘤胃微生物组成时发现,普雷沃氏菌属和琥珀酸菌属是瘤胃细菌区系的优势菌属。高雨飞[40]通过测序发现锦江牛瘤胃细菌多样性发现在属水平普雷沃氏菌属、帕拉普氏菌属、理研菌属是优势菌属。本试验中,舍饲牦牛瘤胃中优势菌属为普雷沃氏菌属1、拟杆菌目BS11和理研菌科RC9,与前人研究结果[33, 38, 40]不完全一致,推测可能由动物品种、年龄、饲粮结构、饲养管理等不同引起的。普雷沃氏菌属是瘤胃中数量最多的一类拟杆菌门菌属[38],参与多种微生物代谢、具有较高活性的半纤维素降解能力和适应不同饲粮结构的能力[41],在粗蛋白质、淀粉、木聚糖和果胶的降解过程中发挥重要作用[42-43]。本试验中,普雷沃氏菌属1的相对丰度最高,与前人研究结果[3, 33, 40]一致,且各组间差异不显著。这可能是本研究饲粮粗蛋白质和能量水平相近,没有对普雷沃氏菌属的相对丰度产生显著影响。瘤胃球菌属包括黄色瘤胃球菌和白色瘤胃球菌[38],是瘤胃中主要的纤维降解菌,能产生大量的纤维素酶、半纤维素酶和木聚糖酶,降解粗饲料中的纤维素和半纤维素。本研究中,瘤胃球菌属2的相对丰度呈二次曲线变化,表明在舍饲牦牛饲粮中添加YC可以促进瘤胃球菌的生长、增殖,提高饲粮中纤维的降解率。瘤胃菌科是厚壁菌门中一种革兰氏阴性菌[40],可降解纤维物质产生乙酸。本试验中,瘤胃球菌科UCG-011、瘤胃球菌科UCG-001和瘤胃球菌科UCG-014的相对丰度随YC添加水平的升高而线性降低,使得乙酸比例呈线性降低,推测可能与YC促进非纤维降解菌的生长、增殖和饲养管理方式有关。同时,本试验还发现瘤胃球菌科NK4A214的相对丰度与乙酸比例呈显著正相关,且瘤胃球菌科UCG-001和瘤胃球菌科UCG-014的相对丰度与瘤胃液pH呈显著正相关,NH3-N含量与瘤胃球菌科UCG-011的相对丰度呈显著正相关。这说明疣微菌科不同属的代谢能力不同,其中NK4A214_group、UCG-001和UCG-014菌属可能参与VFA代谢,而UCG-011属的相对丰度可能与NH3-N含量的产生密切相关。克里斯滕森菌科属于厚壁菌门,在维持胃肠道结构和功能和动物机体免疫调节方面发挥重要作用[44-45]。本试验中,克里斯滕森菌科R7的相对丰度随着YC添加水平的升高而降低,且与瘤胃pH和NH3-N含量呈显著正相关,表明克里斯滕森菌科与VFA和NH3-N的代谢相关,说明YC通过改善瘤胃微生物相对丰度,维持肠道结构和功能,进而调节机体的免疫力。
4 结论在舍饲牦牛饲粮中添加YC,可增加舍饲牦牛瘤胃细菌的丰富度,进而对门和属水平部分细菌的相对丰度产生影响,最终影响瘤胃液中pH、MCP含量和乙酸、丙酸、丁酸比例。
| [1] |
BI Y L, ZENG S Q, ZHANG R, et al. Effects of dietary energy levels on rumen bacterial community composition in holstein heifers under the same forage to concentrate ratio condition[J]. BMC Microbiology, 2018, 18(1): 69. |
| [2] |
CARBERRY C A, KENNY D A, HAN S, et al. Effect of phenotypic residual feed intake and dietary forage content on the rumen microbial community of beef cattle[J]. Applied and Environmental Microbiology, 2012, 78(14): 4949-4958. DOI:10.1128/AEM.07759-11 |
| [3] |
LIU Y Z, CHEN X, ZHAO W, et al. Effects of yeast culture supplementation and the ratio of non-structural carbohydrate to fat on rumen fermentation parameters and bacterial-community composition in sheep[J]. Animal Feed Science and Technology, 2019, 249: 62-75. DOI:10.1016/j.anifeedsci.2019.02.003 |
| [4] |
闫碧川, 李振乾, 李胜利, 等. 不同酵母培养物对泌乳中后期奶牛生产性能、养分表观消化率以及血清指标的影响[J]. 动物营养学报, 2018, 30(7): 2732-2740. DOI:10.3969/j.issn.1006-267x.2018.07.034 |
| [5] |
YANG W Z, BEAUCHEMIN K A, RODE L M. Effects of grain processing, forage to concentrate ratio, and forage particle size on rumen pH and digestion by dairy cows[J]. Journal of Dairy Science, 2001, 84(10): 2203-2216. DOI:10.3168/jds.S0022-0302(01)74667-X |
| [6] |
恩和道力格尔.饲喂酵母和枯草芽孢杆菌对奶牛产奶性能、免疫和抗氧化能力及氮排放的影响[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10129-1018960783.htm
|
| [7] |
向洋. 不同淀粉水平日粮中添加酵母培养物对奶牛干物质采食量和瘤胃发酵功能的影响[J]. 中国饲料, 2019(4): 17-21. |
| [8] |
WILLIAMS P E, TAIT C A G, INNES G M, et al. Effects of the inclusion of yeast culture (Saccharomyces cerevisiae plus growth medium) in the diet of dairy cows on milk yield and forage degradation and fermentation patterns in the rumen of steers[J]. Journal of Animal Science, 1991, 69(7): 3016-3026. DOI:10.2527/1991.6973016x |
| [9] |
PRICE K L, TOTTY H R, LEE H B, et al. Use of saccharomyces cerevisiae fermentation product on growth performance and microbiota of weaned pigs during Salmonella infection[J]. Journal of Animal Science, 2010, 88(12): 3896-3908. DOI:10.2527/jas.2009-2728 |
| [10] |
曾钰, 谢昕廷, 彭忠利, 等. 不同精粗比饲粮中添加酵母培养物对牦牛瘤胃体外发酵参数的影响[J]. 动物营养学报, 2019, 31(12): 5582-5594. DOI:10.3969/j.issn.1006-267x.2019.12.024 |
| [11] |
中国农业科学院畜牧研究所, 中国农业大学.NY/T815-2004肉牛饲养标准[S].北京: 中国农业出版社, 2004.
|
| [12] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 6435-2014饲料中水分的测定[S].北京: 中国标准出版社, 2014.
|
| [13] |
全国饲料工业标准化技术委员会.GB/T 6432-1994饲料中粗蛋白测定方法[S].北京: 中国标准出版社, 1994.
|
| [14] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 6433-2006饲料中粗脂肪的测定[S].北京: 中国标准出版社, 2006.
|
| [15] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 6438-2007饲料中粗灰分的测定[S].北京: 中国标准出版社, 2007.
|
| [16] |
中华人民共和国国家质量监督检验检疫总局.GB/T 6436-2002饲料中钙的测定[S].北京: 中国标准出版社, 2002.
|
| [17] |
中华人民共和国国家质量监督检验检疫总局.GB/T 6437-2002饲料中总磷的测定分光光度法[S].北京: 中国标准出版社, 2002.
|
| [18] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [19] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31. |
| [20] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [21] |
NAGARAJA T G, TITGEMEYER E C. Ruminal acidosis in beef cattle:the current microbiological and nutritional outlook[J]. Journal of Dairy Science, 2007, 90(Suppl.1): E17-E38. |
| [22] |
YOON I K, GARRETT J E, COX D J. Effect of yeast culture supplementation to alfafa-grass hay diet on microbial fermentation in continuous culture of rumen contents[J]. Animal Science, 1997, 75: 91-98. |
| [23] |
ERASMUS L J, ROBINSON P H, AHMADI A, et al. Influence of prepartum and postpartum supplementation of a yeast culture and monensin, or both, on ruminal fermentation and performance of multiparous dairy cows[J]. Animal Feed Science and Technology, 2005, 122(3/4): 219-239. |
| [24] |
韩正康, 陈杰. 反刍动物瘤胃的消化和代谢[M]. 北京: 科学出版社, 1988.
|
| [25] |
HRISTOV A N, VARGA G, CASSIDY T, et al. Effect of Saccharomyces cerevisiae fermentation product on ruminal fermentation and nutrient utilization in dairy cows[J]. Journal of Dairy Science, 2010, 93(2): 682-692. DOI:10.3168/jds.2009-2379 |
| [26] |
MAO H L, WANG J K, ZHOU Y Y, et al. Effects of addition of tea saponins and soybean oil on methane production, fermentation and microbial population in the rumen of growing lambs[J]. Livestock Science, 2010, 129(1/3): 56-62. |
| [27] |
DIAS A L G, FREITAS J A, MICAI B, et al. Effect of supplemental yeast culture and dietary starch content on rumen fermentation and digestion in dairy cows[J]. Journal of Dairy Science, 2018, 101(1): 201-221. DOI:10.3168/jds.2017-13241 |
| [28] |
杨宏波, 刘红, 占今舜, 等. 不同精粗比颗粒饲料对断奶公犊牛瘤胃发酵参数和微生物的影响[J]. 草业学报, 2015, 24(12): 131-138. DOI:10.11686/cyxb2015022 |
| [29] |
徐晨晨, 郭娉婷, 刘策, 等. 苜蓿皂苷和酵母培养物对肉羊体外瘤胃发酵特性和甲烷产量的影响[J]. 动物营养学报, 2019, 31(9): 4226-4234. |
| [30] |
朴光赫.米曲霉培养物与酵母培养物组合对绵羊瘤胃发酵及菌群多样性的影响[D].硕士学位论文.长春: 吉林农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10193-1017842918.htm
|
| [31] |
JIAO P X, WEI L Y, WALKER N D, et al. Comparison of non-encapsulated and encapsulated active dried yeast on ruminal pH and fermentation, and site and extent of feed digestion in beef heifers fed high-grain diets[J]. Animal Feed Science and Technology, 2017, 228: 13-22. DOI:10.1016/j.anifeedsci.2017.04.001 |
| [32] |
HARRISON G A, HEMKEN R W, DAWSON K A, et al. Influence of addition of yeast culture supplement to diets of lactating cows on ruminal fermentation and microbial populations[J]. Journal of Dairy Science, 1988, 71(11): 2967-2975. DOI:10.3168/jds.S0022-0302(88)79894-X |
| [33] |
杨琦玥, 黄勇, 陈亚冰, 等. 16S rRNA高通量测序技术筛选牦牛瘤胃细菌基因组DNA提取方法及菌群结构[J]. 中国农业科学, 2017, 50(5): 932-941. |
| [34] |
MAO S Y, ZHANG M L, LIU J H, et al. Characterising the bacterial microbiota across the gastrointestinal tracts of dairy cattle:membership and potential function[J]. Scientific Reports, 2015, 5: 16116. DOI:10.1038/srep16116 |
| [35] |
ZHOU Z M, FANG L, MENG Q X, et al. Assessment of ruminal bacterial and archaeal community structure in yak (Bos grunniens)[J]. Frontiers in Microbiology, 2017, 8: 179. |
| [36] |
EVANS N J, BROWN J M, MURRAY R D, et al. Characterization of novel bovine gastrointestinal tract Treponema isolates and comparison with bovine digital dermatitis treponemes[J]. Applied and Environmental Microbiology, 2011, 77(1): 138-147. DOI:10.1128/AEM.00993-10 |
| [37] |
李岚捷, 成述儒, 刁其玉, 等. 不同NFC/NDF水平饲粮对犊牛瘤胃发酵参数和微生物区系多样性的影响[J]. 畜牧兽医学报, 2017, 48(12): 2347-2357. DOI:10.11843/j.issn.0366-6964.2017.12.014 |
| [38] |
张红涛.不同玉米青贮水平对荷斯坦后备牛瘤胃液微生物组及其代谢组的影响[D].博士学位论文.北京: 中国农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10019-1017157042.htm
|
| [39] |
DERRIEN M, VAN BAARLEN P, HOOIVELD G, et al. Modulation of mucosal immune response, tolerance, and proliferation in mice colonized by the mucin-degrader Akkermansia muciniphila[J]. Frontiers in Microbiology, 2011, 2: 166. |
| [40] |
高雨飞.高精料日粮条件下烟酸对牛瘤胃微生物区系的影响[D].硕士学位论文.南昌: 江西农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10410-1016280674.htm
|
| [41] |
LI Z P, WRIGHT A D G, LIU H L, et al. Response of the rumen microbiota of sika deer (Cervus nippon) fed different concentrations of tannin rich plants[J]. PLoS One, 2015, 10(5): e0123481. DOI:10.1371/journal.pone.0123481 |
| [42] |
JAMI E, ISRAEL A, KOTSER A, et al. Exploring the bovine rumen bacterial community from birth to adulthood[J]. The ISME Journal, 2013, 7(6): 1069-1079. DOI:10.1038/ismej.2013.2 |
| [43] |
THOETKIATTIKUL H, MHUANTONG W, LAOTHANACHAREON T, et al. Comparative analysis of microbial profiles in cow rumen fed with different dietary fiber by tagged 16S rRNA gene pyrosequencing[J]. Current Microbiology, 2013, 67(2): 130-137. DOI:10.1007/s00284-013-0336-3 |
| [44] |
HE J, HAI L, ORGOLDOL K, et al. High-throughput sequencing reveals the gut microbiome of the Bactrian camel in different ages[J]. Current Microbiology, 2019, 76(7): 810-817. DOI:10.1007/s00284-019-01689-6 |
| [45] |
LIU J H, XUE C X, SUN D M, et al. Impact of high-grain diet feeding on mucosa-associated bacterial community and gene expression of tight junction proteins in the small intestine of goats[J]. MicrobiologyOpen, 2019, 8(6): e00745. DOI:10.1002/mbo3.745 |




