铜(copper)是所有动物必需的微量元素之一,其以含铜酶或含铜蛋白的形式广泛参与机体造血、免疫及抗氧化等诸多生理过程[1]。饲料铜缺乏可能导致动物发育异常、生长受阻,影响动物的生产性能及经济价值,铜过量则会对动物产生毒性作用,并且铜在动物体内过量蓄积会增加食品安全隐患[2]。研究发现饲料铜水平与鱼类生长发育之间关系密切,在适宜铜水平下,斑点叉尾[3]、黑带石斑鱼[4]、斜带石斑鱼[5]及黄颡鱼[6]获得了较好的生长性能和饲料效率;饲料铜水平过低时,斑点叉尾[3]、黑带石斑鱼[4]表现出明显的生长缓慢现象;饲料铜水平过高时,斜带石斑鱼[5]和黄颡鱼[6]的增重率及饲料效率显著降低。此外,研究还表明饲料铜缺乏会降低鱼类铜锌超氧化物歧化酶(Cu-Zn SOD)活性且造成总抗氧化能力(T-AOC)下降[4, 7-8],而饲料铜过量则通过芬顿反应形成大量羟自由基,引起生物大分子过氧化,导致鱼类生长减慢、存活率及繁殖力降低[9-10]。
黄鳝(Monopterus albus)属合鳃目,合鳃科,因其具有营养丰富、味道鲜美、无肌间刺且含肉率高等特点而广受消费者欢迎。近年来,黄鳝养殖业得到了长足的发展,现已成为我国重要的水产养殖品种之一[11]。为获得更好的养殖效益,人们对黄鳝营养需求进行了诸多研究,但以往的研究多集中在黄鳝蛋白质及脂肪需求方面[12-13],对其矿物质需求的研究则鲜有报道。因此,本试验拟通过研究不同铜水平饲料对黄鳝生长、血清生化指标和组织铜蓄积的影响,探究黄鳝的适宜铜需求量,为确定饲料中铜水平和保障黄鳝食品安全提供参考。
1 材料与方法 1.1 试验设计及材料于江西农业大学水产养殖基地挑选600尾均重为(62.09±1.07) g的无病无伤、体质健康、活力较佳的黄鳝作为试验动物。将黄鳝随机分为5组,每组4个重复,每个重复30尾,以重复为单位在规格为88 cm×66 cm×64 cm的蓝色塑料箱进行静水养殖,在养殖箱内放置水葫芦,试验开始前7天消毒,养殖用水为曝气后自来水。
试验采用五水硫酸铜(CuSO4·5H2O,分析纯,西陇科学股份有限公司产品)作为饲料铜源,其余饲料原料均购于江西大佑农生物科技有限公司。为使试验饲料铜水平涵盖低铜至高铜,饲料铜水平梯度设计为等对数间距(log10),在基础饲料中分别添加0、10.0、36.8、135.7、500.0 mg/kg含量的铜,实测饲料铜水平分别为14.21、23.95、37.01、135.63、499.63 mg/kg。所有原料均粉碎过80目,制粒时先将五水硫酸铜加入预混料充分混匀,逐级混匀所有原料后调质制粒。试验饲料组成及营养水平见表 1。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验养殖工作在江西农业大学水产养殖基地进行,试验时间为2019年4月6日至2019年6月5日,共60 d。养殖期间保持养殖箱内水质良好、自然水温(21~30 ℃),水葫芦覆盖面积占水面的2/3。每日投喂1次,投喂时间为18:00,饲料每次投放于固定位置,投喂时先投喂部分饲料,根据黄鳝吃食状态酌情补料,使黄鳝将饲料全部吃完,记录每次投料量。
1.3 样品采集及分析方法 1.3.1 生长性能与形态参数测定养殖试验结束后取样,取样前停食1 d。称取每个养殖箱黄鳝总重及条数,计算增重率(WGR)、特定生长率(SGR)、饲料系数(FCR);从每个养殖箱中随机抽取4尾黄鳝(每组16尾),称重、测量体长后采血,采血完成后将黄鳝置于无菌工作台上进行低温解剖,依次取内脏团、肝脏、肠道、脾脏组织称重,计算脏体比(VSI)、肝体比(HSI)、肠体比(CI)、脾体比(SI)、胴体率(CP)和肥满度(CF)。相关指标计算公式如下:

|
式中:W1、W2分别代表试验黄鳝初均重和末均重(g);t代表养殖天数(d);F代表摄食量(g);WV、WH、WI、WS、WC及W分别代表取样黄鳝内脏团、肝脏、肠道、脾脏、胴体及全鱼重(g);L代表取样黄鳝体长(cm)。
1.3.2 营养成分含量黄鳝和饲料水分含量测定参考GB/T 6435—2014,粗灰分含量测定参考GB/T 6438—2007,粗脂肪含量测定参考GB/T 6433—2006,粗蛋白质含量测定参考GB/T 6432—1994。
1.3.3 饲料铜水平及黄鳝各组织铜蓄积量测定饲料铜水平及黄鳝各组织铜蓄积量测定方法参照GB 5009.13—2017中第2法(火焰原子吸收光谱法),采用湿法消解进行样品前处理,原子吸收器型号为TAS-990A(北京普析通用仪器有限责任公司)。
1.3.4 血清生化指标测定采血完成后将血液于4 ℃环境中静置过夜,再于4 ℃条件下以3 500 r/min离心15 min,取上清液于-80 ℃超低温保存待测血清中谷丙转氨酶(GPT)、谷草转氨酶(GOT)、碱性磷酸酶(AKP)、溶菌酶(LZM)、Cu-Zn SOD活性及T-AOC。上述指标测定所用试剂盒均购于南京建成生物工程研究所,测定步骤参照试剂盒操作说明书。
1.4 数据处理与分析试验结果采用平均值±标准误(mean±SE)表示,用SPSS 22.0软件进行单因素方差分析(one-way ANOVA),若组间差异显著,再采用Duncan氏法进行多重比较,显著水平为P<0.05。
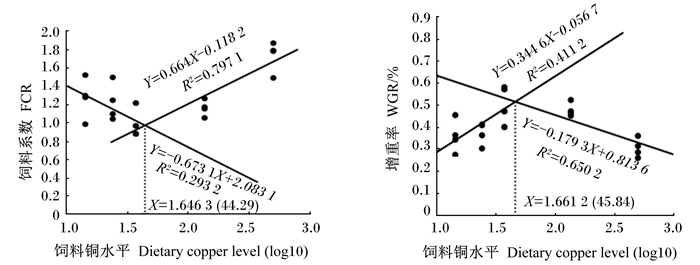
2 结果与分析 2.1 饲料铜水平对黄鳝生长性能的影响由表 2可知,随着饲料铜水平的升高,黄鳝的增重率、特定生长率呈先上升后下降的趋势,饲料系数则呈先下降后上升的趋势,黄鳝在饲料铜水平为37.01 mg/kg时有最佳的生长表现及饲料效率。以饲料系数和增重率作为评价指标,通过折线回归分析得出黄鳝对饲料中铜的需求量分别为44.29、45.84 mg/kg(图 1)。
|
|
表 2 饲料铜水平对黄鳝生长性能的影响 Table 2 Effects of dietary copper level on growth performance of rice field eel (Monopterus albus) |
|
图 1 以饲料系数和增重率为评价指标通过折线回归分析黄鳝对饲料中铜的需求量 Fig. 1 Analysis of dietary copper requirement of rice field eel (Monopterus albus) by broken line regression with FCR and WGR as evaluation indexes |
由表 3可知,饲料铜水平对黄鳝的脏体比、肝体比、肠体比、脾体比、胴体率和肥满度均无显著影响(P>0.05)。
|
|
表 3 饲料铜水平对黄鳝形态参数的影响 Table 3 Effects of dietary copper level on morphological parameters of rice field eel (Monopterus albus) |
由表 4可知,饲料铜水平对黄鳝全鱼水分、粗蛋白质及粗脂肪含量无显著影响(P>0.05),全鱼粗灰分含量则在表现出随饲料铜水平的升高而增加的趋势,135.63、499.63 mg/kg铜组显著高于14.21、23.95、37.01 mg/kg铜组(P < 0.05)。
|
|
表 4 饲料铜水平对黄鳝体成分的影响 Table 4 Effects of dietary copper level on body composition of rice field eel (Monopterus albus) |
由表 5可知,499.63 mg/kg铜组全鱼、肝脏、肠道、脾脏、皮肤中铜蓄积量均为最高,显著高于其他各组(P < 0.05),肾脏及肌肉中铜蓄积量各组间则无显著差异(P>0.05)。观察黄鳝各组织中铜蓄积量的高低可以发现,铜主要蓄积于肝脏及肠道,且蓄积量受饲料铜水平的影响,铜水平为499.63 mg/kg时肝脏和肠道中铜蓄积量分别是铜水平为14.21 mg/kg时的59.28和9.07倍。随着饲料铜水平的升高,脾脏中铜蓄积量无明显规律变化,脾脏铜蓄积量在铜水平为499.63 mg/kg时最高,在铜水平为37.01 mg/kg时次之,并显著高于铜水平为14.21、23.95、135.63 mg/kg时(P<0.05)。
|
|
表 5 饲料铜水平对黄鳝组织铜蓄积的影响(鲜重基础) Table 5 Effects of dietary copper level on copper accumulation in tissues of rice field eel (Monopterus albus) (fresh weight basis) |
由表 6可知,饲料铜水平对黄鳝血清GOT、AKP、LZM活性无显著影响(P>0.05)。随着饲料铜水平的升高,黄鳝血清GPT、Cu-Zn SOD活性和T-AOC先升高后趋于平稳,其中血清GPT活性表现为135.63、499.63 mg/kg铜组显著高于14.21、23.95、37.01 mg/kg铜组(P < 0.05),血清Cu-Zn SOD活性和T-AOC表现为37.01、135.63、499.63 mg/kg铜组显著高于14.21、23.95 mg/kg铜组(P < 0.05)。
|
|
表 6 饲料铜水平对黄鳝血清生化指标的影响 Table 6 Effects of dietary copper level on serum biochemical indexes of rice field eel (Monopterus albus) |
养殖动物生长速度及对饲料效率的高低是衡量饲料营养是否全面的重要指标。本试验中,14.21、23.95及499.63 mg/kg铜组黄鳝的增重率与饲料系数较差,说明饲料铜缺乏或过量均会抑制黄鳝的生长,降低饲料效率。以饲料系数及增重率为评价指标,通过折线回归分析表明,黄鳝饲料铜水平以44.29~45.84 mg/kg为宜。已有研究表明,对饲料中铜需求量黑带石斑鱼为2~3 mg/kg[4]、黄颡鱼为3.1~4.2 mg/kg[6]、俄罗斯鲟为7~8 mg/kg[14]、欧洲鳇为10~13 mg/kg[15]、斑点叉尾为20.2 mg/kg[3]、团头鲂幼鱼为25.17~25.65 mg/kg[16],均低于本试验得出的黄鳝对饲料中铜的需求量,这可能与黄鳝栖息习性有关。自然条件下水体中的重金属通常在水底部沉积[17],黄鳝为营底栖穴居生活的肉食性鱼类,长期生活在水环境底部并以底栖生物为食,这使得黄鳝更易富集铜元素,这可能在一定程度上强化了黄鳝对铜的利用能力,因而对饲料中铜的需求量较高。
3.2 饲料铜水平对黄鳝形体参数及体成分的影响研究发现,升高饲料铜水平会显著降低黄颡鱼的肝体比、脏体比及全鱼粗脂肪含量[6];高铜饲料(铜水平为2 400 mg/kg)导致鲻鱼肝体比和肥满度显著降低[18];饲料铜水平超过900 mg/kg时会引起大西洋鲑肥满度显著降低[19];饲料铜水平升高会显著降低异育银鲫和斑点叉尾的肝体比[20]。但也有研究发现不同铜水平饲料对大黄鱼[8]、俄罗斯鲟[14]的形态参数及体成分无显著影响。上述试验结果的不同可能与试验对象、试验周期、试验饲料铜水平及养殖环境的差异有关。在本试验中,饲料铜水平的差异不足以造成各组间黄鳝形体参数及全鱼水分、粗蛋白质、粗脂肪含量的显著差异;全鱼粗灰分含量则随着饲料铜水平的升高而增加,这与在黄颡鱼[6]及欧洲鳇[15]上的研究结果相似,推测造成此试验结果的主要原因是矿物元素间的相互作用。
3.3 饲料铜水平对黄鳝组织铜蓄积的影响鱼类肝脏是铜的主要代谢器官,在铜摄入过量时,过多的铜可积累在肝脏,进而缓解高铜带来的毒性,当铜摄入不足时,肝脏中储存的铜又可被机体利用[21]。在本试验中,黄鳝肝脏铜蓄积量最高,与在斑点叉尾[3]、黑带石斑鱼[4]及大黄鱼[8]上所得研究结果相同。全鱼铜蓄积量可作为衡量鱼类铜营养水平的优良指标[9]。本试验中,在14.21、23.95、37.01 mg/kg铜组之间全鱼铜蓄积量差异不显著时,肝脏铜蓄积量却出现了显著差异,结合这3组黄鳝的生长表现,笔者认为肝脏铜蓄积量能够更切实的反映黄鳝铜营养状况。
肠道是鱼类吸收并转运饲料铜的主要器官。在本试验中,肠道铜蓄积量在低铜(铜水平为14.21、23.95、37.01 mg/kg)组与高铜(铜水平为135.63、499.63 mg/kg)组间出现显著差异,但全鱼铜蓄积量在14.21、23.95、37.01及135.63 mg/kg铜组间差异不显著,表明饲料铜水平低于需求量时黄鳝肠道对饲料铜具有较强的吸收能力,饲料铜水平高于需求量时黄鳝肠道在一定程度上能够减少铜的吸收和转运,维持机体铜水平的相对稳定。Clearwater等[22]在对虹鳟铜吸收与分布的研究中发现注射至胃中的铜离子(Cu2+)浓度由26 mg/kg提升至192 mg/kg时,肠道对过量铜吸收的屏障能力被抑制,内脏中的铜离子浓度迅速升高。刘博等[23]认为高铜损伤肠道的机制为:过量铜通过芬顿反应产生大量的羟自由基引起肠道细胞死亡脱落,造成肠道氧化损伤,进而引发肠道功能障碍。本试验中,饲料铜水平达到499.63 mg/kg时黄鳝全鱼铜蓄积量显著上升,这表明黄鳝肠道对过高水平铜饲料的转运抵抗屏障能力有限,过量的铜可能造成黄鳝肠道损伤,进而破坏肠道对铜的屏障作用。
脾脏是鱼类重要的造血及免疫器官。蒋蓉[24]在黄颡鱼饲料中补充铜,造成脾脏铜蓄积量增加的同时提升了黄颡鱼的免疫活性。饲料铜水平升高引起试验鱼脾脏铜蓄积量增加的现象同样见于吉富罗非鱼[25-26]。本试验中,37.01 mg/kg铜组黄鳝的生长表现最佳的同时还显著提升了脾脏铜蓄积量,推测脾脏可能是铜发挥生理功能的重要器官。
人工养殖水产动物最终目的是快速获取更多优质的肉制品供人食用,重金属在肌肉中的沉积与消费者健康关系密切[2],因此了解清楚饲料铜是否会在水产动物肌肉中过量蓄积对于水产养殖业具有重要意义。在本试验中,除499.63 mg/kg铜组黄鳝肝脏铜蓄积量超标外,全鱼及其他组织铜蓄积量均符合我国GB 18406.4—2001[27]及NY 5073—2006[28]中规定的铜蓄积量≤50 mg/kg的要求,且不同铜水平饲料对黄鳝肌肉铜蓄积量无显著影响且肌肉铜最高蓄积量仅为0.48 mg/kg,这与在斑点叉尾[3],黄颡鱼[6]、大黄鱼[8]及吉富罗非鱼[25-26]上所得研究结果一致,但在凡纳滨对虾上的研究发现饲料中补充铜显著提升了凡纳滨对虾肌肉铜蓄积量[29],产生不同的结果可能与鱼类和甲壳动物生理功能存在差异有关。
3.4 饲料铜水平对黄鳝血清生化指标的影响血清GPT、GOT活性可作为反映鱼类肝脏受损伤程度的有效指标[30]。Kim等[21]用铜水平为50~500 mg/kg的饲料饲喂许氏平鲉60 d,结果发现许氏平鲉血清GPT、GOT活性显著上升;Al-Akel等[31]用铜水平为250~1 000 mg/kg的饲料饲喂鲤鱼60 d,结果发现鲤鱼血清GPT、GOT活性均显著上升;然而,斑点叉尾摄食铜水平为11.1~51.1 mg/kg的饲料42 d后血清GPT、GOT活性则无显著变化[3]。在本试验中,高铜(铜水平为135.63、499.63 mg/kg)组黄鳝血清GPT活性显著高于低铜(铜水平为14.21、23.95、37.01 mg/kg)组,且135.63、499.63 mg/kg铜组之间差异不显著,表明高铜饲料可能造成黄鳝肝脏细胞损伤,但这种损伤程度未因饲料铜水平的继续上升而加剧。
Cu-Zn SOD是动物体内主要的抗氧化酶之一,占总超氧化物歧化酶(T-SOD)的90%[32],其活性高低被认为是评价动物铜营养状况的优良指标[14]。在本试验中,饲料铜水平达到37.01 mg/kg及以上时黄鳝血清T-AOC及Cu-Zn SOD活性显著上升,表明饲料铜水平上升可促进黄鳝机体抗氧化性能的提升。同样,在俄罗斯鲟[14]、凡纳滨对虾[33]上的研究也发现摄食适宜铜水平的饲料时抗氧化能力得到了显著提升。
血清AKP、LZM活性可有效反映机体免疫状况。研究发现,43.1、78.9 mg/kg铜水平的饲料显著提升了日本沼虾血清AKP、LZM活性[34];100~150 mg/kg铜水平的饲料则显著提升了团头鲂血清AKP活性[7]。但在本试验中,不同铜水平的饲料对黄鳝血清AKP、LZM活性无显著影响,产生不同的结果可能与试验鱼种类、试验饲料铜水平存在一定关系,具体机理还需进一步研究。
4 结论在基础饲料中适量添加铜可提升黄鳝机体的的抗氧化性能,获取更佳的生长性能,但过量添加铜则会对黄鳝的增重率、饲料系数、肝脏功能造成不良影响。以增重率和饲料系数为评价指标,60~95 g的黄鳝对饲料中铜的需求量为44.29~45.84 mg/kg。
| [1] |
麦康森. 水产动物营养与饲料学[M]. 2版. 北京: 中国农业出版社, 2011: 95.
|
| [2] |
常显志, 吴志强, 黄亮亮, 等. 漓江5种常见食用经济鱼类重金属含量分析[J]. 环境科学与技术, 2017, 40(9): 203-208. |
| [3] |
万祖德.叶黄素、氧化豆油、铜和血球蛋白粉对斑点叉尾生长和体色的影响[D].硕士学位论文.上海: 上海海洋大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10264-1016912295.htm
|
| [4] |
LIN Y H, SHIE Y Y, SHIAU S Y. Dietary copper requirements of juvenile grouper, Epinephelus malabaricus[J]. Aquaculture, 2008, 274(1): 161-165. DOI:10.1016/j.aquaculture.2007.11.006 |
| [5] |
叶超霞, 刘永坚, 田丽霞, 等. 饲料中高水平铜对斜带石斑鱼(Epinephelus coioides)生长和铜、铁、锰、锌含量的影响[J]. 海洋与湖沼, 2013, 44(3): 606-610. |
| [6] |
TAN X Y, LUO Z, LIU X, et al. Dietary copper requirement of juvenile yellow catfish Pelteobagrus fulvidraco[J]. Aquaculture Nutrition, 2011, 17(2): 170-176. DOI:10.1111/j.1365-2095.2009.00720.x |
| [7] |
SHAO X P, LIU W B, LU K L, et al. Effects of tribasic copper chloride on growth, copper status, antioxidant activities, immune responses and intestinal microflora of blunt snout bream (Megalobrama amblycephala) fed practical diets[J]. Aquaculture, 2012, 338-341: 154-159. DOI:10.1016/j.aquaculture.2012.01.018 |
| [8] |
CAO J J, MIAO X, XU W, et al. Dietary copper requirements of juvenile large yellow croaker Larimichthys croceus[J]. Aquaculture, 2014, 432: 346-350. DOI:10.1016/j.aquaculture.2014.05.032 |
| [9] |
BERNTSSEN M H G, LUNDEBYE A K, HAMRE K. Tissue lipid peroxidative responses in Atlantic salmon (Salmo salar L.) parr fed high levels of dietary copper and cadmium[J]. Fish Physiology and Biochemistry, 2000, 23(1): 35-48. DOI:10.1023/A:1007894816114 |
| [10] |
CLEARWATER S J, FARAG A M, MEYER J S. Bioavailability and toxicity of dietborne copper and zinc to fish[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2002, 132(3): 269-313. |
| [11] |
罗鸣钟, 斳恒, 杨代勤. 黄鳝生物学及养殖生态学研究进展[J]. 水产科学, 2014, 33(8): 529-534. DOI:10.3969/j.issn.1003-1111.2014.08.014 |
| [12] |
闫建林, 储张杰, 龚世园, 等. 饲料蛋白质含量对黄鳝生长的影响[J]. 湖北农业科学, 2009, 48(1): 156-158. DOI:10.3969/j.issn.0439-8114.2009.01.045 |
| [13] |
王松, 储张杰, 龚世园, 等. 饲料中脂肪含量对黄鳝生长的影响[J]. 水利渔业, 2008, 28(3): 67-68. DOI:10.3969/j.issn.1003-1278.2008.03.025 |
| [14] |
王和伟.俄罗斯鲟Acipenser gueldenstaedtii幼鱼对饲料铜的需要和利用研究[D].博士学位论文.上海: 华东师范大学, 2017: 37-38. http://cdmd.cnki.com.cn/Article/CDMD-10269-1018036754.htm
|
| [15] |
MOHSENI M, POURKAZEMI M, BAI S C. Effects of dietary inorganic copper on growth performance and immune responses of juvenile beluga, Huso huso[J]. Aquaculture Nutrition, 2014, 20(5): 547-556. DOI:10.1111/anu.12107 |
| [16] |
刘汉超.团头鲂(Megalobrama amblycephala)Fe、Cu、Zn、P需要量的研究[D].硕士学位论文.苏州: 苏州大学, 2014. http://d.wanfangdata.com.cn/Thesis/D506635
|
| [17] |
吴红岩, 赵金良, 唐首杰, 等.华东地区鳜肌肉重金属含量现状与风险分析[J/OL].生态毒理学报, 2019: 1-15.[2019-12-11].http://kns.cnki.net/kcms/detail/11.5470.X.20190828.1754.002.html.
|
| [18] |
BAKER R T M, HANDY R D, DAVIES S J, et al. Chronic dietary exposure to copper affects growth, tissue lipid peroxidation, and metal composition of the grey mullet, Chelon labrosus[J]. Marine Environmental Research, 1998, 45(4/5): 357-365. |
| [19] |
BERNTSSEN M H G, LUNDEBYE A K, MAAGE A. Effects of elevated dietary copper concentrations on growth, feed utilisation and nutritional status of Atlantic salmon (Salmo salar L.) fry[J]. Aquaculture, 1999, 74(1/2): 167-181. |
| [20] |
种香玉, 周立志, 韩冬, 等. 饲料中铜浓度对异育银鲫和斑点叉尾的影响[J]. 水生生物学报, 2014, 38(4): 751-763. |
| [21] |
KIM S G, KANG J C. Effect of dietary copper exposure on accumulation, growth and hematological parameters of the juvenile rockfish, Sebastes schlegeli[J]. Marine Environmental Research, 2004, 58(1): 65-82. DOI:10.1016/j.marenvres.2003.12.004 |
| [22] |
CLEARWATER S J, BASKIN S J, WOOD C M, et al. Gastrointestinal uptake and distribution of copper in rainbow trout[J]. Journal of Experimental Biology, 2000, 203(16): 2455-2466. |
| [23] |
刘博, 杨文艳, 杨连玉. 铜肠道稳态平衡调控机制研究进展[J]. 中国畜牧兽医, 2017, 44(9): 2662-2667. |
| [24] |
蒋蓉.铜、铁、锰、锌对黄颡鱼生长和生理机能的影响[D].硕士学位论文.苏州: 苏州大学, 2006: 58-59. http://cdmd.cnki.com.cn/Article/CDMD-10285-2006156508.htm
|
| [25] |
崔欣.日粮中高铜对吉富罗非鱼生长、消化及与铜代谢相关生理机能影响的研究[D].硕士学位论文.湛江: 广东海洋大学, 2013: 49. http://d.wanfangdata.com.cn/Thesis_D329394.aspx
|
| [26] |
王文龙, 崔欣, 李成成, 等. 饲料中铜暴露对吉富罗非鱼幼鱼血红细胞微核和组织中铜蓄积的影响[J]. 生态毒理学报, 2014, 9(4): 757-764. |
| [27] |
中华人民共和国国家质量监督检验检疫总局.GB 18406.4-2001农产品安全质量无公害水产品安全要求[S].北京: 中国标准出版社, 2004.
|
| [28] |
国家水产品质量监督检验中心.NY 5073-2006无公害食品水产品中有毒有害物质限量[S].北京: 中国标准出版社, 2006.
|
| [29] |
刘伟, 文华, 吴建开, 等. 高铜饲料对凡纳滨对虾生长、肌肉和肝胰脏铜积累的影响[J]. 淡水渔业, 2008, 38(2): 12-16. DOI:10.3969/j.issn.1000-6907.2008.02.003 |
| [30] |
唐涛, 钟蕾, 郇志利, 等. 3种大豆产品替代鱼粉对黄鳝生长性能、肠道消化酶活性和血清生化指标的影响[J]. 动物营养学报, 2019, 31(2): 970-980. DOI:10.3969/j.issn.1006-267x.2019.02.055 |
| [31] |
AL-AKEL A S, AL-BALAWI H F A, AL-MISNED F, et al. Effects of dietary copper exposure on accumulation, growth, and hematological parameters in Cyprinus carpio[J]. Toxicological & Environmental Chemistry, 2010, 92(10): 1865-1878. |
| [32] |
王昌禄, 曹俊武, 王玉荣, 等. 铜锌超氧化物歧化酶(SOD)研究进展--从基因到功能[J]. 现代生物医学进展, 2008, 8(5): 940-943. |
| [33] |
董晓慧, 杨原志, 郑石轩, 等. 饲料中不同铜源和水平对凡纳滨对虾生长、免疫和组织铜含量的影响[J]. 大连水产学院学报, 2007(5): 377-383. DOI:10.3969/j.issn.1000-9957.2007.05.012 |
| [34] |
孔有琴.日本沼虾(Macrobrachium nipponense)幼虾的铜营养生理研究[D].博士学位论文.上海: 华东师范大学, 2014: 38-39. http://cdmd.cnki.com.cn/Article/CDMD-10269-1014326210.htm
|




