2. 广东省农业科学院动物科学研究所, 广州 510640;
3. 农业部华南动物营养与饲料重点实验室, 广州 510640;
4. 广东省动物育种与营养公共实验室, 广州 510640;
5. 广东省畜禽育种与营养研究重点实验室, 广州 510640
2. Institute of Animal Science, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China;
3. Key Laboratory of Animal Nutrition and Feed Science in South China of Ministry of Agriculture, Guangzhou 510640, China;
4. Guangdong Public Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China;
5. Guangdong Key Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China
近年来的研究表明,肠道菌群与人类和动物健康息息相关[1-4],肠道菌群通过对摄入的食物进行分工加工,以直接接触、代谢产物等方式与肠道黏膜联系在一起,构成了复杂的微生态系统[5]。而肠道黏膜与食物储存、消化和营养吸收息息相关[6]。黄酮类化合物是以2-苯基色原酮为基本母核的一类植物次生代谢产物,具有抗菌、消炎、抗氧化、抗病毒、抗癌等生物活性[7]。桑叶黄酮(mulberry leaf flavonoids),即从桑叶中提取的黄酮类化合物。杨继华等[8]、陈冰等[9]研究了桑叶黄酮对吉富罗非鱼(Oreochromis niloticus)生长性能、抗氧化能力及肌肉氨基酸组成的研究,结果表明桑叶黄酮可提高吉富罗非鱼的抗氧化应激能力。此外,研究表明黄酮类化合物在代谢过程中依赖肠道菌群的转化[10],影响肠道菌群的组成和数量[11-13],对水产动物肠道绒毛发育有一定的影响[14-15]。凡纳滨对虾(Litopenaeus vannamei),又称南美白对虾,是世界产量最高的三大虾种之一[16]。随着消费需求的增加,凡纳滨对虾养殖业得到快速发展,但集约化、高密度的养殖模式伴随而来的水质污染、疾病爆发等一系列问题,造成水产动物免疫力和抗应激能力下降。为改善这一问题,预防性和治疗性抗生素在养殖过程中大量使用,造成细菌耐药性,引发健康问题和环境问题。因此,本试验以凡纳滨对虾为养殖对象,通过对肠道组织结构观察和16S rRNA测序,研究桑叶黄酮对凡纳滨对虾肠道黏膜形态和肠道菌群的影响,为桑叶黄酮改善凡纳滨对虾肠道健康提供理论依据。
1 材料与方法 1.1 试验饲料以鱼粉、豆粕和花生麸为蛋白质源,鱼油和磷脂油为脂肪源,高筋面粉为糖源配制基础饲料,其组成及营养水平见表 1。在基础饲料中分别添加0、50、100、150、300 mg/kg桑叶黄酮,配制5种试验饲料,分别标记为G0、G50、G100、G150、G300。试验所用桑叶黄酮(主要成分为黄酮和黄酮醇类,纯度为81.40%)由广东省农业科学院蚕业与农产品加工所提供。饲料原料经粉碎后过60目筛,微量成分采取逐级扩大法添加,桑叶黄酮先溶于水配制成液体,将该液体与混合好的饲料原料均匀混合,保持足够水分,在NH-10捏合机中加入鱼油和磷脂油,混合均匀后,用SLX-80型双螺杆挤压机(华南理工大学科技实业总厂生产)和G-500型造粒机(华南理工大学科技实业总厂生产)制成粒径为1.5 mm的颗粒饲料,55 ℃烘干,自然冷却,筛去粉末和破碎小颗粒饲料后放入封口袋排出空气密封,于-20 ℃冰箱中保存备用。
|
|
表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验虾购买于广东中山市龙泽水产养殖有限公司,于3.0 m×2.0 m×1.2 m的水泥池中暂养2周,每天以基础饲料投喂2次。养殖试验在广东省农业科学研究院动物科学研究所水产室室内循环养殖系统(玻璃纤维桶,体积约300 L)中进行。选取初始体重为(1.32±0.01) g的凡纳滨对虾800尾,随机分为5组,每组4个重复,每个重复40尾虾。5组对虾随机饲喂1种试验饲料,以饱食投喂的方式每天投喂3次(08:00、14:00和20:00)。养殖水体为天然海水经过滤、消毒后与自来水混合配制的盐度为5‰~6‰的淡盐水,曝气1 d后再加入养殖系统,每周换水2次,每次换水量为总水量的1/3,从养殖第4周开始每天排污(约占总水量1/10)。养殖期间水体氨氮浓度≤0.2 mg/L,亚硝酸盐浓度≤0.05 mg/L,溶氧浓度≥7.0 mg/L,采用自然光照,水温27~30 ℃。养殖试验为期50 d。
1.3 样品采集养殖试验结束后,禁食24 h,每个重复随机取3尾对虾的中肠,置于10%福尔马林溶液中保存,用于肠道组织切片制作,观察肠道黏膜形态结构。每个重复再随机取5尾对虾,置于冰面上,在酒精灯旁用75%的酒精擦拭体表,活体解剖,取完整肠道,立即装入2 mL Eppendorf管中液氮速冻3~4 h,再转移到-80 ℃保存,用于肠道菌群结构分析。
1.4 生物信息分析以16S DNA“V3+V4”高变区的序列设计引物,进行肠道菌群总DNA的PCR扩增,引物序列为338F:5′-ACTCCTACGGGAGGCAGCAG-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′。采用MiSeq高通量测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行操作分类单元(OTU)聚类分析和物种分类学分析,基于OTU进行alpha多样性分析,包括物种覆盖度(Coverage指数)、丰富度(Chao指数和Ace指数)和多样性(Shannon指数和Simpson指数);基于分类学信息,在各个分类水平上进行群落结构的统计分析。
1.5 数据处理与分析肠道菌群分析全部基于OUT分析,对97%相似水平下的OTU进行统计学分析。试验结果用“平均值±标准差”(mean±SD)表示。数据均在采用SPSS 22.0软件的one-way ANOVA程序进行单因素方差分析,并采用Duncan氏法进行多重比较,P < 0.05表示差异显著。
2 结果 2.1 桑叶黄酮对凡纳滨对虾肠道黏膜形态的影响如图 1所示,各桑叶黄酮添加组(G50、G100、G150、G300组)肠道绒毛高度均高于未添加组(G0组),发育状态良好。结合表 2测量情况可知,各桑叶黄酮添加组肠道绒毛高度均显著高于未添加组(P < 0.05),且G100组还显著高于其他桑叶黄酮添加组(P < 0.05);此外,G50组肠道肌层厚度显著高于其他各组(P < 0.05)。
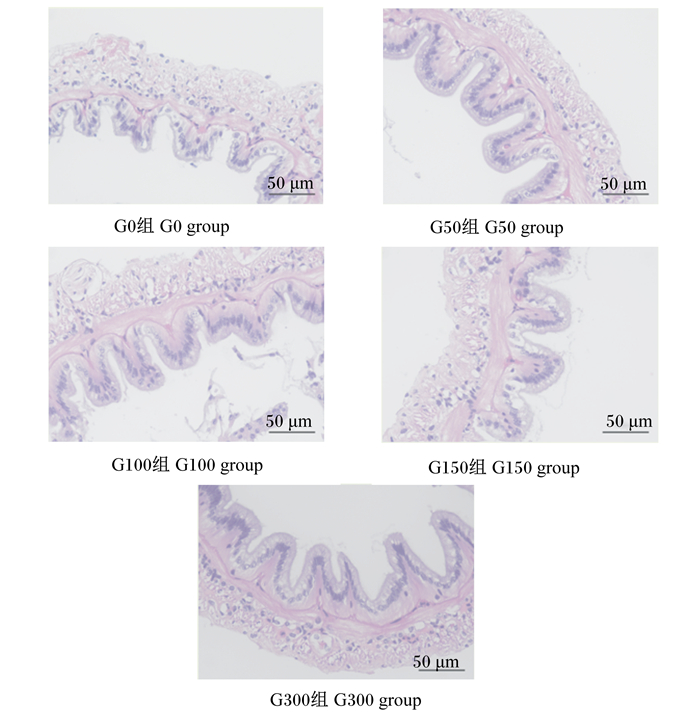
|
图 1 各组凡纳滨对虾肠道黏膜形态 Fig. 1 Intestinal mucosal morphology of Litopenaeus vannamei in each group |
|
|
表 2 桑叶黄酮对凡纳滨对虾肠道绒毛高度和肌层厚度的影响 Table 2 Effects of mulberry leaf flavonoids on intestinal villus height and muscular layer thickness of Litopenaeus vannamei |
由表 3可知,各组Coverage指数均为1.00,表明测序深度已覆盖样品所有物种。各组间Chao指数和Ace指数均无显著差异(P>0.05),表明桑叶黄酮对凡纳滨对虾肠道菌群丰富度无显著影响;Shannon指数和Simpson指数均有显著性差异(P < 0.05),各桑叶黄酮添加组Shannon指数均显著高于未添加组(P < 0.05),并以G50组最高且显著高于其他桑叶黄酮添加组(P < 0.05),而Simpson指数的变化趋势与Shannon指数恰好相反,表明G50组肠道菌群多样性最复杂。
|
|
表 3 桑叶黄酮对凡纳滨对虾肠道菌群alpha多样性的影响 Table 3 Effects of mulberry leaf flavonoids on alpha diversity of intestinal flora of Litopenaeus vannamei |
由凡纳滨对虾肠道菌群Venn图(图 2)可知,G0、G50、G100、G150、G300组OTU数目分别为498、558、454、541、559,呈先增加后降低再增加的趋势,各组共有OTU数目为307,分别占总OTU数目的61.65%、55.02%、67.62%、56.75%、54.94%;G0、G50、G100、G150、G300组独有OTU数目分别为13、18、3、42、20,分别占总OTU数目的2.61%、3.21%、0.66%、7.76%、3.58%。
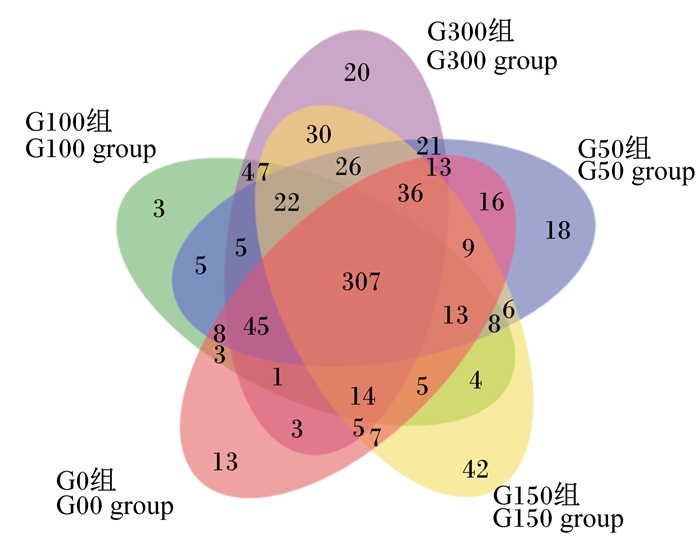
|
图 2 凡纳滨对虾肠道菌群Venn图 Fig. 2 Venn map of intestinal flora of Litopenaeus vannamei |
由图 3可知,在门水平上,肠道菌群主要以变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)为主,各组3个门所占的比例均在95%以上,对这3个门的丰度进行组间显著性分析,结果见表 4。在门水平上,与未添加组相比,各桑叶黄酮添加组变形菌门的相对丰度均显著增加(P < 0.05),其中G100组变形菌门的相对丰度高达66.42%,显著高于其他桑叶黄酮添加组(P < 0.05),高出未添加组约2倍;厚壁菌门的相对丰度在G100组最低,G300组最高;与未添加组相比,各桑叶黄酮添加组放线菌门的相对丰度显著下降(P < 0.05),以G100组最低。由表 5可知,在属水平上,桑叶黄酮添加量对前5种优势菌群的相对丰度有显著影响(P < 0.05),其中红球菌属和乳球菌属的相对丰度在G100组最低,弧菌属和希瓦氏菌属的相对丰度在G100组最高,红杆菌属的相对丰度在G150组最高。
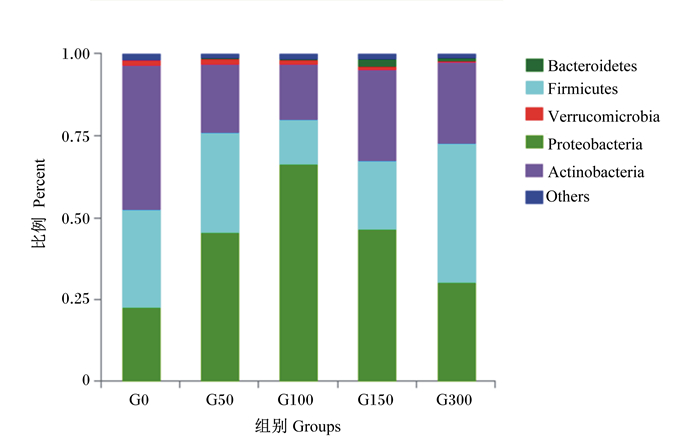
|
拟杆菌门:Bacteroidetes;疣微菌门:Verrucomicrobia;放线菌门Actinobacteria;厚壁菌门Firmicutes;变形菌门:Proteobacteria;Others:其他。 图 3 凡纳滨对虾肠道菌群在门水平上的组成 Fig. 3 Intestinal flora composition of Litopenaeus vannamei at phylum level |
|
|
表 4 桑叶黄酮对凡纳滨对虾肠道菌群门水平上组成的影响 Table 4 Effects of mulberry leaf flavonoids on intestinal flora composition of Litopenaeus vannamei at phylum level |
|
|
表 5 桑叶黄酮对凡纳滨对虾肠道菌群属水平上组成的影响 Table 5 Effects of mulberry leaf flavonoids on intestinal flora composition of Litopenaeus vannamei at genus level |
通过线性回归分析桑叶黄酮添加量(X)与弧菌属的相对丰度(Y)之间的关系,得到的回归方程为:Y=-0.001X2+0.275X+8.470(R2=0.776),得出弧菌属相对丰度最高时的桑叶黄酮添加量为137.5 mg/kg。
3 讨论 3.1 桑叶黄酮对凡纳滨对虾肠道黏膜形态的影响肠道是营养物质消化吸收的主要场所,绒毛高度和肌层厚度是影响动物对营养物质进行吸收的重要因素,绒毛高度和肌层厚度增加可提高肠道对营养物质的消化和吸收能力。研究表明适量的黄酮类化合物可促进肠道上皮细胞DNA的合成,并通过增加细胞内碱性磷酸酶活性促进肠道细胞生长[17];同时,黄酮类化合物也可通过抑制Notch信号相关配体和受体基因的表达,对小肠黏膜上皮细胞的增殖分化进行调节[18],且Notch通过控制分泌细胞和吸收细胞类型之间的平衡来调控肠道发育[19];此外,由于黄酮类化合物在体内代谢与肠道菌群密切相关,其在肠道菌群的代谢下所生成的产物也可能促进肠道发育,但具体作用机制还需进一步研究。本研究结果表明,在饲料中添加桑叶黄酮能促进凡纳滨对虾肠道绒毛发育,且添加50 mg/kg桑叶黄酮还可增加肠道肌层厚度。胡海滨等[20]研究发现在饲料中添加适量大豆黄酮可促进大菱鲆(Scophthalmus maximus)肠道组织结构发育和成熟,这与本试验研究结果一致。但是,另有研究表明在大菱鲆饲料中添加高剂量染料木黄酮[12]和在异育银鲫(Carassius auratus gibelio ♀×Cyprinus carpio)饲料中添加高剂量大豆皂苷对肠道绒毛发育有一定损害作用[13]。在本试验中,即使是最高添加量300 mg/kg,桑叶黄酮也并未对凡纳滨对虾肠道绒毛发育产生负面影响,这可能是由于试验周期较短,也可能是由于300 mg/kg的桑叶黄酮并未达到可损坏肠道绒毛的剂量。
3.2 桑叶黄酮对凡纳滨对虾肠道菌群的影响肠道各项生理功能的正常运行与肠道菌群、肠道上皮细胞以及免疫系统之间的动态平衡紧密相连[21]。肠道菌群的紊乱可能造成免疫系统的破坏,引发炎症等一些健康问题。黄酮类化合物与肠道菌群在动物体内相互作用,肠道菌群可参与黄酮类化合物在体内的转化,如梭菌属(Clostridium)、拟杆菌属(Bacteroides)、芽孢杆菌属(Bacillus)等参与黄酮类化合物在体内的代谢,发挥更强的生理功能[22-23];同时,黄酮类化合物可通过扶植正常菌群的生长,调节微生态失衡,如青钱柳黄酮能有效促进人体肠道有益菌中双歧杆菌和乳酸菌的增殖,而对梭状菌和拟杆菌的增殖有抑制作用[9],藤三七类黄酮能改善小鼠肠道细菌紊乱[10],原花青素二聚体能够显著提高衰老模型小鼠肠道乳酸杆菌属(Lactobacillus)的数量,调节衰老模型小鼠的肠道微生物的菌群结构,从而起到一定的改善肠道健康的作用[11]。
通常来说,肠道菌群多样性越高,微生态系统越稳定,越难被破坏。肠道菌群多样性的降低可能导致细菌群落功能稳定性降低,增加机体患病风险[24]。研究表明,疾病发生后,对虾肠道菌群组成发生显著性变化,多样性降低[25]。本研究发现,在凡纳滨对虾饲料中添加桑叶黄酮可增加肠道菌群多样性,提高宿主肠道微生态稳定性,这与刘敏等[12]研究得出的黄酮类化合物可提高小鼠肠道菌群多样性的结果一致。
对健康凡纳滨对虾肠道菌群结构和组成的研究因受环境、对虾生长阶段、饲料等因素的影响并不相同[26-27],所以正常菌群在肠道中的组成处于动态平衡中。郭慧等[28]的研究表明,在饲料中添加水解单宁可使凡纳滨对虾肠道菌群中变形菌门的相对丰度增加,放线菌门的相对丰度降低,本研究所得结果与此一致。王元等[29]分析了海水和淡水养殖条件下凡纳滨对虾肠道菌群结构的差异,结果发现在门水平上2种养殖模式下肠道菌群均以厚壁菌门和变形菌门为主,但二者的相对丰差异较大。本试验中G0、G50、G100、G150、G300组凡纳滨对虾肠道菌群中变形菌门与厚壁菌门的相对丰度之和分别为49.85%、78.50%、80.39%、69.93%、74.08%,而G0组放线菌门的相对丰度最高,达到46.95%,说明桑叶黄酮可促进肠道菌群中变形菌门和厚壁菌门的增殖,而对放线菌门的增殖有抑制作用。在属水平上,多数研究表明弧菌属是对虾肠道的优势菌属[6, 30-32],并且已有将弧菌属作为水产动物益生菌的报道[33-34],说明弧菌属在对虾肠道菌群中具有重要意义,并有期望作为凡纳滨对虾正常肠道菌群的评价指标。对凡纳滨对虾肠道菌群中弧菌属相对丰度与桑叶黄酮添加量进行回归分析发现,在桑叶黄酮添加量为137.5 mg/kg时,弧菌属的相对丰度最高。红球菌属、希瓦氏菌属、红杆菌属与弧菌属同属于变形菌门,但是添加桑叶黄酮后,红球菌属的相对丰度显著降低,希瓦氏菌属的相对丰度与弧菌属的变化趋势相似,说明适量的桑叶黄酮可提高希瓦氏菌属和弧菌属的增殖,但对红球菌属的增殖有抑制作用。大多研究表明黄酮类化合物能保持肠道菌群结构的稳定,促进有益菌(如乳酸杆菌、双歧杆菌等)的生长,但黄酮类化合物在肠道中达到一定量后,促进作用开始降低;但黄酮类化合物对有害菌(如肠杆菌、肠球菌、梭状菌等)的抑制作用随添加量的增加而增强[9, 35-36]。
4 结论在饲料中添加50 mg/kg桑叶黄酮可促进凡纳滨对虾肠道绒毛发育和增加肌层厚度;饲料中添加桑叶黄酮可增加凡纳滨对虾肠道菌群多样性,促进肠道中变形菌门的增殖,抑制放线菌门的增殖,添加量为137.5 mg/kg时弧菌属的相对丰度最高。结合肠道黏膜形态和肠道菌群多样性可知,在饲料中添加50 mg/kg的桑叶黄酮能促进凡纳滨对虾肠道发育,增加肠道菌群多样性。
| [1] |
RIOS-COVIAN D, SALAZAR N, GUEIMONDE M, et al. Shaping the metabolism of intestinal Bacteroides population through diet to improve human health[J]. Frontiers in Microbiology, 2017, 8: 376. |
| [2] |
REN D Y, GONG S J, SHU J Y, et al. Mixed Lactobacillus plantarum strains inhibit Staphylococcus aureus induced inflammation and ameliorate intestinal microflora in mice[J]. BioMed Research International, 2017(2017): 1-7. |
| [3] |
ADEL M, YEGANEH S, DAWOOD M A O, et al. Effects of Pediococcus pentosaceus supplementation on growth performance, intestinal microflora and disease resistance of white shrimp, Litopenaeus vannamei[J]. Aquaculture Nutrition, 2017, 23(3): 1401-1409. |
| [4] |
胡晓伟, 上官静波, 黎中宝, 等. 低聚木糖对花鲈幼鱼生长性能、血清生化和免疫指标及肠道菌群组成的影响[J]. 动物营养学报, 2018, 30(2): 734-742. |
| [5] |
GILBERT J A, BLASER M J, CAPORASO J G, et al. Current understanding of the human microbiome[J]. Nature Medicine, 2018, 24(4): 392-400. |
| [6] |
TZUC J T, ESCALANTE D R, HERRERA R R, et al. Microbiota from Litopenaeus vannamei:digestive tract microbial community of Pacific white shrimp (Litopenaeus vannamei)[J]. SpringerPlus, 2014, 3: 280. |
| [7] |
何佳珂, 于洋, 陈西敬, 等. 黄酮类化合物的药物代谢研究进展[J]. 中国中药杂志, 2010, 35(21): 2789-2794. |
| [8] |
杨继华, 陈冰, 黄燕华, 等.桑叶黄酮对吉富罗非鱼生长性能及抗氧化能力的影响[C].侯永清.中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集.北京: 中国农业大学出版社, 2016: 633.
|
| [9] |
陈冰, 杨继华, 曹俊明, 等. 桑叶黄酮对吉富罗非鱼肌肉抗氧化指标及营养组成的影响[J]. 淡水渔业, 2018, 48(3): 90-95. |
| [10] |
杭汉强, 陈香花. 肠道微生物与黄酮类化合物的生物转化[J]. 中国现代实用医学杂志, 2006, 5(3): 30-34. |
| [11] |
陈玉慧, 郭彤彤, 张鑫, 等. 青钱柳黄酮及三萜调节人体肠道菌群作用研究[J]. 中国野生植物资源, 2019, 38(2): 6-10, 15. |
| [12] |
刘敏, 陈奇超, 胡瑞良, 等. 藤三七类黄酮组分对小鼠代谢综合征模型及其肠道菌群的调节作用[J]. 中国微生态学杂志, 2017, 29(4): 390-394. |
| [13] |
张梅梅.黄酮类化合物抗氧化能力的比较及其对肠道菌群的调节作用[D].硕士学位论文.重庆: 西南大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10635-1018859903.htm
|
| [14] |
郭海燕, 张彦娇, 麦康森, 等. 染料木黄酮对大菱鲆生长、消化酶活力和肠道组织结构的影响[J]. 中国海洋大学学报(自然科学版), 2014, 44(9): 30-36. |
| [15] |
张伟.大豆皂甙与大豆异黄酮对异育银鲫生长、生理及肠道健康的影响[D].苏州: 苏州大学, 2010. http://d.wanfangdata.com.cn/Thesis/Y1733110
|
| [16] |
熊建华, 赵永贞, 高永华, 等. 凡纳滨对虾良种培育研究进展[J]. 南方农业学报, 2011, 42(5): 556-561. |
| [17] |
林成招, 马海田, 邹思湘, 等. 大豆异黄酮对大鼠小肠上皮细胞生长及葡萄糖和氨基酸吸收的影响[J]. 南京农业大学学报, 2005, 28(1): 71-75. |
| [18] |
晁杰.大豆异黄酮对鸡小肠黏膜上皮细胞的影响[D].硕士学位论文.福州: 福建农林大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10389-1016134135.htm
|
| [19] |
STANGER B Z, DATAR R, MURTAUGH L C, et al. Direct regulation of intestinal fate by Notch[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(35): 12443-12448. |
| [20] |
胡海滨, 刘金桃, 李彦先, 等. 饲料中大豆黄酮对大菱鲆生长、消化酶活力、抗氧化力及肠道结构的影响[J]. 水产学报, 2014, 38(9): 1503-1513. |
| [21] |
GIACOMIN P, AGHA Z, LOUKAS A. Helminths and intestinal flora team up to improve gut health[J]. Trends in Parasitology, 2016, 32(9): 664-666. |
| [22] |
SCHOEFER L, MOHAN R, SCHWIERTZ A, et al. Anaerobic degradation of flavonoids by Clostridium orbiscindens[J]. Applied and Environmental Microbiology, 2003, 69(10): 5849-5854. |
| [23] |
高志敏.白花蛇舌草总黄酮苷和苷元的制备及肠道菌群代谢研究[D].硕士学位论文.济南: 山东中医药大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10441-1014116121.htm
|
| [24] |
JONES S E, LENNON J T. Dormancy contributes to the maintenance of microbial diversity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(13): 5881-5886. |
| [25] |
XIONG J B, WANG K, WU J F, et al. Changes in intestinal bacterial communities are closely associated with shrimp disease severity[J]. Applied Microbiology and Biotechnology, 2015, 99(16): 6911-6919. |
| [26] |
郁维娜, 戴文芳, 陶震, 等. 健康与患病凡纳滨对虾肠道菌群结构及功能差异研究[J]. 水产学报, 2018, 42(3): 399-409. |
| [27] |
杨硕.凡纳滨对虾肠道菌群分析及其利用[D].硕士学位论文.天津: 天津科技大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10057-1017058330.htm
|
| [28] |
郭慧, 朱旭枫, 陈锦霖, 等. 水解单宁对凡纳滨对虾生长性能和肠道微生物的影响[J]. 中国水产科学, 2019, 26(5): 81-86. |
| [29] |
王元, 周俊芳, 韦信贤, 等. 海水和淡水养殖凡纳滨对虾肠道和鳃的菌群结构分析[J]. 湖南农业大学学报(自然科学版), 2018, 44(2): 198-203. |
| [30] |
李海兵.对虾肠道益生菌的筛选与免疫物质活性评价指标的建立[D].硕士学位论文.青岛: 中国海洋大学, 2008. http://d.wanfangdata.com.cn/Thesis/Y1337301
|
| [31] |
杨慧婷.对虾肠道菌群动态平衡的免疫调控研究[D].博士学位论文.济南: 山东大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10422-1016159171.htm
|
| [32] |
LUIS-VILLASENOR I E, CASTELLANOS-CERVANTES T, GOMEZ-GIL B, et al. Probiotics in the intestinal tract of juvenile whiteleg shrimp Litopenaeus vannamei:modulation of the bacterial community[J]. World Journal of Microbiology and Biotechnology, 2013, 29(2): 257-265. |
| [33] |
TZUC J T, ESCALANTE D R, HERRERA R R, et al. Microbiota from Litopenaeus vannamei:digestive tract microbial community of Pacific white shrimp (Litopenaeus vannamei)[J]. SpringerPlus, 2014, 3: 280. |
| [34] |
BALCÁZAR J L, ROJAS-LUNA T, CUNNINGHAM D P. Effect of the addition of four potential probiotic strains on the survival of pacific white shrimp (Litopenaeus vannamei) following immersion challenge with Vibrio parahaemolyticus[J]. Journal of Invertebrate Pathology, 2007, 96(2): 147-150. |
| [35] |
徐君.黄芩-黄连药对与肠道菌群的相互作用研究[D].硕士学位论文.南京: 南京中医药大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10315-1014416750.htm
|
| [36] |
张蔚.二氢黄酮苷及异黄酮苷与人体肠道细菌的相互作用研究[D].硕士学位论文.南京: 南京中医药大学, 2014. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y2673751
|




