2. 江苏农牧科技职业学院动物医学院, 泰州 225300
2. Department of Animal Medicine, Jiangsu Agri-Animal Husbandry Vocational College, Taizhou 225300, China
慢性肾衰竭(chronic renal failure,CRF)可引起小分子尿毒素在体内积聚,进而对机体各系统产生广泛性损伤,已成为严重危害中老年犬的慢性杀手[1]。目前,常采用腹膜透析疗法[2]对CRF实施治疗,但存在价格昂贵和蛋白质结合型毒素清除率低等缺点,限制了其临床应用,因此,寻找经济简便的治疗方法已成为宠物临床需求。肠黏膜是肾衰竭时血中尿素氮(UN)、肌酐(Cr)等小分子尿毒素清除的一个重要通路,促进肠道排泄小分子尿毒素可成为防治CRF的一种新方式。但也有研究表明,这些小分子尿毒素进入肠道后可引起肠道微生物群种类或数量的改变,表现为产脲酶的细菌数量增多,这些细菌数量与血清小分子尿毒素含量呈正相关,而且还可增加肠源性尿毒素[如硫酸吲哚酚(IS)等]的产生和积累,进一步加重CRF发展[3-7]。因此,发现既可促进肠道排泄小分子尿毒素,又能维持肠道菌群平衡的新方法对犬CRF的防治具有重大意义。丁酸梭菌是一种具有调节肠道微生态平衡、抑制肠道有害菌生长、抗炎、抗氧化和提高免疫力等作用的益生菌,已广泛应用于畜牧生产。但关于丁酸梭菌对CRF状态下宠物犬肠道菌群及血清小分子尿毒素含量的影响尚未见报道。因此,本研究通过饲喂丁酸梭菌,评价其对CRF犬肠道菌群及血清小分子尿毒素含量的影响,以期为丁酸梭菌在CRF犬饮食疗法中的应用提供参考。
1 材料与方法 1.1 试验材料丁酸梭菌(ATCC 19398),有效菌数量为1×109 CFU/g,购于江苏雅博动物健康科技有限责任公司。
1.2 试验方法选择20条2岁左右的雄性贵宾犬(泰迪型),体重为(7±1) kg,由江苏农牧科技职业学院宠物科技学院试验犬房提供。按随机数字表随机分为假手术对照组(CL组)、模型组(MD组)、低剂量丁酸梭菌组(LCB组)和高剂量丁酸梭菌组(HCB组)4个组,每组5只,于温度、相对湿度恒定的动物房中适应性饲养1周。
参照王宁等[8]的方法,采取肾动脉结扎法制作CRF模型。CL组只做腹腔打开手术;其余3组打开腹腔,显露左侧肾脏,游离肾动脉分支,逐一结扎,只保留1/6~1/4的动脉供血,第2周切除右侧肾脏。第4周末,每组随机抽取2只犬,检测血清肌酐(Cr)、尿素氮(UN)含量均升高,提示造模成功,并开始丁酸梭菌饲喂试验。LCB组和HCB组分别按每天0.5、1.0 g/kg BW的剂量灌喂丁酸梭菌进行干预,将丁酸梭菌溶于20 mL温水中制成混悬液予以灌喂,MD组和CL组均用20 mL温水予以灌喂。试验期4周。整个试验过程所有犬进食及饮水均不受限制。
1.3 小分子尿毒素含量检测丁酸梭菌饲喂试验前(第0周)及试验后第2周、第4周,分别经头静脉采集各组试验犬的血液并制备血清,用M149928-全自动干式生化分析仪测定血清UN和Cr含量,用酶联免疫吸附测定(ELISA)试剂盒(购于上海江莱生物科技有限公司)测定血清硫酸吲哚酚(IS)含量。试验结束后采集各组犬的粪便,按质量体积比1 : 9比例用蒸馏水稀释搅匀,经3 000 r/min离心10 min后取上清液,检测粪便UN和Cr含量。
1.4 肠道菌群16S rDNA测序 1.4.1 16S rDNA测序试验结束后,无菌经直肠采集粪便。称取无菌粪便样本200 mg,采用Qiagen DNA试剂盒按说明书进行总DNA提取。用细菌通用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对16S rRNA的V3~V4可变区进行PCR扩增,扩增程序为:95 ℃预变性3 min,27个循环后,72 ℃延伸10 min。依次进行切胶回收PCR产物、Tris-HCl洗脱及2%琼脂糖凝胶电泳检测。
使用NEB Next® UltraTM DNA Library Prep Kit for Illumina建库试剂盒进行文库构建,构建好的文库经过Qubit定量和文库检测,合格后,使用Illumina MiSeq PE 300平台进行测序,得到原始数据。
1.4.2 生物信息学分析对测序得到的原始数据进行过滤、拼接,进而得到有效数据。利用贝叶斯算法以97%的一致性将序列聚类成操作分类单元(OTUs),通过对OTUs进行丰度、α多样性、β多样性分析,同时对物种注释在门和属水平上进行分析,得到细菌群落结构,组间细菌差异性用LEfSe分析。
1.5 数据处理试验结果用平均值±标准差表示,小分子尿毒素含量的组间比较采用SPSS 22.0统计软件的ANOVA程序进行单因素方差分析,组内比较采用重复测量资料方差分析,肠道菌群的比较采用Mann-Whitney检验。P < 0.05表示差异显著,P < 0.01表示差异极显著,肠道菌群与血清小分子尿毒素含量的相关性用Spearman秩相关系数表示。
2 结果与分析 2.1 丁酸梭菌对CRF犬血清小分子尿毒素清除作用的影响 2.1.1 各组血清小分子尿毒素含量的比较由表 1可知,不同时间点比较,MD组的血清UN、Cr和IS含量显著升高(P < 0.05),LCB组的血清UN、Cr和IS含量显著降低(P < 0.05),HCB组的血清UN、Cr和IS含量极显著降低(P < 0.01)。
|
|
表 1 各组血清小分子尿毒素含量的比较 Table 1 Comparison of serum micromolecule urotoxin contents in different groups |
不同组间比较,试验结束时(第4周),LCB组和HCB组的血清UN、Cr和IS含量极显著低于MD组(P < 0.01),但极显著高于CL组(P < 0.01);与LCB组比较,HCB组的血清UN、IS含量显著降低(P < 0.05),血清Cr含量极显著降低(P < 0.01)。
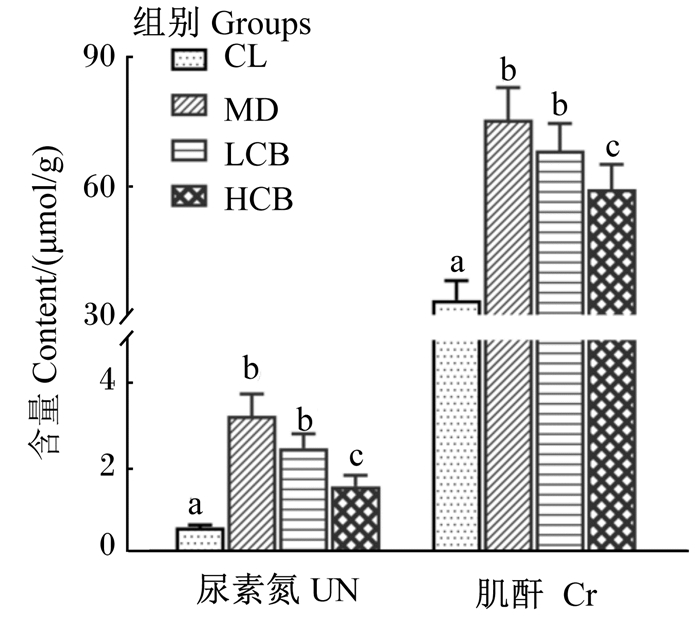
2.1.2 各组粪便UN、Cr含量的比较由图 1可知,试验结束时,HCB组的粪便UN、Cr含量均显著低于MD组(P < 0.05),LCB组的粪便UN、Cr含量与MD组无显著差异(P>0.05),CL组的粪便UN、Cr含量均显著低于MD组、LCB组和HCB组(P < 0.05)。
|
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 各组粪便UN和Cr含量的比较 Fig. 1 Comparison of contents of UN and Cr in feces in different groups |
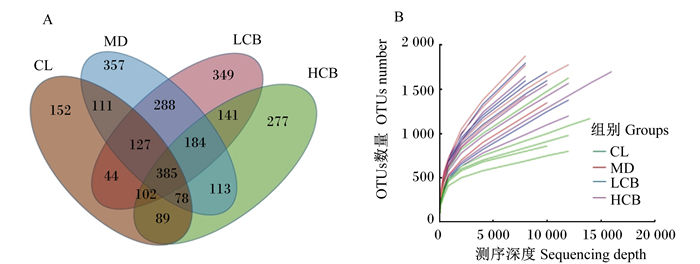
通过Illumina MiSeq PE 300平台测序后以97%相似度进行OTUs划分,结果见图 2-A。由图可知,各组OTUs数量从高到低依次为MD组(1 643个)、LCB组(1 620个)、HCB组(1 369个)和CL组(1 091个),4组共有OTUs数量为385个。稀释曲线如图 2-B所示,随着测序深度增加,各样本OTUs数量趋于饱和。
|
图 2 各样本OTUs韦恩图(A)和稀释曲线图(B) Fig. 2 OTUs venn diagram (A) and dilution curve diagram (B) of each sample |
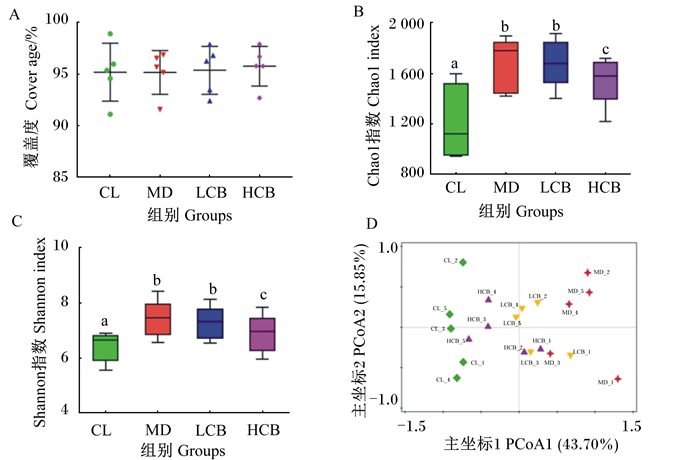
由图 3可知,各组测序覆盖度均达到95%左右(图 3-A),说明本试验的16S rDNA测序量可以满足后续生物信息学分析。α多样性可以反映菌群物种丰富度和多样性,其主要指标有Chao1指数和Shannon指数。犬发生CRF后Chao1指数升高,MD组、LCB组和HCB组显著高于CL组(P < 0.05);随着丁酸梭菌饲喂剂量增加,Chao1指数逐渐降低,HCB组显著低于MD组(P < 0.05)(图 3-B)。Shannon指数与Chao1指数的变化趋势相同(图 3-C)。这说明丁酸梭菌可以降低CRF犬肠道菌群的α多样性。
|
CL_1~CL_5分别为CL组的5个样本,MD_1~MD_5分别为MD组的5个样本,LCB_1~LCB_5分别为LCB组的5个样本,HCB_1~HCB_5分别为HCB组的5个样本。图 4同。 CL_1 to CL_5 were 5 samples of CL group, MD_1 to MD_5 were 5 samples of CL group, LCB_1 to LCB_5 were 5 samples of LCB group, HCB_1 to HCB_5 were 5 samples of HCB group. The same as Table 4. 图 3 丁酸梭菌对CRF犬肠道菌群α多样性和β多样性的影响 Fig. 3 Effects of Clostridium butyricum on intestinal flora α diversity and β diversity of dogs with CRF |
主坐标分析(PCoA)是菌群β多样性的重要指标。PCoA1和PCoA2的主要贡献率分别为43.70%、15.85%,4组样本在PCoA1有明显聚类现象,MD组远离CL组,且随着丁酸梭菌饲喂剂量增加逐渐向CL组聚拢(图 3-D)。这说明丁酸梭菌可扭转CRF引起的犬肠道菌群结构改变。
2.2.2 丁酸梭菌对CRF犬肠道菌群相对丰度的影响在门水平上,4组样本都包含了10个菌门,分别是厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)、无壁菌门(Teneriutes)、异常球菌-栖热菌门(Deinococcus-Thermus)和TM7。主要菌门相对丰度的比较见表 2,可以看出,MD组的肠道Actinobacteria、Proteobacteria相对丰度均显著高于CL组(P < 0.05),LCB组和HCB组的肠道Actinobacteria、Proteobacteria相对丰度均显著低于MD组(P < 0.05)。
|
|
表 2 主要菌群门水平相对丰度的比较 Table 2 Comparison of relative abundance of major microflora at phylum level |
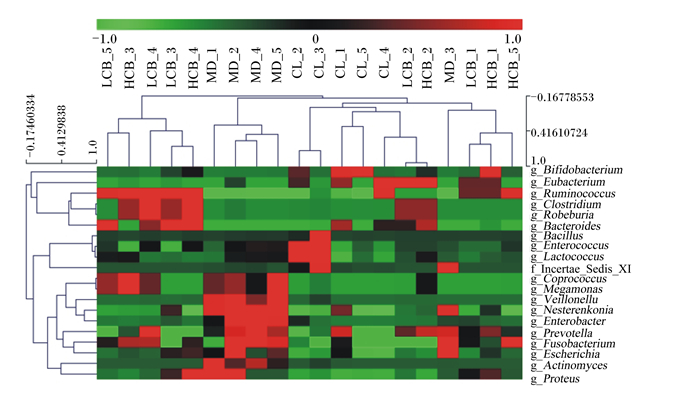
各组样本菌群共鉴定出325个属,部分菌属见图 4,列代表样本,行代表菌属,颜色块代表样本细菌相对丰度值,颜色越红表示细菌的相对丰度越高,颜色越绿表示相对丰度越低。由图可以看出,变形杆菌属(Proteus)、埃希氏菌属(Escherichia)、肠杆菌属(Enterobacter)、普氏菌属(Prevotella)、放线菌属(Actinomyces)和涅斯捷连科氏菌属(Nesterenkonia)等菌属主要富集于CRF犬肠道中,饲喂丁酸梭菌可以降低CRF犬肠道中这些菌属相对丰度,呈剂量效应关系。
|
g_Bifidobacterium:双歧杆菌属;g_Eubacterium:优杆菌属;g_Ruminococcus:瘤胃球菌属;g_Clostridium梭菌属;g_Robeburia:罗斯氏菌属;g_Bacteroides:拟杆菌属;g_Bacillus:芽孢杆菌属;g_Enterococcus;肠球菌属;g_Lactococcus;乳杆菌属;f_Incertae_Sedis_XI:Incertae_Sedis_XI菌科;g_Coprococcus;粪球菌属;g_Megamonas;巨单胞菌属;g_Veillonellu;韦荣氏菌属;g_Nesterenkonia;涅斯捷连科氏菌属;g_Enterobacter;肠杆菌属;g_Prevotella;普氏菌属;g_Fusobacterium;梭杆菌属;g_Escherichia;埃希氏菌属;g_Actinomyces;放线菌属;g_Proteus;变形杆菌属。 图 4 各样本菌属相对丰度的聚类热图 Fig. 4 Cluster heat map of relative abundance of different genuses in each sample |
为了找出各组间具有差异的生物标志物(biomarker),通过非参数因子Kruskal-Wallis秩和检验进行了LEfSe分析,结果见图 5。可以看出,CRF对19个肠道菌群都有影响,可以升高Proteobacteria和Actinobacteria的相对丰度,升高假单胞菌属(Pseudomonas)、Proteus、Escherichia、Enterobacter、Actinomyces、Nesterenkonia、Rothia和梭杆菌属(Fusobacterium)的相对丰度。与CL组相比,其他各组的乳杆菌属(Lactobacillus)和双歧杆菌属(Bifidobacteroides)等有益菌属的相对丰度减少。饲喂丁酸梭菌可扭转这些菌属变化,使之趋于CL组。
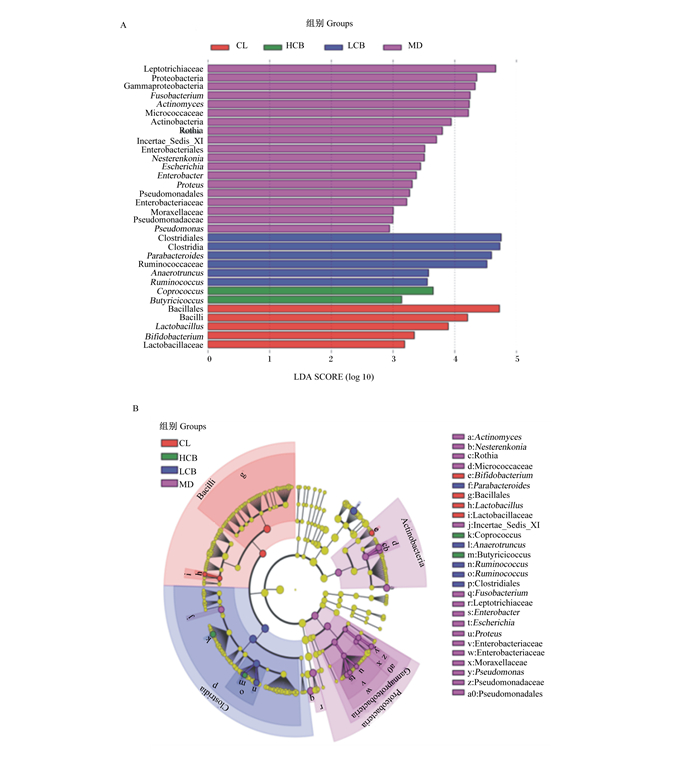
|
Leptotrichiaceae:纤毛菌科;Proteobacteria:变形菌门;Gammaproteobacteria:γ-变形菌纲;Fusobacterium:梭杆菌属;Actinomyces:放线菌属;Micrococcaceae:微球菌科;Actinobacteria:放线菌门;Incertae_Sedis_XI:Incertae_Sedis_XI菌科;Enterobacteriales:肠杆菌目;Nesterenkonia:涅斯捷连科氏菌属;Escherichia:埃希氏菌属;Enterobacter:肠杆菌属;Proteus:变形杆菌属;Pseudomonadales:假单胞菌目;Enterobacteriaceae:肠杆菌科;Moraxellaceae:莫拉菌科;Pseudomonadaceae:假单胞菌科;Pseudomonas:假单胞菌属;Clostridiales:梭菌目;Clostridia:梭菌纲;Parabacteroides:副拟杆菌属;Ruminococcaceae:瘤胃球菌科;Anaerotruncus:厌氧棍状菌属;Ruminococcus:瘤胃球菌属;Coprococcus:粪球菌属;Butyricicoccus:丁酸菌属;Bacillales:芽孢杆菌目;Bacilli:芽孢杆菌纲;Lactobacillus:乳酸菌属;Bifidobacterium:双歧杆菌属;Lactobacillaceae乳酸杆菌科。 图 5 各组菌群LDA值分布柱状图(A)和LEfSe进化分支图(B) Fig. 5 Histogram of LDA value distribution (A) and evolutionary branch diagram of LEfSe (B) in each group |
根据LEfSe结果,将差异菌属和血清小分子尿毒素含量之间进行了Spearman相关性分析,结果见表 3。由表可知,血清UN、Cr和IS含量与一些在CRF犬中富集的菌属,如Enterobacter、Proteus、Escherichia相对丰度存在较强的正相关关系,与Bifidobacterium、Lactobacillus相对丰度存在较强的负相关关系。
|
|
表 3 肠道菌属与血清小分子尿毒素含量的Spearman秩相关系数 Table 3 Spearman rank correlation coefficient between genus of intestinal bacteria and serum micromolecule urotoxin contents |
最新研究表明,CRF状态下,肠道对毒素的清除能力与疾病的发展过程关系密切[9],肾衰患者肠道清除毒素的能力成为人们研究的热点。本研究发现,建模成功后血清、粪便UN、Cr含量均增加,也说明CRF犬能够通过肠道排泄来降低血清UN和Cr含量。小分子尿毒素进入肠道后可改变肠道内细菌生长环境,从而使肠道菌群的结构、数量、组成和分布也发生显著变化,且这些变化与肠道黏膜屏障破坏有着密切联系,进而引发一系列病理过程,加剧肾衰的进程。近几年的试验研究和临床证据证明,慢性肾脏疾病(CKD)宿主肠中微生物组成与健康者比较存在显著差异[10-11],5/6肾切除大鼠肠道内有175个细菌OTUs数量存在显著差异[12]。本研究发现,CRF犬肠道菌群的多样性增加,通过LEfSe分析发现肾衰犬肠道中Proteobacteria和Actinobacteria相对丰度显著增加,特别是Enterobacter、Proteus、Escherichia和Nesterenkonia等。这些菌属含有脲酶,可分解UN,而肾衰时大量UN和Cr进入肠道,为它们生长繁殖提供便利条件。但UN在肠道中经过细菌的代谢后产生大量氨,一方面可经肝肠循环进入肝脏后重新合成UN释放入血液,增加血液中UN含量,不能达到清除目的[13];另一方面,可使肠腔内的pH增加,扰乱肠内稳态,进一步导致兼性厌氧菌增殖,抑制专性厌氧菌生长[14]。本研究也证实了肾衰犬肠道中Lactobacillus和Bifidobacteroides相对丰度减少。
IS是肠道细菌(如Proteus、Escherichia、Citrobacter等)分解色氨酸后经过一系列转化而产生并经肾脏排泄的一种蛋白质结合型小分子物质[15],具有广泛的毒性,如诱导胰岛素抵抗[16]、抑制红细胞生成[17]、促进血管钙化[18]和诱导肾小管间质纤维化[19]等。CRF状态下IS会不断在血液中积累,并可以与蛋白质结合,极难通过血液透析或腹膜透析清除。本研究结果显示,MD组血清IS含量比CL组升高了2.14倍,且与Enterobacter、Proteus、Escherichia等菌属相对丰度呈正相关,说明这些富含色氨酸酶的菌属丰度增加是血清IS含量升高的主要原因。
研究表明,丁酸梭菌是一种厌氧的内生芽孢杆菌,在宿主肠中繁殖较快,产生丁酸等有机酸,降低肠道pH,使有害菌生长受限。曹广添等[20]将丁酸梭菌分别与大肠杆菌、沙门氏菌、产气荚膜梭菌、乳酸杆菌、双歧杆菌按不同的比例混合后共培养,发现联合培养组大肠杆菌、沙门氏菌、产气荚膜梭菌数量均显著低于单独培养组。而Kuroiwa等[21]研究发现,丁酸梭菌能与双歧杆菌、乳酸杆菌和粪杆菌等肠道有益菌共生,并能促进双歧杆菌等有益菌的生长。本研究中给予肾衰犬不同剂量丁酸梭菌后,均可促进了Lactobacillus、Bifidobacteroides等有益菌增殖,降低了Enterobacter、Proteus和Escherichia等生长,且高剂量效果较好。这表明丁酸梭菌具有调节CRF犬肠道菌群平衡的作用,由于这些可促进尿UN和Cr分解及促进IS合成的菌属增殖受到抑制,从而降低了血清UN、Cr和IS等小分子尿毒素含量。
但肠肾轴理论认为,肠道菌群紊乱、肠源性尿毒素产生及肠道屏障损伤等因素均可加剧CRF的进程,恶化病情[22]。而本试验只从调节肠道菌群视角研究了丁酸梭菌对CRF犬小分子尿毒素的清除作用,丁酸梭菌是否可通过多靶点发挥对CRF保护作用,将是下一步研究方向。
4 结论综上所述,CRF可以增加犬肠道中菌群的多样性,提高Proteobacteria和Actinobacteria相对丰度,特别是Proteus、Escherichia、Enterobacter和Nesterenkonia相对丰度,这些菌属相对丰度与血清小分子尿毒素含量呈正相关。丁酸梭菌可扭转CRF引起犬肠道菌群的改变,提高Lactobacillus和Bifidobacteroides等有益菌相对丰度,降低与血清小分子尿毒素含量呈正相关的菌群相对丰度,进而降低血清UN、Cr和IS含量,以1.0 g/kg BW添加量为宜。
| [1] |
OBURAI N L, RAO V V, BONATH R B N. Comparative clinical evaluation of Boerhavia diffusa root extract with standard enalapril treatment in canine chronic renal failure[J]. Journal of Ayurveda & Integrative Medicine, 2015, 6(3): 150-157. |
| [2] |
洪菲, 梁晚枫. 一例犬子宫蓄脓诱发肾衰竭及采用腹膜透析法治疗的效果观察[J]. 黑龙江畜牧兽医, 2018(14): 221-222. |
| [3] |
NALLU A, SHARMA S, RAMEZANI A, et al. Gut microbiome in chronic kidney disease:challenges and opportunities[J]. Translational Research, 2017, 179: 24-37. DOI:10.1016/j.trsl.2016.04.007 |
| [4] |
RAMEZANI A, MASSY Z A, MEIJERS B, et al. Role of the gut microbiome in uremia:a potential therapeutic target[J]. American Journal of Kidney Diseases, 2016, 67(3): 483-498. DOI:10.1053/j.ajkd.2015.09.027 |
| [5] |
VAZIRI N D, WONG J, PAHL M V, et al. Chronic kidney disease alters intestinal microbial flora[J]. Kidney International, 2013, 83(2): 308-315. DOI:10.1038/ki.2012.345 |
| [6] |
WIKOFF W R, ANFORA A T, LIU J, et al. Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(10): 3698-3703. DOI:10.1073/pnas.0812874106 |
| [7] |
VAZIRI N D, ZHAO Y Y, PAHL M V. Altered intestinal microbial flora and impaired epithelial barrier structure and function in CKD:the nature, mechanisms, consequences and potential treatment[J]. Nephrology Dialysis Transplantation, 2016, 31(5): 737-746. DOI:10.1093/ndt/gfv095 |
| [8] |
王宁, 李宁, 陈洋. 肾动脉结扎法制作慢性肾功能衰竭犬模型方法的探索[J]. 中国医科大学学报, 2006, 35(2): 221. DOI:10.3969/j.issn.0258-4646.2006.02.059 |
| [9] |
KANG D H, JOLY A H, OLIFER S W, et al. Impaired angiogenesis in the remnant kidney model:Ⅰ.Potential role of vascular endothelial growth factor and thrombospondin-1[J]. .Journal of the American Society of Nephrology, 2011, 12(7): 1434-1447. |
| [10] |
VANHOLDER R, SCHEPERS E, PLETINCK A, et al. The uremic toxicity of indoxyl sulfate and p-cresyl sulfate:a systematic review[J]. Journal of the American Society of Nephrology, 2014, 25(9): 1897-1907. DOI:10.1681/ASN.2013101062 |
| [11] |
MORADI H, SICA D A, KALANTAR-ZADEH K. Cardiovascular burden associated with uremic toxins in patients with chronic kidney disease[J]. American Journal of Nephrology, 2013, 38(2): 136-148. DOI:10.1159/000351758 |
| [12] |
YOSHIFUJI A, WAKINO S, IRIE J, et al. Gut Lactobacillus protects against the progression of renal damage by modulating the gut environment in rats[J]. Nephrology Dialysis Transplantation, 2016, 31(3): 401-412. DOI:10.1093/ndt/gfv353 |
| [13] |
蒋哲峰, 蒋云生, 林霞, 等. 肾衰状态下肠道细菌对肌酐和尿素清除的影响[J]. 中国医师杂志, 2017, 9(10): 1345-1347. |
| [14] |
KUROIWA T, WANAGA M, KOBARI K, et al. Preventive effect of Clostridium butyricum M588 against the proliferation of Clostridium difficile during antimicrobial therapy[J]. Kansenshogaku Zasshi, 1990, 64(11): 1425-1432. DOI:10.11150/kansenshogakuzasshi1970.64.1425 |
| [15] |
MEIJERS B K I, BAMMENS B, VERBEKE K, et al. A review of albumin binding in CKD[J]. American Journal of Kidney Diseases, 2008, 51(5): 839-850. DOI:10.1053/j.ajkd.2007.12.035 |
| [16] |
KOPPE L, PILLON N J, VELLA R E, et al. p-cresyl sulfate promotes insulin resistance associated with CKD[J]. Journal of the American Society of Nephrology, 2013, 24(1): 88-99. DOI:10.1681/ASN.2012050503 |
| [17] |
ASAI A, HIRATA J, HIRANO A, et al. Activation of aryl hydrocarbon receptor mediates suppression of hypoxia-inducible factor-dependent erythropoietin expression by indoxyl sulfate[J]. American Journal of Physiology-Cell Physiology, 2016, 310(2): C142-C150. DOI:10.1152/ajpcell.00172.2015 |
| [18] |
SHIMIZU H, BOLATI D, ADIJIANG A, et al. Indoxyl sulfate downregulates renal expression of Klotho through production of ROS and activation of nuclear factor-κB[J]. American Journal of Nephrology, 2011, 33(4): 319-324. DOI:10.1159/000324885 |
| [19] |
NIWA T, SHIMIZU H. Indoxyl sulfate induces nephrovascular senescence[J]. Journal of Renal Nutrition, 2012, 22(1): 102-106. DOI:10.1053/j.jrn.2011.10.032 |
| [20] |
曹广添, 刘婷婷, 周琳, 等. 丁酸梭菌对致病菌和有益菌的体外作用效果研究[J]. 中国饲料, 2012(4): 16-19. DOI:10.3969/j.issn.1004-3314.2012.04.006 |
| [21] |
KUROIWA T, KOBARI K, IWANAGA M. Inhibition of enteropathogens by Clostridium butyricum MIYAIRI 588[J]. American Journal of Nephrology, 1990, 64(3): 257-263. |
| [22] |
蔡燕杰.基于"肠-肾轴"研究通腑化浊凉血方对硫酸吲哚酚相关肾损伤的保护机制[D].硕士学位论文.北京: 北京中医药大学: 2019. http://cdmd.cnki.com.cn/Article/CDMD-10026-1019123603.htm
|




