2. 山东隆大生物工程有限公司, 临沂 276400;
3. 上海近岸科技有限公司, 上海 201203
2. Shandong Longda Biotechnology Co., Ltd., Linyi 276400, China;
3. Shanghai Novoprotein Scientific Co., Ltd., Shanghai 201203, China
随着饲料添加剂的广泛使用以及饲料营养水平的不断提高,肉鸡的脂肪沉积日趋增加,然而连接营养因素与肉鸡脂肪代谢的媒介及其作用机制目前却尚未明确。为了更好地促进肉鸡的脂肪沉积,提高肉鸡的生产性能,揭秘营养因素调控肉鸡脂肪代谢的机制非常重要,而寻找连接营养因素与肉鸡脂肪代谢的媒介是其中的一个重要环节。血管生成素样蛋白4(angiopoietin-like protein 4, ANGPTL4)又名PPAR血管生成素相关蛋白和禁食诱导因子,是一类具有高效生物活性的分泌蛋白。在鼠和人上的研究发现,ANGPTL4可以通过抑制脂蛋白脂肪酶(LPL)活性而妨碍甘油三酯沉积到脂肪细胞,且微生物和禁食等因素均可影响其分泌[1-2]。近年来,本课题组研究发现,丁酸梭菌可影响人结肠癌细胞系Caco-2细胞ANGPTL4的产生,且将丁酸梭菌作用于Caco-2细胞的条件培养基用于培养人肝癌细胞系HepG2细胞时,HepG2细胞中脂肪代谢相关基因表达会发生相应改变[3]。此外,本课题组研究还发现,肉鸡血液中ANGPTL4含量会伴随肉鸡脂肪代谢能力改变而发生相应变化[4]。因此,猜测ANGPTL4具有改变肉鸡脂肪代谢的作用,可作为连接营养因素与肉鸡脂肪代谢的媒介。为了验证此猜测,本试验采用原核表达的方法获得鸡ANGPTL4重组蛋白,通过静脉注射的方法研究其对肉鸡血清生化和激素指标的影响,为今后鸡ANGPTL4功能研究的开展提供良好的试验材料,同时也为ANGPTL4在肉鸡脂肪代谢调控中作用机制的阐明提供理论依据。
1 材料与方法 1.1 试验材料原核表达载体pET21a(+)和大肠杆菌BL21(DE3)购自上海近岸科技有限公司;限制性内切酶Nde Ⅰ和Xho Ⅰ、质粒提取试剂盒购自TaKaRa公司。
1.2 试验方法 1.2.1 鸡ANGPTL4基因的人工合成和酶切鉴定通过UniProt查找鸡ANGPTL4的氨基酸序列(系列号为F1NUQ4)和信号肽部分(1~18个氨基酸),去除信号肽并在N端加His-SUMO标签后,对比大肠杆菌偏好密码子,依据密码子的兼并性,在不改变氨基酸组成和排列顺序的基础上,对编码His-SUMO-ANGPTL4的基因序列进行改造,替换为大肠杆菌喜好的密码子,得到新的编码His-SUMO-ANGPTL4的基因序列,送至英潍捷基(上海)贸易有限公司进行全基因合成,并以Nde Ⅰ和Xho Ⅰ酶切位点构建到pET21a(+)表达载体中。将重组原核表达质粒pET21a-His-SUMO-ANGPTL4转化至大肠杆菌BL21(DE3)感受态细胞,在含50 μg/mL氨苄霉素的LB固体培养基上37 ℃倒置培养过夜。挑长势较好的单菌落接种于LB液体培养基中,于37 ℃摇床上振荡培养,抽提重组质粒,Nde Ⅰ和Xho Ⅰ双酶切鉴定正确后,提交英潍捷基(上海)贸易有限公司测序。
1.2.2 阳性重组菌的诱导表达挑取含有重组阳性质粒的单菌落接种于1 mL的LB培养液(含氨苄青霉素50 μg/mL)中,37 ℃、180 r/min过夜培养,次日按1%(V/V)的接种量扩大培养,37 ℃、180 r/min培养至OD600 nm=0.6~0.8,加入不同浓度的异丙基-β-D-硫代半乳糖苷(IPTG)进行诱导。诱导条件设置为:IPTG浓度1 mmol/L,诱导温度37 ℃,诱导时间3 h。按上述条件诱导蛋白表达后,将收集的菌体悬浮于磷酸盐缓冲液(PBS)中,4 ℃进行超声破碎,直至溶液透明。将细胞裂解液在12 000 r/min下离心20 min,分离上清和沉淀,进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.2.3 包涵体复性诱导目的蛋白表达后,使用洗涤缓冲液[含20 mmol/L Tris-HCl、50 mmol/L NaCl、5 mmol/L乙二胺四乙酸(EDTA)、1% Triton X-100,pH 8.0]充分洗涤包涵体,离心取沉淀,用增溶缓冲液[含50 mmol/L Tris-HCl、6 mol/L Gua-HCl、10 mmol/L二硫苏糖醇(DTT),pH 8.0]增溶,离心取上清,用于包涵体复性。包涵体复性选用稀释复性方法:取2 mL包涵体增溶液逐滴加入到100 mL复性缓冲液[含20 mmol/L PB、240 mmol/L NaCl、10 mmol/L KCl、2 mmol/L MgCl2、2 mmol/L CaCl2、0.4 mol/L蔗糖、0.5 mol/L精氨酸、0.05%Triton X-100、1 mmol/L还原型谷胱甘肽(GSH)、0.1 mmol/L氧化型谷胱甘肽(GSSG),pH 6.5]中,置于4 ℃复性24 h。
1.2.4 复性蛋白的纯化将复性后蛋白(缓冲液pH调节至8.0)进行挂Ni柱纯化,用平衡缓冲液(含20 mmol/L Tris-HCl、500 mmol/L NaCl,pH 8.0)平衡柱子,分别以梯度咪唑浓度的洗脱缓冲液(含20 mmol/L Tris-HCl、500 mmol/L NaCl、20/50/500 mmol/L咪唑,pH 8.0)洗脱目的蛋白,收集洗脱液,进行SDS-PAGE检测,然后将500 mmol/L咪唑洗脱组分透析到含20 mmol/L Tris-HCl、500 mmol/L NaCl、10%甘油、1 mmol/L DTT,pH为8.5的缓冲体系中,即得鸡ANGPTL4重组蛋白,用Bradford法测定其浓度。
1.2.5 鸡ANGPTL4重组蛋白对肉鸡血清生化和激素指标的影响试验选用35日龄体重相近的健康禁食状态下(空腹12 h)的爱拔益加(AA)肉公鸡36只,随机分为6组,每组6个重复,每个重复1只鸡。6组肉鸡分别静脉注射0(对照)、20、100、500、2 500和12 500 ng/kg BW剂量的鸡ANGPTL4重组蛋白,并于注射后30 min采集试验肉鸡的空腹血液,制备血清后于-20 ℃保存待测。采用全自动生化分析仪测定血清中葡萄糖(GLU)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)含量,通过酶联免疫分析的方法测定血清中极低密度脂蛋白(VLDL)含量,使用放射免疫分析试剂盒(北京北方生物技术研究所)测定血清中胰岛素、生长激素和瘦素的水平。
1.3 数据统计分析数据采用SAS 9.2软件中的one-way ANOVA程序进行分析,多重比较采用Duncan氏法进行。采用正交多项式的分析方法对不同注射剂量鸡ANGPTL4重组蛋白的处理效应进行一次线性和二次曲线回归分析。P < 0.05为差异显著。
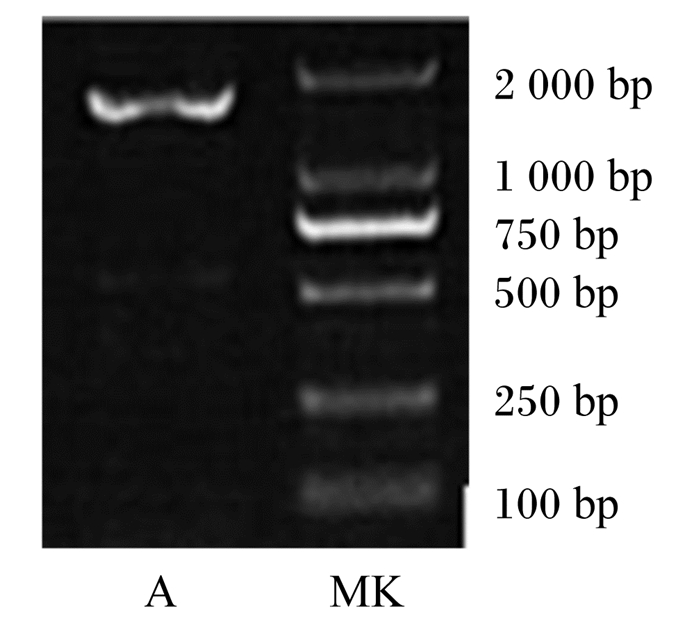
2 结果与分析 2.1 鸡ANGPTL4基因的人工合成及重组质粒的序列分析将人工合成的His-SUMO-ANGPTL4基因以Nde Ⅰ和Xho Ⅰ酶切位点构建到pET21a(+)表达载体中,并转化至大肠杆菌BL21(DE3)感受态细胞中,抽提重组质粒并进行Nde Ⅰ和Xho Ⅰ双酶切,电泳得到大小为1 713 bp的条带(图 1),与预期的大小一致。酶切鉴定正确的克隆提交英潍捷基(上海)贸易有限公司测序,测序结果与设计的His-SUMO-ANGPTL4基因序列完全一致。人工合成的His-SUMO-ANGPTL4基因序列见图 2。
|
A:重组质粒pET21a-His-SUMO-ANGPTL4双酶切产物;MK:DNA分子质量标准物。 A: recombinant plasmid pET21a-His-SUMO-ANGPTL4 digested by restrictive enzyme; MK: DNA molecular weight marker. 图 1 重组质粒pET21a-His-SUMO- ANGPTL4的双酶切鉴定 Fig. 1 Identification of pET21a-His-SUMO-ANGPTL4 recombinant plasmid by restriction enzyme digestion |

|
下划线字母表示6×His标签基因序列,灰色底色字母表示SUMO标签基因序列。 The underscore letters mean the 6×His tag gene sequence, and the gray letters mean the SUMO tag gene sequence. 图 2 人工合成的His-SUMO-ANGPTL4基因序列 Fig. 2 Synthetic His-SUMO-ANGPTL4 gene sequence |
SDS-PAGE结果(图 3)显示,与未诱导的菌体细胞裂解液相比,诱导后的菌体细胞裂解液有1条明显的蛋白条带(65 ku)。将诱导后的菌液经超声破碎后,分别取上清和沉淀进行SDS-PAGE分析,可见大部分重组蛋白在沉淀中,表明目的蛋白主要以包涵体形式表达。

|
A:未诱导细胞裂解液;B:诱导后细胞裂解液(B1、B2、B3为3个不同的阳性克隆);C:诱导后细胞裂解液上清;D:诱导后细胞裂解液沉淀;MK:蛋白质分子质量标准物。 A: non-induced cell lysate; B: induced cell lysate (B1, B2 and B3 were 3 different positive clones); C: supernatant of induced cell lysate; D: precipitation of induced cell lysate; MK: protein molecular weight marker. 图 3 鸡ANGPTL4重组蛋白的诱导表达 Fig. 3 Induced expression of chicken ANGPTL4 recombinant protein |
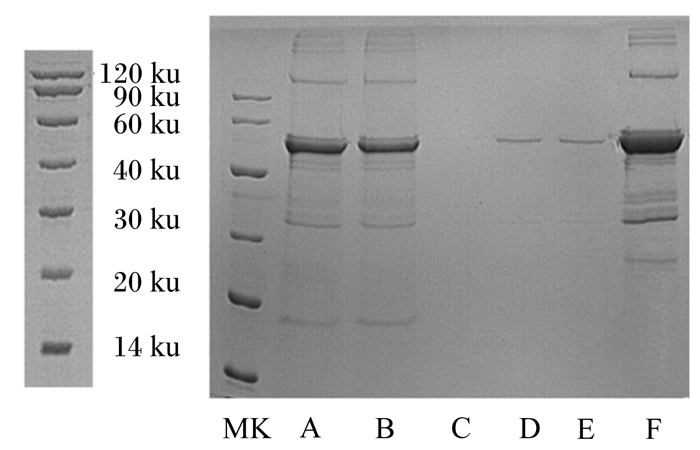
将复性后蛋白进行Ni柱纯化,SDS-PAGE结果(图 4)显示,用50和500 mmol/L咪唑洗脱可获得与预期蛋白(65 ku)相符的蛋白条带,但500 mmol/L咪唑洗脱所得的蛋白量多于50 mmol/L咪唑。因此,采用500 mmol/L咪唑洗脱目的蛋白,经透析后获得纯化蛋白。获得的鸡ANGPTL4重组蛋白采用Bradford法测定蛋白质浓度为0.1 mg/mL。
|
A:上样;B:流穿;C:20 mmol/L咪唑洗脱;D、E:50 mmol/L咪唑洗脱;F:500 mmol/L咪唑洗脱;MK:蛋白质分子质量标准物。 A: load sample; B: flowthrough; C: elution by 20 mmol/L imidazole; D and E: elution by 50 mmol/L imidazole; F: elution by 500 mmol/L imidazole; MK: protein molecular weight marker. 图 4 纯化的鸡ANGPTL4重组蛋白 Fig. 4 Purified chicken ANGPTL4 recombinant protein |
由表 1可知,静脉注射不同剂量的鸡ANGPTL4重组蛋白对肉鸡血清HDL和LDL含量均无显著影响(P>0.05)。2 500和12 500 ng/kg BW鸡ANGPTL4重组蛋白组的血清GLU和VLDL含量较对照组有显著提高(P < 0.05),但上述2组间无显著差异(P>0.05);随着鸡ANGPTL4重组蛋白注射剂量从0增加到12 500 ng/kg BW,血清GLU和VLDL含量均呈现一次线性和二次曲线增加的效应(P < 0.05)。
|
|
表 1 鸡ANGPTL4重组蛋白对肉鸡血清生化指标的影响 Table 1 Effects of chicken ANGPTL4 recombinant protein on serum biochemical indices of broilers |
由表 2可知,静脉注射不同剂量的鸡ANGPTL4重组蛋白对肉鸡血清胰岛素水平无显著影响(P>0.05)。20、2 500和12 500 ng/kg BW鸡ANGPTL4重组蛋白组肉鸡的血清生长激素水平较对照组显著降低(P < 0.05),且以12 500 ng/kg鸡ANGPTL4重组蛋白组降低效果最为明显;随着鸡ANGPTL4重组蛋白注射剂量从0增加到12 500 ng/kg BW,血清生长激素水平呈现一次线性和二次曲线降低的效应(P < 0.05)。此外,20~12 500 ng/kg BW鸡ANGPTL4重组蛋白组肉鸡的血清瘦素水平均较对照组显著降低(P < 0.05),但不同注射剂量的鸡ANGPTL4重组蛋白组之间无显著差异(P>0.05)。
|
|
表 2 鸡ANGPTL4重组蛋白对肉鸡血清激素水平的影响 Table 2 Effects of chicken ANGPTL4 recombinant protein on serum hormone levels of broilers |
众所周知,禁食、高脂饲粮以及益生菌和酸化剂等均具有改变动物脂肪代谢的功能,而动物脂肪代谢的改变将直接影响到动物的生产性能。为了更好地提高肉鸡的生产性能,揭秘营养因素调控肉鸡脂肪代谢的机制,寻找连接营养因素与动物脂肪代谢的媒介越来越引起人们关注。ANGPTL4在鼠和人上已被证实具有抑制LPL活性,调节动物机体氧化分解的多种生物学功能,近年来被认为是沟通营养因素和动物脂肪代谢的重要媒介之一[2]。在鼠和人上已有通过真核表达系统(HEK293细胞)表达的ANGPTL4重组蛋白产品,但鸡ANGPTL4重组蛋白目前却尚未有报道。试验前期,曾尝试用HEK293细胞进行真核表达,但目的蛋白没有获得表达,因此,本试验中采用大肠杆菌进行原核表达鸡ANGPTL4重组蛋白,并通过融合SUMO标签,以期达到提高融合蛋白的表达量和可溶性,促进目的蛋白正确折叠的目的。通过SDS-PAGE分析发现重组蛋白以包涵体的形式存在。由于目的蛋白形成包涵体后不具有生物活性,因此,本试验进一步进行了包涵体复性,并通过复性蛋白的Ni柱纯化,得到了预期大小的终浓度为0.1 mg/mL的融合蛋白His-SUMO-ANGPTL4。
3.2 鸡ANGPTL4重组蛋白对肉鸡血清生化指标和激素水平的影响大多数脂质在血液中的转运是以脂蛋白的形式进行的,其中HDL主要参与逆向转运胆固醇,LDL主要参与转运内源性胆固醇,VLDL主要参与转运内源性甘油三酯和胆固醇[5]。本试验中,2 500和12 500 ng/kg BW鸡ANGPTL4重组蛋白组肉鸡血清中较高的VLDL含量表明,静脉注射一定剂量的鸡ANGPTL4重组蛋白可影响禁食状态下肉鸡甘油三酯在血液中的转运。其原因可能是ANGPTL4具有抑制LPL活性的作用[6],从而导致LPL催化血液中VLDL所携带的甘油三酯水解成甘油和脂肪酸的能力受阻[7]。
胰岛素、生长激素和瘦素是涉及肉鸡脂肪代谢的重要激素,其中胰岛素具有促进肉鸡脂肪沉积的作用,而生长激素和瘦素则具有降低肉鸡脂肪沉积的作用[8]。本试验中,20、2 500和12 500 ng/kg BW鸡ANGPTL4重组蛋白组肉鸡血清中较低的生长激素水平以及2 500和12 500 ng/kg鸡ANGPTL4重组蛋白组肉鸡血清中较低的瘦素水平表明,静脉注射一定剂量的鸡ANGPTL4重组蛋白缓解了生长激素和瘦素对肉鸡脂肪沉积的减少,提高了肉鸡的脂肪沉积,这正与本试验发现的鸡ANGPTL4重组蛋白提高了肉鸡血清VLDL含量的结果相对应;而2 500和12 500 ng/kg鸡ANGPTL4重组蛋白组肉鸡血清中较高的GLU含量则可能是ANGPTL4刺激了葡萄糖异生作用。
关于ANGPTL4对动物血液指标影响的研究多集中于在鼠上,在鸡上尚未见相关报道。Ge等[9]研究表明,过表达ANGPTL4鼠其血浆中VLDL含量较正常鼠显著增加。Köster等[10]研究表明,过表达ANGPTL4鼠在禁食状态下其血浆GLU含量、胰岛素和瘦素水平与正常鼠相比无显著差异。Mandard等[11]研究表明,过表达ANGPTL4鼠在禁食6 h后其血浆VLDL和HDL含量较正常鼠有显著增加,而血浆GLU含量与正常鼠相比无显著差异。Lichtenstein等[12]研究表明,过表达ANGPTL4鼠在禁食24 h后其血浆GLU含量较正常鼠有显著提高,而血浆HDL、LDL含量与胰岛素水平与正常鼠相比无显著差异。不同试验间结果存在差异的原因可能在于各试验所采用的试验动物、禁食时长和ANGPTL4添加量不同。
4 结论① 通过构建鸡ANGPTL4的原核表达载体pET21a-His-SUMO-ANGPTL4,实现其在大肠杆菌BL21(DE3)中的表达,经包涵体复性和复性蛋白的Ni柱纯化,得到了预期大小的融合蛋白His-SUMO-ANGPTL4。
② 静脉注射2 500和12 500 ng/kg BW鸡ANGPTL4重组蛋白均可显著提高肉鸡血清中GLU和VLDL含量,显著降低肉鸡血清中生长激素和瘦素水平。
| [1] |
MANDARD S, ZANDBERGEN F, TAN N S, et al. The direct peroxisome proliferator-activated receptor target fasting-induced adipose factor (FIAF/PGAR/ANGPTL4) is present in blood plasma as a truncated protein that is increased by fenofibrate treatment[J]. The Journal of Biological Chemistry, 2004, 279(33): 34411-34420. DOI:10.1074/jbc.M403058200 |
| [2] |
GROOTAERT C, VAN DE WIELE T, VERSTRAETE W, et al. Angiopoietin-like protein 4:health effects, modulating agents and structure-function relationships[J]. Expert Review of Proteomics, 2012, 9(2): 181-199. DOI:10.1586/epr.12.12 |
| [3] |
ZHAO X, GUO Y M, LIU H B, et al. Clostridium butyricum reduce lipogenesis through bacterial wall components and butyrate[J]. Applied Microbiology and Biotechnology, 2014, 98(17): 7549-7557. DOI:10.1007/s00253-014-5829-x |
| [4] |
ZHAO X, DING X, YANG Z B, et al. Effects of Clostridium butyricum on breast muscle lipid metabolism of broilers[J]. Italian Journal of Animal Science, 2018, 17(4): 1010-1020. DOI:10.1080/1828051X.2018.1453758 |
| [5] |
王镜岩, 朱圣庚, 徐长法. 生物化学(上册)[M]. 3版. 北京: 高等教育出版社, 2002: 118-119.
|
| [6] |
BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. |
| [7] |
GOLDBERG I J. Lipoprotein lipase and lipolysis:central roles in lipoprotein metabolism and atherogenesis[J]. Journal of Lipid Research, 1996, 37(4): 693-707. |
| [8] |
赵旭.丁酸梭菌对肉鸡脂肪代谢的影响及其机理研究[D].博士学位论文.北京: 中国农业大学, 2014: 16-17. http://cdmd.cnki.com.cn/Article/CDMD-10019-1014221313.htm
|
| [9] |
GE H F, YANG G Q, YU X X, et al. Oligomerization state-dependent hyperlipidemic effect of angiopoietin-like protein 4[J]. Journal of Lipid Research, 2004, 45(11): 2071-2079. DOI:10.1194/jlr.M400138-JLR200 |
| [10] |
KÖSTER A, CHAO Y B, MOSIOR M, et al. Transgenic angiopoietin-like (ANGPTL)4 overexpression and targeted disruption of ANGPTl4 and ANGPTl3:regulation of triglyceride metabolism[J]. Endocrinology, 2005, 146(11): 4943-4950. DOI:10.1210/en.2005-0476 |
| [11] |
MANDARD S, ZANDBERGEN F, VAN STRATEN E, et al. The fasting-induced adipose factor/angiopoietin-like protein 4 is physically associated with lipoproteins and governs plasma lipid levels and adiposity[J]. Journal of Biological Chemistry, 2006, 281(2): 934-944. DOI:10.1074/jbc.M506519200 |
| [12] |
LICHTENSTEIN L, BERBÉE J F P, VAN DIJK S J, et al. ANGPTl4 upregulates cholesterol synthesis in liver via inhibition of LPL-and HL-dependent hepatic cholesterol uptake[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2007, 27(11): 2420-2427. DOI:10.1161/ATVBAHA.107.151894 |



