2. 动物生产及产品质量安全教育部重点实验室, 长春 130118;
3. 吉林省动物营养与饲料科学重点实验室, 长春 130118
2. Key Laboratory of Animal Production and Product Quality and Safety, Ministry of Education, Changchun 130118, China;
3. Jilin Province Key Laboratory of Animal Nutrition and Feed Science, Changchun 130118, China
热应激是夏季畜牧业生产中面临的主要问题。在热应激环境下,动物因散热导致肠道缺血缺氧,使肠道受到严重损伤,进一步导致肠道屏障功能受损,从而影响动物的生长性能[1]。猪在高温条件下极易出现热应激反应。研究发现,热应激可导致猪小肠尤其空肠严重损伤,小肠绒毛上皮细胞凋亡加剧[2]。在热应激状态下,大部分蛋白质合成停止以合成热休克蛋白(heat shock protein, HSP)。HSP是机体受到一定强度的刺激诱导产生的,广泛存在于大多数生物体内,在正常情况下表达水平较低的一类热应激蛋白质[3]。热休克蛋白70(heat shock protein 70, HSP70)作为其中重要的一员,具有分子伴侣功能,抗辐射功能,提高细胞抗应激、抗凋亡、抗氧化能力功能,以及促进细胞增殖和参与免疫调节等功能[4]。研究发现,热应激能够通过促进HSP70的合成,进而抑制肠黏膜上皮细胞的凋亡[5]。HSP70可通过线粒体通路对细胞凋亡起调控作用[6]。大量试验结果表明,谷氨酰胺(glutamine,Gln)作为一种条件性必需氨基酸,能够特异性地诱导HSP70的表达,是一种安全高效的HSP70诱导剂[7-9]。本试验从分子水平入手,建立热应激细胞模型,通过谷氨酰胺诱导HSP70表达,观察HSP70对热应激猪小肠上皮细胞(IPEC-J2)细胞凋亡及细胞凋亡线粒体通路中关键基因[B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、凋亡酶激活因子-1(apoptotic protease activating facter-1,Apaf-1)、半胱氨酸天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)、半胱氨酸天冬氨酸蛋白水解酶-9(cysteinyl aspartate specific proteinase-9,Caspase-9)]mRNA和蛋白表达的影响,探讨HSP70可能的作用机制,为明确其作用机制提供理论依据,并为其在畜牧业生产中的应用提供有价值的参考资料。
1 材料与方法 1.1 细胞来源及培养IPEC-J2由中国农业大学赠送。细胞生长于含有10%胎牛血清(FBS)和1%青链霉素的DMEM培养液中,当细胞处于对数生长期时,使用含有乙二胺四乙酸(EDTA)的0.25%胰酶将细胞消化下来后用培养液重悬,接种于细胞培养板中用于后续试验。
1.2 主要试剂及仪器DMEM、FBS、0.25%胰酶、PBS购自美国Gibco公司,青霉素与链霉素混合液(100×)、谷氨酰胺购自美国Sigma公司,Annexin V-FITC细胞凋亡检测试剂盒购自美国BD公司,一抗[(HSP70、Apaf-1、Caspase-3、Caspase-9、Bcl-2、β-肌动蛋白(β-actin)]购自北京博奥森生物技术有限公司,山羊抗兔免疫球蛋白G(IgG)购自北京中杉金桥生物技术有限公司,聚偏二氟乙烯(PVDF)膜购自美国Millipore公司,RIPA裂解液、蛋白酶抑制剂购自北京康为世纪生物科技有限公司,5×蛋白质上样缓冲液、二喹啉甲酸(BCA)蛋白质浓度测定试剂盒购自上海碧云天生物技术有限公司,Trizol购自美国Invitrogen公司),Primer ScriptTM RT Reagent Kit with gDNA Eraser购自日本TaKaRa公司,iQTM SYBR® Green Supermix购自美国Bio-Rad公司。细胞培养箱购自美国Thermo公司,倒置荧光显微镜购自日本Nikon公司,微量紫外分光光度计购自美国Thermo公司,StepOne Plus7500实时荧光定量分析仪购自美国Applied Biosystems公司,流式细胞仪购自美国BD公司。
1.3 谷氨酰胺诱导细胞HSP70上调表达取对数生长期的肠上皮细胞,调整细胞浓度为1.0×106个/mL,接种于6孔细胞培养板中,置于37 ℃、5%二氧化碳(CO2)培养箱中常规培养48 h,吸弃培养基并用磷酸盐缓冲液(PBS)洗2次,分别加入谷氨酰胺浓度为1、2、4、6、8、10 mmol/L的DMEM培养液继续培养24 h,收取细胞。测定细胞中HSP70 mRNA及蛋白表达量。选择HSP70 mRNA表达量最高的Gln浓度作为后续试验中HSP70上调表达的诱导条件。
1.4 细胞分组及处理将试验细胞分为对照组(Con组)、热应激组(Hs组)和谷氨酰胺组(Gln组)。所有试验均选取3代不同细胞,每个试验均设3次重复。处理过程如下:1)取对数生长期细胞,调整细胞浓度为1.0×106个/mL,将细胞分为3组,接种于6孔细胞培养板中,置于37 ℃、5% CO2培养箱中常规培养48 h,吸弃培养基并用PBS洗2次,Con组和Hs组加入完全培养基继续培养,Gln组加入含6 mmol/L谷氨酰胺培养基继续培养。2)24 h后,Con组于37 ℃、5% CO2培养箱中继续培养,将Hs组和Gln组细胞移入42 ℃、5% CO2培养箱中继续培养,12 h后收集细胞待做相关检测(因细胞培养液中含有凋亡细胞,故将培养液一并收集以防试验误差)。
1.5 Annexin V/PI双染检测细胞凋亡将3组处理后的细胞分别收集到10 mL的离心管中,2 000 r/min离心5 min,冷PBS轻轻冲洗2次;用1×Annexin-binding buffer重悬细胞,调整细胞浓度为1.0×106个/mL;每100 μL细胞悬液加入5 μL AnnexinV-FITC和5 μL碘化丙啶(PI)混匀,室温避光孵育15 min后上流式细胞仪检测,激发波长488 nm,发射波长530 nm。用FlowJo V10软件分析细胞凋亡率。
1.6 实时荧光定量PCR检测基因表达Trizol法提取总RNA。利用微量紫外分光光度计测定吸光度(OD)和RNA浓度,OD260/OD280在1.8~2.0之间表示所提的总RNA纯度较好。另取2 μL RNA与1 μL 6×RNA loading buffer混匀后采用琼脂糖凝胶电泳检测其完整性。采用反转录试剂盒两步法对RNA进行反转录(cDNA的合成)。引物的设计合成:以β-actin为内参基因,参照GenBank中猪基因的mRNA序列,运用Primer Premier 5.0设计引物,由生工生物工程(上海)股份有限公司负责引物的合成。引物序列见表 1。荧光定量鉴定:使用iQTM SYBR® Green Supermix荧光染料对基因进行相对定量分析。每个组6个重复,用对照组平均值归一法与2-ΔΔCt法进行基因相对定量分析。
|
|
表 1 引物序列 Table 1 Primer sequences |
用RIPA裂解液与蛋白酶抑制剂苯甲基磺酰氟(PMSF)按照1 mL+10 μL体积混合的细胞裂解液提取细胞总蛋白。按照BCA蛋白质浓度测定试剂盒说明书对蛋白样品进行定量。采用Western blot方法,进行相关蛋白表达的测定。利用Kodak Molecular Imaging systems进行图像采集,Quality One软件进行蛋白灰度值分析。以β-actin为内参蛋白,目的蛋白与内参蛋白灰度值之比表示为该蛋白的相对表达量。
1.8 统计分析使用SPSS 22.0软件进行统计学分析,使用单因素方差分析(one-way ANOVA)并用Duncan氏法进行多重比较。试验数据表示为平均值±标准差。P < 0.05表示差异显著,P<0.01表示差异极显著。
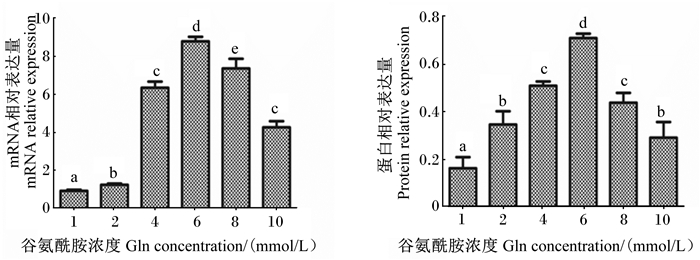
2 结果与分析 2.1 谷氨酰胺对细胞内HSP70 mRNA和蛋白相对表达量的影响由图 1可知,谷氨酰胺对HSP70 mRNA和蛋白相对表达量的影响一致,呈先增加后下降的趋势,经过6 mmol/L的谷氨酰胺诱导24 h后,HSP70 mRNA和蛋白相对表达量到达峰值,显著高于其他浓度(P < 0.05)。
|
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P < 0.01)。下图同。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05), and with different capital letter superscripts mean significant difference (P < 0.01). The same as below. 图 1 谷氨酰胺对细胞内HSP70 mRNA和蛋白相对表达量的影响 Fig. 1 Effects Gln on HSP70 mRNA and protein relative expression in cells |
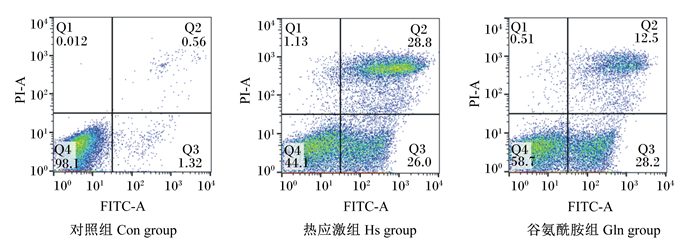
双变量流式细胞仪散点图中Q1区域的细胞为坏死细胞,Q2区域的细胞为晚期凋亡细胞,Q3区域的细胞为早期凋亡细胞,Q4区域的细胞为活细胞。统计细胞凋亡率时采用Q2+Q3。由图 2和表 2可知,与Hs组相比,Gln组细胞凋亡率极显著降低(P < 0.01),但仍极显著高于Con组(P < 0.01)。这表明HSP70的高表达可有效缓解热应激导致的细胞凋亡。
|
图 2 各组细胞凋亡率检测 Fig. 2 Detection of apoptosis rate in each group |
|
|
表 2 HSP70对肠上皮细胞凋亡率的影响 Table 2 Effects of HSP70 on intestinal epithelial cell apoptosis rate |
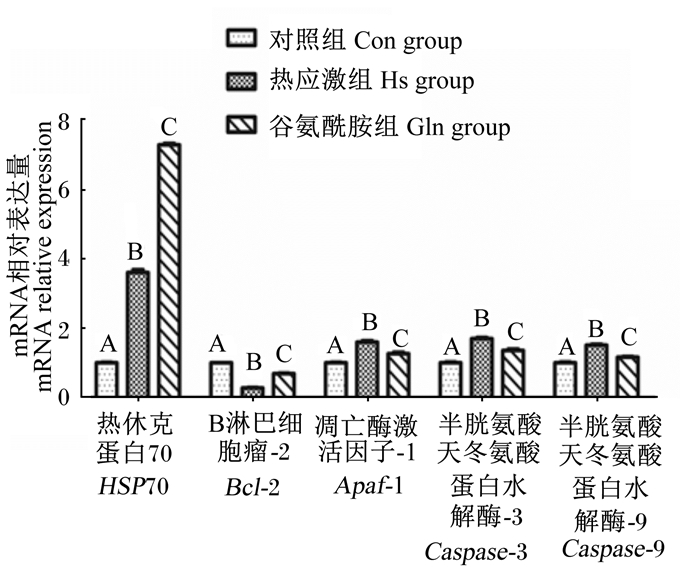
由图 3可知,与Con组相比,热应激和谷氨酰胺均能显著诱导HSP70 mRNA表达,Hs组和Gln组HSP70 mRNA相对表达量极显著升高(P < 0.01),且Gln组HSP70 mRNA相对表达量极显著高于Hs组(P < 0.01)。Hs组Bcl-2 mRNA相对表达量极显著低于Con组(P < 0.01),Hs组Apaf-1、Caspase-3、Caspase-9 mRNA相对表达量均极显著高于Con组(P < 0.01)。与Hs组相比,Gln组Bcl-2 mRNA相对表达量极显著升高(P < 0.01),Apaf-1、Caspase-3、Caspase-9 mRNA相对表达量均极显著降低(P<0.01)。这说明通过诱导HSP70高表达可显著改善上述各凋亡相关基因的相对表达量。
|
图 3 各组细胞基因的实时荧光定量PCR结果 Fig. 3 Real time fluorescent quantitative PCR results of cell genes in each group |
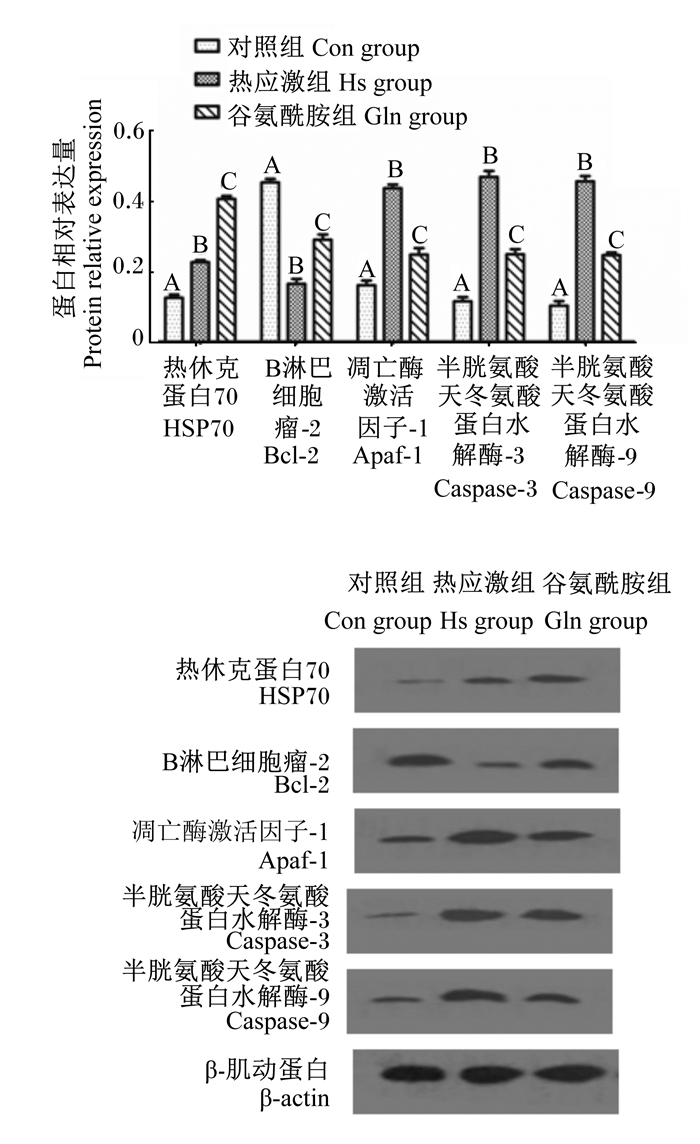
由图 4可知,与Con组相比,Hs组和Gln组HSP70蛋白相对表达量极显著增加(P < 0.01),且Gln组HSP70蛋白相对表达量极显著高于Hs组(P < 0.01)。Hs组Bcl-2蛋白相对表达量极显著低于Con组(P < 0.01),Hs组Apaf-1、Caspase-3、Caspase-9蛋白相对表达量均极显著高于Con组(P < 0.01)。Gln组Bcl-2蛋白相对表达量极显著高于Hs组(P < 0.01),且极显著低于Con组(P < 0.01);Gln组Apaf-1、Caspase-3、Caspase-9蛋白相对表达量均极显著低于Hs组(P < 0.01),而极显著高于Con组而(P < 0.01)。这些均与各基因mRNA相对表达量的趋势相一致。
|
图 4 各组细胞蛋白的免疫印迹结果 Fig. 4 Western blot results of cell proteins in each group |
HSP70作为HSP家族中最重要的一类蛋白,主要行使分子伴侣的功能,如稳定未折叠的新合成肽、参与变性蛋白质的修复清除等;还能保持细胞形态完好,增强细胞的免疫,抑制细胞凋亡,从而维持细胞内环境的稳态[3]。HSP70可以通过增加合成以保护自身组织细胞免受不良应激原刺激所致的损害,在应激耐受和应激保护中发挥重要作用[10]。谷氨酰胺可以增加HSP的表达,达到对抗应激刺激起到保护细胞的作用[11]。在谷氨酰胺对奶牛乳腺上皮细胞HSP70 mRNA表达的影响试验中发现,谷氨酰胺促进了正常状态下奶牛乳腺上皮细胞HSP70 mRNA的表达,8.0 mmol/L的谷氨酰胺诱导24 h后细胞HSP70 mRNA相对表达量达到峰值[12]。本研究结果显示,当谷氨酰胺浓度为6 mmol/L时,HSP70 mRNA和蛋白的相对表达量均达到峰值;当谷氨酰胺浓度低于6 mmol/L时,HSP70 mRNA和蛋白的相对表达量随谷氨酰胺浓度的增加而增加;当谷氨酰胺浓度高于6 mmol/L时,HSP70 mRNA和蛋白的相对表达量受到了抑制。这可能是由于过量的谷氨酰胺会抑制细胞增殖,并且谷氨酰胺的代谢产物会降低HSP70的表达。
细胞凋亡是机体正常细胞受到生理或病理性刺激后,出现的一种由基因控制的自主有序的死亡过程[13],对维持细胞生长和内环境稳定有重要作用,在早期属于可逆过程。半胱氨酸天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)依赖性凋亡具有2条通路:外源性通路(通过细胞外信号激活细胞内的Caspase)和内源性通路(通过线粒体释放凋亡酶激活因子激活Caspase)。研究发现,热应激会导致猪小肠严重受损,小肠细胞凋亡加剧,外源性通路(死亡受体通路)和内源性通路(线粒体通路)均被激活[2]。研究发现,黄岑苷能够通过激活凋亡相关因子及其配体(Fas/FasL)途径和HSP表达来保护睾丸细胞免受热应激诱导的细胞凋亡[14]。Park等[15]研究发现,HSP70乙酰化可通过与Apaf-1相互作用和阻断凋亡体的形成来减弱Caspase依赖性的细胞凋亡。HSP70对细胞凋亡的死亡受体通路和线粒体通路均有抑制作用[16]。鸡原代心肌细胞通过线粒体通路抑制HSP70的表达,从而促进细胞凋亡[17-18]。通过本试验我们发现,猪小肠上皮细胞经过热应激处理后,HSP70 mRNA和蛋白的相对表达量升高,细胞凋亡率显著升高,说明细胞会主动合成HSP70以缓解热应激。通过谷氨酰胺诱导HSP70表达,细胞凋亡率显著降低,但未能恢复至Con组水平,说明HSP70在一定程度上对细胞凋亡有抑制作用。
线粒体信号转导通路是细胞凋亡的主要信号通路[19]。当细胞受到刺激时便会启动Apaf-1所在的线粒体凋亡途径。线粒体膜间腔内所含有的细胞色素C氧化酶(Cyt-C)释放并进入细胞质,Cyt-C可与胞质中Apaf-1结合形成Apaf-1/Cyt-C复合物,该复合物可增强Apaf-1与ATP/dATP结合力,Apaf-1/Cyt-C复合物与ATP/dATP结合后可诱导Apaf-1寡聚化并结合Caspase-9形成凋亡复合体,激活Caspase-9,进而活化Caspase-3并通过级联反应激活下游成分诱导细胞凋亡发生[20-24]。Apaf-1是线粒体凋亡途径中一个重要的促凋亡因子,在正常细胞中以非活性形式存在于细胞质中,是凋亡体的核心[25]。Bcl-2族蛋白主要作用位点就在线粒体膜上,在细胞凋亡中起着重要的调控作用,其中Bcl-2具有抗细胞凋亡的作用[26]。Caspase家族是引起细胞凋亡的关键酶。Caspase-9是凋亡的启动者,Caspase-9必须绑定到凋亡复合体上才能保留并具有较高的催化活性[27-28]。Caspase-9被激活,引起Caspase级联反应[29]。Caspase-3是细胞凋亡主要效应执行者,一旦活化,凋亡不可逆转。霍爱华[30]等研究发现,42 ℃热应激1 h即可激活细胞凋亡线粒体通路。黄岑苷能够下调热应激猪近端肾小管细胞Bcl-2相关X蛋白(Bax)的表达提高Bcl-2和Bax的比值来降低细胞凋亡率[31]。复方参术汤处理猪小肠黏膜上皮细胞后,能够上调Bcl-2 mRNA和蛋白的相对表达量,抑制Caspase-9和Caspase-3的活性,改善猪传染性胃肠炎病毒通过线粒体通路引起的细胞凋亡[32]。本试验结果显示,细胞经过热应激处理后,抗凋亡因子Bcl-2 mRNA和蛋白的相对表达极显著降低,Apaf-1、Caspase-9、Caspase-3 mRNA和蛋白的相对表达量均极显著升高,表明热应激细胞线粒体信号转导通路启动。通过谷氨酰胺预处理诱导HSP70的表达,抗凋亡因子Bcl-2 mRNA和蛋白的相对表达极显著升高,Apaf-1、Caspase-9、Caspase-3 mRNA和蛋白的相对表达均极显著降低。这表明通过上调HSP70表达,能够有效改善细胞凋亡线粒体通路相关因子的表达,使得线粒体信号转导通路诱导的细胞凋亡减少,从而达到降低热应激细胞损伤的作用。
4 结论通过诱导猪小肠上皮细胞HSP70表达,可降低热应激细胞促进细胞凋亡基因Apaf-1、Caspase-9、Caspase-3表达,提高抑制细胞凋亡基因Bcl-2表达,从而减少细胞热应激损伤和凋亡,表明通过上调HSP70表达能够在一定程度上对热应激肠上皮细胞起到保护作用。
| [1] |
熊云霞, 马现永, 郑春田, 等. 热应激对猪肠道健康、免疫系统和肉品质的影响及作用机制[J]. 动物营养学报, 2017, 29(2): 374-381. |
| [2] |
贾丹, 昝君兰, 赵宏, 等. 热应激对猪小肠组织形态和细胞凋亡的影响[J]. 北京农学院学报, 2012, 27(1): 36-38. |
| [3] |
唐姝, 徐蛟, 狄良娇, 等. 热休克蛋白的功能及其在畜牧业中的应用[J]. 南京农业大学学报, 2018, 41(4): 605-615. |
| [4] |
彭乔烽, 陈朗, 马小梅, 等. 热休克蛋白HSP70家族功能研究进展[J]. 甘肃畜牧兽医, 2019, 49(5): 18-20. |
| [5] |
WU X, ZHANG Y Z, YIN Y L, et al. Roles of heat-shock protein 70 in protecting against intestinal mucosal damage[J]. Frontiers in Bioscience, 2013, 18: 356-365. |
| [6] |
肖卫民, 蒋碧梅, 石永忠, 等. 热休克蛋白抑制过氧化氢所致C2C12细胞凋亡的机制[J]. 中南大学学报(医学版), 2004, 29(1): 6-10. |
| [7] |
HAO Y, GU X H, WANG X L. Overexpression of heat shock protein 70 and its relationship to intestine under acute heat stress in broilers:1.Intestinal structure and digestive function[J]. Poultry Science, 2012, 91(4): 781-789. |
| [8] |
孙培明. 热休克蛋白70的生物学功能及其诱导剂——谷氨酰胺在畜牧业中的应用[J]. 饲料工业, 2011, 32(14): 65-68. |
| [9] |
谭权, 张克英. 热休克蛋白70诱导剂及其应用[J]. 畜牧与兽医, 2008, 40(1): 98-101. |
| [10] |
SABIRZHANOV B, STOICA B A, HANSCOM M, et al. Over-expression of HSP70 attenuates caspase-dependent and caspase-independent pathways and inhibits neuronal apoptosis[J]. Journal of Neurochemistry, 2012, 123(4): 542-554. |
| [11] |
ZHANG Y, YAN H, LV S G, et al. Effects of glycyl-glutamine dipeptide supplementation on myocardial damage and cardiac function in rats after severe burn injury[J]. International Journal of Clinical and Experimental Pathology, 2013, 6(5): 821-830. |
| [12] |
张响英, 史红霞, 狄和双, 等. 谷氨酰胺对奶牛乳腺上皮细胞生长、增殖及HSP70 mRNA表达的影响[J]. 浙江农业学报, 2015, 27(9): 1535-1540. |
| [13] |
李超, 伏圣博, 刘华玲, 等. 细胞凋亡研究进展[J]. 世界科技研究与发展, 2007, 29(3): 45-53. |
| [14] |
GUO X T, CHI S K, CONG X, et al. Baicalin protects sertoli cells from heat stress-induced apoptosis via activation of the Fas/FasL pathway and Hsp72 expression[J]. Reproductive Toxicology, 2015, 57: 196-203. |
| [15] |
PARK Y H, SEO J H, PARK J H, et al. HSP70 acetylation prevents caspase-dependent/independent apoptosis and autophagic cell death in cancer cells[J]. International Journal of Oncology, 2017, 51(2): 573-578. |
| [16] |
SETYARANI M, ZINELLU A, CARRU C, et al. High dietary taurine inhibits myocardial apoptosis during an atherogenic diet:association with increased myocardial HSP70 and HSF-1 but not caspase 3[J]. European Journal of Nutrition, 2014, 53(3): 929-937. |
| [17] |
XU J, TANG S, YIN B, et al. Co-enzyme Q10 and acetyl salicylic acid enhance HSP70 expression in primary chicken myocardial cells to protect the cells during heat stress[J]. Molecular and Cellular Biochemistry, 2017, 435(1/2): 73-86. |
| [18] |
XU J, TANG S, SONG E, et al. HSP70 expression induced by Co-enzyme Q10 protected chicken myocardial cells from damage and apoptosis under in vitro heat stress[J]. Poultry Science, 2017, 96(5): 1426-1437. |
| [19] |
CUI J, CHEN C, LU H, et al. Modelling of the mitochondrial apoptosis network[J]. International Journal of Bioinformatics Research and Applications, 2008, 4(2): 172-187. |
| [20] |
REUBOLD T F, WOHLGEMUTH S, ESCHENBURG S. Crystal structure of full-length Apaf-1:how the death signal is relayed in the mitochondrial pathway of apoptosis[J]. Structure, 2011, 19(8): 1074-1083. |
| [21] |
HU Q, WU D, CHEN W, et al. Molecular determinants of caspase-9 activation by the Apaf-1 apoptosome[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(46): 16254-16261. |
| [22] |
REUBOLD T F, ESCHENBURG S. A molecular view on signal transduction by the apoptosome[J]. Cellular Signalling, 2012, 24(7): 1420-1425. |
| [23] |
PANG Y X, BAI X C, YAN C Y, et al. Structure of the apoptosome:mechanistic insights into activation of an initiator caspase from Drosophila[J]. Genes & Development, 2015, 29(3): 277-287. |
| [24] |
YUAN S J, TOPF M, REUBOLD T F, et al. Changes in Apaf-1 conformation that drive apoptosome assembly[J]. Biochemistry, 2013, 52(13): 2319-2327. |
| [25] |
贾明旭, 陈吉. 凋亡蛋白酶活化因子-1与肿瘤相关性的研究进展[J]. 世界华人消化杂志, 2015, 23(23): 3729-3735. |
| [26] |
EDLICH F. BCL-2 proteins and apoptosis:recent insights and unknowns[J]. Biochemical and Biophysical Research Communications, 2018, 500(1): 26-34. |
| [27] |
MANNS J, DAUBRAWA M, DRIESSEN S, et al. Triggering of a novel intrinsic apoptosis pathway by the kinase inhibitor staurosporine:activation of caspase-9 in the absence of Apaf-1[J]. The FASEB Journal, 2011, 25(9): 3250-3261. |
| [28] |
YUAN S J, YU X C, ASARA J M, et al. The holo-apoptosome:activation of procaspase-9 and interactions with caspase-3[J]. Structure, 2011, 19(8): 1084-1096. |
| [29] |
孙军培, 刘久华. Apaf-1、Caspase-9及凋亡体调节的研究进展[J]. 中华全科医学, 2013, 11(7): 1102-1104. |
| [30] |
霍爱华, 孙雪荣, 于文慧, 等. 热应激诱导猪肾小管上皮(LLC-PK1)细胞线粒体凋亡相关因子的时效表达[J]. 华北农学报, 2016, 31(6): 94-99. |
| [31] |
孙春玲, 国晓瞳, 赵园, 等. 黄芩苷对热应激条件下猪近端肾小管(LLC-PK1)细胞凋亡率及B细胞淋巴瘤-2基因(Bcl-2)和Bcl-2相关X蛋白基因(Bax)表达的影响[J]. 农业生物技术学报, 2014, 22(12): 1553-1560. |
| [32] |
王雪飞, 王炼, 丁菲, 等. 复方参术汤通过线粒体通路抑制TGEV诱导猪小肠黏膜上皮细胞凋亡的研究[J]. 中国兽医学报, 2017, 37(10): 1957-1963. |




