紫花苜蓿(Medicago sativa)是世界上人工种植面积最大的豆科牧草,素有“牧草之王”的美称[1]。当前我国苜蓿主要以调制干草为主,调制过程中因雨淋、落叶、甚至腐烂等因素使营养成分损失较大[2-3]。青贮是保存青饲料营养物质的有效方法[3],也是一个复杂的微生物区系变化过程,涉及到乳酸菌、腐败菌、霉菌、芽孢杆菌等多种微生物,这些微生物存在于青贮原料、青贮发酵过程中和发酵完成后的所有时期,并与青贮原料种类和青贮时期有很大关系[4-5]。乳酸菌是青贮发酵成功的关键微生物,它们能够分解糖分产生乳酸,快速降低pH,有效抑制霉菌等有害微生物的活动,从而降低青贮饲料养分损失,提高青贮饲料发酵品质[6-7]。
通过添加微生物添加剂可有效缩短青贮饲料调制时间,提升青贮的成功率,提高青贮饲料品质。植物乳杆菌(Lactobacillus plantarum)、乳酸片球菌(Pediococcus acidilactici)、枯草芽孢杆菌(Bacillus subtilis)、凝结芽孢杆菌(Bacillus coagulans)、粪链球菌(Streptococcus faecalis)等多种微生物菌种被单独或组合应用于青贮饲料,调制的青贮饲料品质优良[4, 8]。
苜蓿可溶性碳水化合物含量低,水分含量高,苜蓿青贮的制作常常依靠青贮添加剂。王丽学等[8]利用5种乳酸菌对紫花苜蓿进行青贮,发现植物乳杆菌和乳酸片球菌能够显著提高青贮品质。也有研究表明,不仅仅只有乳酸菌影响苜蓿青贮的品质,乳杆菌、地衣芽孢杆菌(Bacillus licheniformis)及不可培养酸杆菌对苜蓿进行裹包青贮,能够显著提高苜蓿青贮品质和有氧稳定性[9]。由于苜蓿种植地域和收获季节的差异以及微生物菌种来源和特性的差异,导致苜蓿青贮过程中微生物种群变化情况存在很多未知。
因此,本研究旨在从苜蓿青贮饲料中筛选出主要的微生物菌种,并将其组合应用于新鲜苜蓿的青贮中,评定其对青贮发酵品质的影响,确定影响高水分苜蓿青贮的微生物菌种及组合,指导苜蓿青贮调制,提高苜蓿青贮的品质。
1 材料与方法 1.1 试验材料 1.1.1 紫花苜蓿品种为阿尔冈金(Algonquin),河南科技大学试验牧场种植第3年,春季第1茬,初花期刈割后在试验田晾晒24 h,至水分含量为65%左右时,用于自然发酵苜蓿青贮制作。第2茬用于添加微生物菌种的苜蓿青贮制作。
1.1.2 培养基MRS培养基:葡萄糖4 g,胰蛋白胨2 g,酵母提取物1 g,牛肉膏2 g,MnSO4·4H2O 0.076 g,MgSO4·7H2O 0.04 g,吐温(Tween)-80 0.2 mL,K2HPO4 0.4 g,柠檬酸胺0.4 g(固体培养基加琼脂粉3.2 g),无菌水200 mL,pH 6.2~6.4。
LB培养基:胰蛋白胨2 g,酵母提取物1 g,氯化钠2 g(固体培养基加琼脂粉3.2 g),无菌水200 mL,pH 7.0~7.2。
NA培养基:牛肉膏0.6 g,蛋白胨2 g,氯化钠1 g,无菌水200 mL(固体培养基加琼脂粉3.2 g),pH 7.2。
1.1.3 主要试剂细菌基因组提取试剂盒购自天根生化科技(北京)有限公司,生化试剂购自TaKaRa生物公司,其他化学试剂化十六烷基三甲铵(CTAB)提取液、氯化钠、Tris-盐酸、乙二胺四乙酸、巯基乙醇、酚、氯仿、异戊醇、苯酚、次氯酸钠、亚硝酰铁氰化钠、柠檬酸钠、氯化铵、乙酸钠等均为分析纯,购自洛阳博冠商贸有限公司。
1.1.4 引物通用上游引物:5′-AGAGTTTGATCCTGGCTCAC-3′,下游引物:5′-AAGGAGGTGATCCAGCC-3′[10],由生工生物工程(上海)股份有限公司合成。
1.2 试验方法 1.2.1 筛选青贮微生物菌种的苜蓿青贮制作将春季第1茬刈割的紫花苜蓿,经晾晒24 h,至水分65%左右,用剪刀剪成1 cm长的小段,装入500 mL玻璃广口瓶中,压实后,磨口塞密封并在瓶塞周围滴加纯净水密封,厌氧发酵,青贮至30 d,选取3瓶,开瓶取样用于筛选青贮微生物菌种,每瓶为1个重复。
1.2.2 微生物菌种的筛选鉴定微生物的筛选参考李旭娇等[11]方法,并做如下调整:在超净台中将10 g青贮样品剪碎后放入90 mL无菌水混合于150 mL三角瓶中,封口膜封口,置于摇床上振荡30 min,配制10-2、10-3、10-4 3个稀释梯度,取50 μL稀释液滴在MRS、LB和NA培养基上,用涂布棒将菌液在培养基上涂抹均匀,然后将培养基倒转静置20~30 min,将MRS培养基在37 ℃厌氧、NA和LB培养基在37 ℃有氧条件下培养24~48 h,分离微生物。
参照细菌基因组提取试剂盒说明书,提取所筛选菌种基因组DNA,扩增菌种的16S rDNA保守序列。对扩增产物进行测序,并通过NCBI Blast N进行保守序列的分析比对。PCR扩增体系为25 μL体系,包括2.5 μL 10×Ex Taq Buffer,2 μL dNTP,上、下游引物各1 μL,0.5 μL Ex Taq酶,1 μL模板(基因组DNA),17 μL ddH2O。PCR反应条件及程序为:预变性94 ℃ 2 min→35个循环(变性94 ℃ 30 s→复性57 ℃ 30 s→延伸72 ℃ 1 min 30 s)→终延伸72 ℃ 10 min→4 ℃保存。
1.2.3 微生物发酵苜蓿青贮试验设计将第2茬刈割的紫花苜蓿,水分含量为73.0%,用于微生物发酵苜蓿青贮的调制,微生物菌种添加总量为1.0×107 CFU/g。根据2.2所筛选菌种结果,设计以植物乳杆菌为主,并结合其他微生物菌种作为青贮菌种的9组苜蓿青贮样品。分别为:以植物乳杆菌与乳酸片球菌为发酵菌种,活菌数比例分别为1 : 1、1 : 2和2 : 1,编号为1、2、3组;以植物乳杆菌、枯草芽孢杆菌和乳酸片球菌为发酵菌种,活菌数比例分别为2 : 1 : 1、1 : 1 : 1和4 : 1 : 1,编号为4、5、6组;以植物乳杆菌、解淀粉芽孢杆菌和乳酸片球菌为发酵菌种,活菌数比例分别为2 : 1 : 1、1 : 1 : 1和4 : 1 : 1,编号为7、8、9组,对照组为不加微生物菌种的自然发酵苜蓿青贮。每组设3个重复,发酵60 d后,通过感官评定和化学指标评定,确定苜蓿青贮的品质。
1.2.4 苜蓿青贮品质感官评定[12]由具有青贮饲料质量评估经验的3人做现场感官评分,评定标准参考《德国DLG青贮饲料感观评分标准》分为优(20~16分)、良(15~10分)、中(9~5分)和下(4~0分)4个等级。评分内容为嗅觉、结构和色泽:嗅觉分5个等级(0~14分);结构分4个等级(0~4分);色泽分3个等级(0~2分)。
1.2.5 苜蓿青贮化学指标测定pH:取出样品20 g,加入140 mL去离子水,充分搅拌后,用80目的尼龙布包裹用力压取其中的液体,定量滤纸过滤后采用PHS-25C数显酸度计(上海宇隆仪器有限公司)按照刘瑞香等[13]的方法进行测定。
总酸含量:称取10 g样品,用研钵磨碎,转移到100 mL容量瓶中,定容,摇匀。用定量滤纸过滤,吸取20 mL滤液放在三角瓶中,加2滴酚酞指示剂,氢氧化钠滴定至粉红色,而且要在30 s内不退色为宜。
总氮(TN)含量:采用凯氏定氮法,按照GB/T 6432—2018标准执行。
氨态氮(NH3-N)含量[1]:将苜蓿青贮取出混匀,取20 g样品放入三角瓶加入140 mL去离子水,充分摇匀,放在4 ℃环境中不定时摇晃三角瓶,提取24 h。进行蒸馏、滴定和计算。
1.3 数据分析与处理试验数据用Excel 2007进行整理,采用SPSS 20.0进行方差分析,结果用平均值±标准差(mean±SD)表示,LSD多重比较,P < 0.05为差异显著。
2 结果与分析 2.1 自然发酵苜蓿青贮质量评定对所调制的自然苜蓿青贮样品进行感官品质评定,气味评分为10.78±0.83,结构评分为3.22±0.67,色泽评分为1.56±0.53,综合评分为15.56±0.53,青贮品质评定结果等级为良好,可用于微生物的筛选材料。
2.2 自然发酵苜蓿青贮中主要微生物的筛选与鉴定利用MRS培养基厌氧培养,从苜蓿青贮中筛选出16株菌株,利用NA培养基和LB培养基好氧培养,分别从苜蓿青贮中筛选出8株和7株菌株。提取筛选到的微生物的基因组DNA,以每个菌种基因组DNA为模板,以细菌16S rDNA序列通用引物对其保守序列进行扩增,扩增结果如图 1所示。试验成功扩增出了18株细菌的保守序列,大小约1 500 bp,其中1~12为MRS培养基所筛选菌种,命名为MRS1~MRS12;13~15为NA培养基所筛选菌种,命名为NA1、NA2、NA3;16~18为LB培养基所筛选菌种,命名为LB1、LB2、LB3。
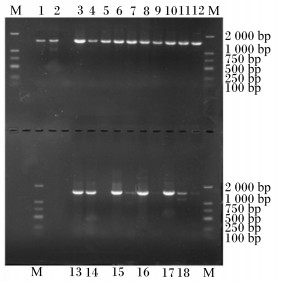
|
1~12为MRS培养基所筛选菌种,命名为MRS1~MRS12;13~15为NA培养基所筛选菌种,命名为NA1、NA2、NA3;16~18为LB培养基所筛选菌种,命名为LB1、LB2、LB3。 1 to 12 were strains screened from MRS medium, named MRS1 to MRS12; 13 to 15 were strains screened from NA medium, named NA1, NA2 and NA3; 16 to 18 were strains screened from LB medium, named LB1, LB2 and LB3. 图 1 苜蓿青贮所筛选菌株16S rDNA电泳图 Fig. 1 16S rDNA electrophoresis of strains screened from alfalfa silage |
对扩增片段进行序列测定,将序列测定结果经NCBI Blast N进行序列比对发现菌株MRS1~MRS9与植物乳杆菌菌株(MG551233.1)的相似度达到了99.8%;菌株MRS10与乳酸片球菌菌株(KY550661.1)的相似度达到98.42%;菌株MRS11、MRS12与粪肠球菌菌株(CP028727.1)的相似度达到了98.80%;菌株LB1、LB2、NA3与解淀粉芽孢杆菌菌株(CP029071.1)的相似度均大于99.63%;菌株NA2、NA3与地衣芽孢杆菌菌株(CP035404.1)的相似度达到了99.92%;菌株LB3与枯草芽孢杆菌菌株(KC422328.1)相似度达到99.58%。结合形态学观察与分析,初步确定从苜蓿青贮样品中筛选到植物乳杆菌9株、乳酸片球菌1株、粪肠球菌2株、各种芽孢杆菌6株。这说明苜蓿青贮样品中的微生物菌种以乳酸菌类和芽孢杆菌类为主。
2.3 添加不同微生物对苜蓿青贮感官评定的影响各组苜蓿青贮60 d结束,对其感官评定结果如表 1所示。各组苜蓿青贮从气味、颜色和结构综合评分在12.0~18.0,根据青贮饲料感官评分标准可知,各组的苜蓿青贮质量感官评分均为良好以上。以植物乳杆菌和乳酸片球菌做发酵菌种的1、2、3组之间总分差异不显著(P>0.05),但均显著高于对照组(P < 0.05),评定等级均为优,属于优质青贮饲料。以植物乳杆菌、枯草芽孢杆菌和乳酸片球菌为发酵菌种的4、5、6组之间总分差异显著(P < 0.05),评定等级与对照组一样,均为良。以植物乳杆菌、解淀粉芽孢杆菌和乳酸片球菌为发酵菌种的7、8、9组之间总分差异显著(P < 0.05),且各组总分显著高于对照组(P < 0.05),评定等级为优,属于优质青贮饲料。
|
|
表 1 不同菌种对苜蓿青贮质量感官评分的影响 Table 1 Effects of different strains on quality sensory score of alfalfa silage |
这说明菌种组合是影响青贮感官评定级别的主要因素,而相同菌种的不同比例对感官评定结果影响较小。感官评定青贮饲料品质最佳的发酵菌种为植物乳杆菌、解淀粉芽孢杆菌和乳酸片球菌,植物乳杆菌所占比例高则青贮饲料品质好。
2.4 添加不同微生物对苜蓿青贮NH3-N/TN、总酸含量和pH的影响测定不同微生物菌种调制的各组苜蓿青贮样品中的NH3-N/TN、总酸含量和pH,结果如表 2所示。添加微生物菌种调制的苜蓿青贮NH3-N/TN均低于对照组,其中解淀粉芽孢杆菌所占比例较大的8组与对照组差异不显著(P>0.05),其他各组NH3-N/TN均显著低于对照组(P < 0.05)。以植物乳杆菌和乳酸片球菌比例为1 : 2的2组NH3-N/TN最低,显著低于其他各组(P < 0.05)。
|
|
表 2 不同菌种组合对苜蓿青贮NH3-N/TN、总酸含量和pH的影响 Table 2 Effects of different strains on NH3-N/TN, total acid content and pH of alfalfa silage |
各组苜蓿青贮的总酸含量差异较大,其中植物乳杆菌所占比例低的2、5、8组的总酸含量显著低于其他各组(P < 0.05),也低于对照组,说明植物乳杆菌的比例与总酸含量密切相关。其余各组的总酸含量显著高于对照组和2、5、8组(P < 0.05),且因为植物乳杆菌在各组所占比例的不同,剩余各组之间也出现较大的差异。
各组苜蓿青贮的pH在4.28~5.20,其中对照组和植物乳杆菌、枯草芽孢杆菌与乳酸片球菌组合比例为1 : 1 : 1的5组pH高于5.0,显著高于其他组(P < 0.05)。其余各组的pH均未达到5.0,其中植物乳杆菌与乳酸片球菌组合的1、3组及植物乳杆菌与枯草芽孢杆菌和乳酸片球菌比例为2 : 1 : 1的4组pH低于其他组,差异显著(P < 0.05)。
表 2数据说明,植物乳杆菌对青贮饲料NH3-N/TN结果影响较大,植物乳杆菌比例低时,NH3-N/TN普遍偏高;乳酸菌(包括植物乳杆菌和乳酸片球菌)的总数是影响总酸含量和pH的关键因素。乳酸菌总数高的各组总酸含量高,pH低。
3 讨论 3.1 微生物菌种对苜蓿青贮感官评定的影响青贮是通过密封压实创造封闭的厌氧环境,通过乳酸菌发酵产生乳酸等有机酸,使pH快速降低,抑制其他微生物的生长、代谢和繁殖,从而减少青贮原料营养物质的损失,保持牧草鲜绿并具有发酵特有的芳香气味[14]。添加适宜的微生物菌种可加快青贮发酵速度,直接增加乳酸菌数量或创造适宜乳酸菌快速繁殖的环境。因此,在青贮饲料调制过程中,为加快青贮发酵速度,保证青贮成功率和品质,青贮添加剂被广泛使用[9]。其中,微生物菌种添加剂又是必不可少的添加物,通过直接补充活菌加速青贮过程的完成。但是青贮微生物的菌种来源却十分广泛,有的是商业菌种,有的是从青贮饲料中筛选并应用于青贮饲料中菌种[4, 15]。本试验所用的微生物菌种全部来自于自然发酵的苜蓿青贮,应用于苜蓿青贮的调制能更快地适应环境,保证菌种的活力和发酵效果。
青贮饲料的气味、色泽、质地、结构等外形特征在一定程度上反映了青贮品质,也会影响饲料的适口性[1, 16]。甚至有专门的仪器辅助研究以气味来评定青贮饲料的品质[17]。青贮饲料的菌种以乳酸菌为主,也有复合了其他菌种共同发酵的成功案例[9]。本试验所用的菌种全部筛选自天然发酵的苜蓿青贮中,保证其再次被应用时对青贮环境的快速适应。其中,以乳酸菌为主要发酵菌种所调制的苜蓿青贮茎叶结构保存完好,颜色接近黄绿色,呈芳香性气味,未出现霉变现象,达到优质青贮饲料等级。这表明以乳酸菌做主要发酵菌种的苜蓿青贮可以改善苜蓿青贮的感官品质[6]。但枯草芽孢杆菌参与的苜蓿青贮在气味评分上得分较低,可能与枯草芽孢杆菌的代谢有关,其合成自身氨基酸时分解蛋白质产生部分具有不良气味的氨和胺类物质[18]。但也有用枯草芽孢杆菌成功调制优质青贮饲料的报道[19],可能与枯草芽孢杆菌的不同菌株有关,不同的菌株各自具有各自的代谢特点。解淀粉芽孢杆菌的使用能够获得较好的感官评分,原因可能在于解淀粉芽孢杆菌丰富的酶系,在发酵前期能够给乳酸菌提供酶解的单糖、氨基酸等[20],有利于乳酸菌快速形成优势菌种。
3.2 微生物菌种对苜蓿青贮化学成分的影响青贮饲料中NH3-N/TN是衡量青贮饲料发酵品质的重要指标之一。NH3-N是牧草收割后由于植物体内的酶利用蛋白质进行代谢活动的产物,其反映的是蛋白质在青贮过程中的分解程度[21]。本试验中NH3-N/TN最低的是植物乳杆菌和乳酸片球菌的组合,这与前人研究[5, 8, 22]中乳酸菌作为青贮发酵前期主要菌种,乳杆菌作为发酵后期主要菌种的结果相符。解淀粉芽孢杆菌未见有作为青贮饲料微生物菌种的报道,本试验中植物乳杆菌、解淀粉芽孢杆菌和乳酸片球菌的比例为4 : 1 : 1时NH3-N/TN显著低于对照组,而各菌种比例为1 : 1 : 1的NH3-N/TN较高,其原因可能是解淀粉芽孢杆菌具有非常丰富的淀粉酶、蛋白酶和纤维素酶,且这些酶的活性较高能够快速分解底物[20]。当植物乳杆菌比例较大时,由于乳酸的产生和优势菌种的原因,使得解淀粉芽孢杆菌的生长代谢及产酶被抑制[23];当解淀粉芽孢杆菌比例较大时,青贮前期氧气充足,作为优势菌种能快速生长繁殖和代谢产酶,导致苜蓿青贮中的蛋白质被分解,部分转化为NH3-N[5, 9]。
青贮过程中对发酵品质影响最大的有机酸是乳酸、乙酸和丁酸,且丁酸含量越少越好,因其具有腐臭味,会直接影响青贮品质。有机酸的累积使青贮饲料的pH下降,进而抑制其他微生物的活性[7]。大量报道指出,添加乳酸菌或其复合菌种能够提高青贮饲料中有机酸尤其是乳酸和乙酸含量,能够提高青贮饲料的适口性和有氧稳定性。本试验结果验证了这一观点,即乳酸菌(植物乳杆菌和乳酸片球菌)所占比例大的各组感官气味评分较高,相对应的总酸含量也较高,pH较低。但本试验各组的pH均在4.3以上,郭晓军等[24]在产酸芽孢杆菌的分离筛选及对玉米秸秆的微贮效果的研究中发现,对照组和试验组的pH均在4.0以下,与本研究结果出入较大,主要因为原料不同。苜蓿原料天然水分含量高,糖分含量少,缓冲能值高,鲜贮更应选择产酸能力强、适应性好的菌种。
4 结论① 自然发酵的苜蓿青贮中优势菌群以各类乳酸菌为主。
② 以所筛选乳酸菌(植物乳杆菌和乳酸片球菌)为主要发酵菌种,苜蓿青贮可以获得较高的感官评分,以枯草芽孢杆菌为发酵菌种,苜蓿青贮的感官评分尤其是气味评分较低。
③ 植物乳杆菌和乳酸片球菌作为主要发酵菌种,苜蓿青贮可以获得较低的NH3-N/TN、较高的有机酸含量和较低的pH,有利于青贮品质的提高。
④ 解淀粉芽孢杆菌作为发酵菌种会改善苜蓿青贮风味,但比例太高会增加NH3-N含量,影响苜蓿青贮的气味。
| [1] |
薛春胜, 刘瑞生, 徐建峰, 等. 不同添加剂对陇东紫花苜蓿青贮品质的影响[J]. 草业科学, 2018, 35(2): 456-462. |
| [2] |
张颖超, 王伟, 侯美玲, 等. 不同干燥方法对苜蓿干草调制的影响[J]. 中国草地学报, 2015, 37(1): 76-82. |
| [3] |
王坤龙, 李兆林, 陈利娜, 等. 调制方式对紫花苜蓿干草品质的影响[J]. 粮食与饲料工业, 2015(10): 51-54, 58. |
| [4] |
牛化欣, 常杰, 胡宗福, 等. 青贮微生物的发掘及其应用的研究进展[J]. 动物营养学报, 2018, 30(11): 4279-4285. |
| [5] |
张慧杰.饲草青贮微生物菌群动态变化与乳酸菌的鉴定筛选[D].硕士学位论文.北京: 中国农业科学院, 2011.
|
| [6] |
GUO J G, XIE Y X, YU Z, et al. Effect of Lactobacillus plantarum expressing multifunctional glycoside hydrolases on the characteristics of alfalfa silage[J]. Applied Microbiology and Biotechnology, 2019, 103(19): 7983-7995. |
| [7] |
TAO L, ZHOU H, ZHANG N F, et al. Effects of different source additives and wilt conditions on the pH value, aerobic stability, and carbohydrate and protein fractions of alfalfa silage[J]. Animal Science Journal, 2017, 88(1): 99-106. |
| [8] |
王丽学, 韩静, 陈龙宾, 等. 5种乳酸菌对苜蓿青贮营养和发酵品质的影响[J]. 饲料研究, 2019, 42(1): 104-108. |
| [9] |
黄峰, 张露, 周波, 等. 青贮微生物及其对青贮饲料有氧稳定性影响的研究进展[J]. 动物营养学报, 2019, 31(1): 82-89. |
| [10] |
朱诗应, 戚中田. 16S rDNA扩增及测序在细菌鉴定与分类中的应用[J]. 微生物与感染, 2013, 8(2): 104-109. |
| [11] |
李旭娇, 玉柱. 苜蓿青贮饲料中优良乳酸菌菌株的筛选[J]. 中国奶牛, 2014(11/12): 37-40. |
| [12] |
刘建新, 杨振海, 叶均安, 等. 青贮饲料的合理调制与质量评定标准(续)[J]. 饲料工业, 1999, 20(3): 4-7. |
| [13] |
刘瑞香, 米艳杰, 陈士超, 等. 冷蒿的青贮特性研究[J]. 中国奶牛, 2015(13): 5-9. |
| [14] |
曹蕾, 王汝富, 张万祥, 等. 不同添加剂对紫花苜蓿拉伸膜裹包青贮饲料品质的影响[J]. 中国草食动物科学, 2019, 39(3): 26-28, 32. |
| [15] |
DING Z T, XU D M, BAI J, et al. Characterization and identification of ferulic acid esterase-producing Lactobacillus species isolated from Elymus nutans silage and their application in ensiled alfalfa[J]. Journal of Applied Microbiology, 2019, 127(4): 985-995. |
| [16] |
张养东, 杨军香, 王宗伟, 等. 青贮饲料理化品质评定研究进展[J]. 中国畜牧杂志, 2016, 52(12): 37-42. |
| [17] |
王满生, 王延周, 杨晶, 等. 饲用苎麻与玉米混合青贮饲料的气味分析[J]. 中国饲料, 2018(5): 75-79. |
| [18] |
HOSKINS A A, ANAND R, EALICK S E, et al. The formylglycinamide ribonucleotide amidotransferase complex from Bacillus subtilis:metabolite-mediated complex formation[J]. Biochemistry, 2004, 43(32): 10314-10327. DOI:10.1021/bi049127h |
| [19] |
穆胜龙, 周波, 甘书灏, 等. 枯草芽孢杆菌与植物乳杆菌对甘蔗尾青贮品质的影响[J]. 饲料工业, 2017, 38(21): 27-31. |
| [20] |
SU Y T, LIU C, LONG Z, et al. Improved production of spores and bioactive metabolites from Bacillus amyloliquefaciens in solid-state fermentation by a rapid optimization process[J]. Probiotics and Antimicrobial Proteins, 2019, 11(3): 921-930. DOI:10.1007/s12602-018-9474-z |
| [21] |
ARNDT C, POWELL J M, AGUERRE M J, et al. Performance, digestion, nitrogen balance, and emission of manure ammonia, enteric methane, and carbon dioxide in lactating cows fed diets with varying alfalfa silage-to-corn silage ratios[J]. Journal of Dairy Science, 2015, 98(1): 418-430. |
| [22] |
保安安.青藏高原不同地区垂穗披碱草青贮饲料中乳酸菌多样性及优势菌种的发酵特性研究[D].硕士学位论文.兰州: 兰州大学, 2016.
|
| [23] |
DUNIÈRE L, SINDOU J, CHAUCHEYRAS-DURAND F, et al. Silage processing and strategies to prevent persistence of undesirable microorganisms[J]. Animal Feed Science and Technology, 2013, 182(1/2/3/4): 1-15. |
| [24] |
郭晓军, 郭威, 周贤, 等. 产有机酸芽孢杆菌对玉米秸秆青贮品质及有氧稳定性的影响[J]. 江苏农业科学, 2017, 45(8): 163-165. |



