单宁酸是一种广泛存在于植物中的多酚化合物,是高分子质量多酚化合物的典型代表[1-2]。传统意义上,单宁酸由于与蛋白质、多糖和金属离子等有较高的亲和力,不利于小肠对养分的消化吸收,而被认为是一种抗营养因子。但是近年来单宁酸的收敛抗腹泻、抗氧化、调节菌群平衡等作用相继被发现,这些生理功能引起了动物营养学界的广泛关注[3-5]。欧盟已于2016年9月批准单宁酸作为所有动物品种的饲料添加剂。研究发现,单宁酸在动物体内的功效因其结构和浓度的不同而存在很大的差异,虽然单宁酸在化学结构上多样化,但是它们都有一个统一的性质,即易与蛋白质结合,而单宁酸与蛋白质的结合强度或许也是单宁酸在单胃动物生产效应中存在争议的原因之一[1]。当饲粮中单宁酸浓度较高时,可作为抗营养因子,对动物的生产效应产生不良影响,而饲粮中适宜浓度的单宁酸又对动物胃肠道有积极的影响[6]。因此,单宁酸在不同动物饲粮中的最佳添加剂量还需要进一步探究,以建立相对统一的添加标准。同时,单宁酸作为一种天然饲料添加剂,具有收敛抗腹泻和改善肠道健康的作用,但较高剂量添加是否会对动物产生病理影响还尚未可知。因此,本试验通过研究高剂量单宁酸对断奶仔猪血液学参数、脏器指数和组织病理学的影响,评估断奶仔猪对单宁酸的耐受性及断奶仔猪饲粮中单宁酸的安全添加剂量,为单宁酸在断奶仔猪上的应用提供参考。
1 材料与方法 1.1 试验材料试验用单宁酸(提取自五倍子)来自广州英赛特生物技术有限公司,为单宁酸与蛋白质结合形成的复合物,单宁酸含量为51.00%,蛋白质含量为40.17%。试验用断奶仔猪购于乐山市康正牧业有限公司,动物饲养试验在四川农业大学动物营养研究所教学科研基地进行。
1.2 试验设计采用单因子试验设计,选取遗传背景一致、健康状况良好、初始体重为(6.60±0.27) kg的(21±1)日龄杜长大(DLY)断奶仔猪144头,按照性别和体重采用随机完全区组设计分为4组,每组6个重复,每个重复6头猪(公母各占1/2)。对照组仔猪饲喂不添加单宁酸的基础饲粮,其为参照NRC(2012)断奶仔猪营养需要配制的粉状配合饲料,基础饲粮组成及营养水平见表 1。试验组仔猪饲喂在基础饲粮中分别添加0.2%、1.0%和2.0%单宁酸(等量代替基础饲粮中的豆粕)的试验饲粮。预试期5 d,正试期28 d。试验期间,仔猪自由采食和饮水,圈舍温度控制在25~28 ℃,定期打扫圈舍卫生,保持圈舍通风、清洁和干燥。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
饲养试验后,仔猪禁食12 h后进行血液样品采集。在每个重复中选取1头接近平均体重的猪,称重后前腔静脉空腹采血15 mL,其中10 mL血液于4 ℃静置30 min,3 500 r/min离心15 min制备血清,用于血清生化指标(总蛋白、白蛋白、总胆红素、肌酐、尿素、葡萄糖含量与谷草转氨酶、谷丙转氨酶、碱性磷酸酶活性)的分析,血清生化指标采用全自动生化分析仪CL-8000检测;另外5 mL血液缓慢注入含乙二胺四乙酸(EDTA)的抗凝管中,缓慢颠倒混匀,用于血常规指标(白细胞数量、红细胞数量、血红蛋白浓度、红细胞压积和血小板数量)的分析,血常规指标采用XT-1800血细胞分析仪检测。
1.3.2 脏器指数采血结束后,参考Chen等[7]的方法对仔猪进行麻醉处理,放血后迅速打开仔猪腹腔,将心脏、肝脏、脾脏、肺脏和肾脏取出,心脏要去除心包膜、污染物,肝脏要去除胆囊以及胆汁,肾脏要去除肾周脂,用滤纸将器官组织表面血液吸干后称鲜重,计算各脏器指数。

|
脏器称重后,分别在心脏、肝脏、脾脏、肺脏和肾脏的同一部位取2.0 cm×2.0 cm×0.3 cm样品,同时在仔猪腹腔中取出胃肠道,迅速分离胃、十二指肠、空肠、回肠和直肠,以及胸腺、胰腺和肠系膜淋巴结,均在同一部位取组织样品,放入4%多聚甲醛溶液中固定。然后对固定好的样品进行修整、脱水、石蜡包埋、切片和苏木素-伊红(HE)染色,制成切片,在光学显微镜(显微镜型号:NIKON Eclipse ci,成像系统:NIKON digital sight DS-FI2)下观察其是否出现病变,并拍照记录结果。
1.4 数据统计分析试验数据先用Excel 2010软件进行初步处理,采用SAS 9.2的一般线性模型(GLM)对数据进行方差分析,然后采用Duncan氏法进行多重比较,并使用线性或二次曲线来确定检测指标对单宁酸添加剂量的反应。所有数据均以平均值和均值标准误(SEM)表示,P < 0.05为差异显著,0.05≤P < 0.10为有差异趋势。
2 结果 2.1 单宁酸对断奶仔猪血液学参数的影响由表 2可知,与对照组相比,饲粮添加0.2%的单宁酸对血常规指标无显著影响(P>0.05),添加1.0%和2.0%的单宁酸显著提高了血液中红细胞数量(P < 0.05),对血红蛋白浓度和红细胞压积有提高趋势(0.05≤P < 0.10),且血液中红细胞数量、血红蛋白浓度和红细胞压积与单宁酸添加剂量呈显著的线性正相关(P < 0.05);饲粮添加0.2%、1.0%和2.0%的单宁酸对血液中白细胞和血小板的数量均无显著影响(P>0.05)。
|
|
表 2 单宁酸对断奶仔猪血常规指标的影响 Table 2 Effects of tannic acid on blood routine indexes of weaned piglets |
由表 3可知,与对照组相比,饲粮添加0.2%、1.0%和2.0%的单宁酸有提高血清中白蛋白含量的趋势(0.05≤P < 0.10),对其他血清生化指标无显著影响(P>0.05)。血清中谷草转氨酶活性随着单宁酸添加剂量的增加而线性提高(P < 0.05)。
|
|
表 3 单宁酸对断奶仔猪血清生化指标的影响 Table 3 Effects of tannic acid on serum biochemical indexes of weaned piglets |
由表 4可知,与对照组相比,饲粮添加0.2%、1.0%和2.0%的单宁酸对断奶仔猪的心脏和肺脏指数无显著影响(P>0.05);饲粮添加1.0%和2.0%的单宁酸显著降低了肝脏指数(P < 0.05),且肝脏指数随着单宁酸剂量的增加而线性降低(P < 0.05);饲粮添加0.2%的单宁酸有降低脾脏指数的趋势(0.05≤P < 0.10),但添加1.0%和2.0%的单宁酸对脾脏指数无显著影响(P>0.05);饲粮添加0.2%和1.0%的单宁酸对肾脏指数有降低趋势(0.05≤P < 0.10),且肾脏指数随着单宁酸添加剂量的增加先降低后增高,有二次回归趋势(0.05≤P < 0.10)。
|
|
表 4 单宁酸对断奶仔猪脏器指数的影响 Table 4 Effects of tannic acid on organ indexes of weaned piglets |
各组断奶仔猪的心脏、肝脏、脾脏、肺脏、肾脏、胸腺、胰腺、胃、十二指肠、空肠、回肠、直肠、肠系膜淋巴结组织病理学结果见图 1至图 3。饲粮添加高剂量单宁酸对断奶仔猪心脏、肝脏、脾脏、肺脏、肾脏、胸腺、胰腺、胃、十二指肠、空肠、回肠、直肠等组织均无负面影响,没有导致组织的病理学变化,但是饲粮添加2.0%的单宁酸导致肠系膜淋巴结中局部淋巴小结生发中心扩张。
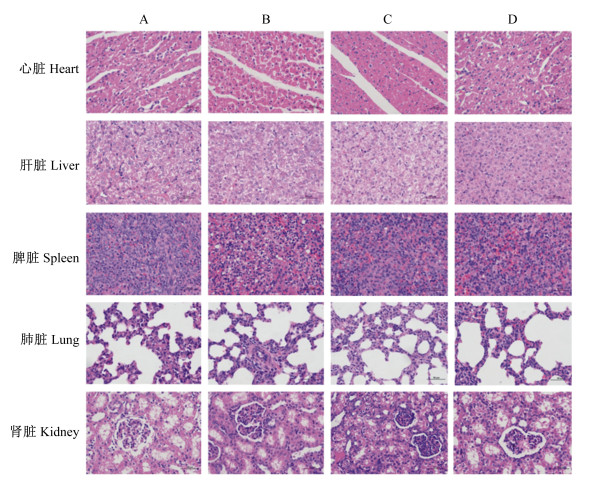
|
A:对照组;B:0.2%单宁酸组;C:1.0%单宁酸组;D:2.0%单宁酸组。下图同。 A: control group; B: 0.2% tannic acid group; C: 1.0% tannic acid group; D: 2.0% tannic acid group. The same as below. 图 1 单宁酸对断奶仔猪心脏、肝脏、脾脏、肺脏和肾脏组织病理学的影响 Fig. 1 Effects of tannic acid on histopathology of heart, liver, spleen, lung and kidney of weaned piglets (400×) |
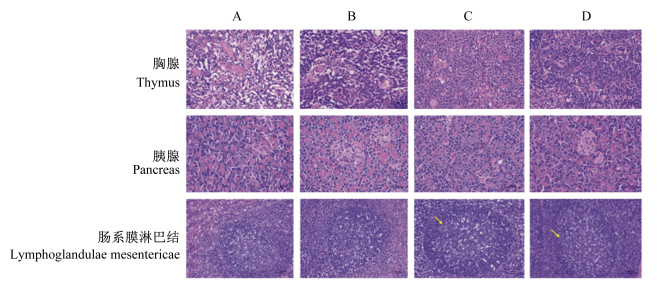
|
图 2 单宁酸对断奶仔猪胸腺、胰腺和肠系膜淋巴结组织病理学的影响 Fig. 2 Effects of tannic acid on histopathology of thymus, pancreas and lymphoglandulae mesentericae of weaned piglets (400×) |
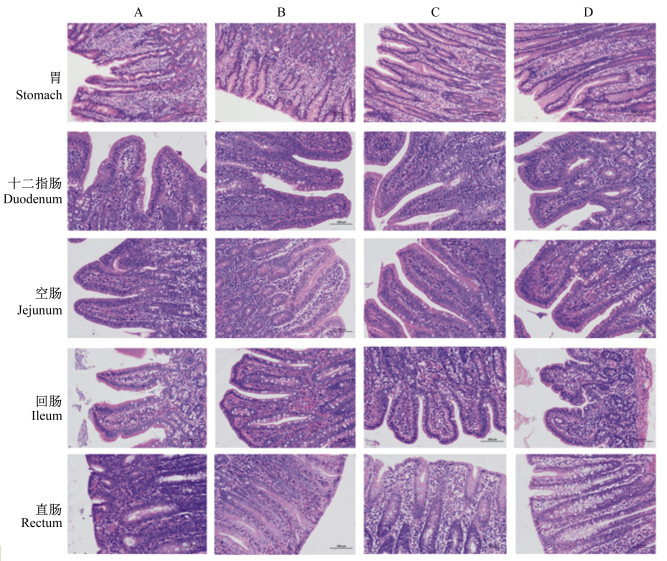
|
图 3 单宁酸对断奶仔猪胃、十二指肠、空肠、回肠和直肠组织病理学的影响 Fig. 3 Effects of tannic acid on histopathology of stomach, duodenum, jejunum, ileum and rectum of weaned piglets (200×) |
单宁酸与蛋白质具有很强的亲和力,单宁酸的这种特性已成功地应用于反刍动物营养中,减少了反刍动物瘤胃中蛋白质的降解,从而提高了蛋白质的利用和动物的生产效率[8]。但是单宁酸在其他动物机体上的应用研究依然是充满争议的。Barszcz等[9]研究发现,饲粮添加单宁酸对雄性大鼠的采食量并无负面影响,但是当单宁酸添加剂量高于1.0%(试验设定的添加剂量分别为1.0%、1.5%和2.0%)时,显著降低了大鼠的活体增重。C ˇ andek-Potokar等[10]研究发现,饲粮添加1%和2%的单宁酸对公猪的生长性能没有负面影响,但添加3%的单宁酸降低了公猪的采食量,且公猪的生长速度较慢。刘倩[5]研究发现,与对照组相比,在饲粮中添加3%的单宁酸对布氏田鼠的采食量和体重均无显著影响。但也有研究表明单宁酸有利于提高单胃动物的生长性能[11-12]。本课题组关于单宁酸对断奶仔猪生长性能影响的研究发现,饲粮中添加0.2%、1.0%和2.0%的单宁酸对断奶仔猪的平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)均无显著影响。与反刍动物相比,单宁酸对单胃动物的促生长作用的机制尚不清楚,目前比较被认可的说法是单宁酸对单胃动物的促生长作用依赖于其与蛋白质、多糖和消化酶等的络合作用对饲粮适口性和营养消化的负面作用以及其通过它们的抗菌、抗氧化和抗炎作用对肠道生态系统健康状况的积极作用之间的平衡[8]。
血常规指标是血液学中最基本的检查指标,能够直接反映动物机体的新陈代谢情况和健康状态,对于评估机体是否遭受感染以及是否存在潜在疾病十分重要[13]。向发[14]研究表明,饲粮添加单宁酸对大鼠的血常规指标均无显著影响,但高剂量单宁酸组(单宁酸浓度为2 500 mg/kg,按照大鼠体重灌胃给药,剂量为每100 g体重1 mL)的血常规指标中除了血红蛋白浓度以外均高于对照组。在本试验中,高剂量(1.0%和2.0%)的单宁酸提高了断奶仔猪血液中红细胞数量、血红蛋白浓度和红细胞压积,表明在一定程度上,高剂量单宁酸或许可以改善仔猪血液的载氧能力。但是此研究结果与Lee等[15]的研究结果不一致,Lee等[15]报道,断奶仔猪血液中红细胞数量、血红蛋白浓度和红细胞压积随着饲粮中单宁酸添加剂量的增加而呈线性下降,这可能与单宁酸的来源和化学结构有关。
血清白蛋白是血清总蛋白的主要蛋白质成分,由肝脏合成。它在维持血液胶体渗透压、体内代谢物质运输、营养等方面均起着很重要的作用。谷丙转氨酶和谷草转氨酶是肝脏损伤的常用生物标记物[16]。当肝脏细胞膜被破坏时,谷丙转氨酶和谷草转氨酶会从肝细胞里逸出进入血液,使血清中的谷丙转氨酶和谷草转氨酶活性升高[17]。研究表明饲粮添加高剂量的单宁酸能够显著提高大鼠血液中谷草转氨酶活性[14]。在本试验中,饲粮添加0.2%、1.0%和2.0%的单宁酸均提高了断奶仔猪血清中白蛋白含量,但血清中谷草转氨酶活性随着单宁酸添加剂量的增加而线性提高,表明在饲粮中添加高剂量的单宁酸对断奶仔猪机体免疫、维持血液渗透压等功能有促进作用,但是对肝脏功能有轻微的损伤。
脏器指数是一项生物学特征指标,在一定程度上能够反映动物机体的机能状况[18]。肝脏、肾脏是动物机体重要的代谢器官,若肝脏、肾脏相对重量降低,将直接影响动物代谢能力,同时肝脏也是动物的免疫器官之一。脾脏是动物体内主要的免疫器官,是体液免疫和细胞免疫的中枢[19]。已有研究表明在饲粮中添加高剂量的单宁酸能够显著降低雄性大鼠的脾脏指数[14]。朱美霖[20]研究发现,布氏田鼠的肝脏重量与单宁含量呈线性关系,随着单宁含量(3%、5%、7%、10%)的增加,肝脏重量逐渐降低,肾脏重量随着单宁含量的增加也降低,但是无线性关系,这与本试验的研究结果基本一致。但是,朱美霖[20]试验中布氏田鼠的脾脏重量随着单宁含量的增加先增加后降低,在单宁含量为5%时最大、10%时最小,这与本试验的研究结果几乎相反,可能与动物种类有关。在本试验中,饲粮添加1.0%和2.0%的单宁酸较对照组显著降低了肝脏指数,并且有降低肾脏指数的趋势,表明饲粮添加高剂量的单宁酸可能对断奶仔猪机体的代谢能力有一定的负面影响。与对照组相比,饲粮添加0.2%的单宁酸有降低脾脏指数的趋势,但添加1.0%和2.0%的单宁酸对脾脏指数无显著影响,具体原因需要进一步探究。
本试验中,饲粮添加高剂量单宁酸对断奶仔猪心脏、肝脏、脾脏、肺脏、肾脏、胸腺、胰腺、胃、十二指肠、空肠、回肠和直肠等组织均无负面影响,没有导致组织的病理学变化;而饲粮添加2.0%的单宁酸导致肠系膜淋巴结局部淋巴小结生发中心扩张。向发[14]研究发现,高剂量单宁酸对大鼠肝脏具有一定的损伤,主要表现为血管充血、肝细胞发生不同程度的颗粒变性和空泡变性,严重者发生局灶性坏死。在本试验中,饲粮添加2.0%的单宁酸虽然造成了肝脏指数的降低,但是并没有导致断奶仔猪的肝脏组织发生病变,表明断奶仔猪的肝脏组织可以耐受2.0%的单宁酸。猪对食物中的单宁酸较其他家畜似乎有更强的抵抗力,它们能够食用富含相对大量单宁酸的饲粮而不会出现任何中毒症状,这可能是由于猪的腮腺肥大,以及唾液中分泌的富含脯氨酸的蛋白质结合并中和了单宁酸的毒性作用[8]。淋巴结是反映机体病理状态的器官,淋巴小结是反映体液免疫应答的重要形态学标志。生发中心是B细胞增殖、分化和提高抗体亲和力的区域,B细胞在生发中心内进行亲和力选择、体细胞高频突变、克隆扩增以及浆细胞和记忆细胞的分化反应[21]。本试验中断奶仔猪肠系膜淋巴结局部淋巴小结生发中心的扩张可能与B细胞的大量扩增有关。
4 结论在本试验条件下,饲粮添加0.2%、1.0%和2.0%的单宁酸虽然降低了断奶仔猪的肝脏指数,但对断奶仔猪的血液学参数和组织病理学无明显的负面影响,表明饲粮中添加不超过2.0%的单宁酸对断奶仔猪是相对安全的。
| [1] |
MUELLER-HARVEY I. Unravelling the conundrum of tannins in animal nutrition and health[J]. Journal of the Science of Food and Agriculture, 2006, 86(13): 2010-2137. DOI:10.1002/jsfa.2577 |
| [2] |
YE M H, NAN Y L, DING M M, et al. Effects of dietary tannic acid on the growth, hepatic gene expression, and antioxidant enzyme activity in Brandt's voles (Microtus brandti)[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2016, 196. |
| [3] |
GIRARD M, THANNER S, PRADERVAND N, et al. Hydrolysable chestnut tannins for reduction of postweaning diarrhea:efficacy on an experimental ETEC F4 model[J]. PLoS One, 2018, 13(5): e0197878. DOI:10.1371/journal.pone.0197878 |
| [4] |
JAMROZ D, WILICZKIEWICZ A, SKORUPI N ′ SKA J, et al. Effect of sweet chestnut tannin (SCT) on the performance, microbial status of intestine and histological characteristics of intestine wall in chickens[J]. British Poultry Science, 2009, 50(6): 687-699. DOI:10.1080/00071660903191059 |
| [5] |
刘倩.单宁酸对布氏田鼠代谢的影响[D].硕士学位论文.扬州: 扬州大学, 2014.
|
| [6] |
INSERRA L, LUCIANO G, BELLA M, et al. Effect of including carob pulp in the diet of fattening pigs on the fatty acid composition and oxidative stability of pork[J]. Meat Science, 2015, 100: 256-261. DOI:10.1016/j.meatsci.2014.09.146 |
| [7] |
CHEN J L, YU B, CHEN D W, et al. Chlorogenic acid improves intestinal barrier functions by suppressing mucosa inflammation and improving antioxidant capacity in weaned pigs[J]. The Journal of Nutritional Biochemistry, 2018, 59: 84-92. DOI:10.1016/j.jnutbio.2018.06.005 |
| [8] |
HUANG Q Q, LIU X L, ZHAO G Q, et al. Potential and challenges of tannins as an alternative to in-feed antibiotics for farm animal production[J]. Animal Nutrition, 2018, 4(2): 137-150. DOI:10.1016/j.aninu.2017.09.004 |
| [9] |
BARSZCZ M, TACIAK M, SKOMIAŁ J. A dose-response effects of tannic acid and protein on growth performance, caecal fermentation, colon morphology, and β-glucuronidase activity of rats[J]. Journal of Animal and Feed Sciences, 2011, 20(4): 613-625. DOI:10.22358/jafs/66219/2011 |
| [10] |
ČANDEK-POTOKAR M, ŠKRLEP M, LUKAČ N B, et al. Hydrolysable tannin fed to entire male pigs affects intestinal production, tissue deposition and hepatic clearance of skatole[J]. The Veterinary Journal, 2015, 204(2): 162-167. DOI:10.1016/j.tvjl.2015.02.012 |
| [11] |
BIAGI G, CIPOLLINI I, PAULICKS B R, et al. Effect of tannins on growth performance and intestinal ecosystem in weaned piglets[J]. Archives of Animal Nutrition, 2010, 64(2): 121-135. DOI:10.1080/17450390903461584 |
| [12] |
SCHIAVONE A, GUO K, TASSONE S, et al. Effects of a natural extract of chestnut wood on digestibility, performance traits, and nitrogen balance of broiler chicks[J]. Poultry Science, 2008, 87(3): 521-527. DOI:10.3382/ps.2007-00113 |
| [13] |
王黎琦, 汪攀, 曹珺, 等. 约氏乳杆菌对断奶仔猪生产性能、血液学指标、脏器指数和组织病理学的影响[J]. 中国畜牧杂志, 2016, 52(21): 76-80. DOI:10.3969/j.issn.0258-7033.2016.21.017 |
| [14] |
向发.五倍子溶液剂的安全性评价[D].硕士学位论文.雅安: 四川农业大学, 2015.
|
| [15] |
LEE S H, SHINDE P L, CHOI J Y, et al. Effects of tannic acid supplementation on growth performance, blood hematology, iron status and faecal microflora in weanling pigs[J]. Livestock Science, 2010, 131(2/3): 281-286. |
| [16] |
GOORDEN S M I, BUFFART T E, BAKKER A, et al. Liver disorders in adults:ALT and AST[J]. Nederlands Tijdschrift Voor Geneeskunde, 2013, 157(43): A6443. |
| [17] |
刘英娜, 张慧媛, 林嘉楠, 等. 单宁酸对脂多糖诱导小鼠肝损伤的保护作用及机制研究[J]. 人参研究, 2017(6): 36-39. |
| [18] |
盖向荣, 何东亭, 杨文军, 等. 高剂量乙氧基喹啉对生长育肥猪生长性能、血清生化指标、抗氧化性能、脏器指数和肉品质的影响[J]. 动物营养学报, 2018, 30(9): 3643-3651. DOI:10.3969/j.issn.1006-267x.2018.09.035 |
| [19] |
MEBIUS R E, KRAAL G. Structure and function of the spleen[J]. Nature Reviews Immunology, 2005, 5(8): 606-616. DOI:10.1038/nri1669 |
| [20] |
朱美霖.单宁对布氏田鼠(Lasiopodomys brandtii)食物选择的影响[D].硕士学位论文.郑州: 郑州大学, 2017.
|
| [21] |
廖子傑, 严意华, 胡雪峰. 生发中心的发生与发展[J]. 中国生物化学与分子生物学报, 2018, 34(6): 610-616. |




