羔羊断奶是一个循序渐进的过程,但当羔羊完全断奶并转为全部采食固体饲料时,会对羔羊造成一定的应激,羔羊表现出烦躁不安、采食量降低、肠道菌群紊乱、腹泻等,而此时羔羊的胃肠道发育尚未完善,使生长发育受到阻碍,若能尽快完善羔羊的胃肠道发育,则有利于缓解羔羊的断奶应激[1]。鉴于目前畜牧行业对于饲用抗生素的抵制,营养研究者们更多的把目光投向了一些可部分替代抗生素的物质,如微生态制剂、复合酶制剂和营养活性物质等。丁酸钠作为抗生素的替代物质,其有效成分丁酸属于营养活性物质,能促进断奶仔猪的生长,提高养分表观消化率,改善肠道菌群,增强断奶仔猪的免疫力[2]。此外,丁酸钠也可促进犊牛的胃肠道发育,为胃肠道上皮细胞快速提供能量来源[3-4]。有研究发现,在犊牛的代乳粉和开食料中添加丁酸钠,可以提高犊牛前胃重量、乳头的高度和宽度[5]。然而,丁酸钠对于断奶羔羊胃肠道形态发育的影响未见报道。为此,本试验以包被丁酸钠为试验材料,探究丁酸钠对断奶羔羊胃肠道发育的影响,为解决羔羊断奶应激问题提供理论依据。
1 材料与方法 1.1 试验材料包膜丁酸钠购于禾润德生物东营百森进出口有限公司,丁酸钠含量为30%;羔羊(德国美利奴羊×杜泊羊)购于黑龙江中升牧业有限公司。
1.2 试验设计选择42日龄断奶的羔羊24只,随机分成4组,分别空白对照组、抗生素组、丁酸钠A组和丁酸钠B组,每组6个重复,每个重复1只羊。空白对照组饲喂基础饲粮,抗生素组饲喂在基础饲粮中添加250 mg/kg黄霉素的饲粮,丁酸钠A组和丁酸钠B组分别饲喂在基础饲粮中添加2和3 g/kg包膜丁酸钠的饲粮。各组分别在试验第14天、第28天选取3只羔羊屠宰取样。
1.3 饲养管理与基础饲粮试验前对羊舍进行冲洗消毒处理。羔羊采用全舍饲饲养管理,试验期间每日饲喂2次,饲喂时间是07:00和17:00,将每日需要饲喂的包膜丁酸钠平均分配到精料中,供给充足清洁饮水,每天清粪、消毒,观察断奶羔羊健康状况。
根据断奶羔羊体重和营养需要特点,参照我国《肉羊饲养标准》(NY/T 816—2004)配制基础饲粮,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
在试验第14天、第28天,每组选择3只羔羊,称羔羊活体重后颈静脉放血致死。迅速打开腹腔,找到羔羊胃部,结扎各胃室的连接处,剪切开后将各胃室中的内容物倒出后洗净,然后用滤纸吸干,称重。之后分别采集瘤胃背囊和腹囊组织块,固定于4%多聚甲醛中,用于观察瘤胃形态。
1.4.2 肠道样品的采集在采集完瘤胃样品的羔羊的十二指肠、空肠和回肠各段中部分别采集适宜大小的组织样品,用冰生理盐水冲洗干净后,固定于4%多聚甲醛中,用于观察小肠形态。
1.4.3 瘤胃相对质量和容积的测定将各胃室剪切后洗净,用排水法测定各胃室的容积,之后用滤纸吸干,称量各胃室质量。计算瘤胃相对质量和相对容积[6]。

|
将固定于4%多聚甲醛中的瘤胃和小肠组织通过常规方法进行苏木精-伊红(HE)染色,制作为石蜡切片,在光学显微镜(40×)下观察并测量瘤胃乳头的长、宽、角质层厚度以及肌层厚度,测量小肠绒毛高度、绒毛宽度以及隐窝深度,并计算绒毛表面积(2πrh,r为绒毛半径,h为绒毛高度)和绒毛高度/隐窝深度。
1.5 统计方法试验数据采用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),运用Duncan氏法进行多重比较,结果均以“平均值±标准误”表示,以P < 0.05作为差异显著标准。
2 结果与分析 2.1 丁酸钠对断奶羔羊瘤胃相对质量和相对容积的影响由表 2可知,丁酸钠对断奶羔羊的瘤胃相对质量和相对容积无显著影响(P>0.05)。
|
|
表 2 丁酸钠对断奶羔羊瘤胃相对质量和相对容积的影响 Table 2 Effects of sodium butyrate on relative weight and relative volume of rumen of weaned lambs |
图 1为试验第14天时各组断奶羔羊瘤胃背囊和腹囊乳头和肌层切片图。由表 3可知,试验第14天时,抗生素组、丁酸钠A组和丁酸钠B组断奶羔羊的各瘤胃形态指标与空白对照组相比均无显著变化(P>0.05)。
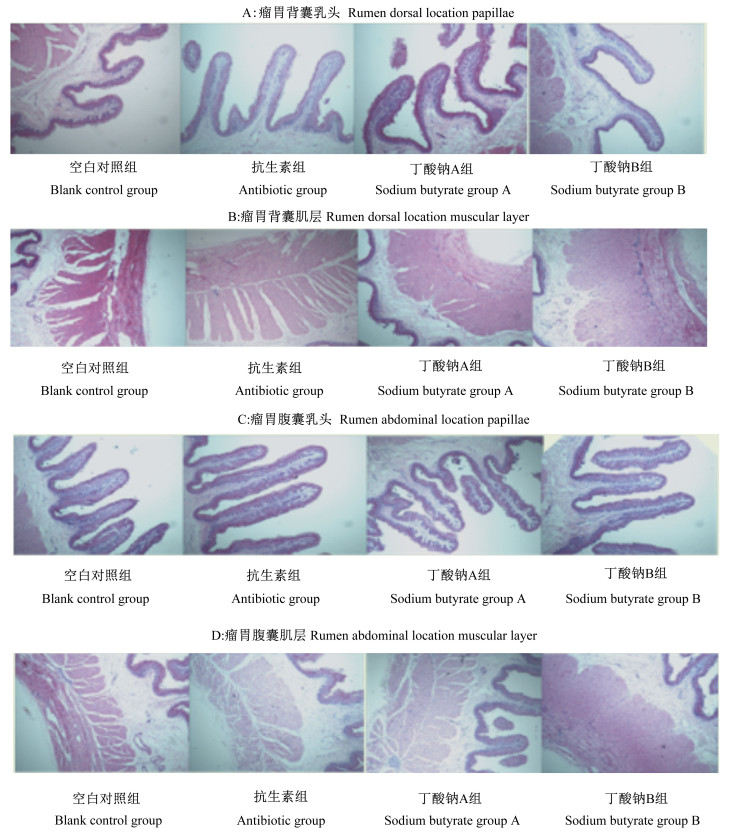
|
图 1 试验第14天断奶羔羊瘤胃背囊和腹囊乳头和肌层切片图 Fig. 1 Slice maps of papillae and muscular layer of rumen dorsal and abdominal locations of weaned lambs on day 14 of trial (40×) |
|
|
表 3 丁酸钠对试验第14天时断奶羔羊瘤胃形态的影响 Table 3 Effects of sodium butyrate on rumen morphology of weaned lambs on day 14 of trial |
图 2为试验第28天时各组断奶羔羊瘤胃背囊和腹囊乳头和肌层切片图。由表 4可知,试验第28天时,抗生素组、丁酸钠A组和丁酸钠B组断奶羔羊的瘤胃背囊肌层厚度、瘤胃腹囊乳头高度显著高于空白对照组(P < 0.05),同时丁酸钠B组断奶羔羊的瘤胃腹囊肌层厚度也显著高于空白对照组(P < 0.05)。
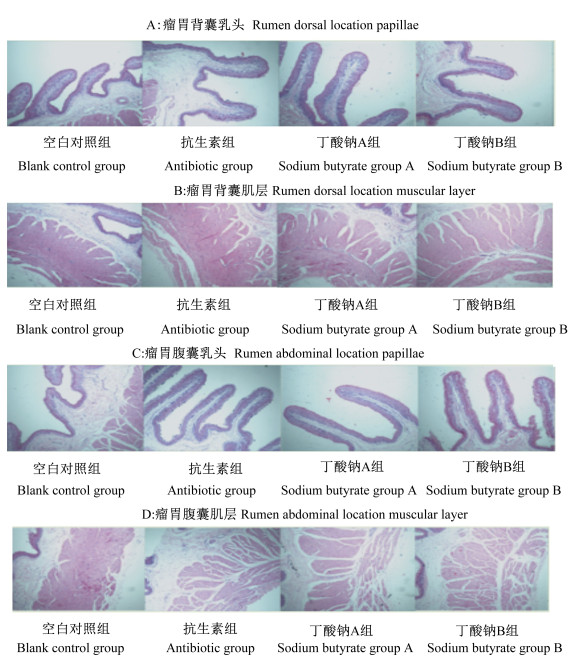
|
图 2 试验第28天断奶羔羊瘤胃背囊和腹囊乳头和肌层切片图 Fig. 2 Slice maps of papillae and muscular layer of rumen dorsal and abdominal locations of weaned lambs on day 28 of trial (40×) |
|
|
表 4 丁酸钠对试验第28天时断奶羔羊瘤胃形态的影响 Table 4 Effects of sodium butyrate on rumen morphology of weaned lambs on day 28 of trial |
图 3为试验第14天断奶羔羊肠道切片图。由表 5可知,试验第14天时,除抗生素组断奶羔羊空肠的绒毛表面积显著高于空白对照组(P < 0.05)外,其他各项小肠形态指标各组之间均无显著差异(P>0.05)。
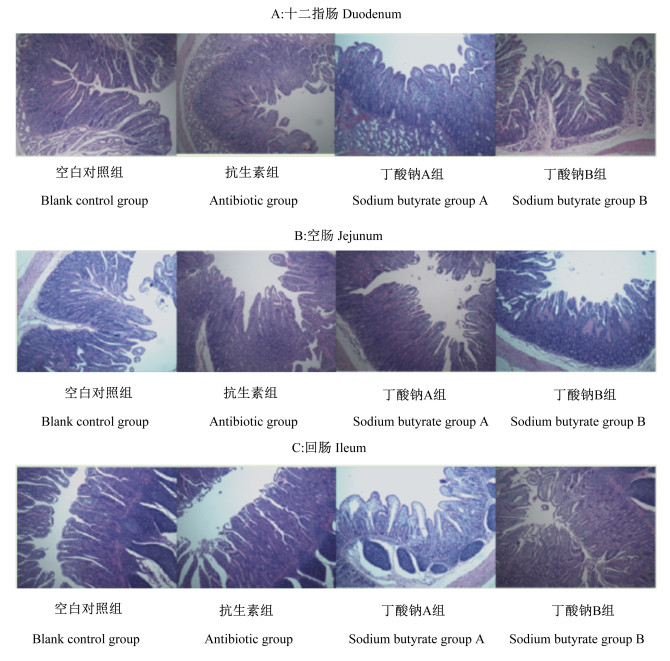
|
图 3 试验第14天断奶羔羊肠道切片图 Fig. 3 Slice maps of small intestine of weaned lambs on day 14 of trial (40×) |
|
|
表 5 丁酸钠对试验第14天时断奶羔羊小肠形态的影响 Table 5 Effects of sodium butyrate on small intestinal morphology of weaned lambs on day 14 of trial |
图 4为试验第28天断奶羔羊肠道切片图。由表 6可知,试验第28天时,丁酸钠B组断奶羔羊十二指肠、空肠和回肠的绒毛高度,空肠的绒毛表面积以及空肠和回肠的绒毛高度/隐窝深度显著高于空白对照组(P < 0.05),同时还高于抗生素组和丁酸钠A组,但差异未达显著水平(P>0.05)。
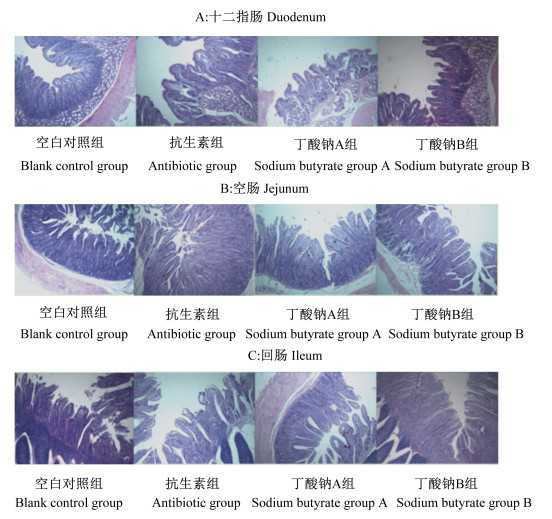
|
图 4 试验第28天断奶羔羊肠道切片图 Fig. 4 Slice maps of small intestine of weaned lambs on day 28of trial (40×) |
|
|
表 6 丁酸钠对试验第28天时断奶羔羊小肠形态发育的影响 Table 6 Effects of sodium butyrate on small intestinal morphology of weaned lambs on day 28 of trial |
羔羊从哺乳过渡到采食固体饲料时,会对瘤胃产生一定的物理刺激,而其瘤胃内容物发酵产物会对瘤胃上皮产生化学刺激[6]。Wang等[7]研究发现,为绵羊羔羊补饲开食料使羔羊瘤网胃的重量提高了50%,容积提高了40%。Górka等[5]研究发现,在代乳粉和开食料中添加0.3%的丁酸钠能增加新生犊牛前胃重量。从上述研究结果可知,在羔羊还没完全断乳前饲喂丁酸钠能有效提高瘤胃的质量发育。本试验中,各组断奶羔羊在试验第14天和第28天时瘤胃相对重量(相当于活体重、相对于全胃重)和相对容积(相对于全胃容积)无显著差异,其原因可能是由于羔羊早已经有过固体开食料的刺激,当完全断奶后,由于羔羊采食相似的固体饲料所以产生的刺激一样,以至于各组的瘤胃相对质量和相对容积无显著差异。
3.2 丁酸钠对断奶羔羊瘤胃形态的影响瘤胃上皮组织的良好发育有利于瘤胃对营养物质的消化吸收。瘤胃上皮细胞的分化和乳头发育取决于其发酵产物,尤其是丁酸和丙酸的存在[8-9]。有研究证明,60%~80%的挥发性脂肪酸被瘤胃壁吸收,75%~90%被吸收的丁酸盐会被瘤胃上皮细胞代谢[10]。吕小康[11]的研究发现,代乳粉+精料+苜蓿颗粒组山羊羔羊瘤胃乳头的高度和宽度均高于代乳粉+精料组,通过其对瘤胃液的分析发现,代乳粉+精料+苜蓿颗粒组瘤胃液中丁酸含量显著高于代乳粉+精料组。Zhao等[6]的研究也有类似发现,豌豆淀粉组羔羊的瘤胃乳头高度、乳头表面积均显著高于木薯淀粉组,其原因很可能是因为豌豆淀粉组瘤胃中的丁酸含量显著高于木薯淀粉组。研究发现,在瘤胃内灌注丁酸钠显著增加了羔羊瘤胃乳头的高度[12];给绵羊瘤胃灌注乙酸、丙酸、丁酸均能刺激绵羊瘤胃上皮细胞分裂,其中丁酸作用效果最为明显[13-14];灌注丁酸能够提高瘤胃上皮细胞细胞周期蛋白D1(CCND1)基因的表达,使细胞从G0/G1期转变成S期,促进DNA的合成,致使瘤胃上皮细胞增殖[15]。此外,挥发性脂肪酸能够促进胰岛素样生长因子-Ⅰ受体(IGF-ⅠR)数目的增加,提高血浆中胰岛素样生长因子-Ⅰ(IGF-Ⅰ)的含量,丁酸可以调节IGF-Ⅰ的产量,增加瘤胃乳头的高度[16]。IGF-Ⅰ与IGF-ⅠR结合后能够激活下游Ras/细胞外信号调节激酶(ERK)等信号转导途径,提高CCND1蛋白表达,CCND1的主要功能是促进细胞增殖,能够推动细胞周期由G1时期进入到S时期,从而促进瘤胃上皮细胞增殖[17-18]。本试验中,在试验第28天时,丁酸钠A组和丁酸钠B组瘤胃背囊的肌层厚度和瘤胃腹囊的乳头高度显著提高,丁酸钠B组瘤胃腹囊的肌层厚度也显著提高。这可能是因为:一方面,在饲粮中添加丁酸钠增强了瘤胃上皮的细胞代谢,为瘤胃上皮的发育提供了营养底物;另一方面,丁酸钠能刺激瘤胃上皮细胞分裂增殖,促进瘤胃上皮细胞中生长因子的表达,从而促进瘤胃的发育。
3.3 丁酸钠对断奶羔羊小肠形态的影响小肠是营养物质消化吸收的主要场所,小肠黏膜的发育状态至关重要。有研究表明,断奶会导致仔猪的氧化应激,致使肠黏膜损伤,表现为肠绒毛的高度下降和隐窝加深[19-21]。夏冰等[22]研究发现,21日龄断奶严重影响了仔猪肠道的形态和发育,引起仔猪肠道绒毛的变短和脱落。引起这些变化的原因是因为断奶显著降低了仔猪肠道上皮细胞中紧密连接蛋白闭锁小带蛋白-1(zonula occluden-1)、闭锁蛋白(occludin)的mRNA的表达,显著降低了肠黏膜中二胺氧化酶的活性。研究发现,在饲粮中添加丁酸钠可以缓解由断奶应激导致的肠道绒毛损伤,促进肠道绒毛的发育[4, 23-24]。邴新帅[25]研究发现,丁酸钠可以显著增加断奶羔羊肠道的绒毛高度,增加绒毛高度/隐窝深度。肠道绒毛高度与表面积的增加,会促进肠道对食糜中营养物质的吸收,提高动物的生长性能。绒毛高度/隐窝深度反映了小肠的吸收能力,比值越大,代表小肠的消化吸收能力越强,有利于完善肠道黏膜结构。丁酸钠促进肠道黏膜发育的主要原因有以下2点:1)作为一种营养物质,直接被肠道上皮细胞吸收代谢,进而促进肠道细胞增殖;2)增加肠道黏膜中生长因子的表达。研究发现,丁酸钠能刺激胰高血糖素样-2(GLP-2)的生成,进而促进肠道细胞再生[26-27]。邴新帅[25]研究发现,在断奶羔羊饲粮中添加丁酸钠可显著增加血清和肠道组织中GLP-2的含量,丁酸钠加沙篙多糖同时饲喂能显著增加血清中IGF-Ⅰ的含量。于洋洋[28]研究发现,高直链/支链淀粉比的豌豆淀粉显著提高羔羊十二指肠、空肠和回肠中丁酸的含量,进一步研究发现,豌豆淀粉显著增加十二指肠和回肠中的IGF-Ⅰ、IGF-ⅠR mRNA的表达量,显著增加十二指肠、空肠和回肠中表皮生长因子(EGF)、钠-葡萄糖协同转运蛋白-1(SGLT-1)、葡萄糖转运蛋白-2(GLUT-2)mRNA的表达量。EGF的高表达促进了肠道上皮细胞的增殖,改善了肠道的形态发育,有利于断奶羔羊对营养物质的消化吸收,提高其生长性能。本试验中,试验第28天时,丁酸钠B组十二指肠、空肠和回肠的绒毛高度,空肠的绒毛表面积以及空肠和回肠的绒毛高度/隐窝深度显著高于空白对照组。这可能是因为,丁酸钠作为一种营养物质可直接为肠道上皮组织供能,丁酸钠还可以作为营养活性物质促进肠道上皮组织中生长因子的表达,使上皮组织细胞分裂增殖,增加小肠绒毛的高度以及表面积。
4 结论综上所述,饲喂添加3 g/kg丁酸钠的饲粮28 d可以促进断奶羔羊瘤胃乳头和肌层以及肠道绒毛的生长,增加肠道绒毛高度,有利于胃肠道的发育。
| [1] |
李冲.断奶应激对羔羊消化道结构与功能发育的影响及其机理研究[D].博士学位论文.兰州: 兰州大学, 2019.
|
| [2] |
张瑞阳, 孟玲, 李方方, 等. 包被丁酸钠对断奶仔猪生长性能、血清生化指标、养分表观消化率和粪便微生物菌群的影响[J]. 动物营养学报, 2019, 31(5): 2296-2302. |
| [3] |
俞文靓, 王超, 王敏, 等. 丁酸钠对犊牛胃肠道发育的研究进展[J]. 中国畜牧兽医, 2019, 46(8): 2354-2359. |
| [4] |
赵会利, 高艳霞, 李建国, 等. 丁酸钠对断奶犊牛生长、血液生化指标及胃肠道发育的影响[J]. 畜牧兽医学报, 2013, 44(10): 1600-1608. DOI:10.11843/j.issn.0366-6964.2013.10.013 |
| [5] |
GÓRKA P, PIETRZAK P, KOTUNIA A, et al. Effect of method of delivery of sodium butyrate on maturation of the small intestine in newborn calves[J]. Journal of Dairy Science, 2014, 97(2): 1026-1035. DOI:10.3168/jds.2013-7251 |
| [6] |
ZHAO F F, REN W, ZHANG A Z, et al. Effects of different amylose to amylopectin ratios on rumen fermentation and development in fattening lambs[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(10): 1611-1618. DOI:10.5713/ajas.17.0833 |
| [7] |
WANG W M, LI C, LI F D, et al. Effects of early feeding on the host rumen transcriptome and bacterial diversity in lambs[J]. Scientific Reports, 2016, 6: 32479. DOI:10.1038/srep32479 |
| [8] |
BROWNLEE A. The development of rumen papillæ in cattle fed on different diets[J]. British Veterinary Journal, 1956, 112(9): 369-375. DOI:10.1016/S0007-1935(17)46456-6 |
| [9] |
SANDER E G, WARNER R G, HARRISON H N, et al. The stimulatory effect of sodium butyrate and sodium propionate on the development of rumen mucosa in the young calf[J]. Journal of Dairy Science, 1959, 42(9): 1600-1605. DOI:10.3168/jds.S0022-0302(59)90772-6 |
| [10] |
ALLEN M S. Relationship between fermentation acid production in the rumen and the requirement for physically effective fiber[J]. Journal of Dairy Science, 1997, 80(7): 1447-1462. DOI:10.3168/jds.S0022-0302(97)76074-0 |
| [11] |
吕小康.不同饲粮对20~60日龄山羊羔羊瘤胃发育的影响[D].硕士学位论文.北京: 中国农业科学院, 2019.
|
| [12] |
CAVINI S, IRAIRA S, SIURANA A, et al. Effect of sodium butyrate administered in the concentrate on rumen development and productive performance of lambs in intensive production system during the suckling and the fattening periods[J]. Small Ruminants Reseach, 2015, 123(2/3): 212-217. DOI:10.1016/j.smallrumres.2014.11.009 |
| [13] |
SAKATA T, TAMATE H. Rumen epithelial cell proliferation accelerated by rapid increase in intraruminal butyrate[J]. Journal of Dairy Science, 1978, 61(8): 1109-1113. DOI:10.3168/jds.S0022-0302(78)83694-7 |
| [14] |
SAKATA T, TAMATE H. Rumen epithelium cell proliferation accelerated by propionate and acetate[J]. Journal of Dairy Science, 1979, 62(1): 49-52. DOI:10.3168/jds.S0022-0302(79)83200-2 |
| [15] |
MALHI M, GUI H B, YAO L, et al. Increased papillae growth and enhanced short-chain fatty acid absorption in the rumen of goats are associated with transient increases in cyclin D1 expression after ruminal butyrate infusion[J]. Journal of Dairy Science, 2013, 96(12): 7603-7616. DOI:10.3168/jds.2013-6700 |
| [16] |
SHEN Z M, SEYFERT H, L ÖHRKE B, et al. An energy-rich diet causes rumen papillae proliferation associated with more IGF type 1 receptors and increased plasma IGF-1 concentrations in young goats[J]. The Journal of Nutrition, 2004, 134(1): 11-17. DOI:10.1093/jn/134.1.11 |
| [17] |
COQUERET O. Linking cyclins to transcriptional control[J]. Gene, 2002, 299(1/2): 35-55. DOI:10.1016/s0378-1119(02)01055-7 |
| [18] |
卢梦玲, 闫超, 赖多, 等. Cyclin D1与细胞周期调控[J]. 生物技术通报, 2011(10): 55-59. |
| [19] |
HU C H, XIAO K, LUAN Z S, et al. Early weaning increases intestinal permeability, alters expression of cytokine and tight junction proteins, and activates mitogen-activated protein kinases in pigs[J]. Journal of Animal Science, 2013, 91(3): 1094-1101. DOI:10.2527/jas.2012-5796 |
| [20] |
ZHU L H, ZHAO K L, CHEN X L, et al. Impact of weaning and an antioxidant blend on intestinal barrier function and antioxidant status in pigs[J]. Journal of Animal Science, 2012, 90(8): 2581-2589. DOI:10.2527/jas.2011-4444 |
| [21] |
YIN J, WU M M, XIAO H, et al. Development of an antioxidant system after early weaning in piglets[J]. Journal of Animal Science, 2014, 92(2): 612-619. DOI:10.2527/jas.2013-6986 |
| [22] |
夏冰, 孟庆石, 解竞静, 等. 21日龄断奶对仔猪肠道形态、肠道通透性及肠黏膜屏障的影响[J]. 动物营养学报, 2018, 30(6): 2097-2108. DOI:10.3969/j.issn.1006-267x.2018.06.012 |
| [23] |
薛萍, 沈峰, 王恬, 等. 丁酸钠对早期断奶仔猪肠道微生物菌群、pH值、挥发性脂肪酸及肠道形态的影响[J]. 饲料研究, 2018(6): 7-13. |
| [24] |
李虹瑾, 沙万里, 尹柏双, 等. 包膜丁酸钠对断奶仔猪肠道菌群及生长性能的影响[J]. 家畜生态学报, 2017, 38(9): 30-34. DOI:10.3969/j.issn.1673-1182.2017.09.006 |
| [25] |
邴新帅.丁酸钠与沙蒿多糖对断奶羔羊肠道发育及胰高血糖素样肽-2的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2018.
|
| [26] |
GUILLOTEAU P, SAVARY G, JAGUELIN-PEYRAULT Y, et al. Dietary sodium butyrate supplementation increases digestibility and pancreatic secretion in young milk-fed calves[J]. Journal of Dairy Science, 2010, 93(12): 5842-5850. DOI:10.3168/jds.2009-2751 |
| [27] |
HORNBY P J, MOORE B A. The therapeutic potential of targeting the glucagon-like peptide-2 receptor in gastrointestinal disease[J]. Expert Opinion on Therapeutic Targets, 2011, 15(5): 637-646. DOI:10.1517/14728222.2011.556620 |
| [28] |
于洋洋.不同淀粉源对羔羊小肠发育、消化酶活性及相关基因表达量的影响[D].硕士学位论文.大庆: 黑龙江八一农垦大学, 2018.
|




