我国集约化奶牛、肉牛和肉羊生产过程中, 为了提高生产效率而大量饲喂以谷物为主要能量饲料的高精料饲粮, 导致以瘤胃酸中毒(subacute ruminal acidosis, SARA)为主的代谢性疾病的发病率提高。SARA的发生会影响奶牛的产奶量和乳品质、瘤胃内环境、微生物区系的平衡和瘤胃的消化代谢, 引起奶牛腹泻、瘤胃上皮损伤、蹄叶炎、炎症和肝脏疾病[1-3]。SARA是当前反刍动物养殖中极为常见而又危害最大、经济损失非常严重的疾病之一[4]。SARA的发生不仅给畜牧业带来重大的损失, 同时也对反刍动物的消化道健康带来负面影响, 已经成为现代反刍动物生产中的突出问题。本文综述了国内外反刍动物高谷物饲粮与消化道健康关系方面的研究成果和新兴谷物原料处理方法预防反刍动物SARA患病风险的现状及前景, 为谷物原料预处理在反刍动物饲粮配制中的应用提供参考。
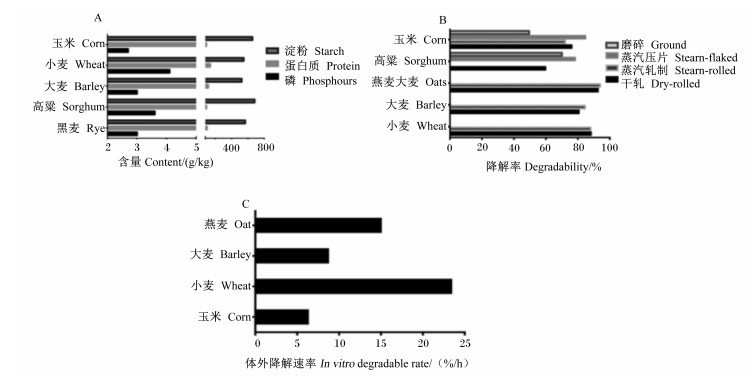
1 谷物饲料作为反刍动物能量饲料原料的营养特性谷物是反刍动物饲粮中碳水化合物的主要来源, 因其能够提供丰富的能量而广泛被用于高产反刍动物饲粮[1]。淀粉是谷物的主要成分, 淀粉的合理利用决定了反刍动物谷物的饲用价值。在反刍动物饲粮中谷物不仅是淀粉的主要来源, 也是蛋白质和矿物质的重要来源, 尤其是磷(图 1-A)。大量谷物在反刍动物饲粮中的应用几乎能完全满足反刍动物对磷的需要[5]。因反刍动物将谷物中淀粉在瘤胃中降解为有机酸作为能量代谢的前体物供能, 而单胃动物可将谷物中淀粉直接降解为葡萄糖供能, 这致使反刍动物对谷物的能量利用效率比猪、禽等单胃动物低[6]。大部分谷物淀粉在瘤胃内被降解, 但其降解速率和程度因谷物来源和加工方式不同而不尽相同(图 1-B、图 1-C)[7-8]。谷物淀粉在瘤胃内的降解特性主要受品种、淀粉颗粒大小、直链淀粉与支链淀粉比例、胚乳结构、淀粉脂质复合物和淀粉蛋白质复合物结构等因素的影响[9]。在现代奶牛、肉牛和肉羊生产过程中, 为了提高生产效率而过量使用谷物饲料, 大量谷物淀粉在瘤胃内可发酵产生过量的挥发性脂肪酸(VFA)和乳酸, 破坏瘤胃微生态环境。这样消耗掉大量谷物的同时, 也对反刍动物的机体健康带来不良影响。
|
图 1 反刍动物常用谷物饲料中淀粉、蛋白质、磷含量(饲喂基础; 改编自中国饲料成分及营养价值表, 2018年第29版)和谷物淀粉瘤胃降解率和体外降解速率 Fig. 1 Starch, protein and phosphorus contents (as-fed basis; adapted from Tables of Feed Composition and Nutritive Values in China, 29th edition 2018) of most common cereal feed in ruminants and cereal starch ruminal degradability and in vitro degradable rate[7-8] |
高产反刍动物需要大量的能量供应, 然而饲粮中易发酵碳水化合物的骤然增加会导致瘤胃内VFA和乳酸迅速累积, 进而降低瘤胃pH, 增高渗透压和增加瘤胃内毒性物质[10-11]。许多研究者们发现, SARA的发生可以改变瘤胃内微生物的结构和丰度[12-13]。Pan等[14]采用高通量测序技术研究发现, 高谷物饲粮增加了奶牛瘤胃内厚壁菌门的丰度, 降低了变形菌门的丰度, 在属水平上, 高谷物饲粮降低了拟杆菌属等共19个菌属的丰度。另有研究报道, 与常规饲粮组相比, 饲喂高谷物饲粮的奶牛瘤胃液中牛链球菌(Streptococcus bovis)和乳酸杆菌(Lactobacillus)的数量分别提高3.62%和4.65%, 溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)和埃氏巨型球菌(Megasphaera elsdenii)的数量分别降低1.14%和4.90%[15]。
正常生理状态下, 反刍动物瘤胃上皮具有良好的屏障功能, 而SARA的发生会导致瘤胃上皮角质层明显脱落损伤, 瘤胃乳头长度、宽度及角质层厚度降低, 颗粒层的细胞连接退化, 紧密连接数量减少, 结构模糊, 上皮完整性遭到严重的破坏[16-17]。除此之外, Klevenhusen等[18]利用尤斯灌流系统研究发现, 高精料饲粮能显著提高瘤胃上皮短路电流和组织导电性, 证明了瘤胃上皮通透性显著增加。瘤胃上皮组织结构的变化最终会影响瘤胃上皮营养物质吸收和毒性物质易位。
2.1.2 改变瘤胃中乳酸代谢模式高谷物饲粮条件下, 反刍动物瘤胃内乳酸产生菌与乳酸利用菌之间的菌群失调导致瘤胃内乳酸大量累积是加速SARA进程的重要原因[19]。牛链球菌作为瘤胃内的主要乳酸产生菌, 其增殖速率和产酸模式均受pH的调控[20], 当pH低于5.7时, 将以乳酸为主要代谢终产物[21]。以淀粉为主的高谷物饲粮饲养方式会引起反刍动物瘤胃中牛链球菌快速增殖, 利用易发酵碳水化合物发酵产生大量乳酸, 因乳酸代谢产生ATP的效率明显低于其他有机酸, 这样会降低谷物能量的利用效率, 当瘤胃pH过低时乳酸利用菌受到抑制, 乳酸的产量超出利用量而造成乳酸积累, 加速SARA进程[22]。瘤胃内主要乳酸利用菌丰度下降和活力降低会导致反刍动物抵抗SARA的能力也随之下降。为此, 研究者尝试构建了耐酸工程菌Megasphaera elsdenii H6F32, 并发现Megasphaera elsdenii H6F32能够有效降低体外模拟SARA培养液的pH和乳酸浓度[23]。此外, 也有研究学者通过牛链球菌果糖-1, 6-二磷酸醛缩酶(FBA)过表达调控乳酸产生, 研究发现, 大量易发酵碳水化合物作为底物时牛链球菌FBA过表达可以减少乳酸产生, 相反, 少量易发酵碳水化合物和不易发酵碳水化合物作为底物时FBA过表达增加乳酸产量[24]。Asanuma等[25]在牛链球菌12U1中鉴定了一个编码牛链球菌全局分解代谢控制蛋白A(catabolite control protein A, ccpA)基因, 并研究了ccpA基因在乳酸脱氢酶基因转录调控中的作用, 结果显示, 与野生菌株相比, ccpA基因突变菌株降低了乳酸产生的比率。这些研究为调控瘤胃乳酸蓄积提供了潜在的预防措施, 因此, 采用基因调控重组菌株并使之成功定植于瘤胃或将成为运用微生物手段调控SARA的有效方法。
2.2 高谷物饲粮诱发反刍动物机体产生炎症反应高谷物饲粮诱发SARA后, 瘤胃中会产生大量异常代谢产物, 主要包括脂多糖/内毒素(LPS)和组胺等[26]。瘤胃中的LPS和组胺激活瘤胃上皮细胞的核因子-κB(nuclear factor-kappa B, NF-κB)信号通路, 引起奶牛瘤胃上皮细胞的炎症损伤[27-29], 瘤胃上皮屏障完整性受损, LPS和组胺易位入血。血液中的LPS首先与脂多糖结合蛋白(LBP)结合, 形成LPS-LBP复合物。LBP通过与类脂A结合, 从而显著增加LPS活性, 并将LPS传递至靶细胞膜表面的膜结合型CD14(mCD14)和传统可溶性CD14(sCD14), 随后与之结合形成LPS-LBP-CD14三联复合物[30]。Toll样受体4在识别并结合该三联复合物后被激活, 并介导一系列细胞内信号转导机制, 激活多种蛋白激酶, 并且随后激活胞浆内转录因子, 如NF-κB, 活化的NF-κB进入细胞核, 结合基因的启动区域, 激发一系列重要的促炎性细胞因子和趋化因子基因表达, 从而释放大量细胞因子[31], LPS诱导细胞因子的表达而激活免疫系统。研究发现, 粗饲料为玉米秸秆的高精料(63%)饲粮相对于粗饲料为混合粗料的低精料(41%)饲粮, 能诱发奶牛血中白细胞、中性粒细胞和CD14淋巴细胞数量显著升高[32]。SARA也会导致奶牛血清淀粉样蛋白A和触珠蛋白含量上升[33]。Zebeli等[34]进一步研究发现, 奶牛瘤胃中LPS增加还可引起血液中C反应蛋白含量的上升。
3 谷物原料加工处理预防SARA的应用前景为了解决追求高产和动物机体健康的突出问题, 研究者们通过改变饲养决策, 包括改变饲粮碳水化合物平衡, 饲粮中添加益生菌、缓冲剂、离子载体抗生素、有机酸、硫胺素和植物提取物等方法缓解SARA的发生[35-36]。此外, 近些年来通过化学方法和酶处理谷物原料寻找反刍动物高产和机体健康的平衡引起了科研人员的关注, 从谷物原料加工角度出发解决亚急性酸中毒问题成为了领域内的研究热点。
3.1 新兴化学法传统的谷物化学处理方法包括氢氧化钠浸泡、甲醛浸泡以及氨处理等, 因这些方法存在处理时间长、增加动物饮水量、具有腐蚀性和损害反刍健康等潜在问题而尚未得到广泛的推广应用。有机酸乳酸和柠檬酸已经被广泛应用于食品行业中改变淀粉消化特性, 研究者发现有机酸处理淀粉可能会使高度分化的支链淀粉分子线性化, 从而限制了酶解速率[37]。Iqbal等[38]利用这一特性, 采用乳酸处理大麦以降低奶牛SARA的患病风险, 同时维持了泌乳后期荷斯坦奶牛的高乳脂含量。由于谷物热处理与淀粉糊化有关[39], Iqbal等[40]尝试乳酸联合热处理大麦预防SARA的发生, 结果显示瘤胃密集发酵阶段(8~12 h)的pH均高于5.8, 乳脂产量、乳脂含量和脂肪蛋白比增加; 乳酸联合热处理大麦具有更好的牛奶能量效率、能量矫正乳和较低的牛奶尿素氮, 有机酸联合热处理大麦在饲喂泌乳后期的荷斯坦奶牛试验中显示出了多重优势。Harder等[41]进一步尝试应用有机酸和热循环联合处理大麦, 利用淀粉回生增加抗性淀粉含量, 这些处理工艺的改变显著提高了大麦中抗性淀粉含量。
目前, 我国反刍动物饲粮中能量的主要供给谷物原料为玉米, Shen等[42]报道了柠檬酸处理玉米降低了奶山羊SARA的患病风险, 但柠檬酸处理玉米对奶山羊的干物质采食量和产奶量均无显著影响, 有提高乳脂含量和4%乳脂校正乳产量的趋势。另有研究者报道乳酸或盐酸处理玉米能够调控淀粉在肉牛瘤胃内的降解特性, 进而改善瘤胃和血浆代谢状况, 降低高谷物饲粮诱发的肉牛机体免疫反应[43]。除了以上提及的酸处理方法, 单宁酸也被用于修饰谷物淀粉结构抵抗瘤胃的快速降解, 同时降低了挥发性脂肪酸、丙酸和支链脂肪酸浓度[44]。根据扫描电子显微镜图像, 淀粉的保护可能主要来自于单宁酸与蛋白质和淀粉颗粒嵌入的胚乳细胞基质的结构碳水化合物之间的相互作用[45]。单宁酸处理谷物可能是一种潜在的方式, 将部分淀粉的消化部位从瘤胃转移到肠道, 从而减少瘤胃发酵紊乱的发生。关于新兴化学法处理谷物原料及其对反刍动物生产影响的研究相对较少, 有机酸处理谷物降低SARA患病风险的机制尚不明晰, 缺乏深入的体内研究来评估该技术在实际应用中的潜力。
3.2 酶处理较化学方法相比, 酶处理淀粉具有底物特异性、处理时间相对短的优点。酶处理主要是通过去支链分子增加直链淀粉的水平以增加抗性淀粉含量, 典型的具有提高抗性淀粉的去支化酶包括普鲁兰酶、异淀粉酶等[46]。近年来, Metzler-Zebeli等[47]和Newman等[48]分别报道了转糖基淀粉对猪的大肠黏膜固有免疫应答基因、肠道菌群及其与肝脏脂质合成相关基因表达的影响。研究发现, 糖基转移淀粉一定程度上通过改变大肠微生物作用下调促炎通路调控猪的抗炎能力; 糖基转移淀粉可能通过改变肠道细菌状态、丙酸和宿主脂质代谢影响肠道细菌信号通路。目前, 关于酶处理谷物淀粉与反刍动物生产相关的研究信息缺乏。Harder等[49]应用普鲁兰酶处理大麦, 结果发现经5%普鲁兰酶在22℃处理后大麦中的抗性淀粉含量从0.26%增加至1.29%, 且抗性淀粉含量的上升和普鲁兰酶的浓度增加呈线性关系。另有研究报道, α-淀粉联合普鲁兰酶、高压联合β-淀粉酶可有效促进抗性淀粉的形成[50-51]。因此, 尝试联合酶法和物理法处理谷物淀粉用于抵抗反刍动物瘤胃的快速降解或将成为有效的措施。但关于优化工艺、降低成本及其在生产中的应用任重道远。
4 小结高谷物饲粮诱发SARA可导致瘤胃内环境和微生物平衡遭到破坏, 大量革兰氏阴性菌崩解释放过量的LPS和组胺等有害代谢产物, 致使瘤胃上皮组织损伤, LPS和组胺易位入血液诱发机体炎症。若反刍动物生产上仅一味的追求效益, 大量使用以谷物饲料为基础的高精料, 而忽视动物体内的应有的碳水化合物结构平衡, 必将损害动物的健康, 影响反刍动物生产性能的发挥, 这反而会降低生产效益。为了解决这一矛盾问题, 近年来科研人员们尝试从谷物原料角度出发预防SARA的患病风险, 寻找反刍动物高产和机体健康的平衡点。现有研究发现有机酸和酶处理谷物原料可以提高抗性淀粉的含量。为有效预防SARA的发生, 保证反刍动物瘤胃健康和生产性能, 探究谷物预处理的确切作用机制, 未来研究中一方面需要挖掘有效的处理方法, 优化处理工艺参数; 另一方面, 可以借助转录组和代谢组学等检测技术手段, 系统地揭示谷物预处理对反刍动物健康的影响和作用机制。这对于进一步在生产中进行有效预防和调控反刍动物SARA的发生具有重要现实意义。
| [1] |
NOCEK J E. Bovine acidosis:implications on laminitis[J]. Journal of Dairy Science, 1997, 80(5): 1005-1028. DOI:10.3168/jds.S0022-0302(97)76026-0 |
| [2] |
KLEEN J L, HOOIJER G A, REHAGE J, et al. Subacute ruminal acidosis (SARA):a review[J]. Journal of Veterinary Medicine Series A, 2003, 50(8): 406-414. DOI:10.1046/j.1439-0442.2003.00569.x |
| [3] |
ALZAHAL O, RUSTOMO B, ODONGO N E, et al. Technical note:a system for continuous recording of ruminal pH in cattle[J]. Journal of Animal Science, 2007, 85(1): 213-217. DOI:10.2527/jas.2006-095 |
| [4] |
KLEEN J L, HOOIJER G A, REHAGE J, et al. Subacute ruminal acidosis in Dutch dairy herds[J]. The Veterinary Record, 2009, 164(22): 681-683. DOI:10.1136/vr.164.22.681 |
| [5] |
HUMER E, ZEBELI Q. Phytate in feed ingredients and potentials for improving the utilization of phosphorus in ruminant nutrition[J]. Animal Feed Science and Technology, 2015, 209: 1-15. DOI:10.1016/j.anifeedsci.2015.07.028 |
| [6] |
葛长荣, 曹正辉, 苏子峰. 反刍动物小肠可利用淀粉代谢调控进展[J]. 饲料研究, 2005(4): 29-31. DOI:10.3969/j.issn.1002-2813.2005.04.010 |
| [7] |
HERRERA-SALDANA R E, HUBER J T, POORE M H. Dry matter, crude protein, and starch degradability of five cereal grains[J]. Journal of Dairy Science, 1990, 73(9): 2386-2393. DOI:10.3168/jds.S0022-0302(90)78922-9 |
| [8] |
HUNTINGTON G B. Starch utilization by ruminants:from basics to the bunk[J]. Journal of Animal Science, 1997, 75(3): 852-867. DOI:10.2527/1997.753852x |
| [9] |
GÓMEZ L M, POSADA S L, OLIVERA M. Starch in ruminant diets:a review[J]. Revista Colombiana de Ciencias Pecuarias, 2016, 29(2): 77-90. |
| [10] |
PLAIZIER J C, KRAUSE D O, GOZHO G N, et al. Subacute ruminal acidosis in dairy cows:the physiological causes, incidence and consequences[J]. The Veterinary Journal, 2008, 176(1): 21-31. |
| [11] |
ASCHENBACH J R, PENNER G B, STUMPFF F, et al. Ruminant nutrition symposium:role of fermentation acid absorption in the regulation of ruminal pH[J]. Journal of Animal Science, 2011, 89(4): 1092-1107. DOI:10.2527/jas.2010-3301 |
| [12] |
PLAIZIER J C, LI S C, DANSCHER A M, et al. Changes in microbiota in rumen digesta and feces due to a grain-based subacute ruminal acidosis (SARA) challenge[J]. Microbial Ecology, 2017, 74(2): 485-495. DOI:10.1007/s00248-017-0940-z |
| [13] |
PLAIZIER J C, LI S C, TUN H M, et al. Nutritional models of experimentally-induced subacute ruminal acidosis (SARA) differ in their impact on rumen and hindgut bacterial communities in dairy cows[J]. Frontiers in Microbiology, 2017, 7: 2128. |
| [14] |
PAN X H, XUE F G, NAN X M, et al. Illumina sequencing approach to characterize thiamine metabolism related bacteria and the impacts of thiamine supplementation on ruminal microbiota in dairy cows fed high-grain diets[J]. Frontiers in Microbiology, 2017, 8: 1818. DOI:10.3389/fmicb.2017.01818 |
| [15] |
王洪荣, 张红伟. 硫胺素和硫水平对山羊人工瘤胃代谢和微生物菌群的影响[J]. 中国农业科学, 2012, 45(8): 1595-1605. DOI:10.3864/j.issn.0578-1752.2012.08.015 |
| [16] |
邬宇航.亚急性瘤胃酸中毒对瘤胃、瓣胃上皮细胞增殖与凋亡的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2013.
|
| [17] |
程萌.亚急性瘤胃酸中毒对奶山羊瘤胃上皮通透性及细胞连接蛋白表达的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2016.
|
| [18] |
KLEVENHUSEN F, HOLLMANN M, PODSTATZKY-LICHTENSTEIN L, et al. Feeding barley grain-rich diets altered electrophysiological properties and permeability of the ruminal wall in a goat model[J]. Journal of Dairy Science, 2013, 96(4): 2293-2302. DOI:10.3168/jds.2012-6187 |
| [19] |
ENEMARK J M D, JØRGENSEN R J, ENEMARK P S. Rumen acidosis with special emphasis on diagnostic aspects of subclinical rumen acidosis:a review[J]. Veterinarija Ir Zootechnika, 2002, 20(42): 16-29. |
| [20] |
CHEN L M, LIU S M, WANG H R, et al. Relative significances of pH and substrate starch level to roles of Streptococcus bovis S1 in rumen acidosis[J]. AMB Express, 2016, 6: 80. DOI:10.1186/s13568-016-0248-2 |
| [21] |
RUSSELL J B, HINO T. Regulation of lactate production in Streptococcus bovis:a spiraling effect that contributes to rumen acidosis[J]. Journal of Dairy Science, 1985, 68(7): 1712-1721. DOI:10.3168/jds.S0022-0302(85)81017-1 |
| [22] |
WANG H R, PAN X H, WANG C, et al. Effects of different dietary concentrate to forage ratio and thiamine supplementation on the rumen fermentation and ruminal bacterial community in dairy cows[J]. Animal Production Science, 2015, 55(2): 189-193. DOI:10.1071/AN14523 |
| [23] |
LONG M, FENG W J, LI P, et al. Effects of the acid-tolerant engineered bacterial strain Megasphaera elsdenii H6F32 on ruminal pH and the lactic acid concentration of simulated rumen acidosis in vitro[J]. Research in Veterinary Science, 2014, 96(1): 28-29. |
| [24] |
ASANUMA N, HINO T. Fructose bisphosphate aldolase activity and glycolytic intermediate concentrations in relation to lactate production in Streptococcus bovis[J]. Anaerobe, 2002, 8(1): 1-8. DOI:10.1006/anae.2001.0398 |
| [25] |
ASANUMA N, YOSHII T, HINO T. Molecular characterization of CcpA and involvement of this protein in transcriptional regulation of lactate dehydrogenase and pyruvate formate-lyase in the ruminal bacterium Streptococcus bovis[J]. Applied and Environmental Microbiology, 2004, 70(9): 5244-5251. DOI:10.1128/AEM.70.9.5244-5251.2004 |
| [26] |
DONG G Z, LIU S M, WU Y X, et al. Diet-induced bacterial immunogens in the gastrointestinal tract of dairy cows:impacts on immunity and metabolism[J]. Acta Veterinaria Scandinavica, 2011, 53(1): 48. DOI:10.1186/1751-0147-53-48 |
| [27] |
OWENS F N, SECRIST D S, HILL W J, et al. Acidosis in cattle:a review[J]. Journal of Animal Science, 1998, 76(1): 275-286. |
| [28] |
ASCHENBACH J R, GÄBEL G. Effect and absorption of histamine in sheep rumen:significance of acidotic epithelial damage[J]. Journal of Animal Science, 2000, 78(2): 464-470. DOI:10.2527/2000.782464x |
| [29] |
SUN X, YUAN X, CHEN L, et al. Histamine induces bovine rumen epithelial cell inflammatory response via NF-κB pathway[J]. Cellular Physiology and Biochemistry, 2017, 42(3): 1109-1119. DOI:10.1159/000478765 |
| [30] |
WRIGHT S D, RAMOS R A, TOBIAS P S, et al. CD14, a receptor for complexes of lipopolysaccharide (LPS) and LPS binding protein[J]. Science, 1990, 249(4975): 1431-1433. DOI:10.1126/science.1698311 |
| [31] |
GUHA M, MACKMAN N. LPS induction of gene expression in human monocytes[J]. Cellular Signalling, 2001, 13(2): 85-94. |
| [32] |
吴永霞.不同日粮模式对奶山羊和奶牛血中内毒素含量及免疫活化状态的影响[D].硕士学位论文, 重庆: 西南大学, 2012.
|
| [33] |
陆天水, 陈杰, 汤艾菲, 等. 利用瘤胃缓冲剂调控奶牛血浆组胺内毒素水平与提高产奶性能的研究[J]. 中国奶牛, 1992(6): 45-47. |
| [34] |
ZEBELI Q, AMETAJ B N. Relationships between rumen lipopolysaccharide and mediators of inflammatory response with milk fat production and efficiency in dairy cows[J]. Journal of Dairy Science, 2009, 92(8): 3800-3809. DOI:10.3168/jds.2009-2178 |
| [35] |
王洪荣. 反刍动物瘤胃酸中毒机制解析及其营养调控措施[J]. 动物营养学报, 2014, 26(10): 3140-3148. DOI:10.3969/j.issn.1006-267x.2014.10.028 |
| [36] |
BALCELLS J, ARIS A, SERRANO A, et al. Effects of an extract of plant flavonoids (Bioflavex) on rumen fermentation and performance in heifers fed high-concentrate diets[J]. Journal of Animal Science, 2012, 90(13): 4975-4984. DOI:10.2527/jas.2011-4955 |
| [37] |
LILJEBERG H, ÅKERBERG A, BJÖRCK I. Resistant starch formation in bread as influenced by choice of ingredients or baking conditions[J]. Food Chemistry, 1996, 56(4): 389-394. DOI:10.1016/0308-8146(95)00199-9 |
| [38] |
IQBAL S, ZEBELI Q, MAZZOLARI A, et al. Feeding barley grain steeped in lactic acid modulates rumen fermentation patterns and increases milk fat content in dairy cows[J]. Journal of Dairy Science, 2009, 92(12): 6023-6032. DOI:10.3168/jds.2009-2380 |
| [39] |
SVIHUS B, UHLEN A K, HARSTAD O M. Effect of starch granule structure, associated components and processing on nutritive value of cereal starch:a review[J]. Animal Feed Science and Technology, 2005, 122(3/4): 303-320. |
| [40] |
IQBAL S, TERRILL S J, ZEBELI Q, et al. Treating barley grain with lactic acid and heat prevented sub-acute ruminal acidosis and increased milk fat content in dairy cows[J]. Animal Feed Science and Technology, 2012, 172(3/4): 141-149. |
| [41] |
HARDER H, KHOL-PARISINI A, ZEBELI Q. Modulation of resistant starch and nutrient composition of barley grain using organic acids and thermal cycling treatments[J]. Starch-Stärke, 2015, 67(7/8): 654-662. |
| [42] |
SHEN Y Z, DING L Y, CHEN L M, et al. Feeding corn grain steeped in citric acid modulates rumen fermentation and inflammatory responses in dairy goats[J]. Animal, 2019, 3(2): 301-308. |
| [43] |
YANG Y, DONG G Z, WANG Z, et al. Treatment of corn with lactic acid or hydrochloric acid modulates the rumen and plasma metabolic profiles as well as inflammatory responses in beef steers[J]. BMC Veterinary Research, 2018, 14(1): 408. DOI:10.1186/s12917-018-1734-3 |
| [44] |
DECKARDT K, METZLER-ZEBELI B U, ZEBELI Q. Processing barley grain with lactic and tannic acid ameliorates rumen microbial fermentation and degradation of dietary fibre in vitro[J]. Journal of the Science of Food and Agriculture, 2016, 96(1): 223-231. DOI:10.1002/jsfa.7085 |
| [45] |
MARTÍNEZ T F, MOYANO F J, DÍAZ M, et al. Use of tannic acid to protect barley meal against ruminal degradation[J]. Journal of the Science of Food and Agriculture, 2005, 85(8): 1371-1378. DOI:10.1002/jsfa.2100 |
| [46] |
DUPUIS J H, LIU Q, YADA R Y. Methodologies for increasing the resistant starch content of food starches:a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2014, 13(6): 1219-1234. DOI:10.1111/1541-4337.12104 |
| [47] |
METZLER-ZEBELI B U, NEWMAN M A, GRÜLL D, et al. Consumption of transglycosylated starch down-regulates expression of mucosal innate immune response genes in the large intestine using a pig model[J]. British Journal of Nutrition, 2018, 119(12): 1366-1377. DOI:10.1017/S0007114518001113 |
| [48] |
NEWMAN M A, PETRI R M, GRÜLL D, et al. Transglycosylated starch modulates the gut microbiome and expression of genes related to lipid synthesis in liver and adipose tissue of pigs[J]. Frontiers in Microbiology, 2018, 9: 224. DOI:10.3389/fmicb.2018.00224 |
| [49] |
HARDER H, KHOL-PARISINI A, ZEBELI Q. Treatments with organic acids and pullulanase differently affect resistant starch and fiber composition in flour of various barley genotypes (Hordeum vulgare L.)[J]. Starch-Stärke, 2015, 67(5/6): 512-520. |
| [50] |
ZHANG H X, JIN Z Y. Preparation of products rich in resistant starch from maize starch by an enzymatic method[J]. Carbohydrate Polymers, 2011, 86(4): 1610-1614. DOI:10.1016/j.carbpol.2011.06.070 |
| [51] |
HICKMAN B E, JANASWAMY S, YAO Y. Autoclave and β-amylolysis lead to reduced in vitro digestibility of starch[J]. Journal of Agricultural and Food Chemistry, 2009, 57(15): 7005-7012. DOI:10.1021/jf9010164 |




