2. 中国农业科学院饲料研究所, 农业部饲料生物技术重点实验室, 奶牛营养学北京市重点实验室, 北京 100081
2. Beijing Key Laboratory for Dairy Cow Nutrition, Key Laboratory of Feed Biotechnology of the Ministry of Agriculture, Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China
温室气体排放量的增加所导致的全球气候变暖是人类面临的巨大环境挑战。温室气体主要来自自然环境、能源工业和农业生产。数据显示, 来自农业部门的畜牧业产生的温室气体占所有人为温室气体的15%[71亿t二氧化碳(CO2)当量/年], 其中, 反刍动物产生的温室气体为57亿t CO2当量/年[1]。从经济方面来看, 反刍动物排放的温室气体对生态系统和人类健康造成的经济损失分别约为6 790亿和130亿美元[2-3]。温室气体中前两大成分分别为CO2和甲烷(CH4), 但CH4的增温潜势是CO2的22~24倍。而反刍动物产生的温室气体中约44%是CH4; 在我国, 反刍动物CH4排放量为1 020万t, 占人为CH4排放总量的20.5%[4]。因此, 反刍动物CH4的排放与全球气候变暖有着紧密联系, 并对生态系统和人类健康具有危害性。
饲粮中碳水化合物进入瘤胃后, 在微生物的厌氧发酵作用下, 产生挥发性脂肪酸(VFA)、氢气和CO2等物质, 产甲烷菌利用这些物质合成CH4。CH4是一种高能物质, 但其能量不能被动物利用, 通过嗳气、呼气和直肠排气3种方式排出体外。因此, 除对气候的影响外, CH4的产生将造成反刍动物2%~12%的摄入总能损失[5]。由此可见, 降低反刍动物CH4排放量对缓解温室效应、节约饲料能源、降低畜牧业成本具有重要意义。近年来, 国内外学者开展了大量通过抑制甲烷菌生长、去原虫、减少氢气生成、竞争氢气和抑制CH4合成过程中某些酶的活性等途径降低反刍动物CH4排放量的研究[6]。反刍动物胃肠道CH4排放量的准确测量是这些研究的基础。本文将对常见直接测定方法的误差来源及应用特点进行综述, 以期为研究CH4减排措施提供帮助。
1 测定方法直接测定法中的呼吸代谢室法, 在校正准确和操作正确的前提下, 得到的结果通常被作为"黄金标准", 但其测量周期长、测定动物数量少, 代表性差。与呼吸代谢室法相比, 六氟化硫(SF6)示踪法能够在较多动物和不改变动物饲养状态的条件下应用, 改进了呼吸代谢室法测定动物数量少的问题, 但也具有测量周期长的弊端并且结果可变性高。而自动头室(automated head chambers, GreenFeed)系统是目前直接测定反刍动物CH4排放量的最新技术, 具有无创伤、非侵入式、测量时间短和可用于大群动物的优点, 应用前景广阔。各个测定方法及其应用特点如表 1。
|
|
表 1 反刍动物CH4排放量的测定方法及其应用特点 Table 1 Measurement methods of ruminant CH4 emission and its application characteristics[7] |
呼吸室已有100多年历史, 起初被用作间接测热, 以测量反刍动物在呼吸和CH4排放过程中造成的能量损失[7]。目前, 最常用的是开路式呼吸室。其原理为:吸入的空气通过在室内循环, 使室内空气中的CH4混合均匀, 同时以进气相同速率排出空气, 并对吸入和排出气体进行采样分析。CH4排放量为气流量和排出气体与吸入气体之间浓度差的乘积。
此方法不能用于正常的动物生产条件, 测量期间动物要一直处于呼吸室内。每个呼吸室通常只能测量1只动物, 而且动物需要较长时间的训练以适应室内的密闭空间[6]。另外, 呼吸代谢室的仪器精密度高和操作复杂, 对研究人员要求高。呼吸代谢室法因具有对动物排放的CH4全面采样、测量周期长和仪器精密的特点, 并因其结果准确, 常被作为"黄金标准"[8]。
根据试验目的和条件, 呼吸室测量CH4排放量的时间通常为连续的1~7 d。在试验动物方面也有要求, 在时间较长的情况下, 需要维持和控制室内的温度和湿度, 降低动物应激, 尤其对于通过呼吸过程中水分的蒸发来散热的高产泌乳牛[7]。根据动物的CH4和CO2排放量来改变气流量, 以保持进气和排气之间的浓度差。室内的CO2浓度必须保持在动物新陈代谢水平的1%以下[9]。有研究表明, 奶牛CH4排放量的大约30%是基于前1天的干物质采食量(DMI)的结果, DMI的每日变化可导致CH4产量预测误差高达3%[10]。因此, 呼吸代谢室法中的动物必须有稳定的DMI。与其他方法不同, 呼吸代谢室法可以用于瘘管牛。
操作要求及误差最为重要, 在每次试验开始之前和结束之后, 都应对呼吸室进行常规校准, 保证气体回收率约为100%是结果准确的前提条件。开路式呼吸室需校准气体流量和浓度, 以达到标准的温度、压力条件以及适当的湿度, 并测量试验开始和结束时呼吸室内的CH4残余量, 排除对气体体积的影响。呼吸室内通常为负压, 但也有正压情况, 应保证绝对气密性。在动物挤奶和室内清洁时, 需要打开室门, 这将造成测量间隙, 对于测量间隙的研究有不同结果。有学者认为用每次打开室门之前和之后的CH4排放速率的平均值, 或者每次打开室门之前的CH4排放速率, 比全天CH4排放速率平均值作为测量间隙的数值更为准确[11]。但Van等[12]认为将舍弃此间隙数值与补入此间隙数值的测量结果相比, CH4排放速率之间只有1%的差异。除人为操作因素外, 设备因素也会影响试验结果。Gardiner等[13]通过测试在呼吸室中定点并以校准速度释放的超高纯度CH4标准参考源的回收率, 检验测量系统中特定组件的准确性。结果表明, 误差来源分别为分析仪器误差、管道效率(从呼吸室到分析仪器之间, 并包括对气流的测量)以及呼吸室内空气的混合程度。总体来看, 用呼吸代谢室法测量CH4排放量所产生的数值变化, 主要来源于呼吸室的气流速度和呼吸室中的空气混合动态。
呼吸代谢室法在操作准确, 试验开始和结束时回收率固定并且接近100%时测定的结果, 被认为是反刍动物胃肠道CH4排放量的黄金标准。除能全面测量动物CH4排放量(呼气、嗳气和直肠排气)并且适用于瘘管动物外, 还能测量其他气体(如氧气、CO2、氢气、氨气等)和动物能量代谢, 但是其测量动物数量少、造价高, 并且改变了动物的正常饲养状态。
1.2 SF6示踪法Zimmerman等[14]和Johnson等[15]提出了测量反刍动物胃肠道CH4排放量的SF6示踪法。将已知SF6气体释放速率的渗透管投放到动物的瘤胃中, 在动物口鼻附近安装带有限流器的管道并连接到背部真空收集罐, 对呼出气体连续采集, 同时采集动物周围环境空气。通过渗透管中已知的SF6释放速率、环境空气和收集罐中CH4及SF6的浓度计算CH4排放量, 计算公式如下:
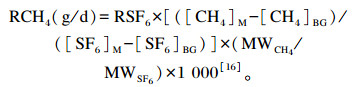
|
式中:RCH4为瘤胃CH4排放速率(g/d); RSF6为测得的渗透管中SF6释放速率(mg/d); 1 000为单位转换系数; 下角标M表示气体样本, 下角标BG表示环境空气; MWCH4和MWSF6分别为CH4(16)和SF6(146)的相对分子质量; [CH4]的浓度单位为mg/L, [SF6]的浓度单位为ng/L。
SF6示踪法可用于放牧、散栏和栓系式牛舍等饲养条件, 能同时测量较多动物, 放牧条件具有最佳的环境空气浓度。环境中的SF6和CH4浓度应当小于动物气体样本, 环境气体中的SF6浓度较高时, 在计算CH4浓度过程中将会产生不确定性从而影响结果的准确性和精确性, 环境空气浓度较高时也会导致与SF6计算相关的高方差[17]。在封闭圈舍以及靠近工厂的圈舍开展试验时, 环境空气中CH4和SF6浓度较高[7]; 在通风良好的圈舍中, 得到的CH4排放量计算误差也在-31~4 g CH4/(头·d)[16]; 在栓系式牛舍条件下, 不同季节间的CH4排放量也有较大变化[18]。但在通风良好的放牧条件下, 具备适宜的环境空气浓度条件以获得准确的结果。经验证, 当SF6环境浓度大于动物气体样品中SF6浓度的10%时, 无法得到正确的CH4排放量, 建议SF6环境浓度不超过10 ng/L[7]。
试验过程中应确保足够的动物数量以及测量次数, 并至少连续测量5 d, 以降低所得数据的可变性[11]。SF6示踪技术是一种依赖于瘤胃中SF6恒定释放的时间平均技术, 收集周期小于24 h的气体样本不适用于估算CH4日排放速率。否则, 将导致结果偏差, 因为饲喂方式和采食频率变化造成不同时段的CH4浓度不同[7]。不建议将此方法用于瘘管动物, 在试验过程中瘘管与动物体应当紧密结合, 但很难保证其气密性。通过瘘管泄漏的SF6和CH4占各自总量的比例可能不同, 造成SF6和CH4进入门静脉的量占各自总量的比例也不同, 因此可能无法正确追踪静脉吸收的CH4[19]。
对于SF6示踪法, 环境空气浓度至关重要, 试验过程中应当保持圈舍持续通风。采集具有代表性的环境气体, 以校正测量值。最好将试验中没有投入渗透管的牛只, 也作为采集环境空气的对象。已知且较高的渗透管SF6释放率也是其前提条件[11]。Deighton等[20]报道, 渗透管在瘤胃中的浸没状态或放置方位并不重要, 但渗透管的温度会影响SF6气体的释放速率。瘤胃温度每变化1℃将造成2.2%的SF6释放速率差异, 营养水平或影响温度的因素可能会影响不同饲粮或动物之间的CH4排放差异, 但通常瘤胃温度变化不大, 产生实际影响的几率较小。通常, 同一动物分别使用SF6示踪法和呼吸室测得的平均CH4排放量之间具有差异(低或高5%~10%)。另外, 单独使用SF6示踪法时, 同一动物或动物间的CH4排放量也有较大差异[7]。对于SF6示踪法结果可变性较高的特点, Deighton等[21]对渗透管释放率以及采样率随时间而变化的问题进行了技术改进。如果测量值是在渗透管校准后的60 d以上获得, 则释放率的变化可以部分地通过使用Michaelis-Menten动力学取代一级动力学来计算, 以估算释放率随时间的衰减。此外, 使用孔板流量限制器替代毛细管采集气体样本, 则由于在全天采样过程中采样率的变化而引起的偏差将显著降低。经过改良后的SF6示踪法与呼吸代谢室法具有良好的一致性, 二者获得的CH4产量之间没有差异, 并改进了动物间的变异系数[21]。
SF6是温室气体, 但SF6方法中使用的SF6的量非常小。Williams等[16]估算, 自SF6技术建立以来, 全球反刍动物研究中使用的SF6总量不足12 kg, 与工业使用量相比, 这是微不足道的。与呼吸代谢室法相比, 该技术具有一定缺陷, 即CH4排放量受采样点到口鼻距离、气体样本中CH4:SF6比值以及呼气与嗳气比例的影响[22]。SF6示踪法和呼吸代谢室法均具有测量周期长的特点, 但SF6示踪法能同时在大量动物的正常生产条件下使用, 并且成本低。
1.3 GreenFeed系统GreenFeed系统是直接测量反刍动物CH4排放量的最新技术, 由美国某公司研制[23]。在头室内放置诱食剂诱导动物自愿访问, 测量间隔可由研究人员设置。当动物访问系统单元(GreenFeed unit)时, 传感器对动物头部定位, 抽气扇将空气经过动物的口鼻从其头顶抽入排气管, 并使用热膜风速计测量气流速度。此后, 动物的呼气和嗳气经过混合以及过滤后被现场采集, 样品中CH4的浓度用非色散红外分析法测量。动物CH4排放速率计算公式如下:
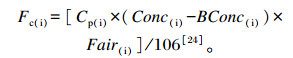
|
式中:Cp是在任何时间(i)对空气的采样率; Conc是采集气体中的CH4浓度(mg/L); BConc是CH4的环境浓度(mg/L); Fair以干燥气体为基础测得的气流量(L/min)。
与SF6示踪法相同, GreenFeed系统也可用于放牧、散栏和栓系式牛舍等饲养条件, 能够用于大群动物, 在拴系式牛舍条件下更易操作。测量周期根据研究目的制定, 最多为3~5周[11]。对每只动物在特定时间点进行连续几天的采样, 可提高测量结果的精确度; 但如果此时间点不能代表全天CH4排放规律, 将不能准确测量出全天CH4排放量[25]。然而在时间点和访问次数之间较难达到平衡, 在特定时间点和不同时间点分别为动物提供诱食剂来诱导动物访问单元, 特定时间的到访次数往往高于不同时间点, 并受到饲粮类型的影响[7, 26-27]。Arthur等[28]对肉牛开展了2项研究, 研究发现不一定要解决全天CH4排放量变化与访问分布不平衡的问题, 只要每次测量时间≥ 3 min并且总共测量次数达到30次, 无论每天获得多少次测量均可获得可靠的CH4排放数据。目前, 通常的测量方法为连续测量3 d共8个测量时间点, 测量间隔大约6 h, 每次先采集5 min动物气体再采集2 min环境气体[29]。
并不是所有动物都能频繁地访问系统单元[30], 与其他CH4测量技术相似, 动物需要训练。与呼吸代谢室法不同, 该系统不推荐用于瘤胃瘘管动物[31], 因为通过瘘管可能会损失CH4以及瘘管手术和CH4泄漏将影响嗳气峰形。虽然GreenFeed系统推出了适用于瘘管牛的"瘘管附件", 能够成功地捕获通过瘤胃瘘管损失的气体, 并将气体引导至主气流, 但在使用瘘管附件时必须限制动物的活动。
动物访问系统单元时, 头部与取样口之间的距离由红外传感器确定, 头部相对于气流的位置对于成功测量CH4非常重要。因动物可以自由移动, 所以只保留对头部位置准确定位和不间断测量的数据进行统计分析。GreenFeed系统需要为动物提供额外的饲粮或其他诱食剂, 诱使其访问系统单元。通过诱食剂的种类和预计的访问时间可确定饲喂量, 虽然控制了饲喂量, 但也有可能造成采食过多, 干扰试验结果[26, 30, 32]。在舍外研究中, 风是另外一种影响试验结果的因素, 风速和风向的变化将影响气体采样率[24]。但可安装风速仪记录测量期间的风速, 使用校正系数校正风对气体回收率的影响, 排除风对CH4排放速率测量的影响。在青年肉牛中的研究表明, 白天CH4排放量(263 g/d)显著高于夜间(216 g/d), CH4排放量与DMI呈明显的相关变化规律, 夜间采食量低时则CH4排放量低, 在采食后和反刍期间CH4浓度较高[7]。因此, 需要在全天适当分配动物的访问量, 以准确测量全天CH4排放量。访问的次数和时间点根据动物类型、饲粮和DMI而有所不同, 如对于在1 d内的访问次数少且不规律的动物, 则需要更长的访问时间[7]。在拴系式牛舍中可以控制访问时间和次数, 在放牧条件下可通过延长2次测量的时间间隔来提高结果准确性[11]。另外, 当动物正在访问系统单元时, 应避免其他动物靠近单元, 保证采样气体为单一动物源。所有试验动物访问系统单元充足的时间, 是能够测定出全天CH4排放量以及降低测量值不确定性的重要前提。
从试验条件来看, 呼吸代谢室法改变了动物正常饲养状态, SF6示踪法虽然根据动物体型调整相应采样设备的尺寸、重量以及附件, 可以降低气体收集设备对动物的干扰, 但需要向瘤胃中投放渗透管, 并不可避免地经常与动物接触, 这将影响动物的正常行为[7]。GreenFeed系统和SF6示踪法均可用于大批量试验动物, 但SF6示踪法的渗透管测试等前期准备工作较为繁琐, 而且GreenFeed系统具有不影响动物行为的特点[33]。呼吸代谢室法和SF6示踪法通常用于连续测量24 h以上的CH4排放量, 而GreenFeed系统测量时间短。因此, GreenFeed系统具有自动化、无创、非侵入性、测量时间短和可用于大批量动物的优点。虽然呼吸代谢室和安装"瘘管附件"的GreenFeed系统可以用于瘘管动物, 但是Moate等[34]发现与非瘘管牛相比, 瘘管牛的瘤胃上部空间气体成分发生了变化, CH4产量降低了10%。因此, 瘤胃瘘管对所有的测定方法均有影响。
从试验数据来看, 一项Meta分析显示, 在同一试验中使用呼吸代谢室法和GreenFeed系统测得的CH4排放量之间具有很强的相关性[35]。Hammond等[26]表明使用GreenFeed系统测得的后备奶牛CH4排放量与呼吸室的测量值无差异, 但低于SF6示踪法。而Dorich等[32]发现, 使用GreenFeed系统和SF6示踪法测量的泌乳牛的平均CH4排放量相似, 但SF6示踪法在CH4排放速率和DMI之间的关系上显示出更高的可变性, SF6示踪法测量结果的高可变性可能归因于环境气体的高浓度和牛舍通风不良。但Oh等[18]在带隧道通风的栓系式牛舍中, 使泌乳奶牛在规定时间访问GreenFeed系统, 得出相似结果, 即SF6示踪法平均标准偏差和变异系数均高于GreenFeed系统。GreenFeed系统与SF6示踪法相比, 其结果稳定性较强。Hammond等[26]发现使用呼吸代谢室法和SF6示踪法检测到的显著处理间差异和个体动物间CH4排放差异, 在GreenFeed系统数据中没有显现。这归因于使用Greenfeed系统装置获得的测量数量有限, 导致测量时间不能代表CH4排放的日变化, 突出了使用Greenfeed系统时获得足够测量数量的重要性。GreenFeed系统与SF6示踪法相似, 所获得的测量值均不包括来自直肠排气的CH4排放量, 但这些排放量较低, 只占总排放量的1%~3%[36-37]。GreenFeed系统与SF6示踪法在正确使用和校准的前提下, 均可产生准确的瘤胃CH4排放量测量值, 对方法和装置改进的重视将会继续提高二者的准确性。
2 小结呼吸代谢室法、SF6示踪法和GreenFeed系统在正确、合理的使用情况下, 均能产生准确的数据。通过3种方法的直接比较, 表明各个方法仍然存在不确定性。应当根据试验条件和目的选用合适的测量方法, 严格遵守操作规范, 获得精确及准确的结果。我国对呼吸代谢室[38]和SF6示踪法[39-40]已有大量应用, 然而GreenFeed系统虽然具有无创伤、非侵入式和可用于大群动物的特点, 有助于CH4减排措施的研究, 但在国内的应用还是空白。
| [1] |
GERBER P J.Tackling climate change through livestock[M].Rome: Food and Agriculture Organization of the United Nations, 2013.
|
| [2] |
GOEDKOOP M, HEIJUNGS R, HUIJBREGTS M, et al.ReCiPe a life cycle impact assessment method which comprises harmonised category indicators at the midpoint and the endpoint level[M].Bilthoven: RIVM, 2009: 1-126.
|
| [3] |
WEIDEMA B P. Using the budget constraint to monetarise impact assessment results[J]. Ecological Economics, 2009, 68(6): 1591-1598. |
| [4] |
黄满堂, 王体健, 赵雄飞, 等. 2015年中国地区大气甲烷排放估计及空间分布[J]. 环境科学学报, 2019, 39(5): 1371-1380. |
| [5] |
董利锋, 付敏, 陈天宝, 等. 反刍动物瘤胃优势产甲烷菌菌群结构及多样性研究进展[J]. 动物营养学报, 2019, 31(9): 3927-3935. |
| [6] |
程胜利, 肖玉萍, 杨保平, 等. 反刍动物甲烷排放现状及调控技术研究进展[J]. 中国草食动物科学, 2013, 33(5): 56-59. |
| [7] |
HAMMOND K J, CROMPTON L A, BANNINK A, et al. Review of current in vivo measurement techniques for quantifying enteric methane emission from ruminants[J]. Animal Feed Science and Technology, 2016, 219: 13-30. |
| [8] |
HUHTANEN P, RAMIN M, HRISTOV A N. Enteric methane emission can be reliably measured by the GreenFeed monitoring unit[J]. Livestock Science, 2019, 222: 31-40. |
| [9] |
MCLEAN J A, TOBIN G.Animal and human calorimetry[M].New York: Cambridge University Press, 1988.
|
| [10] |
MOATE P J, DEIGHTON M H, HANNAH M C, et al.Intake effects on methane emissions from dairy cows[C]//CCRSPI Conference.Melbourne: [s.n.], 2012: 27-29.
|
| [11] |
HRISTOV A N, KEBREAB E, NIU M, et al. Symposium review:uncertainties in enteric methane inventories, measurement techniques, and prediction models[J]. Journal of Dairy Science, 2018, 101(7): 6655-6674. |
| [12] |
VAN GASTELEN S, VISKER M H P W, EDWARDS J E, et al. Linseed oil and, DGAT1 K232A polymorphism:effects on methane emission, energy and nitrogen metabolism, lactation performance, ruminal fermentation, and rumen microbial composition of Holstein-Friesian cows[J]. Journal of Dairy Science, 2017, 100(11): 8939-8957. |
| [13] |
GARDINER T D, COLEMAN M D, INNOCENTI F, et al. Determination of the absolute accuracy of UK chamber facilities used in measuring methane emissions from livestock[J]. Measurement, 2015, 66: 272-279. |
| [14] |
ZIMMERMAN P R.System for measuring metabolic gas emissions from animals: U.S.Patent 5265618[P].1993-11-30.
|
| [15] |
JOHNSON K, HUYLER M, WESTBERG H, et al. Measurement of methane emissions from ruminant livestock using a sulfur hexafluoride tracer technique[J]. Environmental Science & Technology, 1994, 28(2): 359-362. |
| [16] |
WILLIAMS S R O, MOATE P J, HANNAH M C, et al. Background matters with the SF6 tracer method for estimating enteric methane emissions from dairy cows:a critical evaluation of the SF6 procedure[J]. Animal Feed Science and Technology, 2011, 170(3/4): 265-276. |
| [17] |
LASSEY K R. On the importance of background sampling in applications of the SF6 tracer technique to determine ruminant methane emissions[J]. Animal Feedence & Technology, 2013, 180(1/2/3/4): 115-120. |
| [18] |
OH J, GIALLONGO F, FREDERICK T, et al. Comparison between the GreenFeed system and the sulfur hexafluoride tracer technique for measuring enteric methane emissions from dairy cows[J]. Journal of Dairy Science, 2015, 98(5): 601. |
| [19] |
BEAUCHEMIN K A, COATES T, FARR B, et al. Technical note:can the sulfur hexafluoride tracer gas technique be used to accurately measure enteric methane production from ruminally cannulated cattle?[J]. Journal of Animal Science, 2012, 90(8): 2727-2732. |
| [20] |
DEIGHTON M H, WILLIAMS S R O, LASSEY K R, et al. Temperature, but not submersion or orientation, influences the rate of sulphur hexafluoride release from permeation tubes used for estimation of ruminant methane emissions[J]. Animal Feed Science and Technology, 2014, 194: 71-80. |
| [21] |
DEIGHTON M H, WILLIAMS S R O, HANNAH M C, et al. A modified sulphur hexafluoride tracer technique enables accurate determination of enteric methane emissions from ruminants[J]. Animal Feed Science and Technology, 2014, 197: 47-63. |
| [22] |
BERENDS H, GERRITS W J J, FRANCE J, et al. Evaluation of the SF6 tracer technique for estimating methane emission rates with reference to dairy cows using a mechanistic model[J]. Journal of Theoretical Biology, 2014, 353: 1-8. |
| [23] |
ZIMMERMAN P R.Method and system for monitoring and reducing ruminant methane production: U.S.Patent 7966971[P].2011-06-28.
|
| [24] |
HUHTANEN P, CABEZAS-GARCIA E H, UTSUMI S, et al. Comparison of methods to determine methane emissions from dairy cows in farm conditions[J]. Journal of Dairy Science, 2015, 98(5): 3394-3409. |
| [25] |
DOREAU M, ARBRE M, ROCHETTE Y, et al. Comparison of 3 methods for estimating enteric methane and carbon dioxide emission in nonlactating cows[J]. Journal of Animal Science, 2018, 96(4): 1559-1569. |
| [26] |
HAMMOND K J, HUMPHRIES D J, CROMPTON L A, et al. Methane emissions from cattle:estimates from short-term measurements using a GreenFeed system compared with measurements obtained using respiration chambers or sulphur hexafluoride tracer[J]. Animal Feed Science and Technology, 2015, 203: 41-52. |
| [27] |
HAMMOND K J, JONES A K, HUMPHRIES D J, et al. Effects of diet forage source and neutral detergent fiber content on milk production of dairy cattle and methane emissions determined using GreenFeed and respiration chamber techniques[J]. Journal of Dairy Science, 2016, 99(10): 7904-7917. |
| [28] |
ARTHUR P F, BARCHIA I M, WEBER C, et al. Optimizing test procedures for estimating daily methane and carbon dioxide emissions in cattle using short-term breath measures[J]. Journal of Animal Science, 2017, 95(2): 645-656. |
| [29] |
HRISTOV A N, OH J, GIALLONGO F, et al. Short communication:comparison of the GreenFeed system with the sulfur hexafluoride tracer technique for measuring enteric methane emissions from dairy cows[J]. Journal of Dairy Science, 2016, 99(7): 5461-5465. |
| [30] |
WAGHORN G, GARNETT E J, PINARES-PATINO C S, et al.Implementation of GreenFeed in a dairy herd grazing pasture[C]//Advances in Animal Biosciences, Proceedings of the 5th Greenhouse Gases and Animal Agriculture Conference (GGAA2013).Dublin: Greenhouse Gasesand Animal Agriculture Conference, 2013, 4: 436.
|
| [31] |
GARNETT E J.Evaluation of the GreenFeed system for methane estimation from grazing dairy cows[D].Master's Thesis.Palmerston North, New Zealand: Massey University, 2012: 16-18.
|
| [32] |
DORICH C D, VARNER R K, PEREIRA A B D, et al. Short communication:use of a portable, automated, open-circuit gas quantification system and the sulfur hexafluoride tracer technique for measuring enteric methane emissions in Holstein cows fed ad libitum or restricted[J]. Journal of Dairy Science, 2015, 98(4): 2676-2681. |
| [33] |
MILLER J, SCHNEIDER D, HOLZWARTM, et al.Grazing behaviour of cattle in rangeland grazing system with or without access to a Green Feed emission monitor[C]//Abstracts of Invited Papers and Posters.Canberra: Recent Advance in Animal Nutrition Australia, 2015, 63-64.
|
| [34] |
MOATE P J, WILLIAMS, S R O, DEIGHTON M H, et al.Influence of rumen cannulation on feed intake, milk production, enteric methane production and composition of rumen headspace gas[C]//Advances in Animal Biosciences: Proceedings of the 5th Greenhouse Gases and Animal Agriculture Conference (GGAA2013).Dublin: Greenhouse Gasesand Animal Agriculture Conference, 2013, 4: 423.
|
| [35] |
MURRAY R M, BRYANT A M, LENG R A. Rates of production of methane in the rumen and large intestine of sheep[J]. British Journal of Nutrition, 1976, 36(1): 1-14. |
| [36] |
MUÑOZ C, YAN T, WILLS D A, et al. Comparison of the sulfur hexafluoride tracer and respiration chamber techniques for estimating methane emissions and correction for rectum methane output from dairy cows[J]. Journal of Dairy Science, 2012, 95(6): 3139-3148. |
| [37] |
MADSEN J, BJERG B S, HVELPLUND T, et al. Methane and carbon dioxide ratio in excreted air for quantification of the methane production from ruminants[J]. Livestock Science, 2010, 129(1/2/3): 223-227. |
| [38] |
周艳, 许贵善, 董利锋, 等. 不同饲养模式下饲粮非纤维性碳水化合物/中性洗涤纤维对生长期杜寒杂交母羊生长性能、营养物质表观消化率和甲烷产量的影响[J]. 动物营养学报, 2018, 30(4): 1367-1376. |
| [39] |
王贝, 许贵善, 李斌昌, 等. 饲粮NDF/NFC对泌乳后期奶牛瘤胃甲烷排放量、营养物质表观消化率及生产性能的影响[J]. 中国畜牧杂志, 2019, 55(11): 120-127. |
| [40] |
李斌昌, 董利锋, 王贝, 等. 日粮不同精粗比对9月龄后备奶牛甲烷排放与生长性能及营养物质消化率的影响[J]. 饲料工业, 2019, 40(11): 12-18. |




