近年来,养殖业中抗生素滥用所导致的病菌耐药性、药物残留和环境污染等问题严重影响人类和动物健康,饲料中全面禁止添加抗生素已是大势所趋。因此,寻找安全高效的饲用抗生素替代品已成为动物营养的研究热点。大量研究证实,乳酸菌制剂能够抑制肠道内有害细菌的生长与繁殖[1],提高肠道菌群多样性,改善消化道菌群结构[2-3],提高机体免疫功能[4]和动物的生长性能[5-6],是当前最受关注的新型饲料添加剂之一。本实验室从健康断奶北京黑猪粪便中筛选得到的1株乳酸菌,经鉴定为乳酸片球菌,其具有优良的耐酸、耐胆盐和抑菌等体外益生特性,能够提高哺乳母猪的繁殖性能和免疫功能[7],但该菌在生长猪中的应用效果尚不清楚。为此,本试验拟研究该乳酸片球菌对生长猪生长性能、粪便菌群、血清生化和免疫指标的影响,以期为乳酸菌制剂在生长猪生产中的应用提供理论和实践依据。
1 材料与方法 1.1 试验材料试验用乳酸片球菌分离于健康断奶仔猪粪便,其冻干制剂由北京市农林科学院畜牧兽医研究所动物营养研究室制备。
1.2 试验动物、基础饲粮与饲养管理选用140头平均体重为(23.21±0.84) kg的健康“长×大”二元杂交生长猪,按性别、体重一致的原则随机分成对照组和试验组,每组5个重复,每个重复14头。对照组饲喂基础饲粮,试验组在基础饲粮中添加乳酸片球菌冻干制剂(饲粮中乳酸片球菌终浓度为2.70×109 CFU/kg)。预试期为5 d,正试期为34 d。基础饲粮为参照NRC(2012)20~50 kg生长猪营养需要配制的粉状配合饲料,其组成及营养水平见表 1。试验按照猪场常规饲养管理程序进行,试验期间猪只自由采食、饮水,常规免疫。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
分别在试验开始和结束时对试验猪进行空腹称重,记录每天消耗饲粮情况,由此计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.4 粪便样品采集及指标测定 1.4.1 粪便采集试验结束当天早晨采集新鲜粪样,每个重复随机选择6头生长猪采集新鲜粪便,每3份混合成1个样品,即每个重复2个样品,每组10个样品,试验共计20个样品。每个样品再分成2份,一份分装于50 mL离心管中,置于冰盒内,用于粪便菌群数量的测定;另一份分装于EP管中,迅速置于干冰中,带回实验室后-80 ℃保存,用于粪便菌群多样性的测定。
1.4.2 粪便菌群数量分别采用改良MRS培养基、伊红美蓝培养基和Baird-Parker培养基培养猪粪便中乳酸菌、大肠杆菌和金黄色葡萄球菌,并计数菌群数量。菌群数量以每克粪便中所含细菌群落总数的对数[lg(CFU/g)]表示。
1.4.3 粪便菌群多样性采用粪便基因组DNA提取试剂盒提取粪便总DNA,纯化后检测浓度和纯度。以粪便总DNA为模板,PCR扩增细菌16S rRNA V3~V4区。上、下游引物采用细菌通用引物:338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。扩增体系为:5×FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,5 μmol/L上、下游引物各0.8 μL,FastPfu Polymerase 0.4 μL,DNA模板10 ng,补ddH2O至20 μL。PCR反应参数为:95 ℃ 3 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,27个循环,72 ℃ 10 min。每个样品3个重复,将同一样品的PCR产物混合后进行2%琼脂糖凝胶电泳检测,切胶回收,并进行Illumina Miseq PE300测序。通过barcode区分样品序列,将各样品序列进行质量控制过滤后,进行alpha多样性及菌群组成分析。alpha多样性指数包括丰富度指数(Chao1指数、ACE指数)、多样性指数(Simpson指数、Shannon指数)和覆盖率(Coverage指数)。采用RDP classifier贝叶斯算法对97%相似水平的操作分类单元(OTU)进行分类学分析,在各个水平上对每个样品的菌群组成进行统计。
1.5 血清生化和免疫指标的测定试验结束时,每个重复随机选择2头生长猪,前腔静脉采血5 mL,3 000 r/min离心10 min,分离血清后-20 ℃保存备用。采用日立7020自动生化分析仪测定血清中总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、尿素氮(UN)含量与谷丙转氨酶(ALT)、谷草转氨酶(AST)活性,上述指标测定所用试剂盒为南京建成生物工程研究所产品;采用酶联免疫吸附测定(ELISA)法测定免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)(试剂盒为美国Bethyl公司产品)和结合珠蛋白(HP)含量(试剂盒为美国ADI公司产品)。
1.6 数据处理与分析数据经Excel 2016初步处理后,采用SPSS 19.0软件中的独立样本t检验方法进行分析,以P < 0.05作为差异显著标准,试验结果用平均值±标准误表示。
2 结果与分析 2.1 乳酸片球菌对生长猪生长性能的影响由表 2可知,与对照组相比,试验组生长猪的平均日增重提高了5.64%(P < 0.05),料重比降低了4.62%(P < 0.05)。2组间的始重、末重和平均日采食量差异不显著(P>0.05)。
|
|
表 2 乳酸片球菌对生长猪生长性能的影响 Table 2 Effects of Pediococcus acidilactici on growth performance of growing pigs |
由表 3可知,与对照组相比,试验组生长猪粪便中乳酸菌数量显著提高(P < 0.05),大肠杆菌和金黄色葡萄球菌数量显著降低(P < 0.05)。
|
|
表 3 乳酸片球菌对生长猪粪便菌群数量的影响 Table 3 Effects of Pediococcus acidilactici on fecal microbiota number of growing pigs |
由表 4可知,与对照组相比,试验组生长猪粪便菌群的Shannon指数、ACE指数和Chao1指数显著增加(P < 0.05),说明乳酸片球菌能够增加生长猪粪便菌群的物种丰富度和多样性。另外,生长猪粪便菌群的Coverage指数均在0.99以上,说明测序质量极高,基本上覆盖了绝大多数所测样品的菌群情况。
|
|
表 4 生长猪粪便菌群的alpha多样性指标 Table 4 Alpha diversity indexes of fecal microbiota of growing pigs |
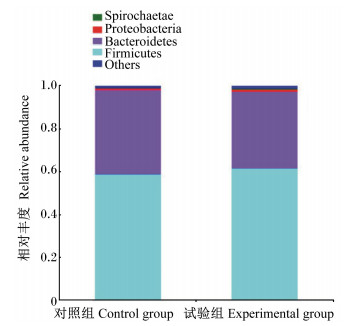
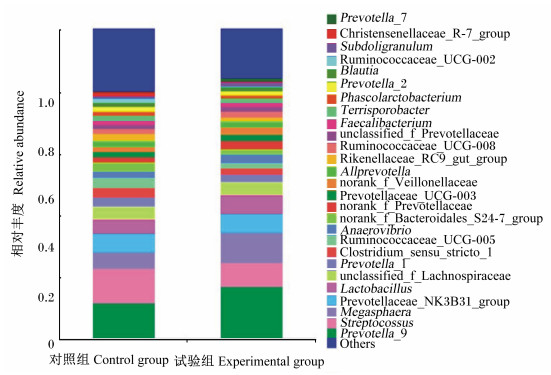
根据物种注释结果,试验组和对照组生长猪粪便菌群在门、属分类水平上的相对丰度分别见图 1和图 2。在门分类水平上,2组粪样中总共有17个菌门,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是优势菌门,其中Firmicutes占60.39%,Bacteroidetes占37.56%;其次是变形菌门(Proteobacteria)和螺旋体门(Spirochaetae)等,它们的总占比为1.23%。与对照组相比,试验组Firmicutes的相对丰度增加(59.26% vs. 61.52%),而Bacteroidetes的相对丰度降低(39.11% vs. 36.01%)。在属分类水平上,2组粪样中总共有205个菌属,对照组和试验组分别有188和202个菌属;对照组和试验组中相对丰度大于1%的菌属各有25个,它们相对丰度总和分别为78.84%和83.42%。试验组相对丰度较高的菌属有普雷沃菌属9(Prevotella_9,16.85%)、巨球菌属(Megasphaera,9.98%)、链球菌属(Streptocossus,7.57%)、乳酸杆菌属(Lactobacillus,6.18%)、普雷沃菌科NK3B31群(Prevotellaceae_NK3B31_group,5.89%)和未分类毛螺菌科(unclassified_f_Lachnospiraceae,4.16%)等,而对照组相对丰度较高的菌属有Prevotella_9(11.49%)、Streptocossus(11.30%)、Prevotellaceae_NK3B31_group(6.01%)、Megasphaera(5.22%)、Lactobacillus(4.39%)和unclassified_f_Lachnospiraceae(4.37%)等。此外,试验组和对照组中均有几个独有菌属,但相对丰度都较低。
|
Others:其他;Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Proteobacteria:变形菌门;Spirochaetae:螺旋体门。 图 1 门水平上粪便菌群相对丰度 Fig. 1 Relative abundance of fecal microbiota at phylum level |
|
Others:其他;Prevotella_9:普雷沃菌属9;Streptocossus:链球菌属;Megasphaera:巨球菌属;Prevotellaceae_NK3B31_group:普雷沃菌科NK3B31群;Lactobacillus:乳酸杆菌属;unclassified_f_Lachnospiraceae:未定义毛螺菌科;Prevotella_1:普雷沃菌属1;Clostridium_sensu_stricto_1:狭义梭菌属1;Ruminococcaceae_UCG-005:瘤胃菌科UCG-005;Anaerovibrio:厌氧弧菌属;norank_f_Bacteroidales_S24-7_group:未分类拟杆菌门S24-7群;norank_f_Prevotellaceae:未分类普雷沃菌科;Prevotellaceae_UCG-003:普雷沃菌科UCG-003;norank_f_Veillonellaceae:未分类韦荣氏菌科;Allprevotella:拟普雷沃菌属;Rikenellaceae_RC9_gut_group:理研菌科RC9群;Ruminococcaceae_UCG-008:瘤胃菌科UCG-008;unclassified_f_Prevotellaceae:未定义普雷沃菌科;Faecalibacterium:粪杆菌属;Terrisporobacter:土孢杆菌属;Phascolarctobacterium:考拉杆菌属;Prevotella_2:普雷沃菌属2;Blautia:布劳特氏菌属;Ruminococcaceae_UCG-002:瘤胃菌科UCG-002;Subdoligranulum:罕见小球菌属;Christensenellaceae_R-7_group:克里斯滕森菌科R-7群;Prevotella_7:普雷沃菌属7。 图 2 属水平上粪便菌群相对丰度 Fig. 2 Relative abundance of fecal microbiota at genus level |
由表 5可知,与对照组相比,试验组生长猪血清中TP、GLB、IgG和IgA含量分别提高了13.45%(P < 0.05)、14.91%(P < 0.05)、20.91%(P < 0.05)和44.00%(P < 0.05),血清UN、HP含量分别降低了19.46%(P < 0.05)和38.71%(P < 0.05)。2组间血清中ALB、IgM含量与ALT、AST活性的差异不显著(P>0.05)。
|
|
表 5 乳酸片球菌对生长猪血清生化和免疫指标的影响 Table 5 Effects of Pediococcus acidilactici on serum biochemical and immune indexes of growing pigs |
前人研究表明,乳酸菌能够降低动物消化道pH[8],促进肠道发育[9],调控肠道菌群平衡[10],提高肠道内消化酶活性[11],从而促进畜禽对饲粮营养物质的消化吸收及健康状况的改善。目前有关乳酸菌在断奶仔猪中的应用研究较多,而在生长猪阶段的应用研究相对较少。李雪莉[12]研究发现,在生长猪饲粮中添加2.0×108 CFU/kg的植物乳杆菌显著提高了猪群的平均日增重和平均日采食量,显著降低了料重比。张董燕等[13]在生长猪饲粮中添加5.5×109 CFU/kg的卷曲乳杆菌显著提高了生长猪的试验末重和平均日增重,显著降低了料重比。本试验结果显示,在饲粮中添加2.70×109 CFU/kg的乳酸片球菌显著改善了生长猪的平均日增重和料重比,与上述研究结果基本一致,说明乳酸片球菌对生长猪的生长性能具有改善作用。
3.2 乳酸片球菌对生长猪粪便菌群数量的影响外源乳酸菌进入动物肠道后可在肠壁定植并产生乳酸、乙酸等有机酸,能够抑制大肠杆菌等有害菌的生长,促进乳酸菌等有益菌的增殖[14-15],进而改善肠道微生态环境。刘公言等[16]在断奶仔猪饲粮中添加乳酸片球菌后,肠道中乳酸菌的数量显著增加,大肠杆菌的数量显著降低。Cai等[17]研究表明,发酵乳杆菌可以显著提高仔猪粪便中乳酸菌的数量,显著降低大肠杆菌的数量。本试验中,生长猪饲喂乳酸片球菌后,粪便中乳酸菌的数量显著提高,大肠杆菌和金黄色葡萄球菌的数量显著降低,说明乳酸片球菌在改善生长猪的肠道健康方面具有积极作用。
3.3 乳酸片球菌对生长猪粪便菌群多样性和组成的影响肠道菌群对宿主肠道结构功能、物质消化吸收、物质代谢、肠道免疫调节等具有重要影响[18]。粪便菌群变化可反映肠道菌群的状态,本研究通过Illumina高通量测序技术对生长猪粪便菌群进行测序、分析,可以更全面了解乳酸片球菌对肠道菌群的影响。Chao1指数和ACE指数主要用来反映群落丰富度,二者值越大说明物种丰富度越高,Simpson指数和Shannon指数用来反映群落多样性,Simpson指数值越小、Shannon指数值越大,说明群落多样性越高,个体分配越均匀。研究认为,肠道菌群越丰富、分配越均匀,菌种之间相互依赖和制约的能力就越强[19],肠道菌群更平衡,更益于动物的整体健康和生产力的提高[20-21]。本试验结果显示,乳酸片球菌显著增加了生长猪粪便菌群的Shannon指数、ACE指数和Chao1指数,这与Zhang等[2]、王四新等[22]的研究结果一致,说明该菌株能够提高生长猪肠道菌群的物种丰富度和多样性,有利于肠道菌群稳定和猪群生长性能的提高。
本试验中,在菌群组成方面,在门水平上,生长猪粪便菌群中Firmicutes和Bacteroidetes是优势菌门,这与诸多猪粪便和肠道中菌群组成的研究结果[23-24]一致。研究表明,Firmicutes和Bacteroidetes主要参与饲粮中碳水化合物代谢,具有降解多糖和促进机体能量吸收的作用[25-26]。Firmicutes丰度的增加被认为对机体增重和健康有益[27],而Bacteroidetes丰度的降低可能代表机体感染病原的风险得到了降低[28]。本试验中,饲喂乳酸片球菌的生长猪粪便中Firmicutes的相对丰度增加、Bacteroidetes的相对丰度减少,表明乳酸片球菌有利于生长猪肠道对植物碳水化合物的消化利用及机体健康。进一步在属水平分析发现,乳酸片球菌增加了生长猪粪便菌群中普雷沃菌属(Prevotella)、Megasphaera和Lactobacillus的相对丰度,降低了Streptocossus的相对丰度。研究表明,Prevotella是猪肠道中丰度最高的属,并且是一类重要的挥发性脂肪酸产生菌[29-30],较高丰度的Prevotella有益于仔猪的健康生长[31]。Megasphaera和Lactobacillus是肠道内的有益菌,可以产生乳酸和丙酸、丁酸等挥发性脂肪酸,能够提高机体对营养物质的吸收和抑制有害菌数量的增加[32]。由此可见,乳酸片球菌能够促进生长猪肠道内有益菌以及产酸菌的增殖,有益于肠道微生态环境的改善和对营养物质的消化吸收,这可能也是本研究中生长猪生长性能、粪便菌群数量等指标得以改善的原因之一。
3.4 乳酸片球菌对生长猪血清生化和免疫指标的影响动物的血清生化指标可在一定程度上反映动物的机体代谢、营养状况及疾病等状况,从而间接反映动物的生长性能。血清TP由ALB和GLB组成,可以反映动物机体蛋白质代谢水平[33]。本试验发现,饲粮中添加乳酸片球菌可以提高生长猪血清中TP、GLB含量,表明机体的蛋白质代谢有所增强,其原因可能是乳酸片球菌进入机体后会产生有益的代谢产物,能够激活酸性蛋白酶的活性,促进蛋白质的消化吸收。血清UN是动物体内蛋白质、氨基酸代谢的终产物,可以较准确地反映动物体内蛋白质代谢和氨基酸之间的平衡状况。本试验中,乳酸片球菌显著降低了血清中UN含量,表明乳酸片球菌可以促进生长猪的蛋白质合成,增加机体氮沉积,从而促进动物生长。HP是存在于血清中的一种急性期蛋白,当机体处在应激状态时,其含量明显增多[34]。本试验中,乳酸片球菌显著降低了生长猪血清中HP含量,说明乳酸片球菌在减少动物应激、促进动物健康方面具有积极作用。
血清中的免疫球蛋白直接参与动物机体的体液免疫反应,是反映机体免疫状况的重要指标[35]。Szabó等[36]、Dong等[37]的研究均表明,饲粮中添加乳酸菌制剂能够显著提高仔猪血清中IgM和IgA含量。本试验结果显示,乳酸片球菌显著提高了生长猪血清中IgG和IgA含量,表明乳酸片球菌能够提高生长猪的免疫功能和健康水平,其原因可能是,乳酸菌在肠道内繁殖与代谢,通过调整肠道菌群组成和刺激肠道黏膜免疫系统,增强机体的免疫力[38-39]。
4 结论本试验条件下,在生长猪饲粮中添加乳酸片球菌(添加剂量为2.70×109 CFU/kg)能够改善生长猪的肠道菌群组成,增强机体免疫功能,进而提高生长性能。
| [1] |
DOWARAH R, VERMA A K, AGARWAL N, et al. Effect of swine based probiotic on performance, diarrhoea scores, intestinal microbiota and gut health of grower-finisher crossbred pigs[J]. Livestock Science, 2017, 195: 74-79. DOI:10.1016/j.livsci.2016.11.006 |
| [2] |
ZHANG D Y, JI H F, LIU H, et al. Changes in the diversity and composition of gut microbiota of weaned piglets after oral administration of Lactobacillus or an antibiotic[J]. Applied Microbiology and Biotechnology, 2016, 100(23): 10081-10093. DOI:10.1007/s00253-016-7845-5 |
| [3] |
PLUSKE J R. Feed- and feed additives-related aspects of gut health and development in weanling pigs[J]. Journal of Animal Science and Biotechnology, 2013, 4: 1. DOI:10.1186/2049-1891-4-1 |
| [4] |
王志林. 复合乳杆菌制剂对仔猪生产性能和免疫功能的影响[J]. 广东饲料, 2016, 25(5): 51. |
| [5] |
GIANG H H, VIET T Q, OGLE B, et al. Growth performance, digestibility, gut environment and health status in weaned piglets fed a diet supplemented with potentially probiotic complexes of lactic acid bacteria[J]. Livestock Science, 2010, 129(1/2/3): 95-103. |
| [6] |
王志祥, 乔家运, 王自恒, 等. 乳酸杆菌对断奶仔猪生长性能、养分表观消化率和消化酶活性的影响[J]. 西北农林科技大学学报, 2006, 34(4): 23-27. DOI:10.3321/j.issn:1671-9387.2006.04.006 |
| [7] |
LIU H, WANG S X, ZHANG D Y, et al. Effects of dietary supplementation with Pediococcus acidilactici ZPA017 on reproductive performance, fecal microbial flora and serum indices in sows during late gestation and lactation[J]. Asian-Australasian Journal of Animal Sciences, 2020, 33(1): 120-126. DOI:10.5713/ajas.18.0764 |
| [8] |
CANIBE N, JENSEN B B. Fermented and nonfermented liquid feed to growing pigs:effect on aspects of gastrointestinal ecology and growth performance[J]. Journal of Animal Science, 2003, 81(8): 2019-2031. DOI:10.2527/2003.8182019x |
| [9] |
QIAO J Y, LI H H, WANG Z X, et al. Effects of Lactobacillus acidophilus dietary supplementation on the performance, intestinal barrier function, rectal microflora and serum immune function in weaned piglets challenged with Escherichia coli lipopolysaccharide[J]. Antonie van Leeuwenhoek, 2015, 107(4): 883-891. DOI:10.1007/s10482-015-0380-z |
| [10] |
LOH T C, VAN THU T, FOO H L, et al. Effects of different levels of metabolite combination produced by Lactobacillus plantarum on growth performance, diarrhoea, gut environment and digestibility of postweaning piglets[J]. Journal of Applied Animal Research, 2013, 41(2): 200-207. DOI:10.1080/09712119.2012.741046 |
| [11] |
COLLINGTON G K, PARKER D S, ARMSTRONG D G. The influence of inclusion of either an antibiotic or a probiotic in the diet on the development of digestive enzyme activity in the pig[J]. British Journal of Nutrition, 1990, 64(1): 59-70. DOI:10.1079/BJN19900009 |
| [12] |
李雪莉.植物乳杆菌制剂对断奶仔猪生长性能和肠道微生态的影响及猪源乳酸菌的分离与鉴定[D].硕士学位论文.南京: 南京农业大学, 2017. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=1019150561.nh
|
| [13] |
张董燕, 季海峰, 刘辉, 等. 卷曲乳杆菌对生长猪生长性能、粪便菌群和短链脂肪酸组成以及血清长链脂肪酸组成的影响[J]. 动物营养学报, 2019, 31(4): 1564-1573. |
| [14] |
AFRC R F. Probiotics in man and animals[J]. Journal of Applied Bacteriology, 1989, 66(5): 365-378. DOI:10.1111/j.1365-2672.1989.tb05105.x |
| [15] |
ROSELLI M, FINAMORE A, BRITTI M S, et al. Alternatives to in-feed antibiotics in pigs:evaluation of probiotics, zinc or organic acids as protective agents for the intestinal mucosa.A comparison of in vitro and in vivo results[J]. Animal Reasearch, 2005, 54(3): 203-218. |
| [16] |
刘公言, 孙海涛, 刘策, 等. 乳酸片球菌对断奶仔猪生长性能及肠道微生物的影响[J]. 山东农业科学, 2020, 52(1): 131-135. |
| [17] |
CAI C J, CAI P P, HOU C L, et al. Administration of Lactobacillus fermentum I5007 to young piglets improved their health and growth[J]. Journal of Animal and Feed Sciences, 2014, 23(3): 222-227. DOI:10.22358/jafs/65684/2014 |
| [18] |
DELZENNE N M, CANI P D. Interaction between obesity and the gut microbiota:relevance in nutrition[J]. Annual Review of Nutrition, 2011, 31(1): 15-31. DOI:10.1146/annurev-nutr-072610-145146 |
| [19] |
MCCANN K S. The diversity-stability debate[J]. Nature, 2000, 405(6783): 228-233. DOI:10.1038/35012234 |
| [20] |
LU X M, LU P Z, ZHANG H. Bacterial communities in manures of piglets and adult pigs bred with different feeds revealed by 16S rDNA 454 pyrosequencing[J]. Applied Microbiology and Biotechnology, 2014, 98(6): 2657-2665. DOI:10.1007/s00253-013-5211-4 |
| [21] |
HILDEBRAND F, NGUYEN T L A, BRINKMAN B, et al. Inflammation-associated enterotypes, host genotype, cage and inter-individual effects drive gut microbiota variation in common laboratory mice[J]. Genome Biology, 2013, 14: R4. DOI:10.1186/gb-2013-14-1-r4 |
| [22] |
王四新, 季海峰, 石国华, 等. 干酪乳杆菌对北京黑猪保育阶段生长性能及肠道菌群的影响[J]. 动物营养学报, 2018, 30(1): 326-335. DOI:10.3969/j.issn.1006-267x.2018.01.039 |
| [23] |
ZHAO W J, WANF Y P, LIU S Y, et al. The dynamic distribution of porcine microbiota across different ages and gastrointestinal tract segments[J]. PLoS One, 2015, 10(2): e0117441. DOI:10.1371/journal.pone.0117441 |
| [24] |
PARK S J, KIM J, LEE J S, et al. Characterization of the fecal microbiome in different swine groups by high-throughput sequencing[J]. Anaerobe, 2014, 28: 157-162. DOI:10.1016/j.anaerobe.2014.06.002 |
| [25] |
LAMENDELLA R, DOMINGO J W S, GHOSH S, et al. Comparative fecal metagenomics unveils unique functional capacity of the swine gut[J]. BMC Microbiology, 2011, 11: 103. DOI:10.1186/1471-2180-11-103 |
| [26] |
VAN DER MEULEN R, MAKRAS L, VERBRUGGHE K, et al. In vitro kinetic analysis of oligofructose consumption by Bacteroides and Bifidobacterium spp. indicates different degradation mechanisms[J]. Applied and Environmental Microbiology, 2006, 72(2): 1006-1012. DOI:10.1128/AEM.72.2.1006-1012.2006 |
| [27] |
TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [28] |
FALAGAS M E, SIAKAVELLAS E. Bacteroides, Prevotella, and Porphyromonas species:a review of antibiotic resistance and therapeutic options[J]. International Journal of Antimicrobial Agents, 2000, 15(1): 1-9. DOI:10.1016/S0924-8579(99)00164-8 |
| [29] |
HU J, NIE Y F, CHEN J W, et al. Gradual changes of gut microbiota in weaned miniature piglets[J]. Frontiers in Microbiology, 2016, 7: 1727. |
| [30] |
SHAN H N, COLLINS D M. Prevotella, a new genus to include Bacteroides melaninogenicus and related species formerly classified in the genus Bacteroides[J]. International Journal of Systematic Bacteriology, 1990, 40(2): 205-208. DOI:10.1099/00207713-40-2-205 |
| [31] |
FUKUDA S, TOH H, HASE K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate[J]. Nature, 2011, 469(7331): 543-547. DOI:10.1038/nature09646 |
| [32] |
LOUIS P, HOLD G L, FLINT H J. The gut microbiota, bacterial metabolites and colorectal cancer[J]. Nature Reviews Microbiology, 2014, 12(10): 661-672. DOI:10.1038/nrmicro3344 |
| [33] |
MENG Q W, YAN L, AO X, et al. Influence of probiotics in different energy and nutrient density diets on growth performance, nutrient digestibility, meat quality, and blood characteristics in growing-finishing pigs[J]. Journal of Animal Science, 2010, 88(10): 3320-3326. DOI:10.2527/jas.2009-2308 |
| [34] |
PETERSEN H H, NIELSEN J P, HEEGAARD P M. Application of acute phase protein measurements in veterinary clinical chemistry[J]. Veterinarian Research, 2004, 35(2): 163-187. |
| [35] |
AI W Q, YUE Y, XIONG S D, et al. Enhanced protection against pulmonary mycobacterial challenge by chitosan-formulated polyepitope gene vaccine is associated with increased pulmonary secretory IgA and gamma-interferon+T cell responses[J]. Microbiology and Immunology, 2013, 57(3): 224-235. DOI:10.1111/1348-0421.12027 |
| [36] |
SZABÓ I, WIELER L H, TEDIN K, et al. Influence of a probiotic strain of Enterococcus faecium on Salmonella enterica serovar Typhimurium DT104 infection in a porcine animal infection model[J]. Applied and Environmental Microbiology, 2009, 75(8): 2621-2628. |
| [37] |
DONG X L, ZHANG N F, ZHOU M, et al. Effects of dietary probiotics on growth performance, faecal microbiota and serum profiles in weaned piglets[J]. Animal Production Science, 2013, 54(5): 616-621. |
| [38] |
SÁNCHEZ B, GUEIMONDE M, PEÑA A S, et al. Intestinal microbiota as modulators of the immune system[J]. Journal of Immunology Research, 2015, 2015: 159094. |
| [39] |
GILL H S. Stimulation of the immune system by lactic cultures[J]. International Dairy Journal, 1998, 8(5/6): 535-544. |




