2. 广东华红饲料科技有限公司, 肇庆 526060;
3. 北京君德同创农牧科技股份有限公司, 北京 100089
2. Guangdong Huahong Feed Technology Co., Ltd., Zhaoqing 526060, China;
3. Beijing Jundetongchuang Agriculture and Animal Husbandry Technology Co., Ltd., Beijing 100089, China
胍基乙酸主要是由L-精氨酸和甘氨酸在肾脏中通过脒基转移酶催化合成,是脊椎动物内源合成肌酸的唯一前体物,其最重要的生理功能就是在肝脏中通过甲基化的形式合成肌酸;而肌酸作用的磷酸原供能系统可快速为机体供能,在动物生长及能量代谢中发挥重要作用[1-4]。肌酸主要来源于动物性蛋白质饲料原料,而植物性蛋白质原料中缺乏肌酸。近年来鱼粉价格的不断上涨限制了其在生产中的大量使用,且如今植物性蛋白质原料的过度使用加上动物内源合成肌酸不足的现状更是增加了动物对肌酸的需求,但在生产实践中通过饲料直接添加肌酸的效果并不理想。有研究报道,与直接添加肌酸相比,饲粮添加胍基乙酸其稳定性更好、成本更低,且在动物肝脏和肌肉组织中转化效率更高,因此,在植物性蛋白质饲料中通过直接添加胍基乙酸来补充肌酸可取得更好的效果[5-7]。目前对胍基乙酸在养猪生产中的研究主要集中在提高生产性能[7-13]和抗氧化能力[10, 12]、改善胴体及肉品质[7-11, 13-14]、提高能量转化效率[10, 14-15]等方面,尚未见其对肠道功能影响的研究。
为提高生产效率,早期断奶在集约化养猪模式中普遍推广应用,也给断奶仔猪的生长造成一系列的严重影响。仔猪断奶后饲料的过早摄入导致仔猪肠道的形态和功能发生变化、肠道屏障受损、通透性增加,病原微生物和内毒素增多,从而引起采食量下降、消化不良、腹泻和生长缓慢等一系列“仔猪早期断奶综合征”[16-17],极大地影响其后期生长。因此,本文通过探究在无动物性蛋白质饲粮中添加胍基乙酸对断奶仔猪生长性能和肠道屏障的影响及其机理,为胍基乙酸作为饲料添加剂进一步在动物生产中的推广应用提供理论依据。
1 材料与方法 1.1 试验材料本试验所用胍基乙酸由北京某农牧科技股份有限公司提供,分子式为C3H7N3O2,有效成分含量>98.5%(以干物质计)。
1.2 试验设计及饲养管理试验选取42日龄“杜×长×大”三元杂交断奶仔猪204头(28日龄断奶),随机分为3组(每个组4个重复,每个重复17头):第1组为对照组,饲喂不含有胍基乙酸的基础饲粮(含有3%秘鲁进口鱼粉的动物性蛋白质原料);第2组为无动物性蛋白质组(采用3%的去皮豆粕替代基础饲粮中3%的鱼粉,作为参照组,以减少饲粮中蛋白质源饲料原料变动引起的误差);第3组为胍基乙酸组(采用3%的去皮豆粕+600 mg/kg胍基乙酸替代基础饲粮中3%的鱼粉)。各组饲粮调整后营养水平和限制性氨基酸含量均相同。基础饲粮采用玉米-豆粕型饲粮,参照NRC(2012)6~20 kg猪营养需要量进行配制。基础饲粮组成及营养水平见表 1。仔猪分组饲养在保育舍中,按照试验场的常规生产管理制度进行管理,采用颗粒料进行饲喂,每日饲喂4次,仔猪自由采食,保证充足饮水。试验期为28 d。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验前分组称重,试验结束后称重,记录其日采食量以及死淘数,用于生长性能和健康状况的评价。计算平均日增重、平均日采食量、料重比和死淘率。
1.3.2 血清相关指标及内毒素试验结束称重后,每组屠宰8头猪(空腹12 h),心脏采血、静置,2 500 r/min离心15 min,取上清液于-20 ℃冰箱保存。血清总蛋白、白蛋白、尿素氮、甘油三酯、胆固醇、葡萄糖含量采用南京建成生物工程研究所的相应检验试剂盒测定,血清内毒素含量采用酶联免疫吸附试验(ELISA)试剂盒测定,血清游离胰岛素样生长因子-Ⅰ(free insulin-like grpwthfactor-Ⅰ,fIGF-Ⅰ)、胰岛素(insulin,INS)、三碘甲状腺原氨酸(T3)和四碘甲状腺原氨酸(T4)含量采用放射免疫试剂盒测定。
1.3.3 组织及杯状细胞观察试验猪屠宰后剖出肠道,结扎,分离出十二指肠、空肠、回肠,分别在各肠段从头向后采集15 cm作为样品;从样品中剪取2~3 cm,放入4%的多聚甲醛中固定24 h,石蜡包埋,厚度4~7 nm切片,展片,置于载玻片上烘干,然后过2道二甲苯各15 min,分别进行苏木精-伊红(HE)染色和过碘酸-希夫(PAS)染色,最后擦净载玻片后中性树脂封片晾干,拍照,计算绒毛高度、隐窝深度、绒毛高度/隐窝深度(V/C)值和杯状细胞数量。
1.3.4 Western blot法检测肠道紧密连接蛋白的表达取肠道组织匀浆后离心吸取上清液,采用二喹啉甲酸(BCA)法检测蛋白含量,99 ℃变性10 min进行凝胶电泳,用封闭液封闭2 h,于4 ℃孵育抗体过夜,再用TBST洗涤后孵二抗2 h,结束后用TBST溶液再洗涤,于发光液放1 min后在凝胶成像系统扫描。
1.3.5 实时荧光定量PCR法检测炎性因子根据Magen公司组织样品中总RNA提取试剂盒上的步骤提取肠道组织RNA,于-80 ℃保存。用超微量核酸蛋白检测仪检测RNA的质量,反转录合成cDNA,用Primer 5.0软件设计并通过上海生工生物工程科技有限公司合成目的基因,引物序列见表 2,内参基因选用β-肌动蛋白(β-actin)。根据公式2-ΔCt=2-(Ct目的基因-Ct内参基因)计算出目的基因的mRNA表达量。
|
|
表 2 引物序列 Table 2 Primer sequences |
本试验数据采用SPSS 18.0统计软件进行独立样本t检验统计分析,分析结果以“平均值±标准误(mean±SE)”的形式表示,取P < 0.05表示差异显著,P < 0.01表示差异极显著,P≥0.05表示差异不显著。
2 结果与分析 2.1 胍基乙酸对断奶仔猪生长性能的影响由表 3可知,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸(即胍基乙酸组)显著提高了断奶仔猪的末重(P < 0.05),极显著提高了断奶仔猪平均日增重(P < 0.01),显著降低料重比(P < 0.05),且断奶仔猪的死淘率无显著差异(P≥0.05)。与对照组相比,采用3%的去皮豆粕替代3%的鱼粉(即无动物性蛋白质组),断奶仔猪的死淘率增加33.33%(P≥0.05),而在此基础上添加适量的胍基乙酸后死淘率降低至与对照组同一水平。
|
|
表 3 胍基乙酸对断奶仔猪生长性能的影响 Table 3 Effects of guanidineacetic acid on growth performance of weaned piglets |
由表 4可知,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸显著提高断奶仔猪血清中总蛋白和球蛋白的含量(P < 0.05),对血清中白蛋白和尿素氮的含量均无显著影响(P≥0.05)。与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸对断奶仔猪血清中甘油三酯、胆固醇和葡萄糖的含量均无显著影响(P≥0.05),且对血清中fIGF-Ⅰ、T3、T4和INS的含量均无显著影响(P≥0.05)。与无动物性蛋白质组相比,胍基乙酸组断奶仔猪血清中除T4含量显著降低外(P < 0.05),其他指标无显著差异(P≥0.05)。
|
|
表 4 胍基乙酸对断奶仔血清中相关生化代谢指标和激素指标的影响 Table 4 Effects of guanidineacetic acid on serum related biochemical, metabolic indicators and hormone indicators of weaned piglets |
由表 5可知,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸除了显著降低断奶仔猪空肠绒毛高度(P < 0.05)外,对空肠隐窝深度和V/C值以及对十二指肠、回肠的绒毛高度、隐窝深度和V/C值均无显著差异(P≥0.05)。与无动物性蛋白质组相比,胍基乙酸组断奶仔猪十二指肠隐窝深度极显著增加(P < 0.01),V/C值极显著降低(P < 0.01);空肠绒毛高度极显著降低(P < 0.01),其他指标均无显著差异(P≥0.05)。
|
|
表 5 胍基乙酸对断奶仔猪肠道发育的影响 Table 5 Effects of guanidineacetic acid intestine development of weaned piglets |
由表 6可知,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸极显著增加断奶仔猪空肠和回肠的杯状细胞数量(P < 0.01),对十二指肠杯状细胞数量无显著差异(P≥0.05);与无动物性蛋白质组相比,胍基乙酸组断奶仔猪各肠断的杯状细胞数量无显著差异(P≥0.05)。
|
|
表 6 胍基乙酸对断奶仔猪肠道绒毛杯状细胞数量的影响 Table 6 Effects of guanidineacetic acid on the number of goblet cells in intestinal villi of weaned piglets |
如图 1所示,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸极显著增加断奶仔猪十二指肠和回肠封闭蛋白(occludin)的表达量(P < 0.01),显著增加十二指肠闭合蛋白-1(claudin-1)的表达量(P < 0.05)。与无动物性蛋白质组相比,在无动物性蛋白质饲粮中添加胍基乙酸极显著增加断奶仔猪回肠occludin的表达量(P < 0.01),显著增加十二指肠occludin和空肠claudin-1的表达量(P < 0.05)。同时,如图 2所示,与其他2组相比,在无动物性蛋白质饲粮中添加胍基乙酸显著降低了断奶仔猪血清中内毒素的含量(P < 0.05)。
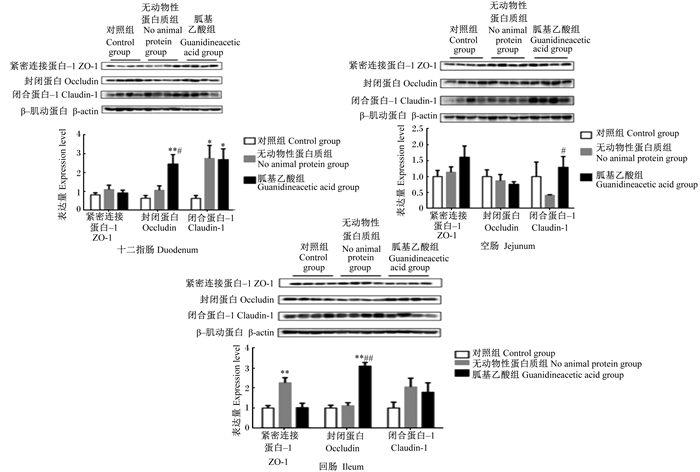
|
*和**分别表示无动物性蛋白质组和胍基乙酸组与对照组相比差异显著(P < 0.05)和极显著(P < 0.01),#和##分别表示胍基乙酸组与无动物性蛋白质组相比差异显著(P < 0.05)和极显著(P < 0.01)。下图同。 * and ** mean there was significant (P < 0.05) and extremely significant (P < 0.01) difference in no animal protein group and guanidineacetic acid group compared with the control group, # and ## mean there was significant (P < 0.05) and extremely significant (P < 0.01) difference between guanidineacetic acid group and no animal protein group, respectively. The same as below. 图 1 胍基乙酸对断奶仔猪肠道紧密连接蛋白表达的影响 Fig. 1 Effects of guanidineacetic acid on intestinal tight junction protein expression of weaned piglets |
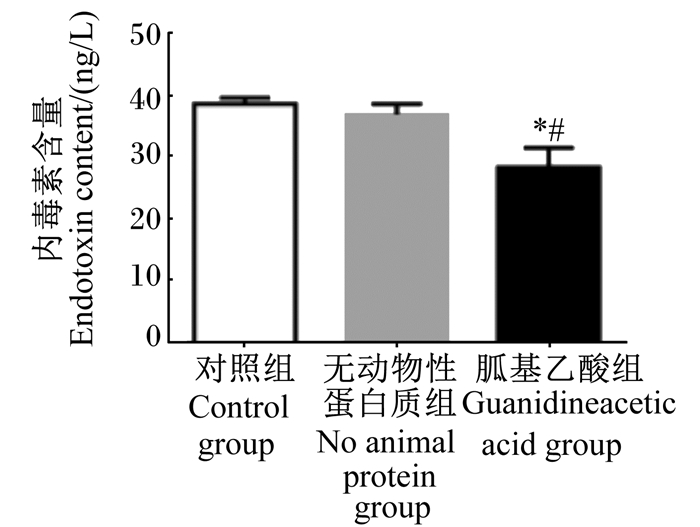
|
图 2 胍基乙酸对断奶仔猪血清内毒素含量的影响 Fig. 2 Effects of guanidineacetic acid on serum endotoxin content of weaned piglets |
如图 3所示,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸对断奶仔猪回肠促炎因子[肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)]的mRNA表达量无显著影响(P≥0.05),但能显著提高抗炎因子白细胞介素-10(IL-10)的mRNA表达量(P < 0.05)。
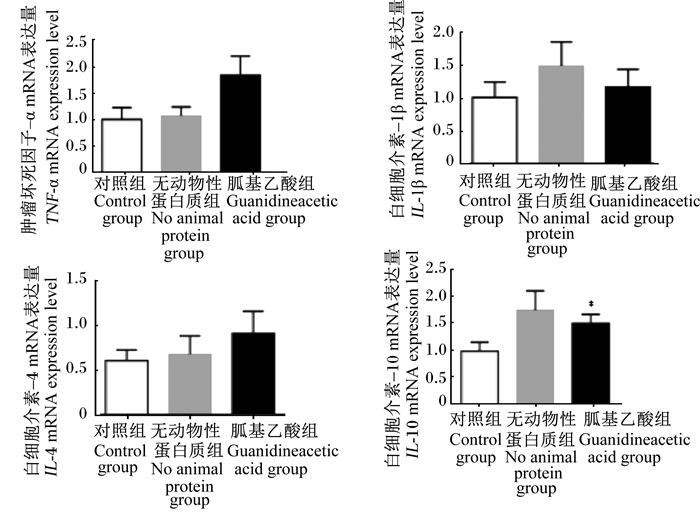
|
图 3 胍基乙酸对断奶仔猪回肠促炎和抗炎因子mRNA表达的影响 Fig. 3 Effects of guanidineacetic acid on mRNA expression of ileal pro-inflammatory and anti-inflammatory factors of weaned piglets |
动物的生长发育与能量密切相关,胍基乙酸是脊椎动物内源合成肌酸的唯一前体物,其合成的肌酸是能量代谢中的重要物质,在饲粮中添加胍基乙酸主要是为了补充肌酸,以提高动物能量代谢,促进生长。Jayaraman等[8]的研究发现,添加胍基乙酸可显著增加猪整个生长及育肥期的平均日增重和瘦肉产量,显著降低料重比,且与性别无关。本试验研究发现,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸显著提高断奶仔猪的末重,极显著提高断奶仔猪平均日增重,显著降低料重比。这与李洁蕾[10]、潘宝海等[11]、张德福等[7]、王欢等[12]的研究结果基本一致。本研究还发现,与对照组相比,用3%的去皮豆粕替代3%的鱼粉后,断奶仔猪的死淘率增加了33.33%,死淘率的增加导致断奶仔猪猪群中弱仔减少,试验期仔猪的平均日增重显著高于饲喂含有鱼粉组的仔猪,但死淘率的增加也导致仔猪的出栏率下降,生产效益降低;而在此基础上添加适量的胍基乙酸后死淘率降低至与对照组同一水平。上述结果提示,用去皮豆粕+胍基乙酸替代鱼粉能有效提高断奶仔猪的生长性能。
血清中的球蛋白是反映机体免疫功能的重要指标之一。本研究发现,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸显著提高了断奶仔猪血清中球蛋白的含量,提示去皮豆粕+胍基乙酸替代鱼粉能在一定程度上改善断奶仔猪的免疫功能,血清中球蛋白的含量显著提高也是胍基乙酸组血清中总蛋白的含量显著增加的主要原因。此外,对相关内源激素的测定发现,去皮豆粕+胍基乙酸替代鱼粉对断奶仔猪血清中与生长和代谢相关激素fIGF-Ⅰ、T3、T4和INS含量均无显著影响,上述结果与相关报道(促进胰岛素样生长因子-Ⅰ、INS[18-20]、生长激素的分泌[21])存在差异,其内在原因有待进一步的研究。
3.2 胍基乙酸对断奶仔猪肠道发育及肠道屏障功能的影响肠道是动物重要的营养器官,肠道形态结构的完整性是肠道消化吸收营养物质的基础,消化吸收的主要部位是小肠绒毛和隐窝。仔猪断奶后,采食方式由乳汁的摄取转变为玉米、豆粕等固体颗粒饲料的摄入,影响了肠道的发育。固体饲料的过早采食,会导致肠绒毛损伤而变短,隐窝加深,绒毛高度和隐窝深度的比值降低,对营养物质的消化吸收能力下降,影响仔猪的生长性能[22-23];戴德渊等[24]的研究也发现,仔猪断奶11 d后隐窝深度显著加深,绒毛高度显著降低,提示仔猪消化系统发育尚未完善,易受到断奶应激的影响。本研究发现,与对照组相比,在无动物性蛋白质饲粮中添加600 mg/kg胍基乙酸除了显著降低断奶仔猪空肠绒毛高度外,对其他8个指标(绒毛高度、隐窝深度和V/C值)均无显著差异;上述结果提示,去皮豆粕+胍基乙酸替代鱼粉对断奶仔猪肠道绒毛的发育在整体上无显著影响。
近年来的研究发现,肠道除了是营养物质的主要消化吸收场所外,在动物机体的免疫功能中也发挥了重要作用,主要体现在肠道屏障功能方面。紧密连接蛋白与完整的肠道形态结构一起是构成肠道物理屏障的结构基础,可以防御有害物质的侵入。内毒素是反映肠道通透性的重要指标,其大量繁殖或死亡后释放出的有毒物质会损伤肠道上皮细胞[25-29]。有研究发现,肠道紧密连接蛋白occludin能有效阻止肠腔内毒素、炎性介质及细菌等物质的旁细胞转运,维持肠道上皮屏障的完整性[30]。本试验结果显示,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸极显著增加断奶仔猪十二指肠和回肠occludin的表达量,显著增加十二指肠claudin-1的表达量;与无动物性蛋白质组相比,在无动物性蛋白质饲粮中添加胍基乙酸极显著增加回肠occludin的表达量,显著增加十二指肠occludin和空肠claudin-1的表达量;且胍基乙酸组断奶仔猪血清内毒素的含量显著低于其他2组,提示添加胍基乙酸能改善断奶仔猪肠道的物理屏障功能。由杯状细胞和肠上皮细胞分泌的黏蛋白和抗菌肽组成的黏液层是肠道化学屏障的基础。黏蛋白是黏液的主要成分,可以为微生物及病原菌的黏附提供位点,防止微生物及病原菌黏附于肠道上皮细胞[17, 31-32]。有研究发现,杯状细胞的增加可促进黏蛋白的分泌,增强黏液屏障的作用,抵抗病原细菌、病毒、寄生虫,还能促进机体免疫[33-34]。本研究发现,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸极显著增加了空肠和回肠上皮杯状细胞数量,这提示去皮豆粕+胍基乙酸替代鱼粉可有效促进断奶仔猪肠道化学屏障功能。肠道是机体最大的免疫器官,肠道的免疫屏障主要包括相关淋巴组织、分泌型免疫球蛋白A及细胞因子构成的肠道免疫防御系统。病原物的侵入会损伤肠道黏膜,引起炎症反应,免疫细胞的介入,相关炎症因子的基因表达会发生改变。在抵御病原菌感染时,促炎因子和抗炎因子发挥重要的作用[35]。本研究发现,与对照组相比,在无动物性蛋白质饲粮中添加胍基乙酸对断奶仔猪回肠促炎因子TNF-α以及IL-1β的mRNA表达量无显著影响,但胍基乙酸组断奶仔猪回肠抗炎因子IL-10的mRNA表达量显著增加,这提示在无动物性蛋白质饲粮中添加胍基乙酸能有效改善断奶仔猪的免疫屏障功能。综上所述,饲粮中采用去皮豆粕+胍基乙酸替代鱼粉能多方面改善断奶仔猪肠道的物理、化学、免疫屏障功能,达到鱼粉的效果,甚至更好。
4 结论无动物性蛋白质饲粮中添加600 mg/kg胍基乙酸能有效改善断奶仔猪的肠道屏障功能,提高其生长性能。
| [1] |
王誉杰, 张进威, 王讯, 等. 胍基乙酸及代谢产物肌酸的研究进展[J]. 畜牧兽医学报, 2018, 49(8): 1577-1584. |
| [2] |
SALES J. A meta-analysis of the effects of dietary betaine supplementation on finishing performance and carcass characteristics of pigs[J]. Animal Feed Science and Technology, 2011, 165(1/2): 68-78. |
| [3] |
OSTOJIC S M, NIESS B, STOJANOVIC M, et al. Creatine metabolism and safety profiles after six-week oral guanidinoacetic acid administration in healthy humans[J]. International Journal of Medical Sciences, 2013, 10(2): 141-147. DOI:10.7150/ijms.5125 |
| [4] |
班博, 蒋庆友, 杨泰, 等. 胍基乙酸的生理作用和机理及其在肉鸡、猪生产方面的应用[J]. 动物营养学报, 2018, 30(12): 4799-4805. DOI:10.3969/j.issn.1006-267x.2018.12.005 |
| [5] |
DA SILVA R P, CLOW K, BROSNAN J T, et al. Synthesis of guanidinoacetate and creatine from amino acids by rat pancreas[J]. British Journal of Nutrition, 2014, 111(4): 571-577. DOI:10.1017/S0007114513003012 |
| [6] |
MCBREAIRTY L E, ROBINSON J L, FURLONG K R, et al. Guanidinoacetate is more effective than creatine at enhancing tissue creatine stores while consequently limiting methionine availability in Yucatan miniature pigs[J]. PLoS One, 2015, 10(6): e0131563. DOI:10.1371/journal.pone.0131563 |
| [7] |
张德福, 李易明, 田耀耀, 等. 胍基乙酸对猪生长性能和饲养经济效益的影响[J]. 中国饲料, 2016(18): 29-31,35. |
| [8] |
JAYARAMAN B, LA K V, LA H, et al. Supplementation of guanidinoacetic acid to pig diets:effects on performance, carcass characteristics, and meat quality[J]. Journal of Animal Science, 2018, 96(6): 2332-2341. DOI:10.1093/jas/sky137 |
| [9] |
赵元, 许迟, 吴仙花, 等. 不同浓度水平胍基乙酸对育肥猪肉品质影响的研究[J]. 中国饲料, 2018(17): 27-31. |
| [10] |
李洁蕾.胍基乙酸对骨骼肌细胞及保育猪的作用效果[D].硕士学位论文.北京: 中国农业科学院, 2017.
|
| [11] |
潘宝海, 孙冬岩, 田耀耀. 胍基乙酸对育肥猪生长性能、胴体品质及肉品质的影响[J]. 中国畜牧杂志, 2016, 52(19): 38-41. |
| [12] |
王欢, 王为雄, 汪宏云, 等. 胍基乙酸在育肥猪中应用效果研究[J]. 粮食与饲料工业, 2015(3): 47-49. |
| [13] |
LI J L, ZHANG L, FU Y N, et al. Creatine monohydrate and guanidinoacetic acid supplementation affects the growth performance, meat quality, and creatine metabolism of finishing pigs[J]. Journal of Agricultural and Food Chemistry, 2018, 66(38): 9952-9959. DOI:10.1021/acs.jafc.8b02534 |
| [14] |
HE D T, GAI X R, YANG L B, et al. Effects of guanidinoacetic acid on growth performance, creatine and energy metabolism, and carcass characteristics in growing-finishing pigs[J]. Journal of Animal Science, 2018, 96(8): 3264-3273. DOI:10.1093/jas/sky186 |
| [15] |
LIU Y, LI J L, LI Y J, et al. Effects of dietary supplementation of guanidinoacetic acid and combination of guanidinoacetic acid and betaine on postmortem glycolysis and meat quality of finishing pigs[J]. Animal Feed Science and Technology, 2015, 205: 82-89. DOI:10.1016/j.anifeedsci.2015.03.010 |
| [16] |
夏冰, 孟庆石, 解竞静, 等. 21日龄断奶对仔猪肠道形态、肠道通透性及肠黏膜屏障的影响[J]. 动物营养学报, 2018, 30(6): 2097-2108. DOI:10.3969/j.issn.1006-267x.2018.06.012 |
| [17] |
韩菲菲, 彭丽媛, 张学斐, 等. 肠道黏液屏障功能的研究进展[J]. 动物营养学报, 2018, 30(12): 4769-4775. DOI:10.3969/j.issn.1006-267x.2018.12.001 |
| [18] |
晁雅琳, 刘博, 寇启芳, 等. 胍基乙酸对舍饲滩羊生长性能、屠宰性能、脂肪沉积及肌肉营养成分的影响[J]. 动物营养学报, 2019, 31(1): 388-394. DOI:10.3969/j.issn.1006-267x.2019.01.046 |
| [19] |
WYSS M, KADDURAH-DAOUK R. Creatine and creatinine metabolism[J]. Physiological Reviwes, 2000, 80(3): 1107-1213. DOI:10.1152/physrev.2000.80.3.1107 |
| [20] |
江涛, 戴燊, 李小燕, 等. 胍基乙酸对AA肉仔鸡生长性能和屠宰性能的影响[J]. 饲料研究, 2012(4): 8-10. DOI:10.3969/j.issn.1002-2813.2012.04.003 |
| [21] |
OSTOJIC S M. Guanidinoacetic acid as a performance-enhancing agent[J]. Amino Acids, 2016, 48(8): 1867-1875. DOI:10.1007/s00726-015-2106-y |
| [22] |
CASPARY W F. Physiology and pathophysiology of intestinal absorption[J]. The American Journal of Clinical Nutrition, 1992, 55(1): 299S-308S. DOI:10.1093/ajcn/55.1.299s |
| [23] |
HAMPSON D J, KIDDER D E. Influence of creep feeding and weaning on brush border enzyme activities in the piglet small intestine[J]. Research in Veterinary Science, 1986, 40(1): 24-31. |
| [24] |
戴德渊, 万红, 刘元述, 等. 断奶仔猪消化生理特点与日粮的酸化调控[J]. 畜禽业, 2006(5): 22-23. DOI:10.3969/j.issn.1008-0414.2006.05.009 |
| [25] |
HAN F F, ZHANG H W, XIA X, et al. Porcine β-defensin 2 attenuates inflammation and mucosal lesions in dextran sodium sulfate-induced colitis[J]. Journal of Immunology, 2015, 194(4): 1882. DOI:10.4049/jimmunol.1402300 |
| [26] |
易宏波.抗菌肽CWA对断奶仔猪肠道炎症和肠道屏障功能的作用及其机制[D].博士学位论文.杭州: 浙江大学, 2016.
|
| [27] |
夏溪.猪抗菌肽PR39抗细菌感染和保护肠道屏障功能的作用及其机制研究[D].博士学位论文.杭州: 浙江大学, 2015.
|
| [28] |
HU C H, GU L Y, LUAN Z S, et al. Effects of montmorillonite-zinc oxide hybrid on performance, diarrhea, intestinal permeability and morphology of weanling pigs[J]. Animal Feed Science and Technology, 2012, 177(1/2): 108-115. |
| [29] |
ZHAO Y, QIN G X, SUN Z W, et al. Effects of soybean agglutinin on intestinal barrier permeability and tight junction protein expression in weaned piglets[J]. International Journal of Molecular Sciences, 2011, 12(12): 8502-8512. DOI:10.3390/ijms12128502 |
| [30] |
耿世杰, 李媛, 程赛赛, 等. 外源粪菌干预对受体猪肠道屏障功能的影响研究[J]. 中国畜牧杂志, 2018, 54(3): 92-98. |
| [31] |
LILLEHOJ E R, KIM K C. Airway mucus:its components and function[J]. Archives of Pharmacal Research, 2002, 25(6): 770-780. DOI:10.1007/BF02976990 |
| [32] |
NEISH A S. Microbes in gastrointestinal health and disease[J]. Gastroenterology, 2009, 136(1): 65-80. DOI:10.1053/j.gastro.2008.10.080 |
| [33] |
MCDOLE J R, WHEELER L W, MCDONALD K G, et al. Goblet cells deliver luminal antigen to CD103+ dendritic cells in the small intestine[J]. Nature, 2012, 483(7389): 345-349. DOI:10.1038/nature10863 |
| [34] |
KIM J J, KHAN W I. Goblet cells and mucins:role in innate defense in enteric infections[J]. Pathogens, 2013, 2(1): 55-70. DOI:10.3390/pathogens2010055 |
| [35] |
YUE Y, WU S C, LI Z K, et al. Wild jujube polysaccharides protect against experimental inflammatory bowel disease by enabling enhanced intestinal barrier function[J]. Food & Function, 2015, 6(8): 2568-2577. |




