2. 吉林农业大学动物科技学院, 动物生产及产品质量安全教育部重点实验室, 长春 130118
2. Jilin Provincial Key Laboratory of Animal Nutrition and Feed Science, College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118, China
细菌感染能够引起肉鸡免疫应激,而免疫应激通常伴随着机体炎症反应的发生及动物生长受到抑制[1]。脂多糖(LPS)是革兰氏阴性菌细胞壁脂质双分子层的外层结构,是构建肠道炎症较好的免疫激活剂[2]。大量研究表明,通过腹腔或静脉注射LPS可以诱导肉鸡发生急性炎症反应,刺激炎症细胞因子的产生,促进炎症相关因子的基因表达,阻碍养分消化利用,最终导致肉鸡生长性能下降[3-5]。除此之外,LPS刺激也会造成肠道结构和功能紊乱,损害肠道屏障功能。而肠道屏障功能是机体先天免疫的重要组成部分,是机体防御病原微生物入侵的第1道屏障及维持肠道和身体健康的关键因素[6-7]。肠黏膜屏障损伤表现为肠道通透性增加[8]。Wang等[9]研究表明,LPS刺激增加了肉鸡肠道炎症因子的表达,降低了肠道紧密连接蛋白的表达,而肠道紧密连接蛋白是肠道通透性的指示性标记物,这意味着LPS破坏了肠道黏膜屏障。Wu等[10]研究同样表明,LPS刺激增加了肉鸡肠道的通透性,破坏了肠道黏膜屏障。因此,为了维持早期肉鸡肠道健康和生长性能,有必要在肉鸡生产中进行营养干预,以减缓LPS刺激对肉鸡带来的不利影响。
研究表明,饲粮添加功能性氨基酸能够调控肠道炎症因子基因表达及细胞内信号,从而调节机体免疫[11-12]。谷氨酰胺(glutamine,Gln)是一种具有多种重要代谢功能的氨基酸,它是机体快速分化细胞(尤其是淋巴细胞和肠上皮细胞)的燃料,是肠道谷胱甘肽(机体主要的抗氧化物质之一)合成的重要前体物质,能够降低肠道炎症反应,具有重要的免疫调控功能[13-15]。研究表明,饲粮添加Gln可以增加肉鸡体重,促进肠道生长及发育[16]。此外,饲粮添加Gln能够提高肉鸡免疫器官指数,增强小肠黏膜免疫机能,缓解机体炎症反应,抑制应激引起的肠道通透性的增加[17-19]。尽管Gln是血液中含量较多的氨基酸,但在某些应激条件下(如创伤和脓毒症),机体对Gln的生理需求量可能超过内源Gln合成量[20-21]。因此,通过饲粮补充外源性L-谷氨酰胺(L-glutamine,L-Gln)可能是缓解肉鸡免疫应激和改善应激状态下肠道功能的有效策略。但到目前为止,有关L-Gln对LPS应激肉鸡肠道黏膜炎症反应调控的研究还较少。因此,本试验通过在肉鸡饲粮中添加L-Gln,并通过给肉鸡腹腔注射LPS建立炎症损伤模型,研究饲粮添加L-Gln对LPS刺激肉鸡血浆生化指标、免疫性能、肠道炎症因子表达及黏膜免疫的影响,从而为早期LPS刺激肉鸡营养调控提供参考。
1 材料与方法 1.1 试验材料L-Gln含量为99.10%,L-丙氨酸(L-alanine,L-Ala)含量为99.20%。LPS来源于大肠杆菌(Escherichia coli),血清型O55 : B5,购自美国Sigma公司。
1.2 试验仪器主要试验仪器包括FA-1004型电子天平(上海精密科学仪器有限公司)、UV759紫外可见分光光度计(上海精密科学仪器有限公司)、Sigma2-16KL型低温高速离心机(Sigma公司,美国)、LX400型掌式离心机(海门市其林贝尔仪器制造有限公司)、QL-901型漩涡混匀器(海门市其林贝尔仪器制造有限公司)、净化工作台(苏州华宏净化技术有限公司)、微量分光光度计(NanoDrop公司,美国)、普通PCR扩增仪(Eppendorf公司,美国)和荧光定量PCR仪(Bio-Rad公司,美国)。
1.3 试验设计及饲养管理选择120只1日龄健康状况良好、体重相近的爱拔益加(AA)肉鸡(雌雄各占1/2),按2×2试验设计随机分为4个组(A、B、C和D组),每组5个重复,每个重复6只鸡。基础饲粮参照NRC(1994)标准进行配制,其组成及营养水平见表 1。为了使饲粮氮平衡,对照饲粮在基础饲粮中添加1.22% L-Ala,L-Ala添加量按照Zhang等[22]的研究进行计算得出;L-Gln饲粮在基础饲粮中添加1% L-Gln。A、C组饲喂对照饲粮,B、D组饲喂L-Gln饲粮。第16天及第21天08:00,B、D组肉鸡分别腹腔注射LPS(500 μg/kg BW),A、C组肉鸡腹腔注射等量的生理盐水,注射前12 h停料不停水。将LPS溶于0.9%无菌生理盐水中,LPS注射剂量参照Li等[4]。试验期21 d,分为LPS注射前(1~15日龄)和LPS注射后(16~21日龄)。每天早、中、晚各喂料1次,自由采食和饮水。按常规鸡只免疫程序进行免疫。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
在试验第21天,LPS注射3 h后,每组选择10羽(每个重复选择2羽)肉仔鸡进行翅下静脉采血。利用含肝素钠的Eppendorf管采集血液各2管,每管10 mL。将所收集的血液在4 ℃、3 000×g离心10 min,收集血浆并分装,放置于-20 ℃冰箱保存,用于相关指标测定。血浆中总蛋白(TP)、尿素氮(UN)含量及谷草转氨酶(AST)、谷丙转氨酶(ALT)活性均采用商品化试剂盒进行测定,操作规程按照试剂盒说明书进行,试剂盒均购自南京建成生物工程研究所。
1.4.2 肠道指数的测定血液采集完毕后将鸡只宰杀(每组10羽,每个重复2羽),立即打开腹腔,分别收集十二指肠、空肠及回肠,轻轻挤出内容物后,分别测定其长度及重量,用以计算肠道指数:

|
鸡屠宰后,立即打开腹腔,分别摘取脾脏、胸腺和法氏囊,利用精密天平称其鲜重,用以计算免疫器官指数:
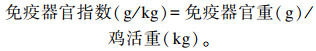
|
采用商品化试剂盒测定空肠黏膜sIgA含量,所用试剂盒购自南京建成生物工程研究所。
1.4.5 组织RNA提取及肠道mRNA表达水平测定利用荧光定量(RT)-PCR试验对肠道炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、黏蛋白1(MUC1)及黏蛋白2(MUC2)mRNA表达水平进行测定,引物序列见表 2。采用RNAiso Plus试剂(No. 9108, TaKaRa)对相应组织RNA进行提取,并用微量分光光度计对所提取的RNA进行浓度测定。利用琼脂糖凝胶电泳及PCR仪分别进行RNA完整性测定及RNA的反转录。在CFX ConnectTM PCR仪上进行RT-PCR试验,所用TB Green Premix Ex Taq试剂盒(No. RR420A)购自TaKaRa公司,操作步骤按试剂盒说明书操作,反应体系20 μL:包括10 μL SYBR Premix Ex Taq (2 ×),0.4 μL ROX Reference Dye Ⅱ (50×),2.0 μL cDNA模板和各0.4 μL上、下游引物,加ddH2O至总体积20 μL。反应程序为:95 ℃ 30 s (1次循环); 95 ℃ 5 s,60 ℃ 34 s (40个循环)。内参基因为β-肌动蛋白(β-actin)。mRNA表达水平的计算参照Livak等[23]的方法进行。所有样品均测定3次。
|
|
表 2 RT-PCR引物序列 Table 2 Primer sequences of RT-PCR |
应用SAS 8.02统计中ANOVA程序进行双因素方差分析,采用Duncan氏法进行多重比较。结果以平均值±标准差表示,P < 0.05表示差异显著。
2 结果 2.1 L-Gln对LPS刺激肉鸡血浆生化指标的影响如表 3所示,LPS刺激显著增加了肉鸡血浆中TP、UA含量及ALT、AST活性(P < 0.05)。饲粮添加L-Gln显著降低了肉鸡TP、UA含量及ALT、AST活性(P < 0.05)。其中,饲粮添加L-Gln和LPS刺激对肉鸡TP含量及ALT活性有显著互作效应(P < 0.05),但对UA含量及AST活性无显著互作效应(P>0.05)。
|
|
表 3 L-Gln对LPS刺激肉鸡血浆生化指标的影响 Table 3 Effects of L-Gln on plasma biochemical parameters of broilers challenged by LPS |
如表 4所示,LPS刺激显著降低了肉鸡十二指肠相对长度、十二指肠相对重量,空肠相对长度、空肠相对重量、回肠相对长度及回肠相对重量(P < 0.05)。饲粮添加L-Gln显著增加了肉鸡十二指肠相对长度、十二指肠相对重量,空肠相对长度、空肠相对重量、回肠相对长度及回肠相对重量(P < 0.05)。其中,饲粮添加L-Gln和LPS刺激对肉鸡回肠相对长度有显著互作效应(P < 0.05),但对十二指肠相对长度、十二指肠相对重量,空肠相对长度、空肠相对重量及回肠相对重量无显著互作效应(P>0.05)。
|
|
表 4 L-Gln对LPS刺激肉鸡肠道指数的影响 Table 4 Effects of L-Gln on intestinal indexes of broilers challenged by LPS |
如表 5所示,LPS刺激显著降低了肉鸡胸腺指数、脾脏指数及法氏囊指数(P < 0.05)。饲粮添加L-Gln显著增加了肉鸡胸腺指数、脾脏指数及法氏囊指数(P < 0.05)。饲粮添加L-Gln和LPS刺激对肉鸡胸腺指数、脾脏指数及法氏囊指数无显著互作效应(P>0.05)。
|
|
表 5 L-Gln对LPS刺激肉鸡免疫器官指数的影响 Table 5 Effects of L-Gln on immune organ indexes of broilers challenged by LPS |
如表 6所示,LPS刺激显著增加了十二指肠TNF-α、IL-1β及IL-6 mRNA表达水平(P < 0.05)。饲粮添加L-Gln显著降低了十二指肠TNF-α及IL-6 mRNA表达水平(P < 0.05),但对十二指肠IL-1β mRNA表达水平无显著影响(P>0.05)。其中,饲粮添加L-Gln和LPS刺激对十二指肠TNF-α mRNA表达水平有显著互作效应(P < 0.05),但对十二指肠IL-1β及IL-6 mRNA表达水平无显著互作效应(P>0.05)。
|
|
表 6 L-Gln对LPS刺激肉仔鸡十二指肠炎症因子mRNA表达水平的影响 Table 6 Effects of L-Gln on mRNA expression levels of inflammatory factors in duodenum of broilers challenged by LPS |
如表 7所示,LPS刺激显著增加了空肠TNF-α、IL-1β及IL-6 mRNA表达水平(P < 0.05)。饲粮添加L-Gln显著降低了空肠TNF-α、IL-1β及IL-6 mRNA表达水平(P < 0.05)。其中,饲粮添加L-Gln和LPS刺激对空肠IL-6 mRNA表达水平有互作效应(P < 0.05),但对TNF-α及IL-1β mRNA表达水平无显著互作效应(P>0.05)。
|
|
表 7 L-Gln对LPS刺激肉仔鸡空肠炎性因子mRNA表达水平的影响 Table 7 Effects of L-Gln on mRNA expression levels of inflammatory factors in jejunum of broilers challenged by LPS |
如表 8所示,LPS刺激显著增加了回肠TNF-α、IL-1β及IL-6 mRNA表达水平(P < 0.05)。饲粮添加L-Gln显著降低了回肠TNF-α、IL-1β及IL-6 mRNA表达水平(P < 0.05)。饲粮添加L-Gln和LPS刺激对回肠TNF-α、IL-1β mRNA表达水平无显著互作效应(P>0.05)。
|
|
表 8 L-Gln对LPS刺激肉仔鸡回肠炎性因子mRNA表达水平的影响 Table 8 Effects of L-Gln on mRNA expression levels of inflammatory factors in ileum of broilers challenged by LPS |
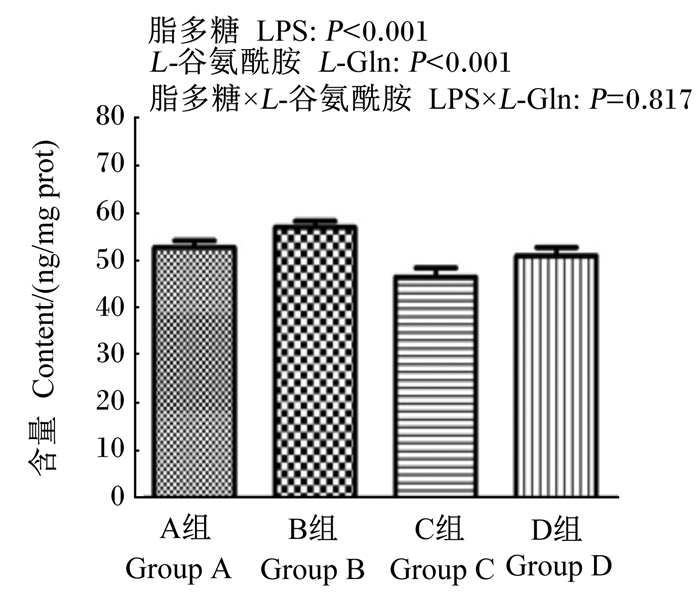
如图 1所示,LPS刺激显著降低了空肠黏膜sIgA含量(P < 0.05)。饲粮添加L-Gln显著增加了空肠黏膜sIgA含量(P < 0.05)。饲粮添加L-Gln和LPS刺激对空肠黏膜sIgA含量无显著互作效应(P>0.05)。
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 L-Gln对LPS刺激肉鸡空肠黏膜sIgA含量的影响 Fig. 1 Effects of L-Gln on content of sIgA in jejunum mucosa of broilers by LPS challenge |
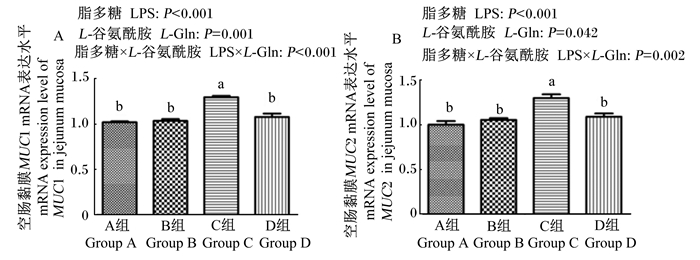
如图 2所示,LPS应激显著增加了空肠黏膜MUC1及MUC2 mRNA表达水平(P < 0.05)。饲粮添加L-Gln显著降低了空肠黏膜MUC1及MUC2 mRNA表达水平(P < 0.05)。饲粮添加L-Gln和LPS应激对空肠黏膜MUC1及MUC2 mRNA表达水平有显著互作效应(P < 0.05)。
|
图 2 L-Gln对LPS刺激肉鸡空肠黏膜MUC1及MUC2 mRNA表达水平的影响 Fig. 2 Effects of L-Gln on mRNA expression levels of MUC1 and MUC2 in jejunum mucosa of broilers by LPS challenge |
血浆生化指标是直接反映动物机体代谢状况的重要指标,是组织细胞通透性和机体新陈代谢机能发生改变的反应,在一定程度上可以反映动物的健康状况[24-25]。血浆TP含量在一定程度上反映了饲粮蛋白质的营养水平,可以反映出蛋白质在机体内的合成情况,在机体营养运输、免疫反应、组织修复等过程中发挥重要的作用[26]。TP是由白蛋白和球蛋白构成,当机体处于免疫应激状态时,能引起机体蛋白质水平的变化,其含量的改变能在一定程度上反映动物的免疫状况和生理状况[27]。其中,球蛋白是由免疫器官产生,当机体发生炎症反应或者被病原菌感染时血液球蛋白含量上升[28]。郑肖川[29]研究表明,LPS刺激显著增加了肉鸡血液中球蛋白含量。本研究结果表明,LPS刺激显著增加了肉鸡血浆中TP含量。因此,本研究TP含量增加可能是由于免疫应激条件下,机体球蛋白合成量大量增加,从而导致血浆TP含量的增加。血浆UA含量可以较准确地反映动物体内蛋白质代谢和氨基酸之间的平衡状况。本试验中,LPS刺激造成了肉鸡血浆中UA含量显著增加,这与Liu等[30]的研究结果一致。但冯焱等[31]选用1日龄肉鸡为试验对象,经肌肉注射500 μg/kg BW的LPS,结果发现,与对照组相比,LPS刺激并未显著增加肉鸡血液中UA含量。这与本试验的结果不同,造成这种差异的原因可能是由于注射方式的不同引起。然而,饲粮添加L-Gln显著降低了血浆UA含量。饲粮添加L-Gln对肉鸡血浆UA含量的影响还未见报道。研究表明,饲粮添加L-Gln显著降低了仔猪血清中尿素氮含量[32]。这些结果意味着L-Gln对LPS刺激下肉鸡蛋白质的代谢和吸收有较好的改善作用。ALT和AST均在肝脏细胞胞浆中合成,血液中含量较低。但在应激条件下,肝细胞受到破坏导致其大量释放进入血液,从而造成血液中转氨酶活性增加[33]。本研究中,LPS刺激显著增加了血浆ALT和AST活性。吴秋珏等[34]研究同样表明,LPS刺激显著增加了肉鸡血浆ALT和AST活性,这与本研究的结果相一致。然而,饲粮添加1% L-Gln能够显著降低LPS刺激引起的血浆AST及ALT活性的增加,这意味着L-Gln对LPS刺激引起的肝脏损伤具有潜在的修复作用。
3.2 L-Gln对LPS刺激肉鸡肠道发育及免疫器官指数的影响本研究发现,LPS刺激显著降低了肉鸡肠道指数,而饲粮添加L-Gln显著增加肉鸡肠道指数。冯焱[35]研究表明,LPS刺激显著降低了21日龄肉鸡十二指肠指数及空肠指数。这可能是由于应激状态下,饲粮养分由促进生长转为更多地被用以增加机体免疫性能,从而使得用于肠道生长的养分不足,造成小肠蛋白质合成下降,从而阻碍了肠道生长发育[1, 36]。胸腺、脾脏及法氏囊是禽类的主要免疫器官,而免疫器官发育情况在一定程度上能够反映机体免疫性能的状况[37]。免疫器官指数是公认的适用于家畜和家禽免疫状态的评价指标[29]。本研究表明,LPS刺激显著降低了肉鸡脾脏指数、法氏囊指数及胸腺指数。Li等[1]选用黄羽肉鸡为试验对象,经腹腔内注射LPS后发现,LPS刺激显著降低了肉鸡脾脏指数、法氏囊指数及胸腺指数,这与本研究的结果相一致。这可能是由于免疫应激条件下,肉鸡的营养供应不足导致器官生长受阻,从而造成肉鸡免疫器官胸腺和法氏囊等的萎缩[38]。然而,饲粮添加L-Gln显著改善了由于LPS所引起免疫器官指数的下降。王中华等[39]研究表明,与对照组相比,饲粮添加L-Gln显著增加了肉鸡的胸腺指数及脾脏指数,其中以1%剂量添加效果最好。肖双双等[40]的研究也表明,饲粮添加Gln显著增加了肉鸡法氏囊指数,促进了免疫器官发育。以上结果提示,L-Gln有利于改善肉鸡免疫应激条件下的免疫性能。
3.3 L-Gln对LPS刺激肉鸡肠道炎症因子表达的影响研究表明,LPS刺激会引起黏膜损伤,从而造成肠道通透性增加,进而引起机体先天免疫细胞活性增加与黏膜免疫系统的激活[1]。促炎症细胞因子如IL-1β、IL-6和TNF-α是先天免疫应答后引起代谢级联改变的主要细胞信使[41],在多种炎症反应中发挥重要作用,并与炎症的严重程度密切相关。本研究发现,LPS刺激显著增加了肉鸡十二指肠、空肠及回肠IL-1β、IL-6和TNF-α mRNA表达水平。与此相似,Wu等[10]和Liu等[42]研究发现,LPS刺激显著增加了肉鸡肠道IL-1β、IL-6和TNF-α mRNA表达水平。Jiang等[41]对LPS应激肉鸡十二指肠炎症因子的研究同样表明,LPS刺激显著增加了十二指肠IL-1β、IL-6和TNF-α mRNA表达水平。本研究发现,饲粮添加L-Gln显著降低了LPS刺激肉鸡肠道IL-1β、IL-6和TNF-α mRNA表达水平。目前为止,有关L-Gln对免疫应激肉鸡肠道炎症因子的研究还未见报道。先前研究表明,Gln是免疫细胞代谢的重要能源,在调控机体免疫方面发挥着重要的作用[43-44]。研究表明,Gln添加能够显著降低大鼠[45]及人[46]肠道炎症因子水平。Wu等[19]研究表明,饲粮添加L-Gln显著降低了热应激肉鸡肠道炎症因子水平。并且,体外试验结果同样表明,Gln缺乏会导致肠道上皮细胞促炎性细胞因子的产生增加,而重新补充Gln则缓解了肠道上皮细胞的炎症反应[12]。这些结果提示,饲粮添加L-Gln有利于缓解LPS刺激所引起的肠道炎症反应。
3.4 L-Gln对LPS刺激肉鸡肠道黏膜免疫的影响肠道健康受肠道微生物、黏膜免疫、养分消化和吸收、肠道通透性及肠道完整性等一系列复杂因素的影响。小肠由一层单层上皮细胞组成,中间分散有杯状细胞、干细胞及肠道内分泌细胞,不仅是营养物质消化吸收的主要场所,在免疫调控及黏膜屏障方面也发挥着重要的作用[2]。肠道上皮细胞通过分泌MUC1、MUC2及sIgA等一系列免疫调控因子参与肠道黏膜免疫的调控[47-48]。sIgA是存在于肠道黏膜固有层浆细胞产生的主要免疫效应因子,是机体分泌量最多的免疫球蛋白,是肠道免疫屏障的第1道防御。sIgA为主的体液免疫在肠道免疫中起主要作用,可与相应抗原结合,防御病原体在肠道中的黏附和定植,对肠道黏膜免疫起着重要的保护作用[49]。本研究发现,LPS刺激显著降低了肉鸡空肠sIgA含量。然而,饲粮添加L-Gln显著增加了空肠sIgA含量。Li等[1]的研究同样表明,LPS刺激显著降低了肉鸡空肠sIgA含量。尽管饲粮添加L-Gln对肉鸡肠道sIgA含量的影响并未见报道,但前期大量在大鼠[50]、猪[47]上的研究均表明,饲粮添加L-Gln能够显著增加肠道sIgA含量。并且,在应激状态下,Gln缺乏能明显降低肠腔中sIgA含量,而sIgA含量的降低可能造成肠上皮细胞对外来抗原的抵抗力下降[51]。这些结果提示,饲粮添加L-Gln有利于肉鸡肠道黏膜免疫球蛋白的合成与分泌,改善LPS刺激引起的肠道免疫屏障功能。
黏蛋白由分泌性上皮细胞合成,能够保护胃肠道免受损伤,是胃肠道内先天免疫屏障的一个重要组成部分。黏蛋白主要分为2类:一类是分泌性黏蛋白,主要以胶体的形式存在于黏膜表面,是黏液组成的主要成分,包括MUC2、黏蛋白6(MUC6)等;另一类是膜结合性黏蛋白,存在于上皮细胞的表层,包括MUC1、黏蛋白4(MUC4)等[48, 52]。本研究发现,LPS刺激显著增加了空肠MUC1及MUC2 mRNA表达水平。Chen等[6]的研究同样表明,LPS刺激显著增加了肉鸡空肠MUC2 mRNA表达水平。这可能是由于LPS刺激可促进肠黏膜隐窝干细胞增殖和杯状细胞分化,上调MUC1和MUC2 mRNA表达水平,从而有利于减轻肠黏膜损伤[53]。饲粮添加L-Gln有效缓解了LPS刺激所引起的MUC1及MUC2表达的增加。然而,L-Gln对肉鸡肠道MUC1及MUC2 mRNA表达的影响未见报道。Xing等[54]在仔猪上的研究发现,饲粮添加丙氨酰谷氨酰胺(Gln的一种二肽形式)能够显著降低LPS应激所引起的空肠MUC1及MUC2 mRNA表达水平的增加。这意味着饲粮添加L-Gln有利于促进肠道化学屏障,减轻LPS刺激下肠道黏膜的损伤。
4 结论饲粮中添加1% L-Gln能够提高肉鸡免疫性能,增加肠道黏膜免疫机能,从而在一定程度上有效缓解LPS刺激引起的肉鸡肠道炎症反应。
| [1] |
LI R, SONG Z H, ZHAO J F, et al. Dietary L-theanine alleviated lipopolysaccharide-induced immunological stress in yellow-feathered broilers[J]. Animal Nutrition, 2018, 4(3): 265-272. DOI:10.1016/j.aninu.2018.05.002 |
| [2] |
GILANI S, HOWARTH G S, KITESSA S M, et al. New biomarkers for intestinal permeability inducedby lipopolysaccharide in chickens[J]. Animal Production Science, 2016, 56(12): 1984-1997. DOI:10.1071/an15725 |
| [3] |
TAN J Z, LIU S S, GUO Y M, et al. Dietary L-arginine supplementation attenuates lipopolysaccharide-induced inflammatory response in broiler chickens[J]. British Journal of Nutrition, 2014, 111(8): 1394-1404. |
| [4] |
LI Y, ZHANG H, CHEN Y P, et al. Bacillus amyloliquefaciens supplementation alleviates immunological stress and intestinal damage in lipopolysaccharide-challenged broilers[J]. Animal Feed Science and Technology, 2015, 208: 119-131. |
| [5] |
WANG W W, LI Z, HAN Q Q, et al. Dietary live yeast and mannan-oligosaccharide supplementation attenuate intestinal inflammation and barrier dysfunction induced by Escherichia coli in broilers[J]. British Journal of Nutrition, 2016, 116(11): 1878-1888. DOI:10.1017/S0007114516004116 |
| [6] |
CHEN Y P, ZHANG H, CHENG Y F, et al. Dietary L-threonine supplementation attenuates lipopolysaccharide-induced inflammatory responses and intestinal barrier damage of broiler chickens at an early age[J]. British Journal of Nutrition, 2018, 119(11): 1254-1262. |
| [7] |
GADDE U D, OH S, LEE Y, et al. Dietary Bacillus subtilis-based direct-fed microbials alleviate LPS-induced intestinal immunological stress and improve intestinal barrier gene expression in commercial broiler chickens[J]. Research in Veterinary Science, 2017, 114: 236-243. |
| [8] |
LIU Y L, HUANG J L, HOU Y Q, et al. Dietary arginine supplementation alleviates intestinal mucosal disruption induced by Escherichia coli lipopolysaccharide in weaned pigs[J]. British Journal of Nutrition, 2008, 100(3): 552-560. DOI:10.1017/s0007114508911612 |
| [9] |
WANG X F, SHEN J, LI S Z, et al. Sulfated Astragalus polysaccharide regulates the inflammatory reaction in LPS-infected broiler chicks[J]. International Journal of Biological Macromolecules, 2014, 69: 146-150. |
| [10] |
WU Q J, ZHOU Y M, WU Y N, et al. The effects of natural and modified clinoptilolite on intestinal barrier function and immune response to LPS in broiler chickens[J]. Veterinary Immunology and Immunopathology, 2013, 153(1/2): 70-76. |
| [11] |
XU C L, SUN R, QIAO X J, et al. Protective effect of glutamine on intestinal injury and bacterialcommunity in rats exposed to hypobaric hypoxia environment[J]. World Journal of Gastroenterology, 2014, 20(16): 4662-4674. DOI:10.3748/wjg.v20.i16.4662 |
| [12] |
ACHAMRAH N, CHELOTTE P D, CO FFIER M. Glutamine and the regulation of intestinal permeability:from bench to bedside[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2017, 20(1): 86-91. |
| [13] |
FAN J, MENG Q Y, GUO G H, et al. Effects of enteral nutrition supplemented with glutamine on intestinal mucosal immunity in burned mice[J]. Nutrition, 2009, 25(2): 233-239. |
| [14] |
WISCHMEYER P. The glutamine story:where are we now?[J]. Current Opinion in Critical Care, 2006, 12(2): 142-148. |
| [15] |
SINGLETON K, BECKEY V, WISCHMEYER P. Glutamine prevents activation of NF-κB and stress kinase pathways, attenuates inflammatory cytokine release, and prevents acute respiratory distress syndrome (ARDS) following sepsis[J]. Shock, 2005, 24(6): 583-589. |
| [16] |
BARTELL S M, BATAL A B. The effect of supplemental glutamine on growth performance, development of the gastrointestinal tract, and humoral immune response of broilers[J]. Poultry Science, 2007, 86(9): 1940-1947. |
| [17] |
WANG B, WU G Y, ZHOU Z G, et al. Glutamine and intestinal barrier function[J]. Amino Acids, 2015, 47(10): 2143-2154. |
| [18] |
刘艳芬, 马建升, 黄银姬, 等. 谷氨酰胺对肉仔鸡免疫器官发育及免疫功能的影响[J]. 中国兽医学报, 2006, 26(5): 567-569. |
| [19] |
WU Q J, LIU N, WU X H, et al. Glutamine alleviates heat stress-induced impairment of intestinal morphology, intestinal inflammatory response, and barrier integrity in broilers[J]. Poultry Science, 2018, 97(8): 2675-2683. |
| [20] |
ZHANG B L, LIN M, YU C N, et al. Alanyl-glutamine supplementation regulates mTOR and ubiquitin proteasome proteolysis signaling pathways in piglets[J]. Nutrition, 2016, 32(10): 1123-1131. |
| [21] |
SOARES A D, COSTA K A, WANNER S P, et al. Dietary glutamine prevents the loss of intestinal barrier function and attenuates the increase in core body temperature induced by acute heat exposure[J]. BritishJournal of Nutrition, 2014, 112(10): 1601-1610. |
| [22] |
ZHANG B L, YU C N, LIN M, et al. Regulation of skeletal muscle protein synthetic and degradative signaling by alanyl-glutamine in piglets challenged with Escherichia coli lipopolysaccharide[J]. Nutrition, 2015, 31(5): 749-756. |
| [23] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2000, 25(4): 402-408. |
| [24] |
王友炜, 侯永清, 丁斌鹰, 等. α-酮戊二酸对脂多糖多次刺激后断奶仔猪生长性能、血液生化指标和内脏器官指数的影响[J]. 中国兽医学报, 2011, 31(1): 141-144. |
| [25] |
周玉香, 吕玉玲, 王洁, 等. 血液生化指标在动物生产与营养调控研究中的应用概况[J]. 畜牧与饲料科学, 2012, 33(5): 72-74. |
| [26] |
张柏林.Ala-Gln对仔猪氮营养素利用的影响及其作用机制研究[D].博士学位论文.南京: 南京农业大学, 2015.
|
| [27] |
王平.益生素对免疫应激肉仔鸡生长性能及血液指标的影响[D].硕士学位论文.晋中: 山西农业大学, 2013.
|
| [28] |
KUNIKA K, ITAKURA M, YAMASHITA K. Correction of fructosamine value for serum albumin and globulin concentrations[J]. Diabetes Research and Clinical Practice, 1991, 13(1/2): 37-44. |
| [29] |
郑肖川.冬凌草甲素对肉鸡免疫应激调控作用研究[D].硕士学位论文.南京: 南京农业大学, 2016.
|
| [30] |
LIU Z Y, WANG X L, OU S Q, et al. Effects of achyranthes bidentata polysaccharides on intestinal morphology, immune response, and gut microbiome in yellow broiler chickens challenged with Escherichia coli K88[J]. Polymers, 2018, 10(11): 1233. DOI:10.3390/polym10111233 |
| [31] |
冯焱, 张芬鹊, 薛智全, 等. 脂多糖和地塞米松对肉鸡生长性能、养分代谢、血清生化指标及肠道形态发育的影响[J]. 中国畜牧兽医, 2017, 44(3): 732-739. |
| [32] |
李宁宁.谷氨酰胺不同蛋白水平日粮中对断奶仔猪生产性能及相关血液生化指标影响的研究[D].硕士学位论文.保定: 河北农业大学, 2012.
|
| [33] |
王友炜.α-酮戊二酸对脂多糖刺激仔猪生长性能、肠道功能和血浆指标的影响[D].硕士学位论文.武汉: 武汉工业学院, 2010.
|
| [34] |
吴秋珏, 郑肖川, 张铁鹰, 等.冬凌草甲素对免疫应激肉鸡血液生化指标的影响[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集.武汉: 中国畜牧兽医学会动物营养学分会, 2016: 315
|
| [35] |
冯焱.免疫应激对肉鸡消化系统、免疫功能及肠道微生物区系的影响[D].博士学位论文.杨凌: 西北农林科技大学, 2012.
|
| [36] |
DUDLEY M A, WYKES L J, DUDLEY A W, J r, et al. Parenteral nutrition selectively decreases protein synthesis in the small intestine[J]. American Journal of Physiology, 1998, 274(1): G131-G137. |
| [37] |
李国军.酵母对脂多糖诱导黄羽肉鸡急性炎症反应的影响[D].硕士学位论文.长沙: 湖南农业大学, 2016.
|
| [38] |
SHINI S, KAISER P, SHINI A, et al. Biological response of chickens (Gallus gallus domesticus) induced by corticosterone and a bacterial endotoxin[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2008, 149(2): 324-333. |
| [39] |
王中华, 黄修奇, 杨艳玲. 谷氨酰胺对肉仔鸡生长、屠宰性能和免疫器官指数的影响[J]. 中国家禽, 2011, 33(18): 64-65. |
| [40] |
肖双双, 叶美玲, 李佳琦, 等. 谷氨酰胺对冷应激雏鸡生长性能与免疫器官指数的影响[J]. 安徽科技学院学报, 2019, 33(4): 9-12. |
| [41] |
JIANG Y, ZHANG W H, GAO F, et al. Effect of sodium butyrate on intestinal inflammatory response to lipopolysaccharide in broiler chickens[J]. Canadian Journal of Animal Science, 2015, 95(3): 389-395. |
| [42] |
LIU S D, SONG M H, YUN W, et al. Effect of carvacrol essential oils on immune response and inflammation-related genes expression in broilers challenged by lipopolysaccharide[J]. Poultry Science, 2019, 98(5): 2026-2033. |
| [43] |
WISCHMEYER P E, RIEHM J, SINGLETON K, et al. Glutamine attenuates tumor necrosis factor-α release and enhances heat shock protein 72 in human peripheral blood mononuclear cells[J]. Nutrition, 2003, 19(1): 1-6. |
| [44] |
COËFFIER M, MARION R, DUCROTTÉ P, et al. Modulating effect of glutamine on IL-1β-induced cytokine production by human gut[J]. Clinical Nutrition, 2003, 22(4): 407-413. |
| [45] |
LI N, LIBONI K, FANG M Z, et al. Glutamine decreases lipopolysaccharide-induced intestinal inflammation in infant rats[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2004, 286(6): G914-G921. |
| [46] |
COËFFIER M, MIRALLES-BARRACHINA O, LE PESSOT F, et al. Influence of glutamine on cytokine production by human gut in vitro[J]. Cytokine, 2001, 13(3): 148-154. |
| [47] |
XING S, ZHANG B L, LIN M, et al. Effects of alanyl-glutamine supplementation on the small intestinal mucosa barrier in weaned piglets[J]. Asian-Australasian Journal of Animal Science, 2017, 30(2): 236-245. |
| [48] |
邢深.日粮添加丙氨酰谷氨酰胺对仔猪小肠黏膜屏障功能的影响[D].硕士学位论文.南京: 南京农业大学, 2016.
|
| [49] |
MANTIS N J, ROL N, CORTHÉSY B. Secretory IgA's complex roles in immunity and mucosal homeostasis in the gut[J]. Mucosal Immunology, 2011, 4(6): 603-611. |
| [50] |
WU M M, XIAO H, LIU G, et al. Glutamine promotes intestinal sIgA secretion through intestinal microbiota and IL-13[J]. Molecular Nutrition & Food Research, 2016, 60(7): 1637-1648. |
| [51] |
叶亚玲.Ala-Gln对断奶仔猪体液免疫及肠黏膜细胞免疫的调控作用[D].硕士毕业论文.南昌: 江西农业大学, 2014.
|
| [52] |
杨占清.粘蛋白1、粘蛋白2 mRNA在炎症性肠病大鼠肠黏膜细胞表达规律的研究[D].硕士学位论文.长春: 吉林大学, 2007.
|
| [53] |
SANT'ANA D M G, GÓIS M B, ZANONI J N, et al. Intraepithelial lymphocytes, goblet cells and VIP-IR submucosal neurons of jejunum rats infected with Toxoplasma gondii[J]. International Journal of Experimental Pathology, 2012, 93(4): 279-286. |
| [54] |
XING S, ZHANG B L, LIN M, et al. Effects of alanyl-glutamine supplementation on the small intestinal mucosa barrier in weaned piglets challenged with lipopolysaccharide[J]. Canadian Journal of Animal Science, 2018, 98(1): 144-155. |




