内蒙古自治区是畜牧业大省,绵羊和山羊存栏数均居于全国前列。近年来由于过度放牧造成了严重的土地荒漠化。草食动物的饲养方式也由之前的放牧逐渐转变为舍饲或半舍饲,这使草食动物养殖对粗饲料的需求量逐渐增加。我国北方地区的灌木植被较丰富,有开发为粗饲料的潜力。柠条作为一种灌木类植物在内蒙古自治区分布广泛,且营养价值较高。营养期的柠条营养价值高于3级苜蓿草粉,其粗蛋白质、粗脂肪和矿物元素含量较丰富,而且氨基酸组成较为平衡, 是优良的非常规饲料资源之一[1]。近年来,国内外研究人员对开发柠条作为新型饲料资源的可行性开展了相关的研究。柠条中富含单宁,单宁是植物饲料的抗营养因子,也是将柠条开发为饲料资源的限制性因素。单宁作为植物进化过程中由碳水化合物衍生出来的一种自我保护性物质,是植物与环境相互作用的产物[2]。单宁按结构可分为水解单宁和缩合单宁两大类[3]。单宁在瘤胃中与消化酶和蛋白质结合形成沉淀,极大地降低了粗蛋白质和纤维素在瘤胃中的降解率,减少了氮和甲烷的排放量,增加了过瘤胃蛋白质含量,从而提高了氮的利用效率[4]。前人研究指出,单宁会改变瘤胃发酵模式和微生物区系,也有减少反刍动物甲烷排放的作用[5-6]。周奕毅[7]研究指出,含单宁的茶皂素通过改变湖羊瘤胃产甲烷菌数量而显著降低甲烷产量。产甲烷菌是专性厌氧菌,属于古菌域,广域古菌界,宽广古生菌门,主要有氢营养型、甲基营养型和乙酸营养型3种营养类型。产甲烷菌可利用二氧化碳、甲酸、乙酸、甲胺和次甲胺等通过一系列复杂的化学过程合成甲烷[8]。甲烷的生成既加剧温室效应,又造成能量损失。一般来说,以甲烷气体形式损失的能量占饲料总能量的7%~10%,反刍动物消化过程中约有2%的可消化能转变成甲烷和热能被消耗[9]。王卫云[10]研究发现,体外培养条件下添加单宁会抑制瘤胃纤维降解细菌的生长,这种抑制作用随单宁浓度增加而增强。Zhou等[11]用16S rRNA高通量测序技术分析了单宁酸对肉牛瘤胃细菌多样性的影响,结果表明添加单宁酸对肉牛瘤胃细菌的相对丰度无显著影响,但增加了细菌群落的多样性。目前,国内外关于单宁对瘤胃微生物区系影响的研究多是在饲粮中添加单宁酸开展的,而不同来源的单宁其组成可能有较大差异,对瘤胃微生物区系的影响可能不尽相同。而细菌数量和古菌群落结构与反刍动物瘤胃内甲烷的生成密切相关。因此,本研究以柠条作为单宁来源研究饲粮中不同水平单宁对瘤胃细菌、产甲烷菌数量和古菌多样性的影响,旨在为柠条这一非常规饲料资源开发利用和减少反刍动物生产中温室气体的排放提供科学依据。
1 材料与方法 1.1 试验设计本试验采用单因素完全随机试验设计,试验动物按照维持需要的1.2倍饲养,按照《动物营养参数与饲养标准》[12]配制饲粮,根据饲粮单宁水平分为3组,分别为Ⅰ组(对照组,不含单宁)、Ⅱ组(含2%单宁)和Ⅲ组(含4%单宁)。预试期14 d,正试期60 d。
饲粮中的单宁由柠条提供,选用结荚期的柠条,根据实测的柠条中缩合单宁含量确定Ⅱ组和Ⅲ组饲粮中柠条的用量,3组饲粮按照等能等氮原则配制,加工成全混合颗粒。柠条的营养成分和缩合单宁含量见王敬尧[13]。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets(DM basis) |
选择体况良好、1~1.5周岁、体重45 kg左右的杜蒙杂交羯羊15只,随机分为3组,每组5只。试验动物单笼饲养,自由饮水,统一驱虫。每天09:00和17:00各饲喂1次。
1.3 样本采集在正式试验期的第1天晨饲后6 h使用口腔采样器采集瘤胃液,经4层纱布过滤,分装于冻存管内液氮速冻后于-80 ℃保存。
1.4 瘤胃细菌和产甲烷菌数量的测定 1.4.1 微生物基因组DNA的提取瘤胃液基因组总DNA的提取参照李子健[14]的十六烷基三甲基溴化铵(CTAB)法。1.5%的凝胶电泳检测DNA的完整性,使用酶标仪测定粗提DNA的浓度和纯度。
1.4.2 目的基因的扩增引物委托北京六合华大基因科技有限公司合成,引物信息见表 2。
|
|
表 2 瘤胃细菌和产甲烷菌PCR扩增引物 Table 2 PCR amplification primers of ruminal bacteria and Methanogens |
PCR反应体系为25 μL, 分别为DNA模板2 μL,上、下游引物各1 μL,DNA连接酶12.5 μL,无酶水8.5 μL。反应参数:95 ℃预变性5 min,95 ℃变性30 s,退火温度根据菌种设定40 s,72 ℃延伸40 s,40个循环,72 ℃ 5 min,4 ℃保温。扩增产物用1.5%的琼脂糖凝胶检测,使用胶回收试剂盒回收目的片段。
1.4.3 PCR产物的克隆培养基的制备、载体的连接、阳性质粒转化及蓝白斑筛选方法参见李子健[14],阳性菌落测序委托北京六合华大基因科技有限公司,测序结果在NCBI上进行比对,相似度均达到95%以上,质粒提取试剂盒提取质粒,制作标准曲线。提取的质粒用酶标仪测定浓度和纯度,利用下列公式计算拷贝数。
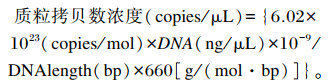
|
绝对定量前将样品浓度统一稀释到100 ng/μL,每个反应体系中加入同Priemix Taq相同量的荧光染料SYBR Green Ⅱ。将待测样品的Ct值代入相应的标准曲线得到拷贝数,计算公式如下:
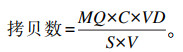
|
式中:MQ为根据标准曲线计算得到的拷贝数;C为样品基因组DNA浓度(ng/μL);VD为熔解基因组DNA时所用去离子水的体积(μL);S为RT-PCR反应中所用DNA的量(ng);V为提取样本基因组DNA时瘤胃液的用量(mL)。
1.5 瘤胃古菌多样性的测定 1.5.1 DNA提取和PCR扩增DNA提取和PCR扩增方法同1.4,引物信息见表 3。
|
|
表 3 测序分析采用的引物信息 Table 3 Information of primer for sequencing analysis |
测序工作委托上海美吉生物医药科技有限公司进行,利用Illumina公司的Miseq PE 300平台进行测序。
1.6 数据统计与分析数据经Excel 2013整理,运用SAS 9.0软件的ANOVA过程进行单因素方差分析,多重比较检验采用Duncan氏法,结果表示为平均值±标准差。以P<0.05作为差异显著性判断标准。
2 结果 2.1 饲粮中不同水平单宁对绵羊瘤胃细菌和产甲烷菌数量的影响从表 4可以看出,Ⅱ组和Ⅲ组的总细菌、白色瘤胃球菌、溶纤维丁酸弧菌、产琥珀酸丝状杆菌数量显著低于Ⅰ组(P<0.05),Ⅱ组和Ⅲ组间无显著差异(P>0.05)。Ⅱ组黄色瘤胃球菌数量显著低于Ⅰ组(P<0.05),Ⅰ组与Ⅲ组、Ⅱ组与Ⅲ组间无显著差异(P>0.05)。Ⅲ组产甲烷菌和甲烷短杆菌数量显著低于Ⅰ组(P<0.05),Ⅰ组与Ⅱ组、Ⅱ组与Ⅲ组间无显著差异(P>0.05)。
|
|
表 4 饲粮中不同水平单宁对绵羊瘤胃细菌和产甲烷菌数量的影响 Table 4 Effects of different levels of tannin in diets on number of rumen bacteria and Methanogens in sheep |
测序数据按最小样本序列进行抽平,经过质量控制后各组瘤胃古菌的多样性指数见表 5。本试验各组测序覆盖度均达到了0.99,满足后续分析要求。从15个样本中共得到703 996高质量的古菌16S rRNA基因序列,每个样本的平均clean reads数目为46 933,各组间无显著差异(P>0.05)。平均分类操作单元(OTU)数目为19,各组间无显著差异(P>0.05)。Ⅲ组香农指数显著低于Ⅰ组(P<0.05),Ⅰ组与Ⅱ组、Ⅱ组与Ⅲ组间无显著差异(P>0.05)、Ⅰ组辛普森指数显著低于Ⅱ组和Ⅲ组(P<0.05),其中Ⅱ组又显著低于Ⅲ组(P<0.05)。Ⅱ组和Ⅲ组Ace指数显著低于Ⅰ组(P<0.05),Ⅱ组和Ⅲ组间无显著差异(P>0.05)。各组间Chao1指数无显著差异(P>0.05)。
|
|
表 5 瘤胃古菌高通量测序质量控制与样品多样性指数 Table 5 High-throughput sequencing quality control and diversity indexes of ruminal archeae |
各组间瘤胃古菌在门水平上的群落组成无显著差异(P>0.05)(表 6),各组优势菌门均为广古菌门,其比例均在98%以上。在门水平上未分类的菌门丰度有随单宁水平的增加而下降的趋势。各组间瘤胃古菌在科水平上的组成无显著差异(P>0.05),各组的优势菌科均为甲烷杆菌科。在科水平上热变形菌科和未分类的菌科丰度均有随单宁水平的增加而下降的趋势。
|
|
表 6 瘤胃古菌在门、科水平上的物种比例(占总古菌比例大于1%) Table 6 Proportion of ruminal archea at phylum and family level (more than 1% of total archea) |
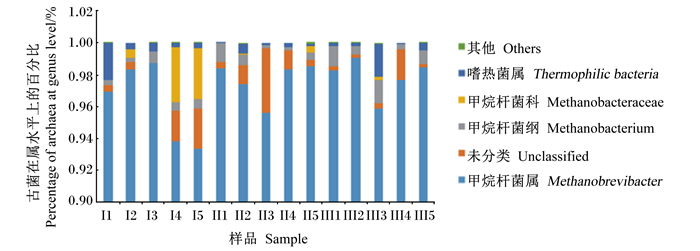
在属水平上各样本中均为甲烷短杆菌属所占比例最高(图 1)。由图 1可知,在属水平上各组中未分类的菌属所占比例较高,Ⅰ组和Ⅲ组甲烷杆菌在纲以下未进行分类的菌属所占比例比Ⅱ组高。
|
图 1 瘤胃古菌属水平上的群落组成 Fig. 1 Community composition of ruminal archea at genus level |
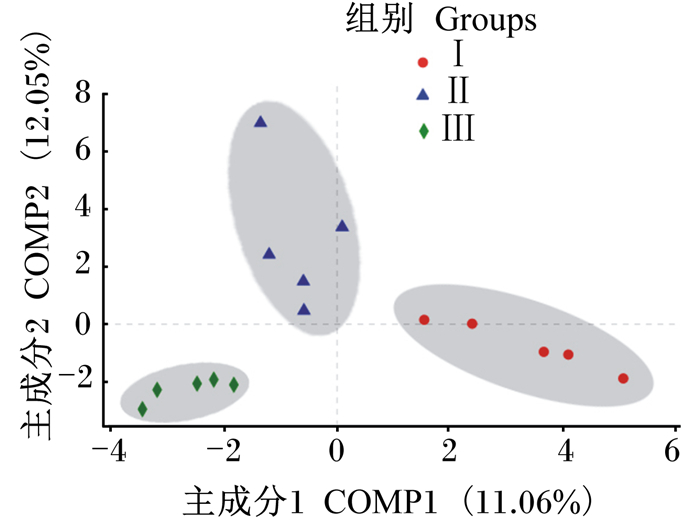
图 2为样本的OTU水平偏最小二乘法判别分析(PLS-DA),样本点的空间距离代表样本间的距离。主成分COMP1和COMP2在样本差异性贡献率上分别为11.06%和12.05%。且各组均被COMP1和COMP2所分开,各组样本不具有相似性。
|
图 2 瘤胃古菌OTU水平PLS-DA Fig. 2 PLS-DA of rumen archaea at OTU level |
反刍动物瘤胃微生物群落是一个复杂的整体,瘤胃中饲粮的降解是在细菌、真菌、古菌、原虫等微生物互相“协作”下完成的。饲粮中添加单宁会改变绵羊瘤胃中某些菌群数量。Tana等[15]研究表明,缩合单宁能够显著降低产甲烷菌数量。张梅梅[16]研究发现,饲粮中添加2%和6%的单宁降低了瘤胃总细菌、产琥珀酸丝状杆菌、黄色瘤胃球菌和产甲烷菌的数量。赵薇等[17]研究发现,在延边黄牛基础饲粮中添加3%不同相对分子质量的缩合单宁,溶纤维丁酸弧菌和甲烷菌数量显著降低,细菌数量呈下降趋势。汪海峰[18]指出,缩合单宁可以改变微生物细胞形态结构。本研究得出,饲粮中添加2%和4%单宁显著降低了绵羊瘤胃中总细菌、白色瘤胃球菌、溶纤维丁酸弧菌、产琥珀酸丝状杆菌数量。饲粮中添加2%单宁显著降低了黄色瘤胃球菌数量,而添加4%单宁组黄色瘤胃球菌数量也有下降趋势。饲粮中添加4%单宁显著降低了绵羊瘤胃中产甲烷菌和甲烷短杆菌数量,而2%单宁组产甲烷菌和甲烷短杆菌数量也有下降趋势。本试验结果与上述研究结果一致,其原因可能是单宁改变了瘤胃细菌和产甲烷菌细胞的形态结构,使细胞壁塌陷、褶皱[10]。单宁对细菌细胞膜的破坏以及结合蛋白质的能力也是导致瘤胃细菌数量发生改变的主要因素之一。
古菌作为瘤胃微生物不可或缺的一部分,其作用不可忽视。产甲烷菌属于古菌,甲烷是产甲烷菌代谢的最终产物,瘤胃内的产甲烷菌通过共生、黏附和伴生模式, 分别从原虫、细菌和真菌中摄取氢, 保证氢营养型甲烷生成途径的顺利进行。抑杀原虫和产氢细菌、竞争性结合氢和阻断氢生成甲烷[19]。甲烷是重要的温室气体, 也是新的清洁能源。反刍动物甲烷排放会导致能量的损失,也会加重温室效应。前人研究指出,反刍动物饲粮中添加缩合单宁会减少甲烷的排放[20]。Waghorn等[21]研究表明,饲粮中添加含单宁的豆科牧草可以减少绵羊甲烷排放量。Animut等[22]研究表明,在山羊饲粮中添加含缩合单宁的胡枝子会减少甲烷的排放。本课题组前期研究表明,柠条来源的单宁可以降低绵羊甲烷排放[13]。本研究得出,饲粮中添加4%单宁可以显著降低产甲烷菌和甲烷短杆菌数量,饲粮中添加2%单宁也有降低产甲烷菌和甲烷短杆菌数量的趋势。这与上述研究结果相一致,其原因是因为单宁通过减少绵羊瘤胃中产甲烷菌数量而降低甲烷排放量。
3.2 饲粮中不同水平单宁对绵羊瘤胃古菌多样性的影响瘤胃古菌作为瘤胃内微生物的一部分,对反刍动物能量代谢有着积极的作用。瘤胃古菌的多样性与反刍动物甲烷的排放量密切相关。辛普森指数和香农指数表征微生物群落多样性,群落多样性与辛普森指数呈负相关,与香农指数呈正相关。Ace指数和Chao1指数表征微生物群落丰度,群落丰度与Ace指数和Chao1指数均呈正相关。Franzolin等[23]研究了水牛瘤胃中甲烷菌多样性,得出甲烷短杆菌属为水牛瘤胃甲烷菌的优势菌属。St-Pierre等[24]发现反刍动物瘤胃甲烷菌以甲烷短杆菌属为主,其次是甲烷球菌属和热源体属。Cheng等[25]对山羊瘤胃产甲烷菌进行了多样性分析,得出甲烷杆菌属为山羊瘤胃中主要的产甲烷菌。本研究得出,绵羊瘤胃古菌共分为6个属,各组中占比最高的均为甲烷短杆菌属,这与以上研究结果一致。林波等[26]研究指出,水牛瘤胃甲烷菌在属水平上的组成不会随着饲粮精粗比的变化而发生改变。Saminathan等[27]研究表明,缩合单宁分子量的增加会显著降低黑头黄源肉牛瘤胃产甲烷菌多样性。Zhao等[28]研究表明,外界环境和饲粮组成的变化并不会影响反刍动物瘤胃内甲烷菌各水平上的组成。本研究得出,饲粮中添加单宁提高了绵羊瘤胃古菌辛普森指数,降低了香农指数和Ace指数,表明单宁降低了瘤胃古菌的群落多样性和菌群丰度。这与本试验得出的2%和4%单宁组产甲烷菌菌群数量低于对照组的结果一致。结合本课题组前期研究发现的2%和4%单宁组绵羊单位干物质采食量甲烷的排放量低于对照组的结果[13],分析得出单宁可能通过改变瘤胃古菌的群落结构影响产甲烷菌代谢路径减少瘤胃发酵过程中甲烷的生成,其机制还有待进一步研究。
4 结论饲粮中含2%和4%柠条来源的单宁减少了绵羊瘤胃细菌和产甲烷菌数量,降低了瘤胃古菌多样性和菌群丰度。
| [1] |
王兴蕾, 梁飘飘, 赵敏杰, 等. 内蒙古阿拉善左旗六种常见沙生植物的营养成分与氨基酸组成分析[J]. 光谱学与光谱分析, 2019, 39(1): 204-209. |
| [2] |
史志诚. 单宁生物活化理论及其应用[J]. 江北农业大学学报, 1987, 17(1): 2732. |
| [3] |
朱南山, 张彬, 李丽立. 单宁的抗营养作用机理及处理措施[J]. 中国饲料, 2006(17): 26-29. |
| [4] |
郑会超, 刘建新, 吴跃明, 等. 单宁对反刍动物营养代谢的影响[J]. 黄牛杂志, 2004, 30(6): 23-25, 32. |
| [5] |
丁学智.单宁酸对瘤胃发酵特性及甲烷产量的影响[D].硕士学位论文.兰州: 甘肃农业大学, 2006.
|
| [6] |
金龙.紫色达利菊提取缩合单宁对大肠杆菌和瘤胃氮代谢以及瘤胃微生物的影响[D].博士学位论文.哈尔滨: 东北农业大学, 2011.
|
| [7] |
周奕毅.茶皂素抑制湖羊甲烷生成的微生物学机制研究[D].硕士学位论文.杭州: 浙江大学, 2009.
|
| [8] |
刘云龙, 王炳, 刁其玉, 等. 绵羊甲烷排放规律及减排技术研究[J]. 饲料工业, 2018, 39(15): 43-47. |
| [9] |
周怿, 刁其玉. 反刍动物瘤胃甲烷气体生成的调控[J]. 草食家畜, 2008(4): 21-24. |
| [10] |
王卫云.不同水平的单宁对瘤胃主要纤维降解细菌纤维降解特性和细胞形态结构的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2017.
|
| [11] |
ZHOU K, BAO Y, ZHAO G Y. Effects of dietary crude protein and tannic acid on rumen fermentation, rumen microbiota and nutrient digestion in beef cattle[J]. Archives of Animal Nutrition, 2019, 73(1): 30-43. |
| [12] |
张宏福. 动物营养参数与饲养标准[M]. 3版. 北京: 中国农业出版社, 2010: 361, 456.
|
| [13] |
王敬尧.单宁对绵羊瘤胃发酵参数、营养物质消化率和甲烷排放量的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2019.
|
| [14] |
李子健.不同生理阶段奶牛瘤胃细菌菌群数量与多样性的比较研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2018.
|
| [15] |
TANA H Y, SIEO C C, ABDULLAH N, et al. Effects of condensed tannins from Leucaena on methane production, rumen fermentation and populations of methanogens and protozoa in vitro[J]. Animal Feed Science and Technology, 2011, 169(3/4): 185-193. |
| [16] |
张梅梅.日粮中添加单宁对绵羊和绒山羊瘤胃细菌数量和多样性影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2015.
|
| [17] |
赵薇, 沈寿东, 李成云, 等. 不同相对分子质量缩合单宁对延边黄牛瘤胃总菌、溶纤维丁酸弧菌和产甲烷菌的影响[J]. 饲料研究, 2014(17): 53-57. |
| [18] |
汪海峰. 缩合单宁对反刍动物的营养作用[J]. 中国饲料, 2004(12): 24-28. |
| [19] |
金舒文, 王佳堃. 瘤胃产甲烷菌与其他微生物间的氢传递及其调控研究进展[J]. 中国畜牧杂志, 2019, 55(2): 1-6. |
| [20] |
ROTH S, STEINGASS H, DROCHNER W.Minde-rung von methane emission und optimierung der N-versorgung bei w iederkauern durch die behandlungvon futtermitteln mitTanninen[M]//BOCKER R.Hohenheimer Umw Elttagung.Stuttgart: Verlag GunterHeimbach, 2002: 181-186.
|
| [21] |
WAGHORN G C, TAVENDALE M H, WOOD-FIELD D R. Methanogenesis from forages fed tosheep[J]. Processing of New Zealand Grassland Association, 2002, 64: 167-171. |
| [22] |
ANIMUT G, PUCHALA R, GOETSCH A L, et al. Methane emission by goats consuming diets with different levels of condensed tannins from lespedeza[J]. Animal Feed Science and Technology, 2008, 144(3/4): 212-227. |
| [23] |
FRANZOLIN R, ST-PIERRE B, NORTHWOOD K, et al. Analysis of rumen methanogen diversity in water buffaloes (Bubalus bubalis) under three different diets[J]. Microbial Ecology, 2012, 64(1): 131-139. |
| [24] |
ST-PIERRE B, WRIGHT A D G. Diversity of gut methanogens in herbivorous animals[J]. Animal, 2011, 7(Suppl.1): 49-56. |
| [25] |
CHENG Y F, MAO S Y, LIU J X, et al. Molecular diversity analysis of rumen methanogenic Archaea from goat in eastern China by DGGE methods using different primer pairs[J]. Letters in Applied Microbiology, 2009, 48(5): 585-592. |
| [26] |
林波, 梁辛, 李丽莉, 等. 饲粮精粗比对泌乳水牛瘤胃细菌和甲烷菌区系的影响[J]. 动物营养学报, 2016, 28(10): 3101-3109. |
| [27] |
SAMINATHAN M, SIEO C C, GAN H M, et al. Effects of condensed tannin fractions of different molecular weights on population and diversity of bovine rumen methanogenic archaea in vitro, as determined by high-throughput sequencing[J]. Animal Feed Science and Technology, 2016, 216: 146-160. |
| [28] |
ZHAO M, HÜNERBERG M, BEAUCHEMIN K, et al. Individuality of ruminal methanogen/protozoa populations in beef cattle fed diets containing dried distillers'grain with solubles[J]. Acta Agriculturae Scandinavica, Section A:Animal Science, 2012, 62(4): 273-288. |




