2. 河北省畜牧兽医研究所, 保定 071001;
3. 安琪酵母股份有限公司, 宜昌 443000;
4. 石家庄市藁城区畜牧工作总站, 石家庄 052160
2. Hebei Institute of Animal Husbandry and Veterinary Medicine, Baoding 071001, China;
3. Angel Yeast Co., Ltd., Yichang 443000, China;
4. Shijiazhuang Gaocheng Animal Husbandry Work Station, Shijiazhuang 052160, China
羔羊的健康饲养是养羊生产的重要环节,羔羊阶段尤其是断奶阶段的生长发育状况直接决定其后期生产潜力。当前,如何在生产中降低羔羊断奶应激,减少疾病发生,寻找具有促生长作用且绿色环保、安全无抗的生物饲料添加剂已成为饲料研发的重要方向。酵母细胞壁(yeast cell wall,YCW)是酿酒酵母生产过程中的副产物,其主要功能成分为β-葡聚糖和甘露聚糖,可以提高动物机体免疫力[1],抑制动物肠道有害菌繁殖,改善动物健康状况,还可以吸附饲料霉菌毒素,促进动物机体生长[2-3]。Baldwin等[4]研究表明,酵母细胞壁能够提高哺乳期动物的生长性能,促进幼畜肠道组织形态的发育;Nargeskhani等[5]研究显示,酵母甘露寡糖能够有效提高增加断奶犊牛的日增重;邵亚群等[6]研究发现,在犊牛饲粮中添加0.4%的酵母细胞壁能够提高犊牛的生长性能,增强机体免疫能力;许飞龙等[7]给保育猪断奶初期饲粮中添加250 mg/kg酵母细胞壁,结果显示能够提高保育猪的采食量和日增重。目前,有关酵母细胞壁的研究多集中在对动物生长性能和免疫功能的改善方面。由于断奶期羔羊特殊的生理阶段和胃肠道结构,对其胃肠道发育进行研究对于缓解断奶应激具有重要意义,但有关酵母细胞壁对其胃肠道发育影响的研究鲜有报道。本试验通过在断奶羔羊饲粮中添加不同水平的酵母细胞壁,拟研究酵母细胞壁对断奶羔羊生长性能、免疫能力及胃肠道发育的影响,探究断奶羔羊饲粮中酵母细胞壁的适宜添加量,为断奶期羔羊的饲养提供参考。
1 材料与方法 1.1 试验设计与饲养管理选择7日龄、初始体重相近、生长状况良好的哺乳羔羊48只,随机分为4组,每组3个重复,每个重复4只,保证各组间羊只初始体重差异不显著(P>0.05)。在随母哺乳的基础上从7日龄开始补饲开食料,自由饮水,各组开食料中酵母细胞壁(由安琪酵母股份有限公司提供,主要成分β-葡聚糖含量≥20%、甘露聚糖含量≥20%)添加量分别为0(Ⅰ组,作为对照组)、0.25%组(Ⅱ组)、0.50%(Ⅲ组)、0.75%组(Ⅳ组),试验期60 d。各组羔羊均随母哺乳,每组12只母羊,胎次一致,全部为双羔,1公1母。各组饲养管理条件相同,保持羊圈内通风良好,空气新鲜,圈舍每周消毒1次,依照羊场免疫程序对羔羊进行免疫,注意观察羊的异常行为及时发现疾病的发生,每天清理剩余开食料并称重记录。
1.2 羔羊开食料组成及营养水平羔羊开食料参照《肉羊饲养标准》(NY/T 816—2004)进行配制,精粗比为7 : 3,粗饲料为玉米青贮,精料主要为玉米、豆粕、酒糟、预混料等,开食料组成及营养水平见表 1。
|
|
表 1 开食料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of starters (air-dry basis) |
试验羊每隔30 d空腹称重1次,称重时要求选择08:00开始,且称重前1天20:00停料,记录结果,计算平均日增重(ADG)。每天早晚准确记录开食料的供给量、剩余量和损耗量,损耗量为投料之后落在饲槽之外的饲料量,每5 d统计1次,计算平均日采食量。根据一定时期内总采食量和体增重计算料重比(F/G)。
1.3.2 血清免疫指标试验第60天晨饲前对羔羊静脉采血10 mL,阴凉处静置30 min后10 000 r/min离心15 min,分离血清,-20 ℃保存备测血清免疫指标。血清中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、白细胞介素-1β(IL-1β)、白细胞介素-2(IL-2)、白细胞介素-4(IL-4)和肿瘤坏死因子-α(TNF-α)使用酶联免疫吸附试验(ELISA)试剂盒[购于卡迈舒(上海)生物科技有限公司],采用双抗体夹心法,使用酶标仪进行检测,具体操作步骤参考试剂盒说明书。
1.3.3 胃肠道发育指标饲养试验结束后,每组随机挑选4只羔羊,屠宰,取瘤胃前背盲囊及十二指肠、空肠和回肠中段各10 cm,用生理盐水冲净残余内容物,迅速将样品浸泡在4%甲醛固定液中,采用石蜡切片法制作组织切片。在显微镜10×10倍光镜下观察并照相,用Image J软件测量瘤胃乳头长度、宽度以及黏膜厚度,小肠绒毛高度(VH)、隐窝深度(CD)和黏膜厚度。每个样本观察3个非连续切片,每张切片选取3个视野,每个视野分别测定3组数据后求平均值。
1.4 数据统计与分析试验数据采用SPSS 19.0统计软件进行单因素方差分析,并用Duncan氏法进行多重比较。试验结果用平均值±标准差表示,以P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 酵母细胞壁对羔羊生长性能的影响由表 2可知,Ⅱ组和Ⅲ组的ADG比Ⅰ组分别增加了5.8%(P>0.05)和23.6%(P < 0.05),Ⅳ组的ADG比Ⅰ组降低了14.9%(P < 0.05),同时Ⅲ组的ADG还极显著高于Ⅳ组(P < 0.01);Ⅲ组和Ⅳ组的ADFI显著低于Ⅰ组和Ⅱ组(P < 0.05);Ⅲ组的F/G最低,比Ⅰ组和Ⅳ组分别降低了33.3%和40.0%(P < 0.01)。
|
|
表 2 酵母细胞壁对羔羊生长性能的影响 Table 2 Effects of yeast cell wall on growth performance of lambs |
由表 3可知,Ⅲ组的血清IgA和IgG含量较Ⅰ组显著增加(P < 0.05),分别增加了26.9%、21.3%;血清IgM含量各组之间差异不显著(P>0.05);Ⅲ组和Ⅳ组血清IL-1β含量分别比Ⅰ组增加了13.1%和28.5%,差异显著(P < 0.05),且Ⅳ组血清IL-1β含量还比Ⅱ组和Ⅲ组分别增加了19.0%和13.7%(P < 0.05);Ⅲ组和Ⅳ组血清IL-2含量均较Ⅰ组显著增加(P < 0.05),分别提高了43.3%和25.4%,且Ⅲ组血清IL-2含量还比Ⅱ组增加了33.8%(P < 0.05);Ⅲ组和Ⅳ组血清IL-4含量均较Ⅰ组显著增加(P < 0.05),分别增加了29.9%、15.6%,且Ⅲ组的血清IL-4含量还比Ⅱ组提高了25.5%(P < 0.05);Ⅱ组血清TNF-α含量较Ⅰ组和Ⅲ组分别提高了18.0%、24.9%(P < 0.05),Ⅳ组的TNF-α含量较Ⅰ组和Ⅲ组分别提高了17.9%和24.8%(P < 0.05)。
|
|
表 3 酵母细胞壁对羔羊血清免疫指标的影响 Table 3 Effects of yeast cell wall on serum immune indexes of lambs |
由表 4和图 1可见,Ⅲ组的瘤胃乳头长度分别比Ⅰ组、Ⅱ组和Ⅳ组增加了24.5%、14.7%和24.5%(P < 0.05);Ⅲ组的瘤胃乳头宽度比Ⅰ组增加了26.4%(P < 0.05);瘤胃黏膜厚度各组之间差异不显著(P>0.05)。Ⅳ组的空肠绒毛高度比Ⅱ组增加了68.7%(P < 0.05);空肠隐窝深度和肌层厚度各组之间差异不显著(P>0.05)。Ⅲ组的回肠绒毛高度比Ⅰ组和Ⅱ组分别增加了19.0%、18.2%(P < 0.05),Ⅳ组的回肠绒毛高度比Ⅰ组和Ⅱ组分别增加了21.3%、20.5%(P < 0.05);Ⅱ组的回肠隐窝深度比Ⅰ组和Ⅲ组分别增加了34.2%、43.1%(P < 0.05),Ⅳ组的回肠隐窝深度比Ⅲ组增加了27.2%(P < 0.05);Ⅲ组的回肠肌层厚度比Ⅰ组和Ⅱ组分别增加了32.7%、22.9%(P < 0.05)。Ⅳ组的十二指肠绒毛高度比Ⅰ组和Ⅱ组分别增加了46.8%和31.3%(P < 0.05);Ⅲ组的十二指肠隐窝深度比Ⅰ组和Ⅱ组分别增加了29.4%、20.5%(P < 0.05),Ⅳ组的十二指肠隐窝深度比Ⅰ组和Ⅱ组分别增加了37.9%、28.4%(P < 0.05);Ⅲ组的十二指肠肌层厚度比Ⅰ组、Ⅱ组分别增加了76.9%、59.9%(P < 0.05)。
|
|
表 4 酵母细胞壁对羔羊瘤胃及肠道形态的影响 Table 4 Effects of yeast cell wall on rumen and intestinal morphology of lambs |
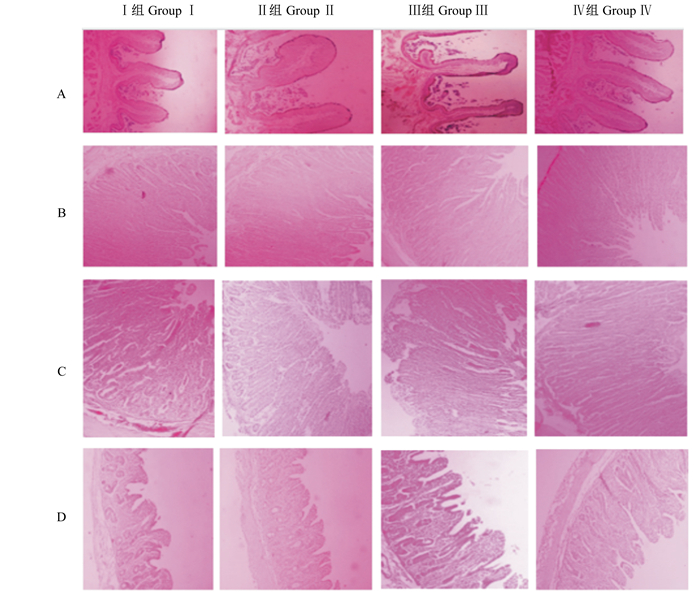
|
A:瘤胃前背盲囊rumen prodorsum blind sac;B:空肠jejunum;C:回肠ileum;D:十二指肠duodenum。 图 1 酵母细胞壁对羔羊瘤胃和小肠形态发育的影响 Fig. 1 Effects of yeast cell wall on rumen and small intestine morphological development of lambs (100×) |
酵母细胞壁是一种功能性饲料原料,对霉菌毒素、细菌性疾病及免疫抑制造成的应激有良好的缓解作用,对动物的生产性能有着良好的改善效果[3]。哺乳期反刍动物的瘤胃发育不完全,所以消化能力比较低下。已有研究发现酵母细胞壁能够提高动物的生长性能,促进幼畜肠道组织形态的发育[4]。目前很多国家和地区都已禁止使用抗生素,所以酵母细胞壁经常被用来作为抗生素的替代品。研究表明,酵母甘露寡糖能够有效增加断奶犊牛的ADG[5];饲粮中添加0.4%的酵母细胞壁能够提高犊牛的生长性能,增强机体免疫力;饲粮中添加250 mg/kg酵母细胞壁能够提高保育猪的采食量和日增重。本试验选择日龄和初始体重相近、生长状况良好的哺乳羔羊48只,并在其饲粮中添加不同水平的酵母细胞壁,其中Ⅱ组和Ⅲ组的ADG比未添加的酵母细胞壁的Ⅰ组分别增加了5.8%和23.6%;Ⅱ组和Ⅲ组的F/G分别比Ⅰ组降低了5.1%和33.0%。上述结果说明酵母细胞壁能够增强羔羊的ADG,并降低F/G,促进羊只的生长,该结果与上述前人的研究结果一致,说明酵母细胞壁对断奶羔羊有积极作用,能够促进其生长,提高其生长性能。
3.2 酵母细胞壁对羔羊免疫能力的影响IgA、IgM和IgG是一类免疫球蛋白,主要参与机体内的体液免疫,对机体有着至关重要的作用。IgM参与机体初次免疫应答,而IgG是机体体液免疫的主要抗体,免疫球蛋白含量的高低体现了机体免疫力的强弱[8]。酵母细胞壁中含有葡聚糖,能通过多种介导途径增强动物机体特异性免疫和非特异性免疫水平[9]。有研究表明,在蛋鸡饲粮中添加酵母细胞壁,能够增加蛋鸡血清球蛋白的含量,从而增强蛋鸡的非特异性免疫能力[10]。王辉田等[1]按2 000 mg/kg的剂量,将酵母细胞壁多糖添加至肉仔鸡饲粮中,结果发现酵母细胞壁能使肉鸡的机体免疫力增强。黄婧溪等[11]发现酵母细胞壁多糖可以通过提高免疫力和抗氧化能力来促进黄羽肉鸡的生长,从而提高生长性能。在本试验中,Ⅲ组的血清IgA和IgG含量比Ⅰ组显著增多,该结果与上述前人研究结果一致,说明在断奶羔羊饲粮中添加酵母细胞壁能够使羔羊血清中的免疫球蛋白含量增多,有利于增强机体免疫能力,促进生长发育。
免疫细胞因子是动物血清中参与抗炎过程的重要物质,细胞因子含量的多少体现了动物机体的健康状况[12]。IL-2和IL-4能够刺激T细胞生长,并且能够促进B细胞和自然杀伤细胞增殖分化,从而促进细胞免疫,增强机体免疫能力。有学者研究发现,酵母甘露寡糖可以显著降低绵羊血清TNF-α含量[13]。徐杰等[14]在断奶仔猪饲粮中添加酵母细胞壁多糖,虽然酵母细胞壁多糖不能增强仔猪的体液免疫,但能在一定程度上提高其免疫性能。在本试验中,以Ⅲ组和Ⅳ组血清IL-2、IL-4含量较高,显著高于未添加的酵母细胞壁的Ⅰ组,说明在该添加量下的酵母细胞壁增强了羔羊的免疫能力。有研究发现,IL-1β和TNF-α的含量越高,动物的生长能力越弱[15],但是本试验结果中,Ⅲ组的IL-1β含量比Ⅰ组和Ⅱ组含量高,而生长性能优于这2组,这可能原因是:由于在饲喂过程中母羊出现如乳房炎等产后疾病,而Ⅲ组的母羊出现产后疾病的只数少于其他组。
3.3 酵母细胞壁对羔羊胃肠道发育的影响胃肠道的发育情况与羊只的消化能力息息相关,羊只的胃肠道发育良好,对摄入饲料的消化能力增强,有利于营养物质的吸收,从而促进机体生长,提高生长性能。瘤胃的发育程度主要由瘤胃乳头长度、宽度和黏膜厚度来决定[16]。董金金等[17]用犊牛作为试验动物,在其饲粮中添加2 g/(头·d)酵母多糖,结果显示瘤胃乳头长度、宽度和黏膜厚度都得到了显著提高。本试验中,Ⅲ组的瘤胃乳头长度比其他3组显著提高,瘤胃乳头宽度比Ⅰ组显著提高,各组的黏膜厚度差异不显著,该结果与上述报道结果相符,说明酵母细胞壁能够增加瘤胃乳头长度和宽度,增强消化能力,有助于营养物质的吸收,从而提高其生长性能。
肠道是食物消化吸收的重要场所,肠道上皮是行使肠道功能的重要结构,同时也是外界环境与内部环境之间的一道重要屏障,保护机体免受肠道病原微生物的侵害。小肠在反刍动物消化过程中起到重要作用,绒毛高度、隐窝深度及肌层厚度等指标能衡量动物的消化吸收功能,隐窝深度越深,肠道的消化吸收能力越弱。绒毛高度与隐窝深度之比是综合反映小肠功能状态的指标,当绒毛高度增加,隐窝深度降低时,小肠的消化吸收功能增强。小肠肌层厚度增加,小肠对营养物质的消化吸收能力增强。董金金等[17]在犊牛饲粮中添加酵母多糖后发现犊牛的隐窝深度变浅,小肠的消化吸收功能得到提高。黄俊文等[18]发现甘露寡糖能显著降低仔猪小肠隐窝深度,李玉欣等[19]在仔猪饲粮中添加毕赤酵母甘露寡糖后也发现了相同结果。本试验中的部分试验结果与前人研究结果相一致,说明酵母细胞壁能够改变羔羊的肠道组织形态,增强其消化吸收功能,从而促进机体生长。
4 结论饲粮中添加酵母细胞壁能够增强断奶羔羊的免疫能力,改变其胃肠道形态,从而提高其消化吸收功能,促进羊只生长发育,提高生长性能。在本试验条件下,断奶羔羊饲粮中酵母细胞壁的添加量以0.50%为宜。
| [1] |
王辉田, 孙超, 陈思, 等. 酵母细胞壁多糖对肉仔鸡生长性能及免疫力的影响[J]. 中国饲料料, 2013(13): 11-14. |
| [2] |
田书音, 李冰. 酵母细胞壁在动物生产中的应用[J]. 饲料博览, 2015(1): 31-34. |
| [3] |
管秀界, 张亚丽, 张鑫, 等. 两种酵母细胞壁对肉鸡生产性能、死淘率和血液免疫的影响[J]. 中国家禽, 2019, 41(9): 44-47. |
| [4] |
BALDWIN Ⅳ R L, MCLEOD K R, KLOTZ J L, et al. Rumen development, intestinal growth and hepatic metabolism in the pre- and postweaning ruminant[J]. Journal of Dairy Science, 2004, 87(Suppl.): E55-E65. |
| [5] |
NARGESKHANI A, DABIRI N, ESMAEILKHANIAN S, et al. Effects of mannanoligosaccharide-β glucan or antibiotics on health and performance of dairy calves[J]. Animal Nutrition and Feed Technology, 2010, 10(1): 29-36. |
| [6] |
邵亚群, 王之盛, 王鸿泽, 等. 酵母细胞壁对犊牛生长性能、营养物质表观消化率和血清免疫指标的影响[J]. 动物营养学报, 2019, 31(1): 378-387. |
| [7] |
许飞龙, 褚青坡, 李会智, 等. 酵母细胞壁多糖对断奶仔猪生产性能和免疫性能的影响[J]. 畜牧与兽医, 2016, 48(11): 43-47. |
| [8] |
周顺伍. 动物生物化学[M]. 北京: 化学工业出版社, 2008.
|
| [9] |
黄鑫, 曾雨雷, 王建林, 等. 酵母细胞壁多糖的结构及功能研究进展[J]. 中国饲料, 2014(23): 42-43. |
| [10] |
贺淼, 廖灿青, 黄鑫, 等. 酵母细胞壁对海兰褐商品代蛋鸡产蛋性能及血液免疫的影响[J]. 中国饲料, 2018(1): 88-91. |
| [11] |
黄婧溪, 夏超笃, 罗龙军, 等. 酵母细胞壁多糖对黄羽肉鸡生长性能、免疫及抗氧化能力的影响[J]. 饲料工业, 2018, 39(1): 27-31. |
| [12] |
胡迎利, 徐春兰, 汪以真. 动物黏膜免疫与细胞因子的研究进展[J]. 中国兽药杂志, 2005, 39(12): 32-35. |
| [13] |
ZHENG C, LI F D, HAO Z L, et al. Effects of adding mannan oligosaccharides on digestibility and metabolism of nutrients, ruminal fermentation parameters, immunity, and antioxidant capacity of sheep[J]. Journal of Animal Science, 2018, 96(1): 284-292. |
| [14] |
徐杰, 陈晖, 陈中平, 等. 日粮中添加酵母细胞壁多糖对断奶仔猪生产性能和免疫性能的影响[J]. 中国饲料, 2018(7): 83-86. |
| [15] |
JOHNSON R W. Inhibition of growth by pro-inflammatory cytokines:an integrated view[J]. Journal of Animal Science, 1997, 75(5): 1244-1255. |
| [16] |
LESMEISTER K E, TOZER P R, HEINRICHS A J. Development and analysis of a rumen tissue sampling procedure[J]. Journal of Dairy Science, 2004, 87(5): 1336-1344. |
| [17] |
董金金, 高艳霞, 李妍, 等. 酵母多糖对哺乳犊牛胃肠道发育及消化酶活性的影响[J]. 动物营养学报, 2018, 30(12): 5247-5254. |
| [18] |
黄俊文, 林映才, 冯定远, 等. 纳豆菌、甘露寡糖对仔猪肠道PH、微生物区系及肠黏膜形态的影响[J]. 畜牧兽医学报, 2005, 36(10): 1021-1027. |
| [19] |
李玉欣, 张立梅, 韩丹丹, 等. 毕赤酵母甘露寡糖对断奶仔猪生产性能肠道绒毛和细胞因子的影响[J]. 中国兽医杂志, 2015, 51(11): 33-35. |




