2. 赣州市畜牧研究所, 赣州 341401
2. Ganzhou Animal Husbandry Research Institute, Ganzhou 341401, China
肠道是一种复杂的器官,既要保持对共生微生物群的耐受性,又要对入侵的病原微生物产生炎症反应[1]。紧密连接是肠道上皮细胞之间的主要连接方式,而紧密连接蛋白是组成紧密连接结构的基础[2]。紧密连接蛋白的表达量在一定程度上可以反映肠道机械屏障功能[3-4]。肠道上皮细胞还能够通过分泌细胞因子、趋化因子调节肠道的免疫应答[5]。因此,调节肠上皮细胞的紧密连接蛋白表达和细胞因子含量对维持肠道屏障功能具有十分重要的意义。研究表明,病原菌对肠道细胞间的紧密连接结构具有破坏作用,使肠道的通透性增高,损坏肠道的屏障功能[6-7]。而植物多糖作为一种生物活性物质,具有免疫调节和抗氧化的功能[8]。Wan等[9]在饲粮中添加海藻酸低聚糖后发现,仔猪的免疫性能和肠道屏障功能得到显著提高。饲粮中添加岩藻多糖可促进小鼠脾细胞增殖和自然杀伤细胞活性,对预防和抵抗细菌病毒感染具有很好的效果[10]。海带多糖可通过核转录因子-κB(NF-κB)、核因子E2相关因子2(Nrf2)、Toll样受体(TLR)等信号通路调节上皮细胞和淋巴细胞的增殖分化,提升机体免疫性能和肠道屏障功能[11]。而岩藻糖则可促进大脑微血管内皮细胞紧密连接蛋白闭合小环蛋白-1(ZO-1)的表达,从而达到维持其上皮通透性的作用[12]。目前,关于海藻多糖在调节仔猪肠道上皮细胞紧密链接蛋白和NF-κB炎症信号通路相关基因表达方面的研究还尚未见报道,不同浓度海藻多糖对细胞水平上屏障功能的作用效果还不明确。当前学者对海藻多糖的研究大多都集中在海藻多糖的医疗保健作用方面,而在生猪方面的应用研究较少,仅有少数的研究表明其可以提高仔猪的生长性能和改善肠道菌群结构。因此,本试验旨在通过研究不同浓度海藻多糖对仔猪小肠上皮细胞紧密连接蛋白闭锁蛋白(occludin)、封闭蛋白-1(claudin-1)和ZO-1及炎症通路相关蛋白髓样分化蛋白88(MyD88)、p65、TLR-4和核转录因子-κB抑制蛋白α(IκBα)基因表达,以及细胞上清液中促炎症因子肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)含量的分析,探讨海藻多糖对仔猪小肠上皮细胞屏障功能的调控作用,以期为海藻多糖对仔猪肠道健康的调节作用提供一定的理论依据。
1 材料与方法 1.1 试验材料 1.1.1 海藻多糖海藻多糖纯度为99%,主要成分为L-岩藻糖和D-木糖。配制时用DMEM : F12培养基(Gibco公司,美国)溶解,0.22 μm除菌过滤器过滤除菌,现用现配。
1.1.2 仔猪小肠上皮细胞仔猪小肠上皮细胞(IPEC-J2细胞)由中国农业大学农业部饲料工业中心馈赠。
1.2 试验方法 1.2.1 IPEC-J2细胞培养完全培养基的配制:89% DMEM : F12(体积比1 : 1)+10%胎牛血清(Bioind公司,以色列)+1%的双抗(索莱宝科技有限公司,北京),吹打混匀,4 ℃保存,1周内使用。
IPEC-J2细胞采用75 cm2的细胞瓶培养,细胞培养于5%的CO2培养箱(Thermo公司,美国),24 h换液1次,待细胞融合80%,采用0.25%的胰酶-乙二胺四乙酸(EDTA)消化。1 200 r/min离心5 min后将细胞接种于6孔板上,每孔接种细胞数量为6×104个/孔,细胞培养24 h后加入终浓度分别为0(对照)、60、120和240 μg/mL的海藻多糖处理培养基,继续培养24 h后用于后续试验测定。
1.2.2 mRNA表达量测定采用实时荧光定量PCR法测定IPEC-J2细胞occludin、claudin-1、ZO-1、TLR-4、IκBα、MyD88和p65的mRNA相对表达量。根据GenBank提供的猪基因序列,用Primer Express 5.0软件设计occludin、claudin-1、ZO-1、TLR-4、IκBα、MyD88和p65的基因特异性扩增引物。引物序列见表 1,引物由上海生物工程有限公司合成。
|
|
表 1 IPEC-J2细胞实时荧光定量PCR特异性引物序列 Table 1 Specific primer sequence for real-time fluorescence quantification PCR of IPEC-J2 cells |
按照Trizol试剂盒(TaKaRa,日本)使用说明提取总RNA。RNA质量和浓度使用超微量核酸分析仪(Biodrop公司,英国)进行检测,其纯度以A260/A280比值介于1.8~2.0为使用标准。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,根据PrimeScriptTM RT-reagent Kit(TaKaRa,日本)说明书步骤,采用两步法将RNA反转录为cDNA。以反转录产物cDNA为模板使用荧光定量PCR(CFX96,Bio-Rad公司,英国)进行基因扩增,荧光定量PCR体系组成见表 2。反应程序为:95 ℃ 3 min预变性,95 ℃ 10 s变性;58 ℃ 30 s延伸;40个循环。各组基因的mRNA相对表达量用2-△△Ct法计算。
|
|
表 2 荧光定量体系组成 Table 2 Fluorescence quantification PCR system composition |
当IPEC-J2细胞融合至80%~90%时,弃去细胞培养板中的培养基,磷酸缓冲盐溶液(PBS)冲洗3次,加入300 mL放射免疫沉淀法(RIPA)裂解液,分别加入10 μL的蛋白酶抑制剂、磷酸酶抑制剂和苯甲基磺酰氟(PMSF),吹打混匀,冰上静置30 min使细胞充分裂解,收集细胞于1.5 mL的EP管中,高速冷冻离心机4 ℃、12 000 r/min离心30 min,收集上清液。加入上样缓冲液(loading buffer)吹打混匀,放入开水中煮沸5 min。4 ℃、12 000 r/min离心5 min,收集上清。
采用BCA试剂盒(碧云天生物有限公司)测定上清液蛋白样品的浓度。采用聚丙十二烷基硫酸钠-烯酰胺凝胶电泳(SDS-PAGE)法分离蛋白,湿转法将蛋白转至聚偏二氟乙烯(PVDF)膜上,牛血清白蛋白(BSA)封闭2 h,分别用Occludin(66378-1-lg,Proteintech公司,美国)、ZO-1(21773-1-AP,proteintech公司,美国)、Claudin-1(ab15098,Abcam公司,英国)、p65(ab16502,Abcam公司,英国)、磷酸化p65(p-p65)(orb6504,Biorbty公司,英国)一抗4 ℃孵育过夜,β-肌动蛋白(β-actin)(ta-09,ZSGB-BIO生物技术有限公司)作为内参,根据一抗物种来源,选用辣根过氧化物酶(HRP)标记的羊抗兔抗体(ab6721,Abcam公司,英国)或HRP标记的羊抗鼠抗体(ab6789,Abcam公司,英国)孵育2 h,再用电化学发光(ECL,Transgen生物科技有限公司)显色,曝光拍照,用Image J软件进行灰度值分析。
1.2.4 酶联免疫吸附试验用海藻多糖处理培养皿中的IPEC-J2细胞后,收集培养基于离心管,4 ℃、12 000 r/min离心30 min,取上清待测。根据IL-6和TNF-α试剂盒(六合生物有限公司)操作步骤,将标准品工作液和待测样品加入酶标板中,每孔100 μL,于37 ℃培养箱中孵育90 min。弃去液体,每孔加入100 μL的生物素化抗体工作液,覆膜,37 ℃培养箱中孵育60 min。洗板3次。每孔中加入酶结合工作液100 μL,37 ℃培养箱中孵育30 min,重复洗板3次。每孔加入底物溶液90 μL,覆膜置于37 ℃培养箱中避光孵育15 min。最后向每孔加入终止液50 μL,终止反应后30 min之内用酶标仪在波长450 nm处测量各孔的吸光度(OD)值。以标准品含量为横坐标,OD值为纵坐标,采用Logistic曲线拟合得到曲线回归方程[决定系数(R2)>0.99],计算出海藻多糖处理的IPEC-J2细胞上清液中促炎症因子IL-6和TNF-α含量。
1.3 统计分析所有数据用Excel 2010进行简单处理后,采用SPSS 17.0进行单因素方差分析,Duncan氏法进行多重比较,各组数据以“平均值±标准误”表示,P < 0.05为显著性判断标准。
2 结果与分析 2.1 海藻多糖对仔猪小肠上皮细胞机械屏障的影响由图 1可知,与对照组相比,60和120 μg/mL的海藻多糖可以显著上调紧密连接蛋白occludin和ZO-1的mRNA相对表达量(P < 0.05);但海藻多糖浓度达240 μg/mL时,occludin和ZO-1的mRNA相对表达量与对照组无显著差异(P>0.05)。与对照组相比,60 μg/mL的海藻多糖可以上调claudin-1的mRNA相对表达量,但差异不显著(P>0.05);120和240 μg/mL的海藻多糖可以显著上调claudin-1的mRNA相对表达量(P < 0.05)。
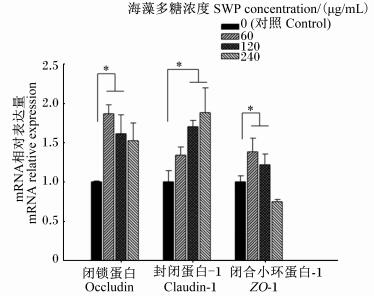
|
*表示差异显著(P < 0.05)。下图同。 * mean significant difference (P < 0.05). The same as below. 图 1 海藻多糖对IPEC-J2细胞紧密连接蛋白mRNA表达的影响 Fig. 1 Effects of SWP on mRNA expression of tight junction protein in IPEC-J2 cells (n=3) |
由图 2可知,与对照组相比,60、120、240 μg/mL的海藻多糖对紧密连接蛋白occludin的蛋白相对表达量没有显著影响(P>0.05);但120、240 μg/mL海藻多糖可以显著上调claudin-1和ZO-1的蛋白相对表达量(P < 0.05)。
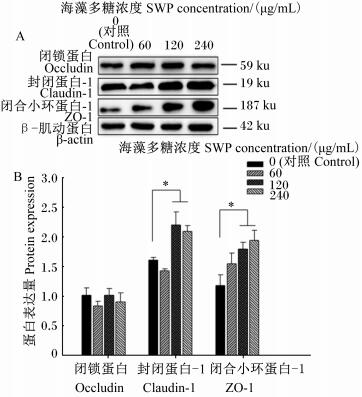
|
图 2 海藻多糖对IPEC-J2细胞紧密连接蛋白蛋白表达的影响 Fig. 2 Effects of SWP on protein expression of tight junction protein in IPEC-J2 cells (n=3) |
由图 3可知,随着海藻多糖浓度的增加,TLR-4、IκBα、MyD88、p65的mRNA相对表达量呈逐渐下降趋势。与对照组相比,60、120和240 μg/mL的海藻多糖均显著降低了MyD88和p65的mRNA相对表达量(P < 0.05);240 μg/mL的海藻多糖显著降低了TLR-4和IκBα的mRNA相对表达量(P < 0.05),而60、120 μg/mL的海藻多糖对TLR-4和IκBα的mRNA相对表达量没有显著影响(P>0.05)。不同浓度海藻多糖对IPEC-J2细胞NF-κB通路p65和p-p65的蛋白相对表达没有显著影响(P>0.05)。尽管240 μg/mL的海藻多糖引起p-p65的蛋白表达量和p-p65/p65较大程度的降低,但未达到显著水平(P>0.05)。
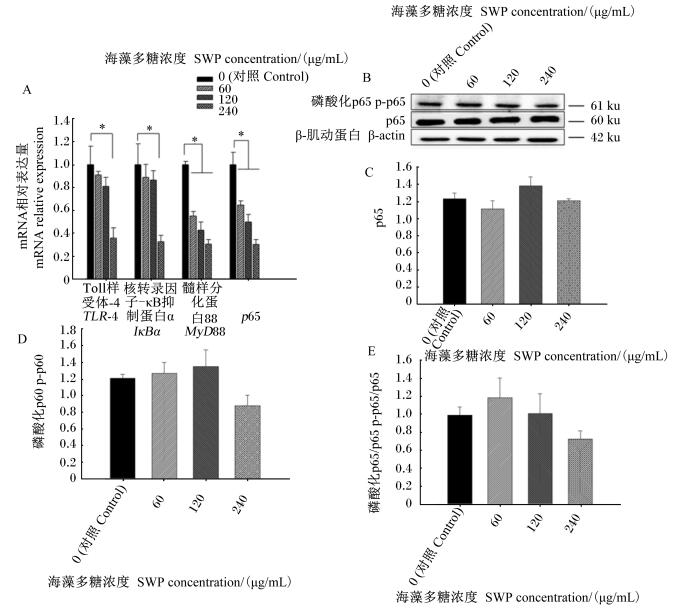
|
图 3 海藻多糖对NF-κB信号通路相关基因和蛋白表达的影响 Fig. 3 Effects of SWP on expression of NF-κB signaling pathway related gene and protein (n=3) |
由图 4可知,与对照组相比,60、120和240 μg/mL的海藻多糖对IPEC-J2细胞促炎症因子IL-6和TNF-α含量没有显著影响(P>0.05)。
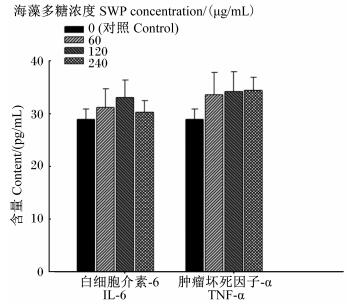
|
图 4 海藻多糖对IPEC-J2细胞促炎症因子IL-6和TNF-α含量的影响 Fig. 4 Effects of SWP on contents of proinflammatory factors IL-6 and TNF-α in IPEC-J2 cells (n=3) |
肠道中的紧密连接是一个高度动态的屏障结构,可以通过调节细胞之间的通透性而选择性吸收水分、离子及营养物质[13]。肠道紧密连接结构的完整性对肠道的防御和免疫起着很大的作用,紧密连接蛋白作为连接肠道上皮细胞之间的桥梁,在一定范围内,紧密连接蛋白表达的上调对机体的紧密连接具有促进作用[2]。研究表明,多糖类营养素(植物多糖)在促进紧密连接蛋白的表达、维持肠道上皮的完整性方面发挥了重要作用[14-15]。例如,刺五加多糖可以有效缓解脂多糖(LPS)刺激后小鼠肠道通透性的变化,同时促进occludin和ZO-1蛋白的表达[16]。而海藻酸钠寡糖可以显著改善断奶仔猪的肠道形态结构,促进紧密连接蛋白occludin和ZO-1蛋白的表达[16]。本试验结果显示,海藻多糖对IPEC-J2细胞紧密连接蛋白的表达同样具有明显的上调作用,其中occludin和ZO-1的mRNA相对表达量随着海藻多糖浓度的增高而降低,claudin-1的mRNA相对表达量和ZO-1的蛋白相对表达量随着海藻多糖浓度的增高而增高,同时,当海藻多糖浓度为120 μg/mL时,claudin-1的蛋白相对表达量达到最高。综上所述,120 μg/mL的海藻多糖可以显著上调紧密链接蛋白occludin、claudin-1和ZO-1的mRNA相对表达量以及claudin-1和ZO-1蛋白相对表达量,在调节肠道上皮细胞紧密链接表达中作用最佳。
3.2 海藻多糖对仔猪小肠上皮细胞免疫屏障的影响NF-κB信号通路是机体内免疫调节的经典通路,可以调控机体内很多生理活动[17]。NF-κB信号通能够影响相应炎症因子的表达,进而介导炎症反应[18]。海藻多糖是一种生物活性物质,大量的研究表明其有一定的抗病毒和免疫调节作用[19-21]。有学者选择红藻多糖对肥大小鼠进行试验后发现,红藻多糖可以显著降低肥大小鼠体内的炎症反应,表现出对小鼠机体的一致炎症效果[22]。还有研究发现,海带多糖能显著下调仔猪结肠黏膜中炎症因子IL-6、白细胞介素-17(IL-17)及白细胞介素-1β(IL-1β)的mRNA相对表达量,降低肠道炎症反应,并改善肠道健康[23]。而褐藻提取物对LPS诱导下仔猪结肠细胞炎症因子IL-6、白细胞介素-8(IL-8)、TNF-α的mRNA相对表达量具有明显的下调作用[24]。本试验结果表明,海藻多糖下调了NF-κB信号通路TLR-4、IκBα、MyD88和p65基因的表达,这与Sanjeewa等[25]报道海藻多糖可通过NF-κB信号通路缓解LPS诱导的巨噬细胞炎症反应结果相似。NF-κB信号通路为炎症信号通路,相关基因表达下调,表明海藻多糖对肠道上皮细胞具有一定的抑炎作用,可有效预防肠道炎症的发生,进而维持肠道屏障功能的完整性。本试验发现,随着海藻多糖浓度的增高,TLR-4、IκBα、MyD88和p65的mRNA相对表达量呈现递减趋势,在预防炎症肠道反应中添加浓度为240 μg/mL海藻多糖为宜。至于海藻多糖促进了NF-κB信号通路相关基因的表达,而尚未对IL-6和TNF-α含量产生显著影响,可能是由于本试验条件下酶联免疫吸附反应时间不够,或者是海藻多糖所添加的剂量梯度不够。
4 结论海藻多糖利于维持上皮屏障功能的完整性,促进紧密连接蛋白的表达,同时可通过下调NF-κB炎症信号通路相关基因表达有效预防肠道炎症的发生,对改善仔猪小肠上皮细胞屏障功能具有积极作用。120 μg/mL的海藻多糖的对肠道完整性的作用效果最佳,240 μg/mL的海藻多糖的对肠道炎症的作用效果最佳。
| [1] |
吴兆海.粪菌移植对被动免疫失败犊牛肠道屏障功能及肠道菌群构建的影响[D].博士学位论文.北京: 中国农业大学, 2018.
|
| [2] |
黄妍君.维生素E及其衍生物对肠道屏障结构蛋白的保护作用研究[D].硕士学位论文.长沙: 湖南师范大学, 2018: 1-2.
|
| [3] |
FANNING A S, MITIC L L, ANDERSON J M. Transmembrane proteins in the tight junction barrier[J]. Journal of the American Society of Nephrology, 1999, 10(6): 1337-1345. |
| [4] |
刘畅.探究TLR4对小鼠肠黏膜紧密连接蛋白的调控作用[D].硕士学位论文.沈阳: 中国医科大学, 2018.
|
| [5] |
崔勇鹤, 孙少明, 李占武, 等. 肠道上皮细胞在肠道免疫屏障中的维护及炎性肠病发生机制[J]. 中国中西医结合消化杂志, 2019, 27(2): 160-162. |
| [6] |
夏溪.猪抗菌肽PR39抗细菌感染和保护肠道屏障功能的作用及其机制研究[D].博士学位论文.杭州: 浙江大学, 2015.
|
| [7] |
王凤杰.HIV-1感染致肠道上皮紧密连接异常的分子机制[D].博士学位论文.北京: 中国疾病预防控制中心, 2019: 13-116.
|
| [8] |
CUMASHI A, USHAKOVA N A, PREOBRAZHENSKAYA M E, et al. A comparative study of the anti-inflammatory, anticoagulant, antiangiogenic, and antiadhesive activities of nine different fucoidans from brown seaweeds[J]. Glycobiology, 2007, 17(5): 541-552. DOI:10.1093/glycob/cwm014 |
| [9] |
WAN J, JIANG F, XU Q S. Alginic acid oligosaccharide accelerates weaned pig growth through regulating antioxidant capacity, immunity and intestinal development[J]. RSC Advances, 2016, 6(90): 87026-87035. DOI:10.1039/C6RA18135J |
| [10] |
HWANG P A, LIN H V, LIN H Y, et al. Dietary supplementation with low-molecular-weight fucoidan enhances innate and adaptive immune responses and protects against Mycoplasma pneumonia antigen stimulation[J]. Marine Drugs, 2019, 17(3): 175. DOI:10.3390/md17030175 |
| [11] |
CIAN R E, DRAGO S R, DE MEDINA F S, et al. Proteins and carbohydrates from red seaweeds:evidence for beneficial effects on gut function and microbiota[J]. Marine Drugs, 2015, 13(8): 5358-5383. DOI:10.3390/md13085358 |
| [12] |
CHOI Y S, EOM S Y, KIM I S, et al. Fucoidan extracted from hijiki protects brain microvessel endothelial cells against diesel exhaust particle exposure-induced disruption[J]. Journal of Medicinal Food, 2016, 19(5): 466-471. DOI:10.1089/jmf.2015.3635 |
| [13] |
赵省如.决明子对小鼠肠道屏障影响的研究[D].硕士学位论文.南昌: 南昌大学, 2017.
|
| [14] |
刘珂, 邱炳勋, 邹利, 等. 黄芪及其有效成分对内皮细胞及其连接的保护作用及机制研究进展[J]. 中草药, 2016, 47(21): 3912-3917. |
| [15] |
谢红兵, 邹云, 刘丽莉, 等. 植物多糖对断奶仔猪小肠黏膜形态及肠黏膜屏障功能的影响[J]. 中国兽医学报, 2019, 39(1): 150-157, 187. |
| [16] |
HAN J, LI J, BAI G, et al. Acanthopanax senticosus polysaccharides-induced intestinal tight junction injury alleviation via inhibition of NF-κB/MLCK pathway in a mouse endotoxemia model[J]. World Journal of Gastroenterology, 2017, 23(12): 2175-2184. DOI:10.3748/wjg.v23.i12.2175 |
| [17] |
WERTZ I E, DIXIT V M. Signaling to NF-κB:regulation by ubiquitination[J]. Cold Spring Harbor Perspectives in Biology, 2010, 2(3): a003350. |
| [18] |
游金明, 郭晓波, 王自蕊, 等. 海藻多糖的免疫调节作用及其在畜禽生产中的应用[J]. 饲料工业, 2017, 38(20): 1-5. |
| [19] |
HEIM G, O'DOHERTY J V, O'SHEA C J, et al. Maternal supplementation of seaweed-derived polysaccharides improves intestinal health and immune status of suckling piglets[J]. Journal of Nutritional Science, 2015, 4: e27. DOI:10.1017/jns.2015.16 |
| [20] |
JEONG S Y, SEOL D W. The role of mitochondria in apoptosis[J]. BMB Reports, 2008, 41(1): 11-22. DOI:10.5483/BMBRep.2008.41.1.011 |
| [21] |
AISA Y, MIYAKAWA Y, NAKAZATO T, et al. Fucoidan induces apoptosis of human HS-Sultan cells accompanied by activation of caspase-3 and down-regulation of ERK pathways[J]. American Journal of Hematology, 2005, 78(1): 7-14. DOI:10.1002/ajh.20182 |
| [22] |
NEELAKANDAN Y, VENKATESAN A. Antinociceptive and anti-inflammatory effect of sulfated polysaccharide fractions from Sargassum wightii and Halophila ovalis in male Wistar rats[J]. Indian Journal of Pharmacology, 2016, 48(5): 562-570. DOI:10.4103/0253-7613.190754 |
| [23] |
WALSH A M, SWEENEY T, O'SHEA C J, et al. Effects of supplementing dietary laminarin and fucoidan on intestinal morphology and the immune gene expression in the weaned pig[J]. Journal of Animal Science, 2012, 90(Suppl.4): 284-286. |
| [24] |
BAHAR B, O'DOHERTY J V, HAYES M, et al. Extracts of brown seaweeds can attenuate the bacterial lipopolysaccharide-induced pro-inflammatory response in the porcine colon ex vivo[J]. Journal of Animal Science, 2012, 90(Suppl.4): 46-48. |
| [25] |
SANJEEWA K K A, JAYAWARDENA T U, KIM H S, et al. Fucoidan isolated from Padina commersonii inhibit LPS-induced inflammation in macrophages blocking TLR/NF-κB signal pathway[J]. Carbohydrate Polymers, 2019, 224: 115195. DOI:10.1016/j.carbpol.2019.115195 |




