双糖[甘露醇(mannitol)和乳果糖(lactulose)]吸收试验被证明是能反映肠道屏障功能的有效方法[1],因此,评估动物血浆中甘露醇和乳果糖含量可以为小肠的渗透性作用提供参考,进而可以对动物生产中的某些疾病进行预判。但是甘露醇和乳果糖吸收试验被限制应用的难点在于血浆中低含量的糖类如何被检测。
对于甘露醇和乳果糖含量的检测,以往的报道采用的方法主要有气相色谱法[2-4]、高效液相色谱法[5-6]、液相色谱-质谱联用法[7-9]、1H-核磁共振波谱法[1]以及离子色谱法[10-12]等,而气相色谱-质谱联用法则鲜有报道。并且,这些测定方法多用于人和动物的尿样,而在动物血液上的应用较少[3, 10-12]。Beruet等[3]利用气相色谱衍生法,首次测定了越南猎犬血液中的甘露醇和乳果糖的含量,以分析肠道的渗透性,评估其屏障功能。Gilani[10-12]利用离子色谱法测定了肉仔鸡血液中甘露醇、乳果糖和鼠李糖的含量,探究了不同条件下的肠道渗透性。
高效液相色谱仪与蒸发光散射[5]、示差折光[6]等检测器联用,测定甘露醇和乳果糖含量,样品需要经过固相萃取净化、浓缩等复杂的前处理,高效液相色谱仪尽管具有快速且自动化程度高的优点[13],但灵敏度和重复性比较差。对于血浆中低至几百纳克到几个微克的乳果糖和甘露醇而言,无论是气相色谱法还是高效液相色谱法,均无法达到检测的目的。离子色谱法需要的样品量较大。液相色谱-质谱联用法能够去除杂质干扰影响,但对人员操作、样品处理等要求较高,且仪器昂贵,不利于一般实验室的应用推广。气相色谱-质谱联用法主要用于测定食品[14]、保健品[15]中的甘露醇含量,且未见其对甘露醇和乳果糖2种目标物同时分离的报道。
甘露醇和乳果糖为水溶性化合物,沸点高,不能直接进入到气相色谱中进行汽化,必须对其进行衍生才能进行气相色谱仪测定分析。常用的衍生方法有硅烷化衍生法[2-3]、糖醇衍生法[4]以及糖腈乙酰酯衍生法[16]。硅烷化衍生法,即采用甲氧胺吡啶或者羟胺吡啶先将糖类物质进行肟化反应,然后再用硅烷化试剂衍生成易挥发的硅烷化衍生物。糖醇衍生法,即采用乙酸酐为衍生化试剂,吡啶为溶剂,将糖醇类物质转化成易挥发的糖醇乙酰化衍生物。糖腈乙酰酯衍生法,即以吡啶-甲醇为溶剂,在盐酸羟胺和4-二甲氨基吡啶作用下,以乙酸酐为衍生化试剂,将糖类物质转化成易挥发的糖腈乙酰酯衍生物。与硅烷化衍生法[17]相比,糖腈乙酰酯衍生法对于水汽不太敏感,反应成功率高;而且由于糖类物质的构型差异,硅烷化衍生法易形成多种衍生产物,糖腈乙酰酯衍生法与其相比,专一性强。与糖醇衍生法的反应温度135 ℃相比,糖腈乙酰酯衍生法衍生温度为75~80 ℃,条件较为温和,易操作也更为节能。
因此,本试验采用糖腈乙酰酯衍生法进行衍生,将目标物转化成易挥发的糖腈乙酰酯衍生物,然后采用气相色谱-质谱联用法进行测定,以期建立一种测定血浆中甘露醇和乳果糖含量的气相色谱-质谱联用方法,为动物肠道渗透性研究提供科学参考。
1 材料与方法 1.1 试剂配制乙腈、甲醇、吡啶、盐酸羟胺、4-二甲氨基吡啶、乙酸酐、盐酸、二氯甲烷、乙酸乙酯和正己烷购等自国药集团有限公司;乳果糖、甘露醇和蜜二糖一水标准品为色谱纯,购自北京索莱宝科技有限公司;内插管购自Hamga公司;超纯水为中国科学院亚热带农业生态过程重点实验室自制。
用超纯水与甘露醇、乳果糖和蜜二糖一水配制相同浓度为100 μg/mL的混合标准品溶液,用作条件优化。用超纯水与甘露醇和乳果糖配制相同浓度为10 μg/mL的混合标准品溶液,作为储备液。用超纯水与蜜二糖一水配制浓度为80 μg/mL的内标液,用作标准曲线的制备。待测样品为中国科学院亚热带农业生态研究所畜禽健康养殖研究中心提供的山羊血浆,-80 ℃保存备用。
1.2 仪器与设备气相色谱-质谱联用仪(Agilent 7890A-5975C,美国),配备有电子轰击(EI)电离源和四级杆质量分析仪,自动进样器;冷冻离心机(日立CR22 GⅡ,日本);离心浓缩仪(Christ RVC2-18 CD plus,德国);Classic DI超纯水系统(ELGA,英国)。
1.3 色谱条件Agilent HP-5色谱柱(30 m×0.25 mm×0.25 μm),程序升温条件:125 ℃,保持1 min,然后以25 ℃/min升至215 ℃,保持1 min,再以3 ℃/min升至235 ℃,保持2 min;再以20 ℃/min升至300 ℃,保持5 min;进样口:300 ℃;离子源:230 ℃;四级杆:150 ℃;质谱接口:280 ℃。流速:1.0 mL/min;进样量:1 μL;分流比:30 : 1;选择离子扫描模式,定量离子选择质荷比(m/z):甘露醇43.0,辅助定量离子115.0,145.0;乳果糖43.0,辅助定量离子328.1,314.1;蜜二糖一水43.0,辅助定量离子328.1,314.1。甘露醇、乳果糖和蜜二糖一水的衍生物质谱图见图 1。
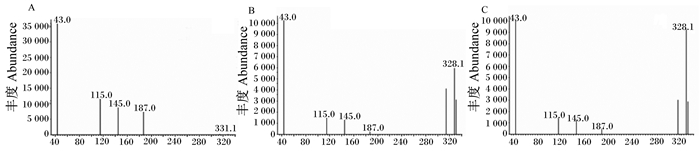
|
图 1 甘露醇(A)、乳果糖(B)和蜜二糖一水(C)的衍生物质谱图 Fig. 1 Mass spectrums of derivatives of mannitol (A), lactulose (B) and melibiose (C) |
将血浆样品在4 ℃条件下融解,充分混匀,取400 μL,向其中加入25 μL蜜二糖一水溶液(80 μg/mL)作为内标,以样品:乙腈=1 : 2的体积比加入乙腈0.8 mL沉淀蛋白质,涡旋混匀30 s;沉淀10 min,12 000 r/min离心10 min,取出全部上清液;以样品:水=1 : 1的体积比向沉淀中加入水0.4 mL,涡旋混匀30 s;沉淀10 min,12 000 r/min离心10 min,取出全部上清液并合并2次上清液,将上清液离心浓缩至干。将300 μL的衍生试剂[吡啶-甲醇溶液(吡啶:甲醇=4 : 1,体积比),含有32 mg/mL盐酸羟胺和45 mg/mL 4-二甲氨基吡啶]加入衍生瓶中,加盖密封,在75~80 ℃条件下加热30~35 min,其间振荡数次。冷却至室温后,加入1 mL乙酸酐,密封75~80 ℃条件下再次加热20 min。冷却后加入1.5 mL二氯甲烷,振荡,使衍生物进入有机相。过量的衍生试剂通过以下2个步骤去除:首先,加入1 mL 1 mol/L HCl,轻轻振摇30 s后,移走上层水相液体;然后,重复上述步骤,每次用1 mL的蒸馏水洗涤,重复2次,在最后一次清洗过程中尽可能去除水相。剩余的有机相在40 ℃下离心浓缩挥发干后,用200 μL的乙酸乙酯-正己烷混合溶剂(乙酸乙酯:正己烷=1 : 1,体积比)溶解后,5 000 r/min离心5 min,然后转移全部上清液至配有内插管的色谱进样瓶中,进行气相色谱-质谱分析。
1.5 试验条件优化以甘露醇、乳果糖和蜜二糖一水混合标准品溶液(100 μg/mL)为试验样本,分别对盐酸羟胺浓度、4-二甲氨基吡啶浓度、水洗涤次数、沉淀血浆用乙腈体积以及程序升温条件进行优化。
1.5.1 盐酸羟胺浓度的选择以混合标准品溶液作为反应底液,冷冻干燥后分别选择浓度为22、28、32、36和40 mg/mL的盐酸羟胺作为反应试剂,4-二甲氨基吡啶浓度为40 mg/mL,按照1.4中步骤和1.3中色谱条件(全扫描模式,离子扫描范围:m/z=40~500)分别进行样品制备和分析,进样口温度为280 ℃。以盐酸羟胺浓度(mg/mL)为横坐标,色谱峰峰面积(A)为纵坐标作图。
1.5.2 4-二甲氨基吡啶浓度的选择以混合标准品溶液作为反应底液,冷冻干燥后分别选择浓度为30、35、40、45、50和55 mg/mL的4-二甲氨基吡啶,盐酸羟胺浓度为32 mg/mL进行反应,按照1.4中步骤和1.3中色谱条件(全扫描模式,离子扫描范围:m/z=40~500)分别进行样品制备和分析。以4-二甲氨基吡啶浓度(mg/mL)为横坐标,色谱峰峰面积(A)为纵坐标作图。
1.5.3 水洗涤次数的选择以混合标准品溶液作为反应底液,冷冻干燥后选择32 mg/mL盐酸羟胺和45 mg/mL的4-二甲氨基吡啶进行反应。反应结束后,首先,加入1 mL 1 mol/L HCl,激烈振摇30 s后,移走上层水相液体;然后,重复上述步骤,每次用1 mL的蒸馏水洗涤,分别洗涤1、2、3、4和5次,按照1.3中色谱条件(全扫描模式,离子扫描范围:m/z=40~500)进行样品分析。以水洗涤次数为横坐标,色谱峰峰面积(A)为纵坐标作图。
1.5.4 样品与乙腈体积比的选择将血浆样品在常温下解冻,充分混匀,各取400 μL,按照样品与乙腈体积比分别为1 : 1、1 : 2和1 : 3将乙腈加入到血浆中,用于沉淀蛋白质;然后12 000 r/min离心10 min,观察沉淀效果。
1.5.5 升温程序的选择设定3个升温程序:1)120 ℃,保持3 min,然后以15 ℃/min升温至215 ℃,保持1 min,然后以5 ℃/min升温至300 ℃,保持5 min。2)120 ℃,保持1 min,然后以25 ℃/min升温至215 ℃,保持1 min,然后3 ℃/min升温至235 ℃,保持2 min,再以20 ℃/min升温至300 ℃,保持5 min。3)120 ℃,保持1 min,然后以20 ℃/min升温至215 ℃,保持2 min,然后2 ℃/min升温至235 ℃,保持1 min,再以20 ℃/min升温至300 ℃,保持5 min。分别执行上述升温程序,观察目标物质的分离情况。
1.6 线性回归方程、线性范围及检出限以1.2中甘露醇和乳果糖的浓度分别为10 μg/mL的混合标准品溶液作为储备液,加入80 μg/mL的蜜二糖一水储备液作为内标液,分别配制成每毫升中含糖为0.25、0.50、1.00、2.00、5.00和10.00 μg以及内标物为2 μg的系列标准曲线。将其冷冻干燥后,按照1.4中样品衍生过程进行样品制备,按照1.3中色谱条件进行分析。以目标物与内标物浓度比(C/CIS,X)为横坐标,目标物与内标物峰面积比(A/AIS,Y)为纵坐标作图,得线性回归方程。选择目标物3倍信噪比的浓度为其检出限,10倍信噪比的浓度为其定量限。
1.7 方法的精密性、重复性和回收率考察以10 μg/mL的标准曲线点为供试品,按1.4进行样品处理后,按照1.3中色谱条件测定,重复测定7次,考察所建立方法的精密性;以血浆样品为供试品,平行取样3份,按1.4进行样品处理后,按照1.3中色谱条件测定,考察所建立方法的重复性;以血浆样品为供试品,分别向其中加入甘露醇和乳果糖的浓度分别为10 μg/mL的混合标准品溶液30、60和90 μL,即分别向其中加入300、600和900 ng/mL,按1.4处理方法将其制成待测溶液,按1.3中色谱条件上机测定加标回收率。
2 结果与分析 2.1 盐酸羟胺浓度的选择由图 2可知,盐酸羟胺浓度为32 mg/mL时,乳果糖和蜜二糖一水的峰面积最大;当盐酸羟胺浓度超过32 mg/mL后,虽然甘露糖的峰面积略有增长,但是乳果糖和蜜二糖一水的峰面积有下降的趋势,因此,选用盐酸羟胺浓度为32 mg/mL。
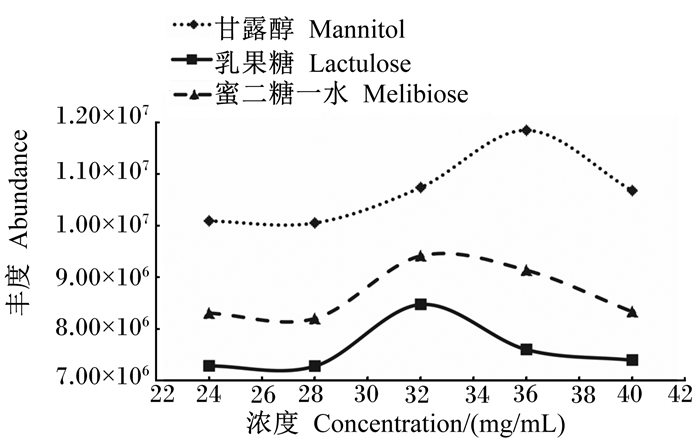
|
图 2 盐酸羟胺浓度对衍生结果的影响 Fig. 2 Effects of hydroxylamine hydrochloride concentration on derivatization |
由图 3可知,当4-二甲氨基吡啶浓度超过45 mg/mL后,衍生物的峰面积趋于稳定。当其浓度为55 mg/mL时,虽然甘露醇峰面积略有增长,但是乳果糖和蜜二糖一水的峰面积呈现下降趋势。因此,选用4-二甲氨基吡啶浓度为45 mg/mL。
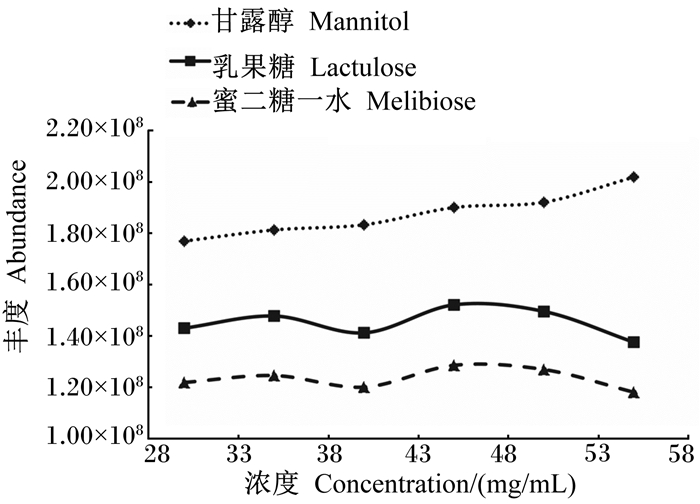
|
图 3 4-二甲氨基吡啶浓度对衍生结果的影响 Fig. 3 Effects of 4-(dimethylamino) pyridine concentration on derivatization |
由图 4可知,水洗涤次数为1、2次时,对3个目标物峰面积基本无影响,洗涤次数为5次时,乳果糖和蜜二糖一水的峰面积略有下降。由于试验中使用了乙酸酐和盐酸,酸对进样针有一定的腐蚀性,同时,清洗次数太多,会加大人工操作的工作量,因此选择水洗涤次数为2次。
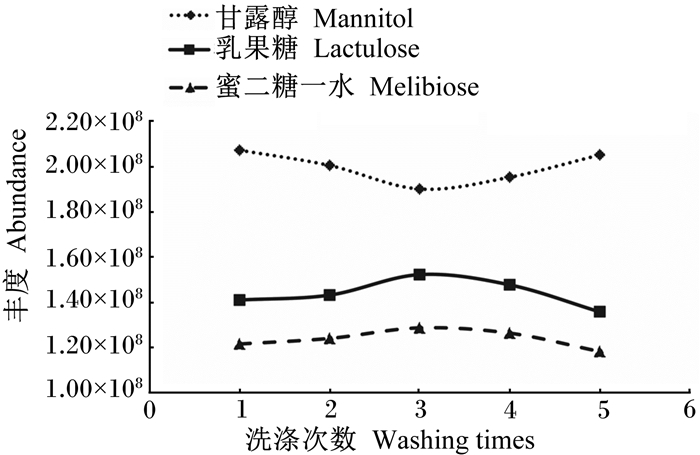
|
图 4 水洗涤次数对衍生结果的影响 Fig. 4 Effects of water washing times on derivatization |
当以样品与乙腈体积比为1 : 1沉淀蛋白质时,不能将血浆样品中的蛋白质完全沉淀下来;当以样品与乙腈体积比为1 : 2沉淀蛋白质时,能基本将血浆样品中的蛋白沉淀下来,当以样品与乙腈体积比为1 : 3沉淀蛋白质时,沉淀蛋白质的效果与体积比为1 : 2时基本相同,因此选择样品与乙腈体积比为1 : 2。
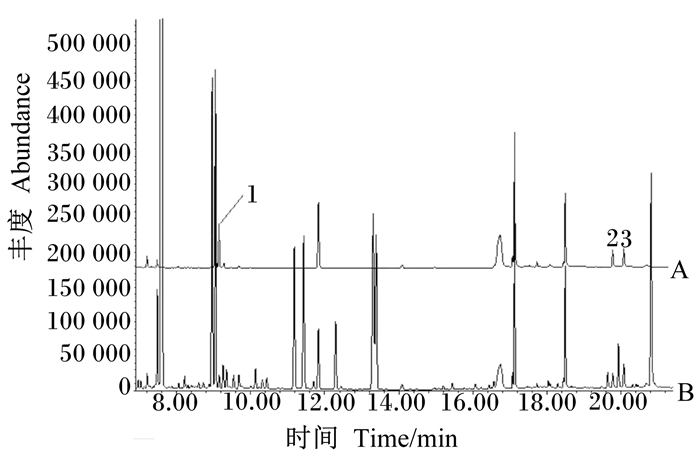
2.5 升温程序的选择选择程序a运行时,目标物质均能达到分离,但是甘露醇出峰位置有干扰峰;当选择程序b运行时,目标物质的峰高比条件a有提高;程序c与程序b相比,目标物质分离效果无明显改善,因此,选择程序b作为色谱分析中的升温程序。标准品与样品中甘露醇、乳果糖和蜜二糖一水衍生物的总离子流图见图 5。
|
图 5 标准品(A, 2 μg/mL)与样品(B)中甘露醇(1)、乳果糖(2)和蜜二糖一水(3)衍生物的总离子流图 Fig. 5 Total ion flow diagram of derivatives of mannitol (1), lactulose (2) and melibiose (3) in standard (A, 2 μg/mL) and sample (B) |
由表 1可知,甘露醇和乳果糖含量分别在0.18~10.00 μg/mL、0.23~10.00 μg/mL范围内线性关系良好,相关系数均在0.998以上,检出限分别为0.052和0.071 μg/mL。
|
|
表 1 甘露醇和乳果糖的线性方程、线性范围、相关系数以及检出限 Table 1 Linear equation, linear range, correlation coefficient and detection limit of mannitol and lactulose |
方法的精密性检测结果表明,各目标物保留时间的相对标准偏差(RSD)不超过0.5%,各目标物浓度的RSD不超过4.7%,说明本方法精密性良好;方法的重复性检测结果表明,各目标物的保留时间的RSD不超过0.5%,各目标物浓度的RSD不超过5.0%;加标回收率检测结果(表 2)表明,样品中甘露醇和乳果糖的加标回收率分别为71.3%~72.5%和89.8%~110.0%。
|
|
表 2 甘露醇和乳果糖的加标回收率 Table 2 Recovery of standard addition for mannitol and lactulose (n=3) |
将乙腈加入到血浆样品中沉淀蛋白质,从沉淀效果来看,样品与乙腈的体积比达到1 : 2时,即能将样品中的蛋白质基本沉淀完全。在后续衍生过程中,样品与乙腈的体积比为1 : 1时,血浆中某些不被沉淀的物质会形成较大的凝胶团块,严重影响衍生结果;当样品与乙腈体积比为1 : 2及以上时,血浆中仍有少量的不被沉淀的物质,通过反应过程中的不断振荡,可以将其中的目标物反应完全。从回收率测定结果来看,甘露醇的回收率略低,可能是由样品的基质效应影响所致。
由于血浆中目标物含量较低,采用100 μL样品时,样品中甘露醇和乳果糖的含量均未被检出。为了保证检测的准确性,将样品量提高到400 μL,以富集其中的目标物,但是同时也增加了血浆中其他非目标组分的含量,这也许是造成甘露醇回收率略低的原因之一。在本试验中,线性范围最高为10.00 μg/mL,该值已远远高于样品中目标物的含量,因此并未将线性范围进一步拓宽。
本方法利用气相色谱-质谱联用法选择离子模式测定,减少了其他非目标离子的干扰,提高了检测的灵敏度。本方法中甘露醇和乳果糖的检出限分别为0.052和0.071 μg/mL,这与胡强等[9]利用液相色谱-质谱联用法测得的检出限基本接近,但是乳果糖的检出限高于Lostia等[7]利用液相色谱-质谱联用法测得的检出限;同时,该方法中目标物检出限远远高于单纯使用气相色谱法和液相色谱法[2-6]测得的检出限,表明该方法具有较高的灵敏度;此外,整个反应过程只需要50 min,与硅烷化衍生法[2]相比,时间缩短近30 min,且该方法对糖醇和中性糖都有比较好的衍生效果。
4 结论本试验以乙腈沉淀山羊血浆中蛋白质,以蜜二糖一水为内标物,采用糖腈乙酰酯衍生法,建立了一种用于测定血浆中甘露醇和乳果糖含量的气相色谱-质谱联用方法。甘露醇和乳果糖保留时间和浓度的RSD分别小于0.5%和5.0%。甘露醇和乳果糖含量的线性范围分别为0.18~10.00 μg/mL和0.23~10.00 μg/mL,相关系数均在0.998以上,检出限分别为0.052和0.071 μg/mL,加标回收率分别为71.3%~72.5%和89.8%~110.0%。该方法专一性强、灵敏度高,适用于痕量血浆样品中甘露醇和乳果糖含量的测定,可为研究动物的肠道渗透性提供科学参考。
| [1] |
JAYALAKSHMI K, GHOSHAL U C, KUMAR S, et al. Assessment of small intestinal permeability using 1H-NMR spectroscopy[J]. Journal of Gastrointestinal and Liver Diseases, 2009, 18(1): 27-32. |
| [2] |
FARHADI A, KESHAVARZIAN A, HOLMES E W, et al. Gas chromatographic method for detection of urinary sucralose:application to the assessment of intestinal permeability[J]. Journal of Chromatography B, 2003, 784(1): 145-154. DOI:10.1016/S1570-0232(02)00787-0 |
| [3] |
BRUET V, BOURDEAU P, BIZZARRI M, et al. Rapid blood sampling method for measuring intestinal permeability by gas chromatography in dogs[J]. Revue de Médecine Vétérinaire, 2008, 159(5): 276-281. |
| [4] |
王和兴, 黎源倩, 李磊. 保健食品中甘露醇的毛细管气相色谱分析[J]. 四川大学学报(医学版), 2006, 37(3): 480-483. DOI:10.3969/j.issn.1672-173X.2006.03.039 |
| [5] |
陈丹, 姜春燕, 马辰. HPLC-ELSD法测定尿液中甘露醇和乳果糖浓度[J]. 感染、炎症、修复, 2007, 8(2): 79-82. DOI:10.3969/j.issn.1672-8521.2007.02.004 |
| [6] |
瞿平, 胡燕, 黎海芪. 高效液相色谱法检测尿样中甘露醇和乳果糖浓度[J]. 儿科药学杂志, 2005, 11(2): 1-3. DOI:10.3969/j.issn.1672-108X.2005.02.001 |
| [7] |
LOSTIA A M, LIONETTO L, PRINCIPESSA L, et al. A liquid chromatography/mass spectrometry method for the evaluation of intestinal permeability[J]. Clinical Biochemistry, 2008, 41(10/11): 887-892. |
| [8] |
DONG Y, YAN K, MA Y H, et al. A modified LC-MS/MS method to simultaneously quantify glycerol and mannitol concentrations in human urine for doping control purposes[J]. Journal of Chromatography B, 2016, 1022: 153-158. DOI:10.1016/j.jchromb.2016.04.023 |
| [9] |
胡强, 徐红兵, 李水军, 等. 液相色谱-串联质谱法测定尿中乳果糖、甘露醇和乳糖含量[J]. 中国现代医学杂志, 2008, 18(13): 1810-1813, 1817. DOI:10.3969/j.issn.1005-8982.2008.13.005 |
| [10] |
GILANI S, HOWARTH G S, KITESSA S M, et al. Intestinal permeability induced by lipopolysaccharide and measured by lactulose, rhamnose and mannitol sugars in chickens[J]. Animal, 2017, 11(7): 1174-1179. DOI:10.1017/S1751731116002470 |
| [11] |
GILANI S, HOWARTH G S, TRAN C D, et al. Reduced fasting periods increase intestinal permeability in chickens[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(1): e486-e492. DOI:10.1111/jpn.12712 |
| [12] |
GILANI S, HOWARTH G S, TRAN C D, et al. Effects of delayed feeding, sodium butyrate and glutamine on intestinal permeability in newly-hatched broiler chickens[J]. Journal of Applied Animal Research, 2018, 46(1): 973-976. DOI:10.1080/09712119.2018.1443109 |
| [13] |
曾道艳. 高效液相色谱在食品质量检测中的应用[J]. 现代食品, 2019(5): 173-175. |
| [14] |
段秀辉, 李露, 薛淑静, 等. 杏鲍菇、香菇及其预煮液中可溶性糖的GC-MS分析[J]. 食品工业科技, 2015, 36(17): 281-285. |
| [15] |
陈晓, 张可冬, 赵广才, 等. 气相色谱-质谱联用技术测定虫草类口服液中甘露醇的含量[J]. 分析仪器, 2015(6): 38-42. |
| [16] |
ZHANG W, HE H B, ZHANG X D. Determination of neutral sugars in soil by capillary gas chromatography after derivatization to aldononitrile acetates[J]. Soil Biology and Biochemistry, 2007, 39(10): 2665-2669. DOI:10.1016/j.soilbio.2007.04.003 |
| [17] |
李雪莹, 林晨, 王李平, 等. 衍生化-气相色谱法在食品安全检测中的应用[J]. 广州化工, 2016, 44(8): 21-23. DOI:10.3969/j.issn.1001-9677.2016.08.008 |




