2. 四川省畜牧科学研究院, 动物遗传育种四川省重点实验室, 成都 610066
2. Animal Genetics and Breeding Key Laboratory of Sichuan Province, Animal Science Academy of Sichuan Province, Chengdu 610066, China
芽孢杆菌是一类较为常见的细菌,广泛分布于自然环境中,其产生的芽孢可在多种极端环境中生存,具有较强的耐受能力[1]。解淀粉芽孢杆菌属于芽孢杆菌科、芽孢杆菌属,具有对动物和环境无害、稳定性强、广谱抑菌作用等特点,常被作为生防菌进行研究和应用,并且具有被开发为动物益生菌的潜力[1-3]。目前,解淀粉芽孢杆菌已被广泛应用于饲料[4]、食品[5-6]、污水处理[7]、植物生防菌[8]等领域。杨乔乔等[9]报道,解淀粉芽孢杆菌X8对多种水产致病菌的生长有较强的抑制作用,并认为其有望成为水产生防菌的研究对象。宁豫昌等[10]报道,解淀粉芽孢杆菌MY-6产生的蛋白酶可促进饲粮中各种蛋白质的水解,提高仔猪的饲料转化率。此外,解淀粉芽孢杆菌还具有提高动物生长性能和机体免疫力等作用[11]。朱博[12]报道,解淀粉芽孢杆菌显著提高了仔猪生长性能和免疫指标,并改善了消化道微生物组成。不同来源的解淀粉芽孢杆菌菌株对动物的作用效果存在一定的差异。藏猪源解淀粉芽孢杆菌SWUN-TP23能显著提高小鼠脾脏指数和日增重[13],而从黄芪样品中分离到的解淀粉芽孢杆菌SSY1对小鼠脾脏指数和日增重的影响均不显著[14]。目前尚未见羊源解淀粉芽孢杆菌对小鼠生长性能、血清生化指标、生长和免疫相关基因表达以及肠道菌群影响的报道。因此,本研究旨在探究不同浓度羊源解淀粉芽孢杆菌对小鼠生长和免疫功能的作用,从而为其在动物饲养中的应用提供参考。
1 材料与方法 1.1 试验菌株和试验动物试验菌株为本课题组从金堂黑山羊粪便中筛选出的具有广谱抑菌作用的羊源解淀粉芽孢杆菌fsznc-06。试验动物为无特定病原体(SPF)级30日龄昆明(KM)小鼠,购自成都达硕实验动物有限公司,许可证号:SCXK(川)2015-030,小鼠共46只(雌雄各占1/2),体重为(15.0±2.8) g。
1.2 试验设计和饲养管理取适量羊源解淀粉芽孢杆菌fsznc-06菌液,4 ℃、5 000 r/min离心10 min,移除上清,加入0.9%生理盐水并配制成浓度分别为1×108、1×1010和1×1011 CFU/mL菌悬液。选取10只小鼠(雌雄各占1/2),灌胃法灌服1×1011 CFU/mL菌悬液,饲养7 d,观察小鼠状态。选取36只健康的小鼠,随机分为3组,每组3个重复,每个重复4只。低剂量组(JD1组)和高剂量组(JD2组)每2 d灌胃1次浓度分别为1×108和1×1010 CFU/mL的羊源解淀粉芽孢杆菌fsznc-06菌悬液,灌胃量为0.3 mL/只;对照组(DZ组)每2 d灌胃1次0.9%生理盐水,灌胃量为0.3 mL/只。试验期为28 d。按常规饲养程序饲养小鼠,自由采食和饮水,并记录投喂饲料量。
1.3 指标测定及方法 1.3.1 生长性能和器官指数在试验的第1天称量小鼠初始体重,并分别在饲养第7、14、21和28天对各组小鼠的体重进行称量,计算体增重,并统计采食量,计算料重比,称量前对小鼠断粮、断水6 h以上。饲养28 d后所有小鼠眼球采血。解剖并观察小鼠内脏有无病变。取出心脏、肝脏、脾脏、胸腺、肾脏、大肠、小肠、胃,剔除筋膜及脂肪组织后称重,计算各器官指数,并测量大肠和小肠长度。
1.3.2 血清生化指标将采集后的血液37 ℃静置2 h后,4 ℃、3 500 r/min离心15 min,吸取上清,即为小鼠血清,置于4 ℃保存备用[15-16]。采用总超氧化物歧化酶(T-SOD)测试盒(羟胺法)、碱性磷酸酶(AKP)测定试剂盒(可见光比色法)、溶菌酶(LZM)测试盒(比浊法)检测血清T-SOD、AKP和LZM活性,试剂盒购自南京建成生物工程研究所。
1.3.3 生长和免疫相关基因表达取各组饲养28 d的小鼠脾脏样品,采用RNAiso Plus提取RNA,反转录合成cDNA。参考GenBank公布的小鼠胃饥饿素(GHRL,GenBank登录号:AB060078.1)、胰岛素样生长因子-1(IGF-1,NCBI参考序列:NM_010512.5)和干扰素α11(IFNα11,NCBI参考序列:NM_008333.2)基因序列,应用Primer Premier 5.0分别设计GHRL-2、IGF-1和IFNα11基因引物,并采用李凤格[17]报道的白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、一氧化氮合酶(iNOS)和肿瘤坏死因子-α(TNF-α)基因引物和甘油醛-3-磷酸脱氢酶(GAPDH)内参引物,以上引物均由上海生工生物工程技术服务有限公司合成,引物序列见表 1。
|
|
表 1 引物序列 Table 1 Primer sequences |
荧光定量PCR(q-PCR)反应体系10 μL:上游引物0.8 μL,下游引物0.8 μL,焦碳酸二乙酯(DEPC)水(H2O)2.2 μL,TB GreenTM Premix Ex TaqTM Ⅱ 5.2 μL,cDNA模板1.0 μL。优化后的反应条件:95 ℃预变性3 min;95 ℃变性10 s,退火20 s,72 ℃延伸30 s,共39个循环;熔解曲线阶段95 ℃ 15 s,60 ℃ 1 min,95 ℃ 5 s。取最适退火温度的PCR扩增产物,分别稀释103、104、105、106、107、108、109倍,进行q-PCR扩增,应用QuantStudioTM Design & Analysis Software v1.4.2和Bio-Rad CFX Manager v1.6绘制标准曲线。以小鼠GAPDH基因为内参,检测各组小鼠在28 d时脾脏组织生长因子和免疫相关基因的表达量。
1.3.4 肠道菌群多样性取各组饲养28 d的小鼠小肠内容物,提取样品基因组DNA,PCR扩增16S rDNA,使用Ion Plus Fragment Library Kit 48 rxns试剂盒构建文库并库检,使用lon S5TM上机测序,由北京诺禾致源生物信息科技有限公司完成全部测序,对Alpha多样性指数组间差异、属水平上的物种相对丰度和种水平优势物种进行分析。
1.4 数据统计和分析试验数据采用SPSS 26.0进行单因素方差分析(one-way ANOVA),并用Duncan氏法多重比较检验组间差异显著性,结果以平均值±标准差(mean±SD)表示,以P < 0.05表示差异显著,以P < 0.01表示差异极显著。应用QuantStudioTM Design & Analysis Software v1.4.2和Bio-Rad CFX Manager v1.6统计并分析q-PCR表达数据和绘制各基因标准曲线,应用GraphPad Prism 5.0绘制柱形图。
2 结果 2.1 羊源解淀粉芽孢杆菌fsznc-06对小鼠生长性能的影响灌服1×1011 CFU/mL菌悬液的小鼠在饲养7 d内未见死亡情况,未见异常,解剖未见明显病变,表明羊源解淀粉芽孢杆菌fsznc-06对小鼠无致病性。
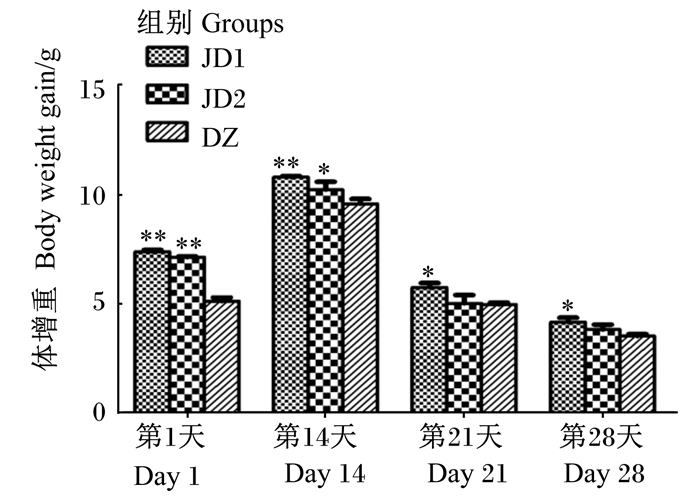
由图 1可见,与DZ组相比,JD1组第7、14、21和28天小鼠体增重显著或极显著提高(P < 0.05或P < 0.01);JD2组第7和14天小鼠体增重显著或极显著提高(P < 0.05或P < 0.01),第21和28天小鼠体增重差异不显著(P>0.05)。
|
*表示与对照组差异显著(P < 0.05),* *表示与对照组差异极显著(P < 0.01)。下图同。 * mean significant difference compared with the control group (P < 0.05), and * * mean extremely significant difference compared with the control group (P < 0.01). The same as below. 图 1 羊源解淀粉芽孢杆菌fsznc-06对小鼠体增重的影响 Fig. 1 Effects of Bacillus amyloliquefaciens fsznc-06 isolated from goats on body weight of mice |
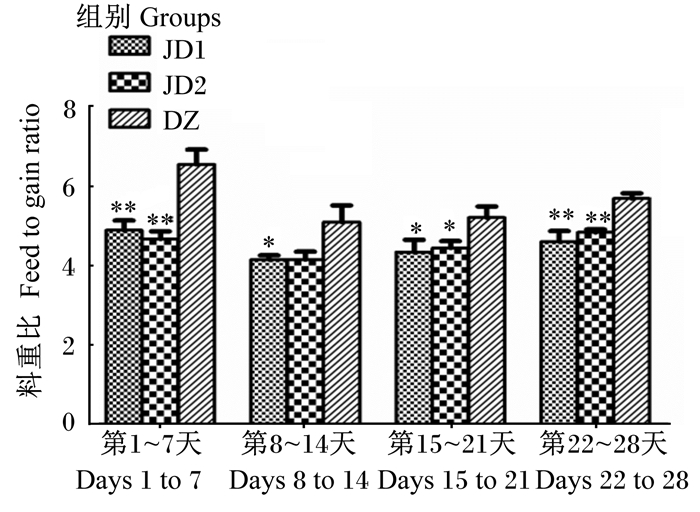
由图 2可见,JD1和JD2组各阶段料重比均低于DZ组。第1~7天,JD1和JD2组料重比均极显著低于DZ组(P < 0.01),其中,JD2组料重比最低,比DZ组降低了28.66%。第8~14天,JD1组料重比显著低于DZ组(P < 0.05),比DZ组降低了18.53%。第9~21天,JD1和JD2组料重比均显著低于DZ组(P < 0.05),其中,JD1组料重比最低,比DZ组降低了16.68%。第22~28天,JD1和JD2组料重比均极显著低于DZ组(P < 0.01),其中,JD1组料重比最低,比DZ组降低了19.09%。
|
图 2 羊源解淀粉芽孢杆菌fsznc-06对小鼠料重比的影响 Fig. 2 Effects of Bacillus amyloliquefaciens fsznc-06 isolated from goats on feed to gain ratio of mice |
|
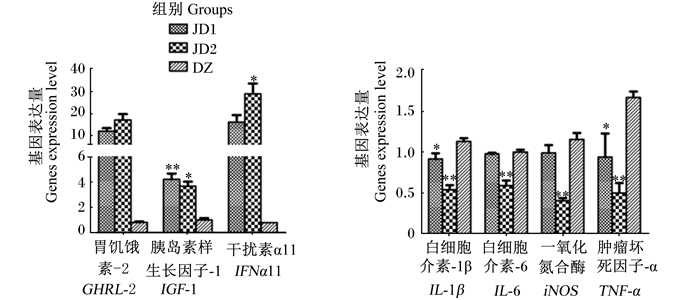
图 3 羊源解淀粉芽孢杆菌fsznc-06对小鼠脾脏生长和免疫相关基因表达量的影响 Fig. 3 Effects of Bacillus amyloliquefaciens fsznc-06 isolated from goats on expression levels of growth and immune related genes in spleen of mice |
由表 2可见,与DZ组相比,JD1和JD2组小鼠心脏指数极显著提高(P < 0.01),JD2组小鼠脾脏、胸腺和大肠指数显著或极显著提高(P < 0.05或P < 0.01),JD1组小鼠小肠指数显著提高(P < 0.05),JD1和JD2组小鼠肝脏、胃指数及大肠、小肠长度无显著差异(P>0.05)。
|
|
表 2 羊源解淀粉芽孢杆菌fsznc-06对小鼠器官指数的影响 Table 2 Effects of Bacillus amyloliquefaciens fsznc-06 isolated from goats on organ indexes of mice |
由表 3可见,与DZ组相比,JD1组小鼠血清T-SOD和AKP活性显著或极显著提高(P < 0.05或P < 0.01),JD2组小鼠血清AKP活性极显著提高(P < 0.01),JD1和JD2组小鼠血清LZM活性无差异显著(P>0.05)。
|
|
表 3 羊源解淀粉芽孢杆菌fsznc-06对小鼠血清生化指标的影响 Table 3 Effects of Bacillus amyloliquefaciens fsznc-06 isolated from goats on serum biochemical indexes of mice |
由表 4可见,与DZ组相比,JD1组小鼠脾脏IGF-1基因表达量极显著提高(P < 0.01),JD2组小鼠脾脏IGF-1和IFNα11基因表达量显著提高(P < 0.05)。与DZ组相比,JD2组小鼠脾脏IL-1β、IL-6、iNOS和TNF-α基因表达量极显著降低(P < 0.01),JD1组小鼠脾脏IL-1β、TNF-α基因表达量显著降低(P < 0.05),JD1组小鼠脾脏IL-6和iNOS基因表达量无显著差异(P>0.05)。
2.4 羊源解淀粉芽孢杆菌fsznc-06对小鼠肠道菌群多样性的影响操作分类单元(OTU)分析结果显示,JD1、JD2和DZ组OTU数量分别为158、169和152个,其中3组共有OTU数量为110个,3组特有的OTU数量分别为15、22、16个,JD1和DZ组特有的OTU数量分别为37、31个,JD2和DZ组特有的OTU数量分别为44和37个。由此可得,JD1和JD2组特有和共有的OTU数量均多于DZ组。
由图 4可见,Shannon指数结果表明,JD1和JD2组Shannon指数明显高于DZ组。在属水平的相对丰度方面,与DZ组相比,JD1和JD2组小鼠肠道乳杆菌属相对丰度略有降低,但双歧杆菌属相对丰度大幅提高。在种水平方面,JD1、JD2和DZ组的优势物种分别为约氏乳杆菌(Lactobacillus johnsonii)、罗伊氏乳杆菌(Lactobacillus reuteri)和肠乳杆菌(Lactobacillus intestinalis),且JD1和JD2组的优势物种相对丰度明显高于DZ组。

|
A:Shannon指数;B:属水平的相对丰度;C:种水平的三元相图。 A: Shannon index; B: relative abundance at genus level; C: ternary phase diagram at species level. 图 4 羊源解淀粉芽孢杆菌fsznc-06对小鼠肠道菌群多样性的影响 Fig. 4 Effects of Bacillus amyloliquefaciens fsznc-06 isolated from goats on intestinal flora diversity of mice |
解淀粉芽孢杆菌具有广谱抑制各种真菌和细菌生长的作用,其可产生多种抗菌蛋白质,如抗菌肽、细胞壁降解酶等[1, 18-21]。郭政宏[13]、王岩等[14]分别报道的解淀粉芽孢杆菌对小鼠饲喂安全性试验结果均表明该菌对小鼠具有良好的安全性。本试验采用高浓度灌胃小鼠的方法评价羊源解淀粉芽孢杆菌fsznc-06的安全性,结果显示该菌对小鼠未造成负面影响。这也说明此菌株对动物具有安全性,可作为一种动物益生菌进行研究。益生菌对动物生长性能的影响能够较为直观地评价其对动物的益生作用。已有研究表明,解淀粉芽孢杆菌对黑鲷鱼、猪等动物有促进生长的作用[3, 13, 22]。张彤[3]饲喂小鼠1×105 CFU/mL的鹿源解淀粉芽孢杆菌XF-3,结果表明该菌显著提高了小鼠体重以及脾脏、胸腺指数。本试验结果表明,羊源解淀粉芽孢杆菌fsznc-06可提高小鼠体增重,且在饲养的前2周体增重效果更好,这可能是因为小鼠在前期生长迅速,而后期的体重基本接近其上限。羊源解淀粉芽孢杆菌fsznc-06提高了小鼠心脏、脾脏和胸腺指数,脾脏和胸腺是重要的免疫器官,可以推断该菌在一定程度上直接或间接地促进了小鼠免疫器官的发育。此外,羊源解淀粉芽孢杆菌fsznc-06降低了小鼠的料重比。料重比可以直观地反映益生菌对动物消化能力的影响,也可评价其在实际生产中对生产成本的意义。
解淀粉芽孢杆菌具有提高机体抗氧化功能和血清生化指标的作用[22-23]。T-SOD是广泛存在于动植物中抗氧化酶系的重要指标之一,其在机体内起到非常重要的平衡氧化和抗氧化作用。AKP广泛分布于肝脏、骨骼、肠等组织中,它是动物生长代谢、维持机体健康的必需的酶,是评价动物生长是否旺盛的重要指标之一。LZM是一种可以水解细菌细胞壁、与病毒蛋白结合形成复盐的碱性酶,它可使细菌破裂溶解,使病毒失活,机体内LZM活性的高低可反映机体清除致病菌的能力。李仕成[24]报道,饲喂1×108 CFU/g的解淀粉芽孢杆菌J4显著提高了罗非鱼血清T-SOD、AKP、LZM活性。本试验中,羊源解淀粉芽孢杆菌fsznc-06显著提高了小鼠血清T-SOD和AKP活性,表明羊源解淀粉芽孢杆菌fsznc-06可能会提高血清免疫机能。但该菌对血清LZM活性并无显著影响,这可能由于血清LZM活性随饲喂羊源解淀粉芽孢杆菌fsznc-06时间的增加呈先增大后减小的趋势[24],而本试验试验组血清LZM活性可能已下降至正常值。
解淀粉芽孢杆菌对动物免疫相关基因表达也具有一定的调控作用。徐函等[25]报道,培养基中含有1×108 CFU/mL的解淀粉芽孢杆菌SC06显著增加猪小肠上皮细胞(IPEC-1)转化生长因子含量并降低白细胞介素的基因表达量。王阳[26]报道,饲粮中添加1×105 CFU/kg的解淀粉芽孢杆菌SC06能降低高脂饲粮所引起的IL-6、TNF-α炎性因子的分泌。GHRL、胰岛素样生长因子(IGF)、干扰素(IFN)是机体中促进生长和免疫的关键因子,在机体感染后巨噬细胞分泌白细胞介素、iNOS、肿瘤坏死因子(TNF)等细胞因子或炎性介质,参与免疫调控[17, 27-28]。本试验中,与DZ组相比,JD1和JD2组小鼠脾脏中GHRL-2、IGF-1和IFNα11基因表达量均有所提高。这说明羊源解淀粉芽孢杆菌fsznc-06促进了小鼠GHRL-2、IGF-1和IFNα11基因的表达,进而提高了小鼠生长和免疫功能。同时,JD1和JD2组小鼠炎性因子相关基因的表达量降低,说明羊源解淀粉芽孢杆菌fsznc-06抑制了炎性因子的表达,从而降低机体发生炎症的概率。
动物肠道内存在着大量的微生物,这些微生物帮助宿主完成多种生理生化功能,与机体的消化、免疫、生理调控等方面息息相关[29]。De Oliveira等[30]报道,饲喂1×106 CFU/g的解淀粉芽孢杆菌CECT 5940可有效促进肉鸡肠道健康。朱博[12]报道,饲喂仔猪添加0.02%的解淀粉芽孢杆菌的饲粮可显著提高消化道乳杆菌属细菌的含量。本试验中,各组小肠中最多的菌种是乳杆菌属和双歧杆菌属,而JD1和JD2组双歧杆菌属相对丰度明显高于DZ组,且优势菌群相对丰度也明显高于DZ组。双歧杆菌在机体中具有抗肿瘤、免疫增强、生物屏障等重要的生理作用[30-31]。这说明羊源解淀粉芽孢杆菌fsznc-06在调节肠道菌群方面起到了一定的积极作用,促进了有益菌群的生长。
4 结论羊源解淀粉芽孢杆菌fsznc-06可降低小鼠料重比,促进小鼠生长,提高血清T-SOD、AKP活性以及脾脏GHRL-2、IGF-1和IFNa11基因表达量,提高肠道有益菌群和优势菌群丰度。采用浓度为1×1010 CFU/mL的羊源解淀粉芽孢杆菌fsznc-06饲喂小鼠效果相对更佳。
| [1] |
李晓宇.解淀粉芽孢杆菌LXY-6-2筛选、鉴定、诱变与发酵条件优化及其对辣椒根腐病的生物防治研究[D].硕士学位论文.咸阳: 西北农林科技大学, 2018.
|
| [2] |
孙淑琴, 杨秀荣, 孙冰冰, 等. 解淀粉芽孢杆菌Bs-18生防功能相关基因的初步鉴定[J]. 山东农业科学, 2019, 51(3): 13-15, 23. |
| [3] |
张彤.两株鹿源芽孢杆菌的分离鉴定及生物学特性研究[D].硕士学位论文.沈阳: 沈阳农业大学, 2017.
|
| [4] |
CAO G T, ZHAN X A, ZHANG L L, et al. Modulation of broilers' caecal microflora and metabolites in response to a potential probiotic Bacillus amyloliquefaciens[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(2): e909-e917. |
| [5] |
BINDIYA E S, TINA K J, SASIDHARAN R S, et al. BaCf3:highly thermostable bacteriocin from Bacillus amyloliquefaciens BTSS3 antagonistic on food-borne pathogens[J]. 3 Biotech, 2019, 9(4): 136. |
| [6] |
姚佳明, 田亚平.解淀粉芽孢杆菌抑菌肽的分离鉴定及其抑菌谱表征[J/OL].食品科学, 2019: 1-12[2019-10-24]. http://kns.cnki.net/kcms/detail/11.2206.TS.20190827.0912.002.html.
|
| [7] |
熊美玲.沸石粉基芽孢杆菌剂对污水处理的研究[D].硕士学位论文.哈尔滨: 哈尔滨工业大学, 2017.
|
| [8] |
柴庆凯, 张斌, 常若葵, 等. 解淀粉芽孢杆菌LJ02对黄瓜抗灰霉病菌的生防效果及其诱导抗性机理的初步研究[J]. 植物病理学报, 2019, 49(6): 825-835. |
| [9] |
杨乔乔, 安贤惠, 韩迎亚, 等. 大鳞副泥鳅腐皮病病原菌及其拮抗菌的分离筛选[J]. 水产科学, 2019, 38(5): 666-675. |
| [10] |
宁豫昌, 张晓静, 乔宏兴. 猪肠道中产蛋白酶解淀粉芽孢杆菌的筛选、鉴定及其酶学性质的初步研究[J]. 中国畜牧兽医, 2017, 44(8): 2398-2407. |
| [11] |
程英显.解淀粉芽孢杆菌TL对肉鸡血清代谢组学影响[D].硕士学位论文.武汉: 华中农业大学, 2018.
|
| [12] |
朱博.解淀粉芽孢杆菌对仔猪生长性能、抗氧化能力、免疫功能和肠道菌群的影响[D].硕士学位论文.南京: 南京农业大学, 2016.
|
| [13] |
郭政宏.藏猪源益生芽孢杆菌的分离鉴定及候选益生菌株的筛选[D].硕士学位论文.成都: 西南民族大学, 2016.
|
| [14] |
王岩, 陈楠楠, 侯美如, 等. 解淀粉芽孢杆菌SSY1株的安全性试验[J]. 中国畜牧兽医, 2017, 44(3): 928-934. |
| [15] |
张李荣.三种益生菌对雏鸡生长、小肠发育及盲肠微生物区系的影响[D].硕士学位论文.扬州: 扬州大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-11117-1018112194.htm
|
| [16] |
徐毓琴.产γ-氨基丁酸益生菌的筛选及对小鼠微生态效应的影响研究[D].硕士学位论文.雅安: 四川农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10626-1017017005.htm
|
| [17] |
李凤格.分枝杆菌LpqT蛋白可抑制巨噬细胞炎性因子的表达及凋亡以促进细菌在体内生存[D].硕士学位论文.苏州: 苏州大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10285-1018071586.htm
|
| [18] |
张雪.一株解淀粉芽孢杆菌的特性及抑菌活性研究[D].硕士学位论文.大连: 大连工业大学, 2018.
|
| [19] |
夏京津, 陈建武, 宋怿, 等. 解淀粉芽孢杆菌HE活性成分鉴定及抗菌特性分析[J]. 南方水产科学, 2019, 15(3): 41-49. |
| [20] |
周银丽, 郭建伟, 杨伟, 等. 石榴枯萎病菌拮抗菌B110的分离鉴定[J]. 中国南方果树, 2018, 47(6): 1-6. |
| [21] |
王静, 宁燕夏, 糟雪云, 等. 解淀粉芽孢杆菌B6防治西瓜枯萎病及对西瓜幼苗抗氧化酶的诱导作用[J]. 中国植保导刊, 2018, 38(6): 5-10. |
| [22] |
覃初斌, 朱海燕, 梅小强, 等. 解淀粉芽孢杆菌对黑鲷幼鱼生长和肝脏功能的影响[J]. 中国农业科技导报, 2017, 19(12): 110-118. |
| [23] |
杨敏馨.解淀粉芽孢杆菌替代饲用抗生素在肉鸡上的应用效果研究[D].硕士学位论文.南京: 南京农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10307-1017261606.htm
|
| [24] |
李仕成.拮抗罗非鱼无乳链球菌的芽孢杆菌筛选与研究[D].硕士学位论文.长沙: 湖南农业大学, 2016.
|
| [25] |
徐函, 曹雪芳, 刘容容, 等. 解淀粉芽孢杆菌SC06与肠毒性大肠杆菌K88对IPEC-1细胞转运载体、紧密连接、凋亡和免疫相关基因表达的影响[J]. 动物营养学报, 2019, 31(5): 2267-2277. |
| [26] |
王阳.解淀粉芽孢杆菌对动物抗氧化功能的影响及其作用机制的研究[D].博士学位论文.杭州: 浙江大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10335-1018263489.htm
|
| [27] |
汤红燕, 肖斌, 王利平, 等. 胰岛素样生长因子家族与皮肤病[J]. 中国医学科学院学报, 2019, 41(3): 415-418. |
| [28] |
李红伟, 钟淡龙, 陈圆, 等. 惠阳胡须鸡IGF-Ⅰ和GHRL基因多态性研究[J]. 河南农业科学, 2017, 46(9): 152-155. |
| [29] |
朱菡, 姚颖. 肠道菌群及益生菌干预:慢性肾脏病治疗的新视角[J]. 科学通报, 2019, 64(3): 291-297. |
| [30] |
DE OLIVEIRA M J K, SAKOMURA N K, DE PAULA DORIGAM J C, et al. Bacillus amyloliquefaciens CECT 5940 alone or in combination with antibiotic growth promoters improves performance in broilers under enteric pathogen challenge[J]. Poultry Science, 2019, 98(10): 4391-4400. |
| [31] |
HVTT P, SHCHEPETOVA J, LIVUKENE K, et al. Antagonistic activity of probiotic Lactobacilli and Bifidobacteria against entero- and uropathogens[J]. Journal of Applied Microbiology, 2006, 100(6): 1324-1332. |
| [32] |
堵雅芳, 石羽杰, 刘彪, 等. 乳双歧杆菌HN019与健康[J]. 卫生研究, 2019, 48(5): 850-852. |




