2. 河南省饲料资源开发及安全评价工程技术研究中心, 郑州 450046
2. Feed Resources Development and Safety Evaluation Engineering Research Center of Henan Province, Zhengzhou 450046, China
近年来,天然植物及其提取物作为添加剂在畜禽饲粮中的应用越来越广泛,在维护畜禽健康、提高生产性能和减少或替代抗生素等方面起到了重要作用。八角茴香(Illicium verum Hook.F.)又称为大茴香,为木兰科八角属植物,是一种食药同源的经济树种。有研究表明,其果实八角富含多种活性成分,主要包括八角茴香精油(主要成分为茴香醛、茴香米、柠檬烯等)、有机酸、黄酮类、糖苷类、萜类和微量元素等,具有较高的营养价值及抗菌、抗氧化、提高机体免疫力等保健功效[1-2]。百里香(thymus mongolicus)为唇形科多年生草本植物,其精油中主要含有百里香酚、香荆芥酚、香芹酚等有效成分,体外研究发现,百里香具有抗细菌、抗真菌、抗病毒、抗寄生虫、抗氧化等作用。
目前,关于八角茴香精油和百里香精油在改善肉鸡生产性能、促进肠道发育、提高养分消化利用[3-4]和抑制细菌[5]等方面的研究报道较多,但关于这2种精油单独或混合使用对蛋鸡生产性能和肠道微生物影响的研究较少,仅见于彩云[6]探讨了饲粮中添加不同剂量八角茴香精油对180日龄蛋鸡生产性能、养分利用率和抗氧化性能的影响,指出饲粮中添加400 mg/kg八角茴香精油对于改善鸡蛋营养成分及蛋鸡养分利用率效果最佳,而饲粮中添加600 mg/kg八角茴香精油则对于改善机体总抗氧化能力效果最佳。蛋鸡产蛋后期存在着生产性能、免疫力和蛋品质下降及组织器官损伤等问题,而且现有研究表明肠道微生物可编码大量基因,为机体提供多种免疫抗原,诱导肠道黏膜产生免疫力,参与机体免疫系统,家禽肠道微生物状态与其生产性能和健康状况密切相关[7]。因此,本试验通过在蛋鸡饲粮中添加复合植物精油,探讨其对产蛋后期海兰褐壳蛋鸡生产性能、蛋品质和肠道菌群结构的影响,以期为复合植物精油在蛋鸡生产中的应用积累生产数据,提供参考依据。
1 材料与方法 1.1 试验动物与材料试验在北京鑫盛养殖有限公司进行,蛋鸡品种为海兰褐蛋鸡。复合植物精油添加剂由北京鑫盛养殖有限公司提供。复合植物精油添加剂中总精油含量为7.5%,其中,八角茴香精油含量为6.8%,百里香酚含量≥0.2%。
1.2 试验设计选取产蛋率、体重相近的健康58周龄海兰褐蛋鸡360只,采用单因子试验设计,随机分为对照组和试验组2个组,每组6个重复,每个重复30只鸡。对照组饲喂基础饲粮,试验组饲喂基础饲粮+150 mg/kg复合植物精油。试验期49 d。基础饲粮参照我国《鸡饲养标准》(NY/T 33—2004)以及《海兰褐蛋鸡饲养手册》配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验鸡采用3层阶梯笼养方式,每天分3次定时饲喂,所用饲粮为粉料,现配现喂,自由采食和饮水。每天观察蛋鸡的采食、粪便和健康状况,正常免疫程序进行免疫。鸡舍内温度、光照条件基本一致。
1.4 指标测定与方法 1.4.1 生产性能试验期间每天15:00定时收蛋,以重复为单位记录试验鸡的采食量、产蛋数和死淘数。试验结束时,计算每组平均日采食量、料蛋比、产蛋率、破蛋率和死淘率。
1.4.2 蛋品质在试验期最后1天每组各随机取15枚鸡蛋进行蛋壳强度、蛋壳厚度、蛋黄色泽、蛋白重量、蛋黄重量及哈氏单位等相关蛋品质指标的测定。其中,蛋壳强度采用蛋壳强度检测仪(ESTG-1,Robotmation公司,日本)测定;蛋壳厚度测定分别取蛋的钝端、中间和锐端的蛋壳碎片,去掉内、外壳膜后采用千分尺测定,精确至0.01 mm;蛋重、哈氏单位以及蛋黄颜色采用多功能蛋品质分析仪(ENT7300,Robotmation公司,日本)测定;蛋白重量和蛋黄重量采用电子天平测量,精确到0.01 g。
1.4.3 蛋鸡肠道菌群结构分析每组随机选取5只健康蛋鸡于试验的第49天禁食12 h后屠宰,取盲肠肠道及内容物,装入灭菌离心管中,经液氮速冻后,转移到-80 ℃冰箱保存,以备检测。
1.4.3.1 基因组DNA的提取、PCR扩增、纯化和测序采用十六烷基三甲基溴化铵(CTAB)方法提取盲肠内容物菌群的基因组DNA,利用1%琼脂糖凝胶电泳和紫外分光光度计检测DNA的纯度和浓度。以稀释后的基因组DNA为模板,对16S rDNA基因V3和V4区,合成带有条形码(barcode)标签的特异性引物,其引物序列为341F:5′-CCTAYGGGRBGCASCAG-3′和806R:5′-GGACTACNNGGGTATCTAAT-3′。
PCR扩增采用含有GC缓冲液的超高保真酶反应体系。扩增获得的PCR产物经浓度测定后,根据其浓度进行等浓度等量混样,充分混匀后用2%琼脂糖凝胶电泳进行PCR产物检测,然后使用胶回收试剂盒(Qiagen公司,德国)回收400~450 bp大小的PCR目的条带。利用建库试剂盒(Illumina公司,美国)构建测序文库,构建好的文库经Qubit和PCR定量确认合格后,使用HiSeq2500 PE250进行上机测序。
1.4.3.2 生物学信息分析及数据处理采用Uparse v7.0.1001软件对有效数据在97%水平上进行操作分类单元(OTU)聚类,根据OUT总数和OUT相对丰度使用Qiime 1.9.1软件计算样品alpha多样性指数(Chaol指数、ACE指数、Shannon指数以及Simpso指数)。使用R 2.15.3软件绘制稀释曲线、物种累积曲线,并进行alpha多样性指数组间差异性分析(t检验和Wilcox检验)、盲肠微生物组间差异物种分析(t检验和Wilcox检验)、主成分分析(PCoA)和非加权组平均法(UPGMA)聚类树分析。其中,alpha多样性指数组间差异和盲肠微生物组间差异物种分析结果以P < 0.05表示差异显著,0.05≤P < 0.10表示有趋势。
1.5 数据统计分析蛋鸡生产性能和蛋品质数据用平均值±标准差表示,用SPSS 19.0统计软件进行单因素方差分析(one-way ANOVA),以P < 0.05表示差异显著。
2 结果与分析 2.1 复合植物精油对58周龄海兰褐蛋鸡生产性能的影响由表 2可知,与对照组相比,饲粮中添加复合植物精油的试验组蛋鸡的产蛋率显著升高(P < 0.05),料蛋比和破蛋率显著降低(P < 0.05),平均日采食量和死淘率无显著差异(P>0.05)。
|
|
表 2 复合植物精油对58周龄海兰褐蛋鸡生产性能的影响 Table 2 Effects of compound plant essential oils on performance of 58-week-old Hy-Line brown laying hens |
由表 3可知,与对照组相比,饲粮中添加复合植物精油的试验组蛋鸡的蛋黄色泽、蛋白重量显著升高(P < 0.05),其他蛋品质指标差异无显著差异(P>0.05)。
|
|
表 3 复合植物精油对58周龄海兰褐蛋鸡蛋品质的影响 Table 3 Effects of compound plant essential oils on egg quality of 58-week-old Hy-Line brown laying hens |
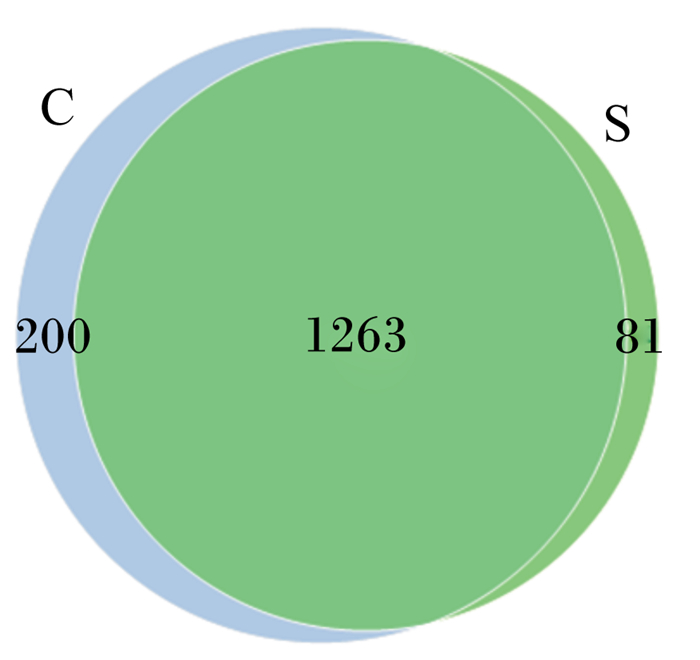
本试验中,进行高通量测序的蛋鸡盲肠内容物细菌基因组的样本数目为12份,共获得了878 696条高质量序列,平均长度为415.67 bp。对照组和试验组的序列数分别为429 286和449 410,对照组和试验组序列的平均长度分别为414.83和416.50 bp。以97%序列相似度为阈值划分OTU,去除无法被聚类和没有获得注释信息的Tags数目后,12个粪样共产生123 12个OTU,其中,对照组含有6 362个OUT,试验组含有5 950个OTU。由图 1可知,对照组和试验组共有的OTU数目为1 263个,对照组独有的OTU数目为200个,试验组独有的OTU数目为81个。
|
C:对照组control group;S:试验组experimental group。下图同The same as below。 图 1 盲肠内容物OTU维恩图 Fig. 1 OTU Venn diagram of cecal content |
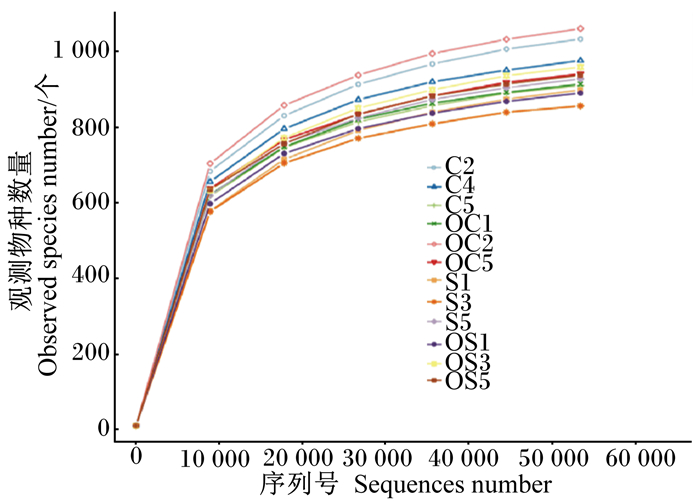
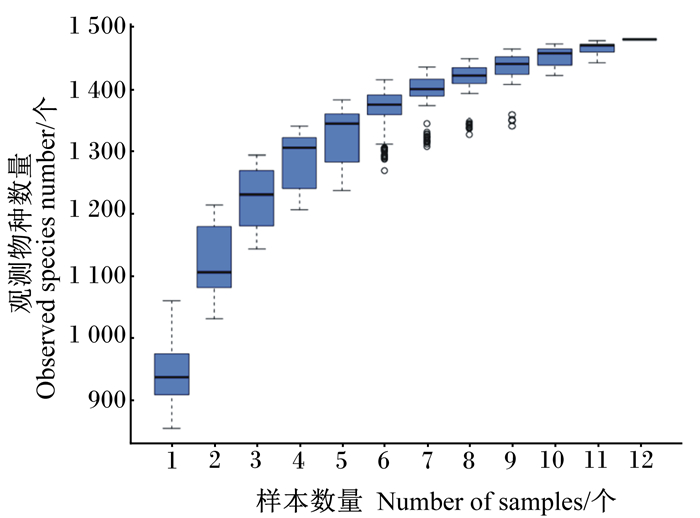
样品的物种稀释曲线(rarefaction curve)和种类累积箱形图(species accumulation boxplot)分别见图 2和图 3。所有样品曲线均趋于平缓达到平台期,说明实际测序量足以覆盖群落物种组成,能够真实反映群落各物种间的相对比例关系,并间接反映样品中物种的丰富程度。
|
C2、C4、C5、OC1、OC2、OC5为对照组的不同重复;S1、S3、S5、OS2、OS3、OS5为试验组的不同重复。下图同。 C2, C4, C5, OC1 OC2 and OC5 were different replicates in control group; S1, S3, S5, OS2, OS3 and OS5 were different replicates in experimental group. The same as below. 图 2 稀释曲线 Fig. 2 Rarefaction curve |
|
图 3 种类累积箱形图 Fig. 3 Species accumulation boxplot |
由表 4可知,与对照组相比,试验组的Chao1指数和ACE指数降低,但差异不显著(P>0.05);Shannon指数显著降低(P < 0.05);Simpson指数差异不显著(P>0.05)。通过对2组样品ACE指数、Chao1指数、Shannon指数和Simpson指数比较,发现对照组的盲肠内容物菌群丰富度和多样性高于试验组。
|
|
表 4 复合植物精油对58周龄海兰褐蛋鸡盲肠内容物菌群alpha多样性指数的影响 Table 4 Effects of compound plant essential oils on alpha diversity indexes of cecal content microflora of 58-week-old Hy-Line brown laying hens |
在门分类水平上,盲肠内容物菌群结构组成情况见表 5(仅列相对丰度>1%的菌群)。试验组和对照组蛋鸡盲肠内容物中共有17个菌门,相对丰度大于1%的有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),5个菌门的总相对丰度达到98.00%以上。与对照组相比,试验组拟杆菌门的相对丰度显著升高(P < 0.05),厚壁菌门和梭杆菌门的相对丰度显著降低(P < 0.05),变形菌门和放线菌门的相对丰度差异不显著(P>0.05)。
|
|
表 5 复合植物精油对58周龄海兰褐蛋鸡盲肠内容物菌群门水平上相对丰度的影响(相对丰度>1%) Table 5 Effects of compound plant essential oils on relative abundance of cecal content microflora in phylum level of 58-week-old Hy-Line brown laying hens (relative abundance>1%) |
在属分类水平上,2组盲肠内容物中共检测到210个菌属,对照组和试验组分别含有161和154个菌属,相对丰度大于1%的菌属有16个,总相对丰度在59.00%以上,盲肠内容物菌群结构组成情况见表 6(仅列相对丰度>1%的菌群)。由表 6可知,对照组和试验组之间有5个菌属差异显著(P < 0.05),与对照组相比,试验组的拟杆菌属(Bacteroides)和unidentified_Ruminococcaceae的相对丰度显著升高(P < 0.05),梭形杆菌属(Fusobacterium)、瘤胃球菌科_UCG-005属(Ruminococcaceae_UCG-005)、厌氧球菌属(Anaerotruncus)的相对丰度显著降低(P < 0.05),瘤胃球菌科_UCG-014属(Ruminococcaceae_UCG-014)和克里斯滕森菌科_R-7族群(Christensenellaceae_R-7_group)的相对丰度有降低趋势(P=0.060)。
|
|
表 6 复合植物精油对58周龄海兰褐蛋鸡盲肠内容物菌群属水平上相对丰度的影响(相对丰度>1%) Table 6 Effects of compound plant essential oils on relative abundance of cecal content microflora in genus level of 58-week-old Hy-Line brown laying hens (relative abundance>1%) |
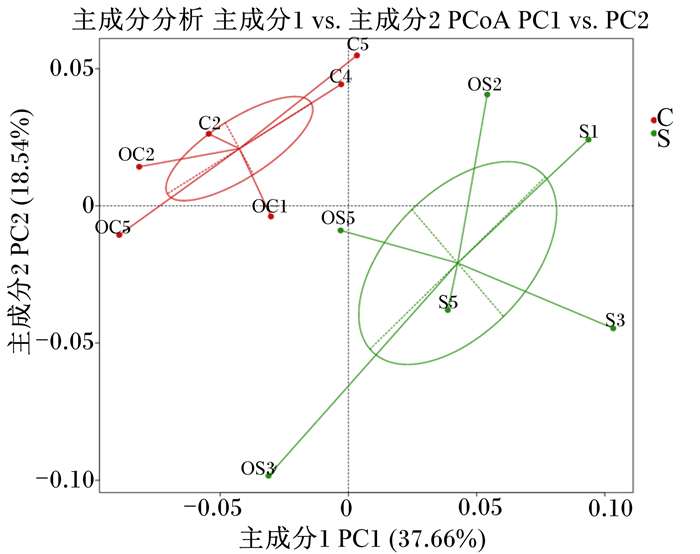
由图 4可以看出,主成分1(PC1)和主成分2(PC2)是造成样品的2个最大差异特征,贡献率分别为37.66%和18.54%。对照组和试验组主成分存在明显差异,对照组主成分2贡献率较大,试验组主成分1贡献率较大。对照组6个样本距离较近,且相对集中,说明对照组中6个样本的物种相似性较高。试验组6个样本距离较远,说明试验组中6个样本的物种相似性存在差异。由图 5可以看出,UPGMA聚类分析进一步说明了主坐标分析的结果,对照组和试验组样本分别位于不同的分支上,说明复合植物精油的添加使盲肠微生物菌群发生了变化。
|
图 4 对照组和试验组蛋鸡盲肠内容物菌群PCoA Fig. 4 PCoA of cecal content microflora of laying hens in control group and experimental group |
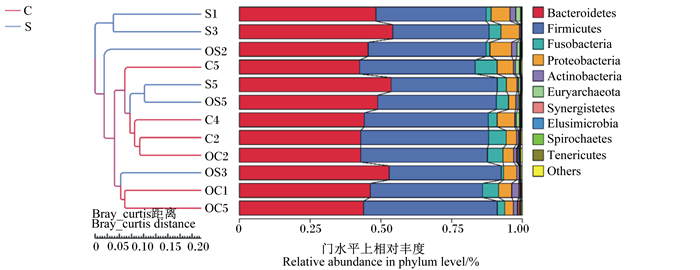
|
Others:其他;Tenericutes:软壁菌门;Spirochaetes:螺旋体门;Elusimicrobia:迷踪菌门;Synergistetes:互养菌门;Euryarchaeota:广古菌门;Actinobacteria:放线菌门;Proteobacteria:变形菌门;Fusobacteria:梭杆菌门;Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门。 图 5 对照组和试验组蛋鸡盲肠内容物菌群UPGMA聚类分析 Fig. 5 UPGMA cluster analysis of cecal content microflora of laying hens in control group and experimental group |
产蛋高峰期的蛋鸡机体承担着高强度和高负荷的代谢变化,高峰期过后,蛋鸡机体代谢水平逐渐减缓,生理功能逐步退化,抗病能力降低,容易感染各种疾病,导致产蛋性能的下降。研究表明,饲粮中添加植物精油可以通过改善动物机体的抗氧化性、抑制细菌和刺激食欲来改善动物的生产性能,提高免疫功能[8-9]。Yu等[10]研究表明,蛋鸡饲粮中添加八角茴香精油28 d后日产蛋量有提高的趋势,随着八角茴香精油添加量的提高,平均蛋重有线性增加趋势,采食量有二次增加的趋势。Irani等[11]研究结果显示,蛋鸡饲粮中添加0.4%的大茴香,对蛋鸡的采食量、饲料转化率、产蛋率、蛋重等均有有益的影响。Bozkurt等[12]研究发现,饲粮中添加以香芹酚、百里香酚为主要成分的植物精油可以提高种鸡产蛋率、采食量,减少蛋破损率。本试验发现,蛋鸡饲粮中添加八角茴香和百里香复合植物精油后,产蛋率显著提高,料蛋比和破蛋率显著降低,平均日采食量和死淘率无显著差异,这与上述研究结果在提高产蛋率、降低破蛋率方面表现相一致。饲粮中添加八角茴香和百里香复合植物精油对表现出改善蛋鸡生产性能的作用,可能与八角茴香精油具有诱发食欲、刺激胃液分泌、兴奋肠道蠕动、改善肠道发育、提高动物的生长性能的作用[13]以及百里香精油具有减轻肠道损伤、改善小肠组织形态的作用[9]有关。但是,本试验中并未观察到饲粮中添加复合精油后蛋鸡平均日采食量和蛋重出现显著变化,这可能与本研究与前人研究在供试动物年龄、饲养环境条件和饲粮类型方面有所差异有关,而且也有研究证明,这些方面都会影响八角茴香精油功效的发挥[4]。
3.2 复合植物精油对58周龄蛋鸡蛋品质的影响蛋品质是影响蛋鸡养殖效益的重要因素,衡量蛋品质的质量指标主要包括蛋壳强度、蛋壳颜色、蛋壳厚度、哈氏单位、蛋黄色度和蛋白高度等。张安等[14]研究表明,饲粮中添加150 mg/kg植物精油混合物(主要成分为肉桂醛18%、香芹酚3%和百里香氛1%,以二氧化硅为载体,由棕榈油包被而成)可改善鸡蛋的蛋白品质。本研究结果显示出类似的研究结果,即饲粮中添加八角茴香和百里香复合植物精油显著提高了蛋白重量。蛋白重量的提高可能与复合植物精油的添加会改善蛋白质的消化率[15]以及影响输卵管腺体浓蛋白分泌量有关[14],但具体机制仍需进一步研究。蛋黄颜色的形成与脂溶性色素在卵形成期间的沉积有关,是衡量禽蛋品质及其商品性能的重要因素之一。王光富[16]研究发现,饲粮中单独添加300 mg/kg植物精油(主要成分为肉桂醛)后,蛋鸡蛋黄颜色较对照组显著上升,与本试验研究结果相一致,其原因可能是饲粮中添加的复合植物精油具有抗氧化功能,降低了机体对类胡萝卜素的消耗,使其在卵形成期间能更多的沉积到蛋黄中,从而改善了蛋黄颜色。
蛋壳强度和蛋壳厚度是影响蛋壳质量的主要因素,蛋壳偏薄会增加鸡蛋的破蛋率,蛋壳过厚又会造成死胚,影响孵化率。研究表明,饲粮中添加八角茴香精油会增加蛋壳厚度[6],而且随着八角茴香精油添加剂量的增加呈线性或二次增加,原因可能是八角茴香精油增加了采食量,促进了钙、磷等矿物质的采食量,从而增加了蛋壳厚度。也有研究表明,百里香会影响蛋鸡肠道内有益菌的定值和代谢活性,从而改善了肠道对矿物质,尤其是钙和镁的吸收速率,进而改善蛋壳质量[13, 17]。本研究中,饲粮中添加复合植物精油没有显著增加蛋壳厚度和蛋壳强度,可能与复合植物精油的添加并没有显著改善蛋鸡的平均日采食量有关;此外,本研究中只设了1个添加剂量,剂量效应没有观察到,仅见复合精油组蛋壳强度稍有增加。
3.3 复合植物精油在蛋鸡饲粮中的适宜添加剂量本试验在饲粮中添加了150 mg/kg的八角茴香和百里香复合植物精油(其中精油总含量为7.5%,八角茴香精油含量6.8%,百里香氛含量≥0.2%),发现显著提高了蛋鸡产蛋率,显著降低了料蛋比和破蛋率,但是因试验条件原因,缺乏不同添加剂量复合植物精油对生产性能影响的对比。Ding等[15]研究了饲粮中添加不同剂量(0、50、100和150 mg/kg)复合植物精油(主要活性成分为13.5%百里香和4.5%肉桂醛)对罗曼蛋鸡生产性能、蛋品质和养分消化率的影响,指出添加复合植物精油并没有显著改善蛋鸡的生产性能,但是有增加蛋壳厚度和提高蛋白质消化率的趋势,因此推荐低剂量(50 mg/kg)添加为宜。于彩云[6]探讨了饲粮中不同添加剂量(0、200、400和600 mg/kg)八角茴香精油对蛋鸡产蛋性能、养分利用效率和抗氧化性能的影响,指出饲粮中添加400 mg/kg八角茴香精油对蛋壳厚度、蛋黄颜色及养分利用效率改善效果最佳,而饲粮中添加600 mg/kg对机体抗氧化能力最佳。从上述研究结果可看出,目前关于饲粮中添加八角茴香精油和百里香精油的适宜剂量尚无定论,各个研究结果不一,添加剂量受精油提取工艺、精油种类和含量以及试验条件等因素影响较大,尤其尚未见到这2种精油复合物添加剂量的报道,后续仍需开展适宜添加剂量的筛选试验。
3.4 复合植物精油对58周龄蛋鸡盲肠菌群结构的影响现有研究表明,肠道菌群组成对于宿主机体的健康、新陈代谢、营养物质消化吸收和免疫有着重要影响[18-19]。在菌群多样性分析过程中,Chao1指数、ACE指数、Shannon指数和Simpson指数常用来反映菌群的Alpha多样性,前3个指数越大,说明菌群的多样性和丰富度越高;而Simpson指数越大,则菌群丰富度越低[20]。本试验结果表明,饲粮中添加复合植物精油对盲肠菌群的Chao1指数和ACE指数无显著影响,但能够显著降低Shannon指数,Simpson指数也有升高的趋势,说明饲粮中添加八角茴香和百里香复合精油后减少了盲肠菌群的多样性。有研究表明,饲粮中添加0.05~0.20 mg/kg的百里香精油可显著降低麻花鸡十二指肠、回肠中大肠杆菌、沙门氏菌和乳酸菌数量[21];八角茴香精油中的反式茴香脑具有抑菌作用,随着饲粮中八角茴香精油水平的增加,蛋鸡盲肠大肠杆菌相对含量线性或二次降低[6],因此,推测添加复合植物精油后盲肠菌群多样性降低可能与精油抑制了肠道有害菌有关。
厚壁菌门和拟杆菌门在营养物质的消化吸收和宿主能量代谢方面起着重要作用,它们共同促进宿主吸收或储存能量[22]。张亚楠[23]对高产期不同产蛋率的蛋鸡肠道微生物群落特征进行了分析,指出在门水平上,不论高产、低产和极低产组,厚壁菌门、拟杆菌门、放线菌门和变形菌门均是4种优势菌门,而且所有组别中厚壁菌门占绝对优势地位。本试验中,2组盲肠微生物中的优势菌门是拟杆菌门、厚壁菌门、梭杆菌门、变形菌门和放线菌门,厚壁菌门和拟杆菌门占比高的特点与张亚楠[23]研究结果相一致。但是,本研究中占绝对优势的并非厚壁菌门,而是拟杆菌门,出现差异的原因可能与所选蛋鸡日龄不一致有关,本研究所选为58周龄产蛋后期蛋鸡,而张亚楠[23]研究所选蛋鸡为190日龄产蛋高峰期蛋鸡,而且研究表明,随着日龄的增长,尤其在生长阶段后期,肠道微生物主要是拟杆菌门[24-26]。
变形菌门包括很多病原菌,如大肠杆菌、沙门氏菌等,有可能对畜禽生产产生不利的影响。放线菌门在肠道中的数量较少,但此门下的双歧杆菌属却是鸡肠道内的有益菌,它能够酸化肠道内环境,抑制病原菌的生长,对动物肠道健康起着不可忽视的重要作用。以往的研究表明,植物精油具有减少肠道有害菌、促进有益菌生长的作用[27]。但在本试验条件下,饲粮中添加复合植物精油后,蛋鸡肠道微生物变形菌门和放线菌门的相对丰度并没有出现显著下降的变化。这可能是因为肠道微生物区系的稳定与变动虽与宿主的健康密切相关,但是肠道健康状况的改变很可能是部分病原体的增加或减少引起的,而非整体菌群多样性的变动导致[28]。
在属水平上,饲粮中添加复合植物精油显著升高蛋鸡盲肠菌群中拟杆菌门的拟杆菌属相对丰度,显著降低了梭形杆菌属的相对丰度。拟杆菌属相对丰度增加,对宿主分解多糖提高营养物质利用效率[29]、加快肠黏膜的血管形成[30]、提高宿主的免疫力[31]以及维持肠道微生态平衡[32]等方面均有着重要作用,并因此可能对蛋鸡的生产性能产生积极的影响。梭形杆菌属被认为是人类和动物的病原菌,梭形杆菌属的相对丰度显著降低,对减少宿主肠道炎症的发生有利[33]。本试验中,与对照组相比,试验组瘤胃菌科的Ruminococcaceae_UCG-005、厌氧球菌属和Ruminococcaceae_UCG-014的相对丰度显著降低,unidentified_Ruminococcaceae的相对丰度显著升高,说明饲粮中添加复合植物精油对瘤胃菌科的菌属相对丰度有“双向调节”的现象,具体原因还需要进一步研究。
4 结论本试验条件下,饲粮中添加150 mg/kg复合植物精油能够改善蛋鸡产蛋后期的生产性能,加深蛋黄颜色,提高盲肠拟杆菌门的相对丰度,降低盲肠厚壁菌门和梭杆菌门的相对丰度,改善盲肠肠道菌群结构。
| [1] |
权美平. 八角茴香精油的成分分析及生物活性研究进展[J]. 中国调味品, 2017, 42(1): 164-166. DOI:10.3969/j.issn.1000-9973.2017.01.038 |
| [2] |
陈鹏.八角和杜仲叶提取物对断奶仔猪免疫和抗氧化性能的研究[D].硕士学位论文.济南: 山东农业大学, 2017
|
| [3] |
DING X, YANG C W, YANG Z B. Effects of star anise (Illicium verum Hook.f.), essential oil, and leavings on growth performance, serum, and liver antioxidant status of broiler chickens[J]. Journal of Applied Poultry Research, 2017, 26(4): 459-466. DOI:10.3382/japr/pfx014 |
| [4] |
AMAD A A, MÄNNER K, WENDLER K R, et al. Effects of a phytogenic feed additive on growth performance and ileal nutrient digestibility in broiler chickens[J]. Poulty Science, 2011, 90(12): 2811-2816. DOI:10.3382/ps.2011-01515 |
| [5] |
HOFFMAN-PENNESI D, WU C. The effect of thymol and thyme oil feed supplementation on growth performance, serum antioxidant levels, and cecal Salmonella population in broilers[J]. Journal of Applied Poultry Research, 2010, 19(4): 432-443. DOI:10.3382/japr.2009-00141 |
| [6] |
于彩云.八角茴香油对蛋鸡产蛋性能、养分利用率和抗氧化性能影响的研究[D].硕士学位论文.泰安: 山东农业大学, 2019.
|
| [7] |
张亚楠, 魏单平, 韩瑞丽, 等. 高产期不同产蛋水平蛋鸡肠道微生物群落特征[J]. 中国兽医学报, 2017, 37(6): 1179-1185. |
| [8] |
张文静.复合植物精油提高肉仔鸡生长性能和抗病力的初步研究与应用[D].博士学位论文.长春: 吉林大学, 2017.
|
| [9] |
杜恩存.百里香酚和香芹酚对肉仔鸡肠上皮屏障和免疫功能的调节作用[D].博士学位论文.北京: 中国农业大学, 2016.
|
| [10] |
YU C Y, WEI J D, YANG C W, et al. Effects of star anise (Illicium verum Hook.f.) essential oil on laying performance and antioxidant status of laying hens[J]. Poultry Science, 2018, 9(11): 3957-3966. |
| [11] |
IRANI M, VARASTEGANI A, ZIARLARIMI A, et al. The effects different levels of aniseed (Pimpinella anisum L.) medicinal plant on laying hens performance[J]. Journal of Medicinal Plants Research, 2013, 7(18): 1249-1254. |
| [12] |
BOZKURT M, ALÇIÇEK A, ÇABUK M, et al. Effect of an herbal essential oil mixture on growth, laying traits, and egg hatching characteristics of broiler breeders[J]. Poultry Science, 2009, 88(11): 2368-2374. DOI:10.3382/ps.2009-00048 |
| [13] |
WANG G Y, YANG C W, YANG Z B, et al. Effects of dietary star anise (Illicium verum Hook f) supplementation during gestation and lactation on the performance of lactating multiparous sows and nursing piglets[J]. Animal Science Journal, 2014, 86(4): 401-407. |
| [14] |
张安, 王来娣, 彭艳, 等. 植物精油混合物对海兰褐蛋鸡生产性能、蛋品质、卵泡发育及血清生殖激素指标的影响[J]. 动物营养学报, 2018, 30(4): 1489-1494. DOI:10.3969/j.issn.1006-267x.2018.04.033 |
| [15] |
DING X M, YU Y, SU Z W, et al. Effects of essential oils on performance, egg quality, nutrient digestibility and yolk fatty acid profile in laying hens[J]. Animal Nutrition, 2017, 3(2): 127-131. DOI:10.1016/j.aninu.2017.03.005 |
| [16] |
王光富.植物精油和有机酸对蛋鸡生产性能、蛋品质及肠道健康的影响[D].硕士学位论文.杨凌: 西北农林科技大学, 2018.
|
| [17] |
PLACHA I, SIMONOVA M P, COBANOVA K, et al. Effect of Enterococcus faecium AL41 and Thymus vulgaris essential oil on small intestine integrity and antioxidative status of laying hens[J]. Research in Veterinary Science, 2010, 89(2): 257-261. DOI:10.1016/j.rvsc.2010.03.006 |
| [18] |
ROUND J L, MAZMANIAN S K. The gut microbiota shapes intestinal immune responses during health and disease[J]. Nature Reviews Immunology, 2009, 9(5): 313-323. DOI:10.1038/nri2515 |
| [19] |
HILDEBRAND F, NGUYEN T L A, BRINKMAN B, et al. Inflammation-associated enterotypes, host genotype, cage and inter-individual effects drive gut microbiota variation in common laboratory mice[J]. Genome Biology, 2013, 14. |
| [20] |
王四新, 季海峰, 张董燕, 等. 干酪乳杆菌对北京黑猪保育阶段生长性能及肠道菌群的影响[J]. 动物营养学报, 2018, 30(1): 326-335. DOI:10.3969/j.issn.1006-267x.2018.01.039 |
| [21] |
朱晓磊.百里香精油对肉鸡肠道微生物菌群及免疫功能影响的研究[D].硕士学位论文.石河子: 石河子大学, 2014.
|
| [22] |
TILG H, MOSCHEN A R. Microbiota and diabetes:an evolving relationship[J]. Gut, 2014, 63(9): 1513-1521. DOI:10.1136/gutjnl-2014-306928 |
| [23] |
张亚楠.蛋鸡肠道微生物菌群结构特征与产蛋水平关联性研究[D].硕士学位论文.郑州: 河南农业大学, 2016.
|
| [24] |
ZHU X Y, ZHONG T, PANDYA Y, et al. 16S rRNA-based analysis of microbiota from the cecum of broiler chickens[J]. Applied and Environmental Microbiology, 2002, 68(1): 124-137. DOI:10.1128/AEM.68.1.124-137.2002 |
| [25] |
LU J R, IDRIS U, HARMON B, et al. Diversity and succession of the intestinal bacterial community of the maturing broiler chicken[J]. Applied and Environmental Microbiology, 2003, 69(11): 6816-6824. DOI:10.1128/AEM.69.11.6816-6824.2003 |
| [26] |
O'TOOLE P W, CLAESSON M J. Gut microbiota:changes throughout the lifespan from infancy to elderly[J]. International Dairy Journal, 2010, 20(4): 281-291. DOI:10.1016/j.idairyj.2009.11.010 |
| [27] |
朱永刚, 王磊, 崔东安, 等. 植物精油在畜禽生产中的应用效果研究进展[J]. 中国畜牧兽医, 2016, 43(7): 1812-1817. |
| [28] |
PRASAI T P, WALSH K B, BHATTARAI S P, et al. Biochar, bentonite and zeolite supplemented feeding of layer chickens alters intestinal microbiota and reduces Campylobacter load[J]. PLoS One, 2016, 11(4): e0154061. DOI:10.1371/journal.pone.0154061 |
| [29] |
CHOI J H, KIM G B, CHA C J. Spatial heterogeneity and stability of bacterial community in the gastrointestinal tracts of broiler chickens[J]. Poultry Science, 2014, 93(8): 1942-1950. DOI:10.3382/ps.2014-03974 |
| [30] |
STAPPENBECK T S, HOOPER L V, GORDON J I. Developmental regulation of intestinal angiogenesis by indigenous microbes via paneth cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(24): 15451-15455. DOI:10.1073/pnas.202604299 |
| [31] |
HOOPER L V. Bacterial contributions to mammalian gut development[J]. Trends in Microbiology, 2004, 12(3): 129-134. DOI:10.1016/j.tim.2004.01.001 |
| [32] |
SEARS C L. A dynamic partnership:celebrating our gut flora[J]. Anaerobe, 2005, 11(5): 247-251. DOI:10.1016/j.anaerobe.2005.05.001 |
| [33] |
KEKU T O, MCCOY A N, AZCARATE-PERIL A M. Fusobacterium spp.and colorectal cancer:cause or consequence?[J]. Trends in Microbiology, 2013, 21(10): 506-508. DOI:10.1016/j.tim.2013.08.004 |




